界面现象
界面现象

第九章 界面现象讲解:日常生活和生产中,有很多现象和界面有关。
如:水在玻璃细管中会上升,这叫毛细现象;水可以在桌面上铺开,水银却成球状等。
通常把气液和气固界面成为表面。
第一节 表面张力和表面吉布斯函数一、表面现象及其本质 1.界面层的定义界面的5种类型:g-l,g-s,l-l,l-s,s-s. 其中g-l 和g-s 界面也叫表面。
界面分子和内部分子的区别:内部分子受力对称,界面分子受力不对称,不均匀。
液体自发使表面积缩小。
讲解:测定液体蒸气压,不能有空气存在,液体表面指纯液体与其纯蒸气之间的过渡层,只有几个分子厚。
日常生活中讲的液体表面,是指液体与空气之间的界面,其中空气被液体蒸气饱和。
2.系统的比表面(分散度)单位质量具有的表面积,或单位体积具有的表面积。
def defS S m V A AA A m V==质量表面积体积表面积例:一个边长为0.01米的立方体表面积是多少?把这个立方体分成10-9m 的小立方体,求其总面积。
解:边长为0.01米的立方体表面积 2-421=60.01=610m A ⨯⨯()321390.011010-=小立方体的个数为-92213226(10)10610m A =⨯⨯=⨯小立方体总面积物体被分散后的体积变化,请看358页表9.1。
二、表面张力、表面功、表面吉布斯函数 在等温等压条件下者3个概念是一回事。
讲解:吉布斯函数变就是等温等压条件下可逆过程得体积功。
:γ等温等压下可逆地增加单位表面积所需的功。
B,,S T p n G A γ⎛⎫∂=⎪∂⎝⎭ 表面张力就是表面功表面张力F:表面上,每米长度所受的收缩力,垂直于表面切线方向。
-2-2-1J m N m m N m⋅=⋅⋅=⋅单位: 表面功 表面张力2F l γ= 2Flγ= 影响表面张力的因素 (1)物质的本性()()s l γγ>一般相同聚集态时(γγγγ>>>金属键)(离子键)(极性共价键)(非极性共价键)讲解:可以看出键的极性越强,σ越大,因为非极性共价键组成的非极性分子之间只有色散力,极性分子间有色散力、取向力、诱导力。
第10章_界面现象-wfz-1

弯曲液面附加压力Δp 与液面曲率半径之间关系的推导: 水平分力相互平衡, 垂直分力指向液体内部 其单位周长的垂直分力为cos 球缺底面圆周长为2r1 ,得垂直分力在圆周上的合力为: F=2r1 cos 因cos = r1/ r ,球缺底面面积为 r12 , 故弯曲液面对于单位水平面上的附加压力 p 整理后得:
表10.1.1 某些液态物质的表面张力
物 质 t / °C
/ mN m-1
18.4 21.8 22.3 26.43 72.75 113.8 137.8 250 582 700 878.5 1300 1800
正己烷 正辛醇 乙醇 乙醚 H2O NaCl LiCl Na2SiO3(水玻璃) FeO Al2O3 Ag Cu Pt
\ dn = - 4p r 2 (dr ) r / M
/mNm-1
1670 1140 685 527 12010 1000 905 4500 1030
Cu Ag Sn 苯 冰 氧化镁 氧化铝 云母 石英(1010晶面)
17
(2) 与接触相的性质有关。
两种互不混溶的液体形成液-液界面时,界面层分子所处力场取 决于两种液体。所以不同液-液对界面张力不同。
18
(3) 温度的影响
T↑ 气相中分子密度↑ 液相中分子距离↑
↓ (有例外)
(表10.1.4) 不同温度下液体的表面张力 0 液体 水 乙醇 甲醇 CCl4 丙酮 甲苯 苯 75.64 24.05 24.5 26.2 30.74 31.6 72.75 22.27 22.6 26.8 23.7 28.43 28.9 69.58 20.60 20.9 24.3 21.2 26.13 26.3 66.18 19.01 21.9 18.6 23.81 23.7 62.61 16.2 21.53 21.3 58.85 15.7 19.39 20 40 60 80 100
界面现象的名词解释

界面现象的名词解释界面现象是指两种不同介质之间形成的边界区域,这个区域具有特殊的物理、化学或生物性质。
界面现象在我们的日常生活中无处不在,而且在科学和工程领域中也起着重要的作用。
本文将对界面现象进行详细解释。
首先,我们来了解一下界面现象的起因。
当两种不同的物质相遇时,它们之间的相互作用形成了一个界面。
这个界面上的物理和化学性质与两种物质本身有着明显的差异。
例如,当水和油相遇时,它们在界面上会形成一个不相溶的薄层,这是由于它们的分子之间的排斥力大于吸引力所致。
界面现象涉及了许多重要的概念和现象。
其中之一是表面张力。
表面张力是液体表面上的一种内聚力,导致液体表面呈现出收缩的趋势。
这可以用一个简单的实验来演示:取一张干净的硬纸币,轻轻放在水面上,可以观察到纸币不会立刻下沉,而是浮在水面上。
这是因为水分子之间存在着相互吸引的力量,使得水的表面呈现出收缩的特性。
除了表面张力,另一个重要的界面现象是浸润性。
浸润性描述了液体对固体的渗透能力。
当一滴液体滴在固体表面上时,它的形状取决于液体和固体之间的相互作用。
如果液体能够充分地渗透进入固体材料中,我们称之为良好的浸润性。
这一现象在涂料、油墨以及润滑剂等领域中具有重要的应用。
此外,界面现象还涉及到界面活性剂的使用。
界面活性剂是一种能在两种不同介质的界面上降低表面张力的物质。
它们能够将不能互溶的物质混合在一起,并形成稳定的乳状液体。
这在食品、日化和医药等行业中被广泛应用。
例如,洗涤剂中的表面活性剂能够使油污和水混合,达到清洁的效果。
界面现象的研究对于解决一些现实生活中的问题非常重要。
例如,界面现象对于研究海洋环境中的表面活性物质分布、油水分离技术的改进以及水处理等方面都具有重要意义。
此外,界面现象还在材料科学、能源储存和转换等领域中发挥着关键作用。
通过研究、理解和利用界面现象,我们可以开发出更高效、更环保的技术和材料。
在总结上述内容之前,值得一提的是生物界面现象。
化学物理中的界面现象与表面反应

化学物理中的界面现象与表面反应在化学物理学中,界面现象与表面反应是研究物质与界面、表面之间相互作用的重要领域。
界面现象是指物质与界面之间产生的物理现象,如表面张力、接触角等;而表面反应则是指发生在物质表面的化学反应。
一、界面现象1.表面张力表面张力是液体表面各点之间的相互作用力。
具体来说,液体表面各处的分子组成不同,内部的分子仍然受到液体内部的相互作用力,而表面上的分子只能受到一侧的相互作用力,这就导致表面上的分子有向下的趋势,而这种向下的趋势就是表面张力。
例如,我们把一根干净的细棒插入一杯水中,可以发现水面会稍稍上升,这就是水分子在表面张力的作用下向外抬起细棒。
表面张力影响着液体的形态,使得液体在排斥进一步收缩形态,从而使得液滴成为尽可能球形的形状。
同时,在界面上的物质转移以及表面活性剂的作用下,表面张力也起到了重要的作用。
2.接触角接触角是表面张力和性质的一个体现,是形成于固体表面和液体之间的,已知液体的表面张力和固体表面对该液体不感性的程度。
按照定义,接触角α 角为液体和固体表面接触在一个贯穿液面和固体交界面的线上时,线上端点所扫过的角度。
易受环境因素影响的表面现象还有溶液表面的吸附现象。
溶液中的赖屯分子聚集在其表面,使表面张力增加,造成液面凹陷,称为溶液的表面凹陷。
二、表面反应表面反应指的是在物质表面发生的化学反应。
表面反应的机制有两种:“电化学反应”和“理化反应”。
1.电化学反应在电化学反应中,化学反应的发生是通过在电极上加电而引起表面电荷变化,从而促使反应发生。
电化学反应常常结合了电化学过程、动力学和反应热力学三个方面来研究。
在电化学反应中,电势的变化是关键参数之一。
在反应过程中电势变化并不是线性的,而是富含非线性项,这对于预测和解释表面反应的活性和选择性是非常具有挑战性的。
2.理化反应与电化学反应相比,理化反应是更加广泛的表面反应机制,其中包括了表面化学、液固相化学、气固相化学等多种机制。
第八章 界面现象
对于纯液体(单组分系统)且只有一种表面,当考虑表 面效应时,热力学函数间的基本关系式为:
dG SdT Vdp dAS dH TdS Vdp dAS dA SdT pdV dAS dU TdS pdV dAS
dG的基本关系式中多出了表面效应引起的增量,相 应的其它基本关系式中均多出了这一项。 由以上四式可以得出纯液体表面能的定义式为:
1
界面与表面
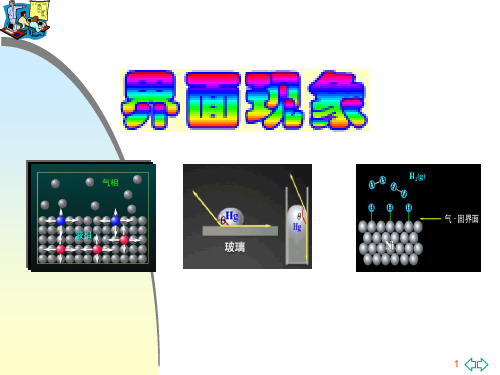
界面是指两相接触的约几个分子厚度的过渡区,若 其中一相为气体,这种界面通常称为表面。 严格讲表面应是液体和固体与其饱和蒸气之间的界 面,但习惯上把液体或固体与空气的界面称为液体 或固体的表面。通常将气-液、气-固界面称为表 面。 对于多相系统来说,各相之间存在相界面,相界面 共有五种类型:气-液、液-液、液-固、气-固、 固-固。
15
例1:20℃时,将0.001 kg的球形水滴分散成直径2 nm的 小水滴。1)求分散前后水滴的表面积和比表面积并进 行比较;2)系统Gibbs函数增大多少?已知20℃时水 的为72.75×10-3 J· -2。 m
解: [复习: 球的表面积AS=4r2,体积V= 4r3/3,
比表面积Asp=AS/V总,1 nm=1×10-9 m] 1) 20℃时水的密度为1000 kg· -3,0.001 kg水滴的体积 m V=0.001 kg/1000 kg· -3=1×10-6 m3 m 大液滴半径r:4r3/3= 1×10-6,r = 0.62×10-2 (m)
21
3、温度的影响 通常,T,分子运动越剧烈→ 分子间平均距离, 所以吸引作用减弱,也就是说,物质的表面张力通 常随温度升高而减小,即表面张力的温度系数 (d/dT)为负值。 但有少数物质的这一系数为正值,这种反常现象, 目前还无一致的解释。 4、的应用: 焊接——用助焊剂改善界面,有利于焊剂铺展。 如用Sn焊接铜管接件。 浇铸——液态金属中可加入第三种物质,使铸件表 面光滑 此外,在纤维增强复合材料与基体界面、塑料注射 成型等研究和应用领域,都有广泛应用。
界面现象

而处在表面上的 分子则不同,一方面 受到体相分子的作用, 另一方面又受到性质 不同的另一相中物质 分子的作用,使得表 面层分子受到不对称 的作用力。
3
如将内部分子移至 表面,必须对所移动的 分子施加外力、做功, 表面层的分子受到指向 物体内部并垂直于表面 的作用力(合力),使物 体表面有自动缩小的趋 势,表面能量较物体内 部大。因而产生各种表 面现象。
48
弗罗因德利希(Freundlich)方程适用范围: 中等压力范围内气体在固体表面上的吸附。 弗罗因德利希(Freundlich)方程如应用于 溶液中溶质的吸附,则其形式为:
物理吸附
吸附类型 化学吸附
40
物理吸附
吸附力 吸附热 选择性
分子间力(范德华力)
较小,近于液体热 ,约为 几百-几千焦耳每摩尔 无选择性 不稳定,易解吸
吸附稳定性 分子层
吸附速率
单分子层或多分子层
较快,不受温度影响,故 一般不需要活化能。
41
化学吸附
吸附力 吸附热 选择性
化学鍵力
较大,近于化学反应热 , 一般大于几万焦耳每摩尔 有选择性 稳定,不易解吸
(1) 液面为水平面时, r,pr = p。 液面为凸面(液滴)时, r > 0, pr > p 。 液面为凹面时(如液体内气泡), r < 0, p r < p 。 (2) 液滴越小,其饱和蒸气压越大。 (3) 应用,如毛细管凝结现象、人工降雨、 过冷、过热、暴沸等现象。
29
毛细管凝结现象:水在玻璃 毛细管内形成凹面, r < 0, pr < p 。对平面未饱和的蒸气,在毛 细管内可能已达饱和或过饱和, 导致蒸气在毛细管内凝结。如硅 胶吸水等。 人工降雨:AgI等微小粒子作成核中心。
10-物理化学第十章 界面现象

ln
Pr Ps
2 M r RT
凸(液滴)~ “+” 凹(气泡)~ “–”
凸(液滴,固体粉末 or r > 0)— Pr>Ps 凹(气泡 or r < 0 )— Pr<Ps
水平液面(r→∞)— Pr=Ps
❖ 亚稳状态和新相的生成 ——分散度对系统性质的影响
亚稳状态
——热力学不稳定态,一定条件下能相对 稳定的存在。
杨氏方程
cos
s l
sl
润湿条件 s sl 铺展条件 s sl l
❖ 应用
毛细管内液面
凹: 润湿
凸: 不润湿
§10–3 弯曲液面下的附加压
由此产生毛细现象,并影响饱和蒸气压
10·3·1 弯曲液面产生附加压
附加压 △P= P心-P外
➢ 杨-拉普拉斯方程
曲面— P 2 膜— P 4
第十章 界面现象
讨论界面性质对系统的影响
新的系统—多相,小颗粒系统
非体积功—表面功
❖ 需考虑界面影响的系统 界面所占比例大的系统
比表面——
aS
AS m
❖ 本章内容 表面张力
① 表面现象的成因 表面现象的总成因
与AS↓有关 ② 各类现象分析
与γ↓有关
§10–1 表面现象的成因 10·1·1 表面张力 ❖ 表面张力 γ 定义—作用于单位边界上的表面紧缩力 方向—总指向使表面积减小的方向
为降低表面张力而产生 吸附剂 —— 起吸附作用的 吸附质 —— 被吸附的
§10–4 固体表面的吸附 固体对气体的吸附
10·4·1 吸附的产生
固体特点—有大的比表面,不稳定。 通过吸附其它分子间力较小的物质,形成 新的表面能较低的界面。
两个相对的过程——吸附和解吸 吸附量——一定T、P下,吸附和解吸达平 衡时,吸附气体的量。
界面现象

太原理工大学物理化学第八章界面现象界面是指相互接触的两相的交界面。
自然界中的物质一般以三种聚集状态存在,三种相态相互接触可 以形成五种界面:液-气、固-气、液-固、液-液和固-固界面。
习惯上将液-气和固-气界面称为表面;而其余 的相界面都称为界面。
由于历史的原因, “表面”和“界面”这两个词经常混用。
界面并不是一个几何平 面,它是从一个相到另一个相的过渡层,有一定的厚度,通常称为界面相或界面层,与界面层相邻的两相 称为体相。
界面现象就是在相界面上所发生的物理化学现象。
许多自然现象、生理现象、工农业生产以至日常生 活上的许多问题都与界面现象有密切的关系,如:液滴呈球形、活性炭能脱色、粉尘容易爆炸等都与界面 现象有关。
产生界面现象的根本原因是由于界面相中的分子与体相中的分子所处的力场不同,因此界面相 的性质和两个体相的性质就会不一样。
在一般情况下,系统所具有的比表面积相当小,表面上的物质、能 量都比体相小得多, 故表面的特殊性质可不考虑。
但当系统的表面积很大时,表面分子所占的比例就很大, 它的特殊性质就成为矛盾的主要方面而表现出各种界面现象。
为了便于比较不同物质的表面性质,提出了比表面积的概念。
比表面积(as)是指单位质量或单位体 积的物质所具有的表面积,用公式表示为: as = As / m 或 as = As / V通常用比表面积来表示物质的分散程度,即分散度。
比表面积越大,分散度越高,表面效应就越明显, 这必然对系统的物理化学性质产生影响,此时就必须考虑界面的特殊性。
这种特殊性反映出的宏观现象就 是人们观察到的界面现象,其具体体现就是界面张力。
§ 8.11.液体的表面吉布斯函数和表面功界面张力界面现象产生的根本原因是由于两相界面上的分子与体相分子所 处环境不同引起的,以液-气界面为例说明之。
如图 8.1.1 所示,处于液 体内部的分子,受周围各分子对它的作用力是对称的,可以相互抵消, 这些分子在液体内部运动时无须对它做功。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
界面现象
界面:密切接触的两相之间的过渡区(约几个分子的厚度)称为界面,有五类界面,其中一相是气体时也可称为表面。
处于表面的分子和处于体相的分子的差异使界面表现出一些独特的性质,在前边的体系的讨论中,由于界面的物质的量和体相比较,微乎其微,所以表面性质的差异对整个体系性质的影响也微不足道,可以不予考虑。
但在下面将要研究的体系中,当分散程度增大时,表面性质对体系将起一定的作用,有必要进行专门的讨论。
界面科学是化学物理生物材料和信息等学科之间相互交叉和渗透的一门重要的边缘科学,是当前三大科学技术(生命科学,材料科学和信息科学)前沿领域的桥梁。
界面化学是在原子或分子尺度上探讨两相界面上发生的化学过程以及化学前驱的一些物理过程。
分散程度和表面积的关系。
由于在界面上分子的处境特殊,有许多特殊的物理化学和化学性质,随着表面张力,毛细现象和润湿现象等逐渐被发现,并赋予了科学的解释。
随着工业生产的发展,与界面现象有关的应用也越来越多,从而建立了界面化学(或表面化学)这一学科分支。
表面化学是一门既有广泛实际应用又与多门学科密切联系的交叉学科,它既有传统,唯象的,比较成熟的规律和理论,又有现代分子水平的研究方法和不断出现的新发现。
1.液体表面张力存在的两个实验:
(1)金属园环内肥皂膜的破裂过程。
(2)U 型框架皂膜的扩大过程。
在皂膜的边缘,存在着一种力,趋向使表面收缩的力,称为表面
张力γ(单位:1-⋅m N 。
表面张力:作用于表面的边缘,并且和边缘相切,
使表面收缩的力。
表面张力是体系的性质,和体相的种类,温度,压力,组成以及与其共存的另一相的性质有关。
当共存的加一相是非气相时,称为界面张力。
2.表面热力学的基本公式
当扩展表面时,就需要对体系做功(反抗表面张力),在p T ,及组成不变的条件下,对系统做的功(W δ)等于在这个过程中体系自由能的增加p T dG ,即
dA
W dG p T γδ==,这个功称为表面功。
在以前的热力学函数变化的表示式中,没有考虑表面功。
在此时,各热力学的变化可以表示如下:
B B
B s dn dA pdV TdS dU ∑++-=μγB B
B s dn dA Vdp TdS dH ∑+++=μγB B
B s dn dA pdV SdT dA ∑++--=μγB B
B s dn dA Vdp SdT dG ∑+++-=μγb
B B B n V S n P S n V T n P T A U A H A F A G ,,,,,,,,⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=∴γ由第一关系式,B n P T A G ,,⎪⎭⎫ ⎝⎛∂∂=∴γ可知它是在p T ,及体系的组成不变时,
扩展单位表面积而引起体系的吉布斯自由能的增加值,所以,也称为比表
面自由能(单位:2-⋅m J ))。
3界面张力与温度的关系应用全微分的性质:
B
B n P A n P T T A S ,,,,⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂γB
B n V A n V T T A S ,,,,⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂γ给上边两式都乘以T ,可得
B
B n P A n P T T T A TS ,,,,⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂γB
B n V A n V T T T A TS ,,,,⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂γ在T 变化的情况下扩展单位面积时所吸收的热,dA TdS
是正
值,
0)(,.<T B n P T ∂∂∴γ。
在指定的条件下扩大单位面积而引起体系的内能和焓的
变化为B
B B n V A n V T n V T T T A S T A U ,,,,,,⎪⎭⎫ ⎝⎛∂∂-=+⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂γγγB
B B n P A n P T n P T T T A S T A H ,,,,,,⎪⎭⎫ ⎝⎛∂∂-=+⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂γγγ当温度上升时,体积膨胀,分子之间的距离增大,引力减小,表面张力下降,有人提出表面张力与温度的关系如下,)
(32T T k V c m -=γ式中的V 是液体的摩尔体积,是常数,对非极性液体,由于接近T 时,气液界面已经模糊不清,有人把公式修正为)
0.6(32--=T T k V c m γ溶液的表面张力与溶液浓度的关系
水的表面张力会随着溶质的加入而
变化,可以分为三种情况:
(1)无机盐,不挥了性的有机酸碱的
加入会使表面张力升高(原因说明),并
且溶质在表面的浓度小于在溶液中的浓
度
>dc d γ(2)可溶性有机物的加入会使表面张
力下降,并且在表面的浓度小于在溶液本体的浓度(原因)
<dc d γ(3)碳原子数大于8的含碳氢链的具有憎水及亲水基团的不对称的有
机物的加入会极大地降低溶液的表面张力,
而且这些物质可以在溶液的表面极大的浓
集。
这种物质称为表面活性剂。
<dc d γTraube(特劳贝)在研究脂肪酸同系物的
表面活性时发现,同一种物质在低浓度时的
表面张力降低效应与浓度成正比,不同的酸在相同的浓度时,对于水的表面张力降低效应(表面活性)随碳原子的增长而增加,每增加一个2CH ,其表面张力降低效应可增加3.2倍,这个规则称为Traube 规则,其它脂肪醇胺酯等也有类似的表面活性随碳原子的增长而增加的情况。
各种有机物溶液的表面张力与溶液浓度的关系如下图所示。
对于可溶性的短链的醇,醛酸类化合物的浓度和溶液的表面张力之间的关系,可以用希斯科夫斯基公式来表示:)1lg('00K c c
b Θ+=-γγγ式中γ0,γ分别纯溶剂及溶液的表面张力,b 为常数,同系物数值相同,对脂肪酸来说,b 的数值约为0.411,'K 是一个常数,随物质而异,对有机物质来说,碳原子数增加,'K 降低。
1.3)
1()("'=+n K n K 当浓度很低时,展开上式,并略去c 的高次项,可以得到:
()ac K c c b ==-'
303.2/00Θγγγ即在低浓度时,溶液的表面张力下降的数值与浓度成正比,这和Traube 规则相同。
弯曲液面上的附加压力
静止的液面一般是一个平面,但是某些特殊情况下如毛细管中,则是
一具弯曲的液面。
由于表面张力的作用,
在弯曲液面的内外,所受到的压力不同。
在凸面上,研究以AB 为弦长的一个
球面上的环作为边界。
由于环上每点两边
的表面张力都与液面相切,大小相等,但
不在同一平面上,所以会产生一个向下的
合力。
凸面上受的总压力为:P o+P s 所
以凸面上所受的压力比平面上大(P o 为
大气压力,P s 为附加压力)。
在凹面上,
研究以AB 为弦长的一个球形凹面上的环
作为边界。
由于环上每点两边的表面张力都与凹形的液面相切,大小相等,但不在同一平面上,所以会产生一个向上的合力。
凹面上向下的总压力为:P o-P s ,所以凹面上所受的压力比平面上小。
弯曲液面内外的表面张力对
内部液体的作用可以用左图表示:
总之,由于表面张力的作用,在弯曲的表面
下面的液体与平面不同,它受到一种附加的压力,
附加压力的方向指向曲面的圆心。
设毛细管充满液体,管端有半径为R ´的球形
液滴与之平衡,若外压为0p ,附加压力为s p ,则
液体所受到的总压为s p p p +=0,如对活塞施加
压力p ,使液滴体积增加,则相应地表面积增加
dA 。
如在这个过程是在可逆的条件下进行的,环
境所消耗的功应和系统增加的表面Gibbs 自由能
相等s
s dA dV p γ=因为
'
'4'434''8'423
2
dR R dV R V dR R dA R A s s ππππ====代入上式,得'2R p s γ
=
在了解了附加压力及其影响因素后,可以解释如下一些现象:1、在不受外力的作用时,液体或液泡总是呈球形;2、毛细管现象ˊ
毛细管现象:当将一根毛细管插入液体
中时,常会出现毛细管上升,而毛细管
上升和毛细管下降和高度是和毛细管
的径,液体的表面张力,以及接触角有
关的。
