高中化学竞赛辅导 无机化学 16.2配位化合物的同分异构现象知识点素材
高中化学竞赛辅导无机化学16.2配位化合物的同分异构现象知识点素材
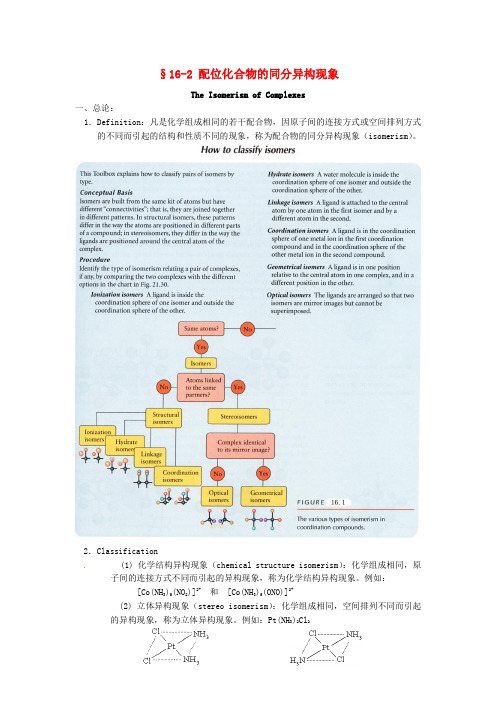
§16-2 配位化合物的同分异构现象The Isomerism of Complexes一、总论:1.Definition:凡是化学组成相同的若干配合物,因原子间的连接方式或空间排列方式的不同而引起的结构和性质不同的现象,称为配合物的同分异构现象(isomerism)。
2.Classification(1) 化学结构异构现象(chemical structure isomerism):化学组成相同,原子间的连接方式不同而引起的异构现象,称为化学结构异构现象。
例如:[Co(NH3)5(NO2)]2+和 [Co(NH3)5(ONO)]2+(2) 立体异构现象(stereo isomerism):化学组成相同,空间排列不同而引起的异构现象,称为立体异构现象。
例如:Pt(NH3)2Cl2cis–二氯·二氨合铂(II)trans - 二氯·二氨合铂(II)二、化学结构异构现象,大致分为五类:Ionization isomerism, Hydrate isomerism, Linkage isomerism, Coordination isomerism,Polymerization isomerism. 1.Ionization isomerism(1) Two coordination compounds which differ in the distribution of ionsbetween those directly coordinated and counter-ions present in the crystal lattice are called ionization isomers.(2) e.g. [Cr(NH 3)5Br]SO 4 and [Cr(NH 3)5SO 4]Br 2.Hydrate isomerism (Solvent isomerism)(1) Hydrate isomerism is similar to ionization isomerism except that anuncharged ligand changes from being coordinated to a free-lattice position whilst another ligand moves in the opposite sense.(2) e.g. [Cr(H 2O)6]Cl 3 ,[Cr(H 2O)5Cl]Cl 2·H 2O ,[Cr(H 2O)4Cl 2]Cl ·2H 2O 3.Linkage isomerism(1) The first example of this type of isomerism was provided by J φrgensen,W erner’scontemporary. His method of preparation was as follows :A"solution "Cl]Cl )[Co(NH 23N aN O H ClN H 253−−−→−−−→−−−→− red Co(ONO)]Cl )[(NH A"solution "253cold in stand let −−−−−→− yellow )]Cl Co(NO )[(NH A"solution "2253H Cl conc heat −−−→−−−→−⋅(2) It deals with a few ligands (ambidenatate) that are capable of bondingthrough are type of donor atom in one situation not a different atom in another complex. Some authors refer to this type of isomerism as “structura l i somerism” but inasmuch as all isomerism is basically “structural” , the term linkage isomerism is preferable.(3) e.g. +252SCN]O)[Cr(H and +252NCS]O)Cr(H [ +]SSO )Co(NH [353 and +S]OSO )[Co(NH 253 4.Coordination isomerism(1) This may occur only when the cation and anion of a salt are bothcomplexes, the two isomers differing in the distribution of ligands between the cation and anion(2) e.g. ]Cr(Ox)][)Co(NH [363 and ]][Co(Ox))[Cr(NH 363 ]][Cr(SCN))[Cr(NH 663 and](SCN))][Cr(NH (SCN))[Cr(NH 423243]PtCl ][)[Pt(NH 643 and ]][PtCl Cl )[Pt(NH 4243(3) Coordination position isomerismIn this form of isomerism the distribution of ligands between two coordination centers differs e.g. and5.Polymerization isomerism(1) Strictly speaking, polymerization isomerism, in which n varies in thecomplex [ML m ]n is not isomerism. It is included in this list because it represents on additional way in which an empirical formula may give incomplete information about the nature of a complex.(2) For example, all members of the following series are polymerization isomers:])(NO )[Co(NH 3233 1=n ])Co(NO ][)Co(NH [62632=n ])(NO )][Co(NH )(NO )Co(NH [42232243 2=n24223253])(NO ))][Co(NH (NO )Co(NH [ 3=n 3422363])(NO )][Co(NH )Co(NH [ 4=n 2623253])Co(NO [)](NO )Co(NH [ 5=n三、立体异构现象 (Stereo Isomerism ) 1.几何异构现象 (Geometrical isomerism )(1) 配合物的配位数与几何构型的关系 (The relationship betweencoordination number of complexes and geometrical structure.)a .两配位:直线型 (linear) +23)Ag(NH 、-2CuClb .三配位:平面三角型 (triangle) -][HgI 3c .四配位:平面四方 (square planar) -24PtCl ; 正四面体 (tetrahedron)-24Zn(CN)d .五配位:三角双锥 (trigonal bipyramid) +])[Co(NCCH 53、+I]Cu(dipy)[2四方锥 (square pyramid) ][VO(acac)2e .六配位:正八面体 (octahed ron) 6SF 、-6PCl三棱柱 (trigonal prism) ])ph C [Re(S 3222f .七配位:五角双锥 (pentagonal bipyramid) ][ZrF Na 73带帽三棱柱 (the one-face centred trigonal prism) ][ZrF )(NH 734带帽八面体 (the one-face centred octahedron)g .八配位:立方体 (cube) 88H C (立方烷)四方反棱柱(square anti prism ) ]Zr(acac)[4 十二面体(dodecahedron ) 44[Zr(ox)]-[ (NH 3)4Co OO Co(NH 3)2Cl 2 ]2+HH[ Cl(NH 3)3Co O O Co(NH 3)3Cl ]2+HH我们将讨论四、五、六配位配合物的几何异构现象(2) 决定配合物几何异构体数目的因素:a .空间构型:例如正四面体几何构型不存在几何异构体。
高一化学同分异构体知识点

高一化学同分异构体知识点同分异构体是指分子式相同、结构不同的有机化合物。
同分异构体存在于有机化合物的世界中,它们具有相同的分子式,但是它们的结构不同,因此,它们的化学性质和物理性质也存在差别。
同分异构体的研究对于深化我们对有机化合物结构与性质的认识,具有重要的科学意义和应用价值。
下面,我将为大家介绍高一化学课程中关于同分异构体的重要知识点。
一、同分异构体的分类1. 构造同分异构体:它们的分子式相同,但是化学式相同的原子按照不同的顺序相连。
2. 空间同分异构体:它们的分子式相同,但是化学式相同的原子在空间中的排列方式不同。
二、构造同分异构体1. 键式同分异构体:它们的原子通过键的连接方式不同而构成,如异构烷烃和环烷烃。
2. 位置同分异构体:它们的化学式中相同的原子或原子团在主链上的位置不同,如卤代烷烃。
3. 功能同分异构体:它们的化学式中相同的原子或原子团发生了功能性基团的改变,如醛和酮、酸和酯、醇和醚等。
4. 顺反异构体:它们的空间中相同的原子或原子团与其他部分的位置关系不同,如烯烃的顺反异构体。
三、空间同分异构体1. 光学异构体:它们的分子式相同,但是它们在空间中的结构是镜像对称的,无法重合,如手性分子。
2. 几何异构体:它们的分子式相同,但是它们在空间中的结构是由于双键的构象不同而导致的,如具有顺式和反式结构的烯烃。
四、同分异构体的性质和应用1. 密度和沸点的差异:由于结构的不同,同分异构体的密度和沸点也存在差异。
2. 光学活性:光学异构体是具有光学旋光性质的,可以将普通光线分解为左旋光和右旋光。
3. 药物活性:同分异构体的结构不同,其生物活性也不同,对于药物的研发和制造具有重要的指导意义。
同分异构体的研究对于我们深入了解有机化合物的特性和性质具有重要意义,通过对同分异构体的研究,可以为有机合成的优化和新药物的研发提供理论基础和指导。
在高一化学课程中,我们需要掌握同分异构体的分类方法、构造特点以及相关的性质和应用知识,为以后的学习和科学研究打下坚实的基础。
高考有机化学二轮复习同分异构体书写知识点

高考有机化学二轮复习同分异构体书写知识点同分异构现象:化合物具有相同的分子式,但因结构不同而产生了性质上的差异的现象。
同分异构体:分子式相同,结构不同的化合物互称为同分异构体。
1.同分异构体的类别(1)碳链异构:碳骨架不同引起的异构。
(5)对映异构(旋光异构):互为实物与镜像而不可重叠的立体异构体,称为对映异构体(称为对映体),对映异构体都有旋光性,其中一个是左旋的,一个是右旋的,所以对映异构体又称为旋光异构体。
手性碳:与4个不同的原子或原子团相连的碳原子。
(6)构象异构:由于有机分子中σ键可以自由旋转,使分子中的原子或基团在空间产生不同的排列,这种特定的排列形式称为构象。
由单链旋转而产生的异构体称为构象异构体或旋转异构体。
2.同分异构体数目的判断方法一般按碳链异构?位置异构?官能团异构的顺序书写。
(1)记忆法记住一些常见有机物异构体数目。
例如:①凡只含一个碳原子的分子均无异构体;②乙烷、丙烷、乙烯、丙烯、乙炔、丙炔无异构体;③4个碳原子的烷烃有2种异构体,5个碳原子的烷烃有3种异构体,6个碳原子的烷烃有5种异构体。
④苯环上有两个取代基,苯环上的位置有邻、间、对3种。
⑤苯环上有三个取代基。
若三个取代基相同,则有3种结构:若三个取代基中有2个相同,则有6种结构:若三个取代基均不相同,则有10种结构:(2)基元法①丙基的结构有2种[CH2CH2CH3、CH(CH3)2],则丙醇(C3H7OH)、丁醛(C3H7CHO)、丁酸(C3H7COOH)有2种同分异构体。
②丁基的结构有4种,则一氯丁烷(C4H9Cl)、丁醇(C4H9OH)、戊醛(C4H9CHO)、戊酸(C4H9COOH)有4种同分异构体。
③戊基的结构有8种,则一氯戊烷(C5H11Cl)、戊醇(C5H11OH)、己醛(C5H11CHO)、己酸(C5H11COOH)有8种同分异构体。
(3)先定后动法分析二元取代物的方法,如分析C3H6Cl2的同分异构体,先固定其中一个Cl的位置,移动另外一个Cl,从而得到其同分异构体,共四种。
全国高中生化学竞赛专题辅导有机化学一同分异构现象

例2,在丁烷碳链异构体各碳上引入双键和 叁键,形成官能团位置异构体,可形成三个 丁烯异构体和二个丁炔异构体:
例3,碳环化合物也能形成官能团位置异构体 。如甲酚有三个异构体:
例4,在多官能团化合物中,官能团位置异构 体,还表现在官能团间相对位置,如溴代环 已烯可有三个溴代环已烯异构体:
Sachse 1889年质疑张力学说只适合小环 ,提出环己烷有船型、椅型两种构象。
(2) 椅型和船型构象 环己烷保持碳原子的109.5°键角,提出了椅
型和船型构象。
椅型构象:C1、C2、C4、C5在一个平面上,C6和 C3分别在平面的下方和平面的上方,很象椅脚和 椅背,故称“椅型”。 船型构象:C1、C2、C4、C5在一个平面上,C3和 C6在平面上方。形状象只船,C3和C6相当船头和
碳架(骨架)异构现象 官能团位置异构 官能团异构 互变异构
1.1.1 碳架(骨架)异构现象
分子中碳原子相互连接的顺序和方式不同,产生不 同的碳链或碳环,称为碳架(骨架)异构。
1.开链烷烃的碳链异构现象
甲烷CH4、乙烷CH3CH3、丙烷CH3CH2CH3无碳链 异构,如果用甲基-CH3取代丙烷中不同类型的氢原
的方法相似,可以用逐步缩小碳环,缩下来的碳 原子组成不同的基,连到缩小后的碳环的不同位 置上,写出环烷烃碳架异构体。
• 例如:分子式为C6H12的环烷烃可以写出12 个异构体:
1.1.2 官能团位置异构 各类化合物可以看成是官能团取代相应烃
中的氢原子的产物。官能团取代碳架异构体中 的不同氢,形成了官能团位置异构。
在船型构象中,船底上四个 C 中 C1 和 C2 ,
C4 和 C5 是重叠构象,有扭转张力,船头和船尾
无机化学-配位化学基础-配合物的同分异构现象

violet
green
八面体配合物MA3B3异构体
经式
meridional (mer-)
面式
facial (fac-)
八面体配合物MA2B2C2
PtCl2(OH)2(NH3)2 [二氯•二羟•二氨合铂(IV))], 5 种异构体
C A| B
╲╱
M ╱╲ B| A
C 全反
C A|C
╲╱
M ╱╲ B| A
紫色 亮绿色 暗绿色
(4) 配位异构:
[Co(en)3][Cr(ox)3] [Cr(en)3][Co(o在空间排列位置不同引起的异构现象 ➢空间几何异构
➢旋光异构(光学异构)
9.2.2.1 空间几何异构
• 顺反异构
顺式 cis - PtCl2(NH3)2
极性
0
水中溶解度 0.2577 / 100 g H2O
1. 两种异构体互为镜象,但永远不能完全重叠(类 似左、右手关系),称为一对“对映体”, 也称 “手性分子”。 2. 平面偏振光通过这两种异构体时,发生相反方向 的偏转(右旋 d, 左旋 l )。
[Co(en)3]3+
[Co(C2O4)3]4-
l-尼古丁(天然)毒性大 d-尼古丁(人工)毒性小
(1) 键合异构
[Co(NO2)(NH3)5]Cl2 硝基, nitro 黄褐色, 酸中稳定
[Co(ONO)(NH3)5]Cl2 亚硝酸根, nitrito 红褐色, 酸中不稳定
(2) 电离异构
[Co(SO4)(NH3)5]Br [CoBr(NH3)5] SO4
(3) 水合异构
• [Cr(H2O)6]Cl3 • [CrCl(H2O)5]Cl2 ·H2O • [CrCl2(H2O)4]Cl ·2H2O
化学竞赛配位化合物

Ag+: 4d105s0
sp杂化 4d 5s 5p
sp
4d 5p
H3N—Ag+ —NH3 直线形, 键角180°
2NH3
sp
4d
5p
2) 配位数为4的配离子构型
(1)四面体构型[Zn(NH3)4]2+ Zn2+:3d104s0
sp3杂化 3d NH3 Zn NH3 NH3 NH3 3d 4s 4p sp3
3d
4p
3) 配位数为6的配离子构型
(1)[FeF6]3-的空间构型( sp3d2 ) Fe 实验结果: 3+与[FeF6]3-磁性相同,八面体构型
Fe3+: 3d54s0
3d 4s 4p 4d Sp3d2杂化
3d
sp3d2
4d
6F-
3d
sp3d2
4d
配离子的空间构型:
F F Fe F F F F
内界
离子键
K 2 [Hg I4 ]
外 界 配 位 数 内 界
外界
中 配 配 配 配离 心 位 位 位 子的 离 键 体 体 电荷 子 数
1. 中心离子或原子(也称形成体)
有空轨道
主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金
属元素的离子; 或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
用ns、np、nd轨道杂化
配位键
配合物
外轨型配位键
外轨型配合物
正八面体 键角90°
(2) [Fe(CN)6]3-的空间构型( d2sp3 ) 实验结果: 八面体,[Fe(CN)6]3-比Fe3+的磁性小 Fe3+:3d54s0
高三化学同分异构体专题复习总结
高三化学同分异构体专题复习(一)【高考趋向】同分异构体的对象是化合物,属于同分异构体的物质必须化学式相同,结构不同,因而性质不同。
具有“五同一异”,即同分子式、同最简式、同元素、同相对原子式量、同质量分数、结构不同。
同分异构体的书写及数目确定是高考的必考点,通常有两种考查形式:一是以选择题的形式考查同分异构体的数目;二是以非选择题的形式考查某些具有特定结构的同分异构体。
【基础回顾】一、同分异构体的书写同分异构体主要有碳链异构;(官能团)位置异构;(官能团)类别异构等。
1. 碳链异构:碳链不同而产生的异构现象。
如CH3CH2CH2CH2CHO(戊醛)与(CH3)2CHCH2CHO(2-甲基丁醛)。
在碳链异构中首先必须掌握对等效氢原子(有机物分子中位置等同的氢)的判断:(1)连在同一个碳原子上的氢原子是等效的;(2)连在同一个碳原子上的甲基上的氢原子是等效的;(3)处于对称位置或镜面对称位置的碳原子上连接的氢原子是等效的。
如其次,书写的方法好顺序为:(1)缩碳法:先将所给出的碳原子写成一条长链,在此基础上依次减碳;(2)先整后散:这一句话包含两层意思,一是取下来的碳原子若有两个,则为一个CH3CH2-,或者两个CH3-,其他与此类推。
二是若有两个取代基时,先将两个取代基连接在一个主链碳原子上,然后再分开连在不同的碳原子上。
(3)由边到心(或由心到边):若取下来的为一个取代基,则在等效氢的前提下,在主链碳上的连接方式为,从两边到中心(或从中心到两边)。
(4)定一变一:若有两个取代基要将其分开连在不同的碳原子上,首先将一个取代基定位,再变动另一个取代基。
2.位置异构:由于官能团在碳链或碳环上的位置不同而产生的异构现象。
如,CH2=CHCH2CH3和CH3CH=CHCH3; CH3CH2CH2COH(1-丙醇)CH3CH(OH)CH3(2-丙醇)。
3.官能团异构:由于官能团的种类不同而产生的异构现象。
官能团的种类主要有以下几种,烯烃~环烷烃,二烯烃~炔烃,饱和一元醇~醚,饱和一元醛~酮,饱和一元羧酸~酯,芳香醇~芳香醚~酚,硝基化合物~氨基酸,葡萄糖~果糖,蔗糖~麦芽糖。
高中化学竞赛讲座同分异构
同分异构体
高乃群高级教师
1几何异构体:因双键或成环碳原子的单键不能自由旋转而引起的异构体称为几何异构体,也称为顺反异构体。
2互变异构体:因分子中某一原子在两个位置迅速移动而产生的官能团异构体称为互变异构体。
互变异构体是一种特殊的官能团异构体。
3立体异构体:分子中原子或原子团互相连接次序相同、但空间排列不同而引起的异构体称为立体异构体。
4同分异构体:分子式相同而结构不同的化合物称为同分异构体,也称为结构异构体。
5同分异构现象:分子式相同而结构不同的现象称为同分异构现象。
6价键异构体:因分子中某些价键的分布发生了改变,与此同时也改变了分子的几何形状,从而引起的异构体称为价键异构体。
7位置异构体:官能团在碳链或碳环上的位置不同而产生的异构体称为位置异构体。
8构型异构体:因键长、键角、分子内有双键、有环等原因引起的立体异构体称为构型异构体。
一般来讲,构型异构体之间不能或很难互相转换。
9官能团异构体:因分子中所含官能团的种类不同所产生的异构体称为官能团异构体。
10构造异构体:因分子中原子的连结次序不同或者键合性质不同引起的异构体称为构造异构体。
11构象异构体:仅由于单键的旋转而引起的立体异构体称为构象异构体。
有时也称为旋转异构体。
由于旋转的角度可以是任意的,单键旋转360˚可以产生无数个构象异构体。
通常以稳定的有限几种构象来代表它们。
12旋光异构体:因分子中没有反轴对称性而引起的具有不同旋光性能的立体异构体称为旋光异构体。
13碳架异构体:因碳架不同产生的异构体称为碳架异构体。
【高中化学】高中化学知识点:同分异构体
【高中化学】高中化学知识点:同分异构体同分异构现象和同分异构体:1.概念:化合物具有相同的分子式.但结构小同,因而产生了性质上的差异,这种现象叫同分异构现象。
具有同分异构现象的化合物互为同分异构体。
2.同分异构体的基本类型(1)碳链异构:指的是分子中碳骨架不同而产生的同分异构现象。
如所有的烷烃异构都属于碳链异构。
(2)边线异构:所指的就是分子中官能团边线相同而产生的同分异构现象。
如l一丁烯与2一丁烯、l一丙醇与2一丙醇、邻二甲苯与间二甲苯及对二甲苯。
(3)官能团异构:指的是有机物分子式相同,但具有不同官能团的同分异构体的现象。
常见的官能团异构关系如下表所示:(4)顺反异构:由于碳碳双键无法转动而引致分子中原子或原子团在空间的排序方式相同所产生的异构现象。
两个相同的原子或原子团排序在双键的同一侧的称作双键结构;两个相同的原子或原子团排序在双键的两侧的称作反式结构。
例如同分异构体的写法:1.烷烃的同分异构体的读法烷烃只存有碳链异构,其书写技巧通常使用“减碳法”,可以归纳为“两特别注意,四句话”。
(1)两注意:①选择最长的碳链为主链;②找出主链的中心对称线。
(2)四句话:主链由短至长、支链由Marciac贫,边线由心到边,轨域邻、间、对。
例如,c6h14的同分异构体可按此法完整写出(为了简便,在所写结构式中删去了氢原子):2.烯烃的同分异构体的读法分子共同组成合乎cnh2n的烃除烯烃外,除了环烷烃(n≥3),并且烯烃中双键的边线相同则结构相同,有的烯烃还存有顺反异构,所以烯烃的同分异构体比烷烃繁杂得多。
以c5h10为基准表明同分异构体的读法:共有5种烯烃,其中(2)还存在顺反异构体,5种环烷烃,共计11种。
3.苯的同系物的同分异构体的读法由于苯环上的侧链边线相同,可以构成多种同分异构体。
以c8h10为基准写下其属苯的同系物的同分异构体:判断同分异构体数目的方法:1.碳链异构和边线异构:先切除官能团,书写最久碳链,移动官能团的边线;再逐渐增加碳数,移动官能团的边线。
中学化学竞赛试题资源库——配位结构和异构
中学化学竞赛试题资源库——配位结构和异构A 组1.已知[Co(NH 3)6]3+呈正八面体结构:各NH 3分子间距相等,Co 3+位于正八面的中心。
若其中二个NH 3分子被Cl -取代,所形成的[Co(NH 3)4Cl 2]+的同分异构体的种数有A 2种B 3种C 4种D 5种2.Co(NH 3)63+离子是正八面体而非三棱柱或平面六边形构型的理由是A 其一氯取代物不存在同分异构体B 它是非极性分子C 它的键长与键角都相等D 其二氯取代物只存在两种同分异构体3.我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B 12等。
叶绿素的结构如图。
下列有关说法中正确的是 A 叶绿素属于高分子化合物 B 叶绿素分子中含有三种类型的双键 C 叶绿素不属于芳香烃 D 在一定条件下,叶绿素能发生加成、水解、酯化等反应 4.本题涉及4种组成不同的配合物,它们都是平面正方形结构。
(1)PtCl 2·2KCl 的水溶液与二乙硫醚(Et 2S )反应(摩尔比1︰2)得到两种结构不同的黄色配合物,该反应的化学方程式和配合物的立体结构是:(2)PtCl 2·2KCl 的水溶液与足量Et 2S 反应获得的配合物为淡红色晶体,它与AgNO 3反应(摩尔比1︰2)得到两种组成不同的配合物,写出上述两个反应的化学方程式。
5.本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(1)PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为: (2)BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2︰5),生成两种产物,其中一种为配合物,该反应的化学方程式为:6.铍及锌分别为ⅡA 及ⅡB 族元素,在很多性质上相类似。
例如,它们的氧化物及其水合物表现为两性,卤化物有显著的共价性,易于形成配位数为4的配合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§16-2 配位化合物的同分异构现象The Isomerism of Complexes一、总论:1.Definition:凡是化学组成相同的若干配合物,因原子间的连接方式或空间排列方式的不同而引起的结构和性质不同的现象,称为配合物的同分异构现象(isomerism)。
2.Classification(1) 化学结构异构现象(chemical structure isomerism):化学组成相同,原子间的连接方式不同而引起的异构现象,称为化学结构异构现象。
例如:[Co(NH3)5(NO2)]2+和 [Co(NH3)5(ONO)]2+(2) 立体异构现象(stereo isomerism):化学组成相同,空间排列不同而引起的异构现象,称为立体异构现象。
例如:Pt(NH3)2Cl2cis–二氯·二氨合铂(II)trans - 二氯·二氨合铂(II)二、化学结构异构现象,大致分为五类:Ionization isomerism, Hydrate isomerism, Linkage isomerism, Coordination isomerism,Polymerization isomerism. 1.Ionization isomerism(1) Two coordination compounds which differ in the distribution of ionsbetween those directly coordinated and counter-ions present in the crystal lattice are called ionization isomers.(2) e.g. [Cr(NH 3)5Br]SO 4 and [Cr(NH 3)5SO 4]Br 2.Hydrate isomerism (Solvent isomerism)(1) Hydrate isomerism is similar to ionization isomerism except that anuncharged ligand changes from being coordinated to a free-lattice position whilst another ligand moves in the opposite sense.(2) e.g. [Cr(H 2O)6]Cl 3 ,[Cr(H 2O)5Cl]Cl 2·H 2O ,[Cr(H 2O)4Cl 2]Cl ·2H 2O 3.Linkage isomerism(1) The first example of this type of isomerism was provided by J φrgensen,W erner’scontemporary. His method of preparation was as follows :A"solution "Cl]Cl )[Co(NH 23NaNO HCl NH253−−−→−−−→−−−→− red Co(ONO)]Cl )[(NH A"solution "253coldin stand let−−−−−→− yellow )]Cl Co(NO )[(NH A"solution "2253HCl conc heat−−−→−−−→−⋅ (2) It deals with a few ligands (ambidenatate) that are capable of bondingthrough are type of donor atom in one situation not a different atom in another complex. Some authors refer to this type of isomerism as “structura l i somerism” but inasmuch as all isomerism is basically “structural” , the term linkage isomerism is preferable.(3) e.g. +252SCN]O)[Cr(H and +252NCS]O)Cr(H [ +]SSO )Co(NH [353 and +S]OSO )[Co(NH 253 4.Coordination isomerism(1) This may occur only when the cation and anion of a salt are bothcomplexes, the two isomers differing in the distribution of ligands between the cation and anion(2) e.g. ]Cr(Ox)][)Co(NH [363 and ]][Co(Ox))[Cr(NH 363 ]][Cr(SCN))[Cr(NH 663 and](SCN))][Cr(NH (SCN))[Cr(NH 423243]PtCl ][)[Pt(NH 643 and ]][PtCl Cl )[Pt(NH 4243(3) Coordination position isomerismIn this form of isomerism the distribution of ligands between two coordination centers differs e.g. and5.Polymerization isomerism(1) Strictly speaking, polymerization isomerism, in which n varies in thecomplex [ML m ]n is not isomerism. It is included in this list because it represents on additional way in which an empirical formula may give incomplete information about the nature of a complex.(2) For example, all members of the following series are polymerization isomers:])(NO )[Co(NH 3233 1=n ])Co(NO ][)Co(NH [62632=n ])(NO )][Co(NH )(NO )Co(NH [42232243 2=n 24223253])(NO ))][Co(NH (NO )Co(NH [ 3=n 3422363])(NO )][Co(NH )Co(NH [ 4=n 2623253])Co(NO [)](NO )Co(NH [ 5=n三、立体异构现象 (Stereo Isomerism ) 1.几何异构现象 (Geometrical isomerism )(1) 配合物的配位数与几何构型的关系 (The relationship betweencoordination number of complexes and geometrical structure.)a .两配位:直线型 (linear) +23)Ag(NH 、-2CuClb .三配位:平面三角型 (triangle) -][HgI 3c .四配位:平面四方 (square planar) -24PtCl ; 正四面体 (tetrahedron)-24Zn(CN)d .五配位:三角双锥 (trigonal bipyramid) +])[Co(NCCH 53、+I]Cu(dipy)[2四方锥 (square pyramid) ][VO(acac)2e .六配位:正八面体 (octahed ron) 6SF 、-6PCl三棱柱 (trigonal prism) ])ph C [Re(S 3222f .七配位:五角双锥 (pentagonal bipyramid) ][ZrF Na 73带帽三棱柱 (the one-face centred trigonal prism) ][ZrF )(NH 734带帽八面体 (the one-face centred octahedron)g .八配位:立方体 (cube) 88H C (立方烷)四方反棱柱(square anti prism ) ]Zr(acac)[4 十二面体(dodecahedron ) 44[Zr(ox)]-[ (NH 3)4Co OO Co(NH 3)2Cl 2 ]2+HH[ Cl(NH 3)3Co O O Co(NH 3)3Cl ]2+HH我们将讨论四、五、六配位配合物的几何异构现象(2) 决定配合物几何异构体数目的因素:a .空间构型:例如正四面体几何构型不存在几何异构体。
这是因为正四面体的四个顶点是等价的。
空间构型中等价点越多,几何异构体越少。
b .配体种类:在配合物中配体种类越多,几何异构体越多。
例如,八面体配合物:Ma 6(一种),Mabcdef (15种) (a 、b 、c 、d 、e 、f 为单齿配体) c .配体的齿数:双齿配体的两个配位原子只能放置在结构中的邻位位置上,不能放置在对位位置上(跨度大,环中张力太大),即: d .多齿配体中配位原子的种类(及环境):种类越多, 环境越复杂,几何异构体越多。
(3) 几种常见配位数的配合物的几何异构现象 a .四配位:(i) 正四面体:不存在几何异构体(ii) 平面四方:M — 中心体 , AA, AB — 双齿配体 ,a, b, c — 单齿配体。
配合物类型 4Ma22c Ma (cd Ma 2)MabcdM(AA)cd M(AB)cd几何异构体数目 1231 2-cis -trans b .五配位:配合物类型 5M ae Ma 4 23d Ma e c Ma 22 de Ma 3 cde Ma 2 Mabcde三角双锥几何异构体数目 1 2 3 5 4 7 10 四方锥几何异构体数目 12 3 6 4915c .六配位:只讨论正八面体几何构型: 配合物类型 Ma 4e 2(Ma 4ef)Ma 3d 3 Ma 3def Ma 2c 2e 2 Mabcdef M(AB)2ef几何异构体数目2245156+]Cl )[Co(NH 243]O)(H RuCl [323-cis -trans -fac -mer(4) 确定几何异构体的方法 −− 直接图示法a .只有单齿配体的配合物 以Ma 2cdef 为例 (9种): 第一步,先确定相同单齿配体的位置MO O C COO NH 3Co3H 3N Cl H 3NCl Co ClH 3N NH 33H 3NClRu 2H 2O Cl H 2OOH 2Ru 2ClCl 2ClM aa① ②第二步,再确定其他配体的位置 ① (6种): ② (3种):b .既有单齿配体,又有双齿配体的配合物 以M(AB)2ef 为例 (6种) 第一步,先固定双齿的位置① ②第二步,确定双齿配体中配位原子的位置.①②第三步,最后确定单齿配体的位置.2.配合物的光学异构现象(Optical isomerism of coordination compounds )(1) 光学异构体定义a .手性分子(chiral molecular ):当两个分子的对称性互为人的左右手的对称关系,即为镜面对称关系,但它们不能相互重合,则称这两个分子为手性分子,手性分子也称一对对映体(enantiomer )。
