原子晶体
原子晶体 ppt课件

(4)由物质类别
–以上皆否定,则多数是分子晶体。
强碱、绝大多数盐、部分金属氧化物及过氧化物
---离子晶体
多数非金属单质、气态氢化物、非金属氧化物、酸和多数有机物 ---分子晶体
SO2 共价键 分子晶体 SiO2 共价键 原子晶体
CO2 H2O
NaCl HCl
共价键 共价键
离子键 共价键
分子晶体 分子晶体
离子晶体 分子晶体
CCl4 共价键 分子晶体 KCl 离子键 离子晶体
练习7 下列各组物质气化或熔化时,所克服的微粒
间的作用(力),属同种类型的是 ( A D )
(A)碘和干冰的升华
三:原子晶体
原子晶体结构
1、定义:
相邻原子间以共价键相结合而形成空 间网状结构的晶体,叫原子晶体.
(1)构成粒子:
原子
(2)粒子间作用力: 共价键
(3):原子晶体结构上的共同特点: 空间网状结构
原子晶体
金刚石
晶体的硬度
食盐
干冰
金刚石
食盐
石墨
2、物理性质
熔、沸点高,硬度大,难压缩,一 般不导电,难溶于常见溶剂.
离子键---离子晶体 从组共价成键上-判--原断子(晶仅体限于中学范围):
分子间作用力 ---分子晶–体有无金属离子?(有:离子晶体) (3)由熔沸点高低及导电性:
很高--原子晶体 较高-–-离是子否晶属体于“较四低种-原-分子子晶晶体体(金刚石、金 熔融状态能导电--离子晶刚砂体(SiC)、晶体硅、石英(SiO2) )”?
练习4
下列物质中熔点最高的是
A. 硫磺 B. 金刚石
C. 冰
D.食盐
练习5
判断熔点的大小, 说出判断依据
什么叫原子晶体

①石墨为什么很软?
石墨为层状结构,各层之间是范德 华力结合,容易滑动,所以石墨很 软。
②石墨的熔沸点为什么很高?
石墨各层均为平面网状结构,碳原 子之间存在很强的共价键,故熔沸 点很高。
小结:
1、离子晶体、分子晶体、原子晶体比较
离子晶体
组成微粒 阴、阳离子 离子键
分子晶体
分 子
原子晶体
原 子
微粒间作用力
熔沸点 硬度 导电性
分子间作用力 共价键
较高
较大
低
小
高
大 一般为 非导体
水溶液、 非导体,水 熔融态导电 溶液可能导电
2、晶体的熔沸点的比较 (1)不同类型晶体
原子晶体>离子晶体>分子晶体
(2)相同类型晶体 由晶体内微粒间作用力大小来确定
①离子晶体 组成相似的离子晶体,看离子键的强度。 ②分子晶体
复习巩固
1、离子晶体、分子晶体的构成粒子 及 粒子间作用各是什么? 2、影响离子晶体、分子晶体熔沸点、
硬度大小的因素各是什么?
阅读思考:
1、什么叫原子晶体? 2、原子晶体的特点?
3、哪些物质属于原子晶体?
一、原子晶体
1、定义:原子间通过共价键结合 而成的晶体叫原子晶体。 ① 构成粒子:原子
② 粒子间作用:共价键
金刚石、单晶硅、碳化硅、二氧化硅等。
石墨 —混合型晶体
石墨晶体由碳原子构成,是层状结构,层内每 个碳原子与周围三个碳原子以共价键结合,形 成以正六边形排列成平面网状结构,层与层之 间以范德华力相结合,且有自由移动的电子。 构成微粒:原子; 微粒间作用力:共价键和分子间作用力; 石墨晶体具有原子晶体结构特点,又有分子晶 体结构特点,所以属混合晶体过渡型晶体。
原子晶体

每个氧原子连接有几个共价键? 2个
思考5. 在SiO2晶体中最小环是几元 环?
十二元环
思考6. 在SiO2晶体中每个硅原子被几
几种类型化学键的比较 键的方向性 和饱和性 影响键强弱 的因素
成键本质
金属离子和 自由电子间 的静电作用
没有方向性和 金属原子半 径和价电子 饱和性 数
离子键 共价键
阴阳离子间 的静电作用
没有方向性 离子半径和 和饱和性 离子电荷数 键长
成键原子轨道 有方向性和 的最大重叠 饱和性
整理与归纳 晶体比较和判断
思考2. 在金刚石晶体中每个碳原子连接
有几个共价键?
4个
思考3. 在金刚石晶体中碳原子个数与CC共价键个数之比是多少? 1:2
? 8个
思考5. 在金刚石晶体中最小环是几元 环?
六元环
思考6. 在金刚石晶体中每个碳原子被几
个最小环共用? 12个 思考7. 在金刚石晶体中每个最小环拥有 几个C原子?
1/2个
【迁移应用】关于金刚石的下列说法中,错
误的是( D)。
A.晶体中不存在独立的分子
B.碳原子间以共价键相结合
C.是硬度最大的物质之一
D.化学性质稳定,即使在高温下 也不会与氧气发生反应
【问题探究2】水晶的结构
Si O
109º 28´
180º
共价键
思考1:在SiO2晶体中每个硅原子周围紧邻
• 某些氧化物:
二氧化硅( SiO2)晶体
3.原子晶体的物理特性
晶体类型

晶体类型只有4种:离子晶体、原子晶体、分子晶体、金属晶体,
判断晶体类型方法:1、首先判断是否为金属晶体,像Mg、Al、Na等金属都是金属晶体,2、然后判断是否为原子晶体,原子晶体常见的只有金刚石、单质硅、SiO
、SiC,3、再判断是否为离子晶体,离子化合物固态时都是离子晶体。
高中2
阶段常见离子化合物中一般含有活泼的金属元素(如含Li、Na、K、Mg、Ca、Ba元素的强电解质)和铵盐,除此之外的单质和化合物一般为分子晶体。
晶体的熔点:原子晶体>离子晶体>分子晶体
、金刚石。
原子晶体的熔点的比较是以原高中阶段原子晶体有:Si、SiC 、SiO
2
子半径为依据的:金刚石> SiC > Si (因为原子半径:Si> C> O).
分子晶体的熔、沸点:组成和结构相似的物质,分子量越大熔、沸点越高。
3.3 原子晶体

拓展练习
碳化硅和立方氮化硼的结构与金刚石类似,碳化硅硬度仅次于金刚石,立方氮 化硼硬度与金刚石相当,其晶胞结构如图所示。
4
拓展练习
4
4
拓展练习 现有两组物质的熔点数据如表所示 :
根据表中数据回答下列问题: (1)A组属于__原___子___晶体,其熔化时克服的微粒间的作用力是 __共___价__键___。
:
Si
O
共价键 实际上就是在晶体硅的Si—Si 键上插入O原子。
金刚石和二氧化硅
SiO2的晶体结构分析 :(1)1个Si原子周围结合_4___个O原子;同时 ,每个O原子跟2____个Si原子相结合。实际 上,SiO2晶体是由Si、O原子1:按2 _____的比例 所构成的立体网状晶体。 (2)晶体中最小的环是由__6___个Si原子和__6___个O原子构成的 _1_2__元环。
原子晶体
教学目标
知道原子晶体的概念,能够从原子晶体的结构特点理解 其物理特性。
了解原子晶体的特征,能以典型物质为例描述原子晶体 结构与性质的关系。
学会晶体熔、沸点比较的方法 。
教学重点
原子晶体的概念;原子晶体的结构和性质 。
教学难点
原子晶体的结构特点 。
分子晶体 什么是分子晶体?举例说明 。分子间通过分子间作用力结合而成的晶体。例如干冰( CO2晶体)和晶体碘等。
金刚石和二氧化硅
②正四面体向空间延伸成立体网状 ③。所有的C—C键长、键角相等 ④。最小的碳环由6个C组成,不在同一平面内 ⑤。每个C参与了4条C—C键的形成,在每条键中的贡献只有一 半,故C与C—C键数之比为1:(4×½)= 1:2。 ⑥晶体硅结构与金刚石相似,只是键长不同
金刚石和二氧化硅
四种晶体类型

晶体,一般包括离子晶体、分子晶体、原子晶体、金属晶体四种类型。
一、依据构成晶体的微粒和微粒间的作用判断(1)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
(2)原子晶体的构成微粒是原子,微粒间的作用是共价键。
(3)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
(4)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
二、依据物质的分类判断(1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅等。
(4)金属单质是金属晶体。
三、依据晶体的熔点判断。
(1)离子晶体的熔点较高。
(2)原子晶体的熔点很高。
(3)分子晶体的熔点低。
(4)金属晶体多数熔点较高,但有少数熔点相当低。
四、依据导电性判断。
(1)离子晶体溶于水及熔融状态时能导电。
(2)原子晶体一般为非导体。
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
(4)金属晶体是电的良导体。
五、依据硬度和机械性能判断。
(1)离子晶体硬度较大、硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
07-典型晶体简介(原子晶体)

原子晶体( 原晶体(covalent crystal)小结 )
• 两大类型的原子晶体: 两大类型的原子晶体:
晶体中的微粒 微粒间的作用力 典型代表 化学式 物理共性 同种原子 非极性共价键 金刚石、 金刚石、单晶硅 C 不同种原子 极性共价键 碳化硅、 碳化硅、石英
Si SiC SiO2 坚硬易碎、不溶于水、 坚硬易碎、不溶于水、 熔点沸点高、 熔点沸点高、导电导热性能差
金刚石晶体的结构
单晶硅的结构 与金刚石相似
每个C原子周围 每个 原子周围 有4个C原子 个 原子 形成4根 形成 根C-C键 键 键角为109028’ 键角为 最小的碳环为六元环
金刚石晶体的结构
金刚石晶体的晶胞属于面心立方晶胞
碳化硅晶体的结构
每个C原子周围 每个 原子周围 有4个Si原子 个 原子 每个 Si原子周围 原子周围 有4个C原子 个 原子 形成4根 形成 根C-Si键 键 键角为109028’ 键角为 最小的环为六元环
石英(水晶 晶体的结构 石英 水晶)晶体的结构 水晶
每个Si原子周围 每个 原子周围 有4个O原子 个 原子 形成4根 形成 根Si-O键 键 O-Si-O键角为 键角为109028’ 键角为 每个O原子周围 每个 原子周围 有2个Si原子 个 原子 Si-O-Si键角约 键角约104.50 键角约 最小的环上有12个原子 最小的环上有 个原子
典型原子晶体的用途
将单晶硅切割成硅片 经蚀刻、 经蚀刻、沉积等 复杂工艺 加工成集成电路 用多晶硅制造太阳能电池
典型原子晶体的用途
SiO2 水晶饰物、镜片、 水晶饰物、镜片、灯具 玛瑙饰物
典型原子晶体的用途
SiO2 石英坩埚、钟表; 石英坩埚、钟表; 石英光导纤维
无机化学——原子晶体与分子晶体
B
B
C A
A
面心立方 紧密堆积
六方紧密堆积
Body-centered cubic cell (BCC)
体心立方紧密堆积 CN=12,利用率 =68% K、Rb、Cs、Li、 Na A B
A
体心立方 紧密堆积
7.4.2 金属键 金属键:金属原子的价电子可以完全失去成为自由电子,并在 晶格中运动,自由电子把金属阳离子胶合成金属晶体,这种胶 合作用就叫金属键。金属键无饱和性和方向性。
氯化氢、氨、三氯化磷、冰等由极性键构成的极性分子,晶体 中分子间存在色散力、取向力、诱导力,有的还有氢键,所以 它们的结点上的粒子间作用力大于分子量相近的非极性分子之 间的引力。
分子晶体的特性 分子晶体是以独立的分子出现的 ,化学式就是分子式。
分子晶体可以是非金属单质,如卤素、H2、N2、O2; 非金属化合物,如CO2、H2S、HCl、HN3等 绝大多数有机化合物,稀有气体的晶体
7.6.3 离子极化对物质性质的影响 一、离子的电子构型
外层电子结构 电子构型 阳离子实例
ns2np6
8
Na+, Mg2+,Al3+,Ti4+
ns2np6 nd1-9
9-17
Cr3+,Mn2+,Fe3+,Cu2+
ns2np6 nd10
18
Ag+,Zn2+,Cd2+,Hg2+
s2p6d10ns2
18+2
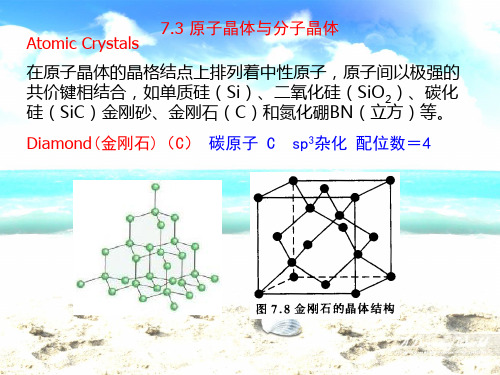
7.3 原子晶体与分子晶体 Atomic Crystals
在原子晶体的晶格结点上排列着中性原子,原子间以极强的 共价键相结合,如单质硅(Si)、二氧化硅(SiO2)、碳化 硅(SiC)金刚砂、金刚石(C)和氮化硼BN(立方)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A
19
小结 晶体类型判断
(1)由构成粒子:
离子--离子晶体 分子--分子晶体 原子--原子晶体
(2)由粒子间作用力:
离子键---离子晶体 从组共价成键上-判--原断子(晶仅体限于中学范围):
分子间作用力 ---分子晶–体有无金属离子?(有:离子晶体) (3)由熔沸点高低及导电性:
很高--原子晶体 较高-–-离是子否晶属体于“较四低种-原-分子子晶晶体体(金刚石、金 熔融状态能导电--离子晶刚体砂(SiC)、晶体硅、石英(SiO2) )”?
由于碳原子半径小于硅原子半径,键长是:
C-C 键< Si-C 键 A< Si-Si 键
11
练习2
化工行业已合成有一种硬度比金刚石还
大的晶体-氮化硅,若已知氮在化合物中
显-3价,推断:
(1)其化学式可能是 Si3N4
.
(2)(2)其晶体类型 原子晶体
是
.
(3)(3)键你能认越为大其硬,硬度度比越金大刚石大的主要
问题:为什么原子晶体的熔沸点很高, 硬度很大?
其本质是因为原子晶体中原子通过很强 的共价键连接,由于共价键比较牢固,要拆 开它需要消耗很大的能量,所以原子晶体 一般具有较高的熔沸A点和较大的硬度. 7
3、常见的原子晶体
• 某些非金属单质:
– 金刚石(C)、晶体硅(Si)、晶体硼 (B)、晶体锗(Ge)等
以下是一些有关晶体性质的数据,判断以下晶 体是否属于同种类型。
晶体 熔点℃ 沸点℃
SiO2 1273 2230
晶体硅 1410 2355
金刚石 2355 3550
原子晶体 熔、沸点高
一般不导电
难溶于A常见溶剂
3
原子晶 体结构
Si
o
思考:构成以上晶体的粒子是什么? 粒子间通过什么样的作用力联系在一起? 以上晶体结构在整体上有什么共同特点?
(4)由物质类别
–以上皆否定,则多数是分子晶体。
9
4、原子晶体熔、沸点的影响因素
原子晶体熔、沸点的高低与共价键的强弱 (即键能的大小)有关。一般说,原子半径 越短,键长越短,共价键的键能越大,熔、 沸点越高。
晶体
液态
熔化时破坏共价键
气态
键长越短 键能越大
共价键越强
物质越稳定
键长:C—C < C– Si < Si—ASi
熔沸点越高 10
练习1 已知金刚砂即碳化硅(SiC)质
原子晶体
共价键(原子半径的大小)
A
14
不同类型的晶体,一般讲,熔沸点:原子晶体>离子晶体>分子晶体。
练习4
下列物质中熔点最高的是
A. 硫磺 B. 金刚石
C. 冰
D.食盐
A
15
练习5
判断熔点的大小, 说出判断依据
HBr 和 HCl
A
16
练习6 下列各组物质的晶体中,化学键类型相同,
晶体类型也相同的是 (
A
原因是
. 12
练习3
晶体类型 定义
(1)、离子晶体、分子晶体、原子晶体结 构与性质关系的比较:
离子晶体 分子晶体 原子晶体
构成粒子
阴阳离子 分子
原子
粒子间作用力 离子键 分子间作用力 共价键
熔沸点 较高
较低高物 理 Nhomakorabea硬度
较大
较小
很大
通
导电性
熔融或水溶 不导电,部分 液中能导电 溶于水导电
不导电,个 别为半导体
第一单元 晶体的类型与性质
第一节 离子晶体、分子晶体和原子晶体
原子晶体
A
1
思考与交流
CO2和SiO2的一些物理性质如下表所示,通过比 较试判断SiO2晶体是否属于分子晶体。
碳元素和硅元素处于元素周期表中同一主族,为
什么CO2晶体的熔、沸点很低,而SiO2晶体的熔 沸点很高?
某些离子晶 体的熔沸点
物质 NaCl KCl RbCl CsCl 熔点 8A 01 776 715 646 2
A
4
三:原子晶体
原子晶体结构
1、定义:
相邻原子间以共价键相结合而形成空 间网状结构的晶体,叫原子晶体.
(1)构成粒子:
原子
(2)粒子间作用力: 共价键
(3):原子晶体结构上的共同特点:
空间网状结构
A
5
三种晶体的熔点
金刚石
晶体的硬度
食盐
干冰
金刚石
食盐
A
石墨 6
2、物理性质
熔、沸点高,硬度大,难压缩,一 般不导电,难溶于常见溶剂.
17
练习7 下列各组物质气化或熔化时,所克服的微粒
间的作用(力),属同种类型的是 ( A D )
(A)碘和干冰的升华
均为分子晶体
(B) 二氧化硅和生石灰的熔化 原子晶体,离子晶体
(C)氯化钠和铁的熔化
离子晶体,金属晶体
(D)水和四氯化碳的蒸发
均为分子晶体
分析:构成物质的微粒间作用(力)相同,其实 质就是物质的晶体类型相同。
性
溶解性
A
一般易溶于水
部分溶于水
不溶 13
(2 )、化学键和分子间作用力的比较:
化学键
分子间作用力
概念 能量
相邻原子或离子间 强 分子间存在的一种 弱
相互作用
相互作用
强
弱
(3)、影响晶体物理性质(熔沸点)的因素:
离子晶体
影响因素
离子键(离子所带电荷数、离子半径的大小)
分子晶体
分子间作用力(组成与结构相似: Mr的大小);若存在氢键,则反常。
• 某些非金属化合物:
– 碳化硅(SiC)晶体、氮化硼(BN)晶 体
• 某些氧化物:
–二氧化硅( SiO2)A 晶体、Al2O3
8
以下是金刚石和晶体硅的
熔、沸点的比较
熔点 沸点
金刚石 3550℃ 4827℃
晶体硅 1410℃ 2355℃
同为结构相同的原子晶体,为什么金刚 石比晶体硅的熔、沸点高?
A
B)
(A)SO2 和 SiO2
(B) CO2 和 H2O
(C)NaCl 和 HCl
(D)CCl4 和 KCl
SO2 SiO2
CO2 H2O
NaCl HCl
共价键 共价键
共价键 共价键
离子键 共价键
分子晶体 原子晶体
分子晶体 分子晶体
离子晶体 分子晶体
CCl4 共价键 分子晶体
KCl 离子键 离A 子晶体
地坚硬,常作优质磨料.其结构和金刚石 相似,只是碳的骨架结构中有一半位置 被硅原子所取代,形成C-Si交替的空间
网状结构.金刚砂属于原子晶体,其熔沸
点与金刚石、晶体硅相比,高低顺序 为 金刚石>碳化硅>晶体硅 .
分析:三种晶体均属原子晶体,其熔点决定于它
们的键长和键能,键长越短,键能越大,其熔点越高。
A
18
练习8 最近,科学家研制得一种新的分子,它具
有空心的类似足球状结构,分子式为C60。下列说法正 确的是( B D )
(A)C60是一种新型的化合物 是一种单质
(B) C60和石墨都是碳的同素异形体 碳元素组成的两种单质
(C)C60中含离子键 (D)C60的分子量为720
含共价键 12×60 = 720
