铁及其化合物用途广泛的金属材料
铁及其化合物导学案完整

铁及其化合物导学案完整一、铁的概述铁是一种非常常见的元素,化学符号为Fe,原子序数为26。
它是地壳中含量最丰富的金属元素之一,广泛用于建筑、制造业等领域。
铁具有良好的导电性和导热性,同时也是人体必需的营养元素之一。
二、铁的性质1. 物理性质铁是一种具有银白色的金属,具有较高的密度和强度。
它的熔点为1535°C,沸点为2750°C。
在常温下,铁是固体状态。
2. 化学性质铁在空气中会与氧气反应生成铁的氧化物,形成铁锈。
铁也可以与硫、氮等元素形成化合物。
此外,铁可以与酸反应产生相应的盐。
三、铁的化合物1. 氧化反应铁可以与氧气发生氧化反应,形成两种不同的化合物:FeO和Fe2O3。
其中,FeO为黑色的物质,Fe2O3为红色的物质。
2. 硫化反应铁也可以与硫反应,形成FeS的化合物。
这种化合物在水中会产生硫化氢气味,有较强的臭味。
3. 氯化反应铁和氯气反应会生成FeCl2和FeCl3两种不同的氯化物。
FeCl2为绿色晶体,FeCl3为黄褐色晶体。
四、铁的用途1. 工业领域铁在工业上被广泛应用于制造钢铁、建筑材料、机械设备等。
其中,钢铁是铁与碳以及其他合金元素的混合物,在建筑、制造业中起着重要的作用。
2. 生活用途铁也在我们的日常生活中发挥着重要的作用。
例如,我们常常用铁制的锅、勺子等炊具;铁制的家具、器皿等都是我们生活中常见的物品。
3. 营养需求铁是人体必需的营养元素之一,它参与了血红蛋白和肌红蛋白的合成,对于人体的造血功能至关重要。
缺乏铁元素会引发贫血等健康问题。
五、铁的环境影响由于铁是一种金属元素,大量的铁在自然界中会对环境产生一定的影响。
例如,铁的氧化反应会形成铁锈,导致金属锈蚀。
此外,不适当的铁的排放会对水质等环境因素产生负面影响。
六、结语铁是一种重要的金属元素,具有广泛的应用价值。
我们应该在合理使用铁的同时,注意对环境产生的影响,以保护我们的生活环境。
同时,合理补充铁元素也是保持健康的重要举措之一。
铁及其化合物知识点

铁及其化合物知识点铁是我们日常生活中常见且重要的金属元素,其化合物在生产生活、工业、化学研究等方面都有着广泛的应用。
下面就让我们一起来深入了解一下铁及其化合物的相关知识。
一、铁元素的基本性质铁的原子序数是 26,位于元素周期表的第四周期第Ⅷ族。
铁的原子核外电子排布为 2、8、14、2,常见的化合价有+2 价和+3 价。
在化学反应中,铁的化学性质比较活泼,能与许多物质发生反应。
铁在纯氧中可以燃烧,生成四氧化三铁(Fe₃O₄),化学方程式为:3Fe + 2O₂=点燃= Fe₃O₄。
铁还能与稀盐酸、稀硫酸等发生置换反应,生成亚铁盐和氢气,例如:Fe + 2HCl = FeCl₂+ H₂↑ 。
二、铁的氧化物1、氧化亚铁(FeO)氧化亚铁是一种黑色粉末,其中铁为+2 价。
它不稳定,在空气中加热时迅速被氧化为四氧化三铁。
2、氧化铁(Fe₂O₃)氧化铁俗称铁红,是一种红棕色粉末,常用于涂料、油漆等工业。
其中铁为+3 价。
3、四氧化三铁(Fe₃O₄)四氧化三铁俗称磁性氧化铁,是具有磁性的黑色晶体。
它可以看作是由氧化亚铁和氧化铁组成的复杂化合物,其中有+2 价和+3 价的铁。
三、铁的氢氧化物1、氢氧化亚铁(Fe(OH)₂)氢氧化亚铁是白色沉淀,但在空气中极易被氧化,迅速变成灰绿色,最终变成红褐色的氢氧化铁。
化学方程式为:4Fe(OH)₂+ O₂+2H₂O = 4Fe(OH)₃。
2、氢氧化铁(Fe(OH)₃)氢氧化铁是红褐色沉淀,具有两性,但碱性强于酸性。
它受热易分解,生成氧化铁和水:2Fe(OH)₃=△= Fe₂O₃+ 3H₂O 。
四、铁盐和亚铁盐1、亚铁盐常见的亚铁盐有硫酸亚铁(FeSO₄)、氯化亚铁(FeCl₂)等。
亚铁盐溶液通常呈浅绿色,具有较强的还原性,容易被氧化剂氧化为铁盐。
例如,氯化亚铁溶液能被氯气氧化:2FeCl₂+ Cl₂= 2FeCl₃。
2、铁盐常见的铁盐有硫酸铁(Fe₂(SO₄)₃)、氯化铁(FeCl₃)等。
《铁及其重要化合物》课件

铁及其化合物的性质与变化 规律
铁的氧化物的性质与变化规律
铁的氧化物分类
根据铁的氧化态,铁的氧化物 可分为氧化亚铁、氧化铁和四
氧化三铁。
物理性质
这些氧化物通常是黑色或红棕 色固体,具有金属光泽。
化学性质
铁的氧化物具有还原性和氧化 性,具体性质取决于其组成和 反应条件。
变化规律
铁的氧化物在高温下可被还原 为铁单质,如四氧化三铁在高 温下可与碳反应生成铁和二氧
铁的硫酸盐的制备方法
铁的硫酸盐种类
01
常见的铁的硫酸盐有硫酸亚铁(FeSO4)和硫酸铁(
Fe2(SO4)3)。
制备方法
02
硫酸亚铁可通过铁粉与稀硫酸反应制备;硫酸铁则由铁的氧化
物与浓硫酸反应得到。
注意事项
03
在制备过程中,需注意防止酸雾等有害气体泄漏,同时要确保
反应完全,以获得高纯度的产物。
05
化学性质
氯化亚铁具有还原性,易被氧化为氯化铁。氯化铁具有氧化性, 可与还原剂反应生成氯化亚铁。
变化规律
氯化亚铁在空气中易被氧化为氯化铁,而氯化铁在高温下可与氢 气反应生成氯化亚铁和氢气。
铁的硫酸盐的性质与变化规律
物理性质
常见的铁的硫酸盐包括硫酸亚铁和硫酸铁。硫酸亚铁是白色至浅绿 色的固体,而硫酸铁则是黄色至棕色的固体。
钢铁在建筑、机械、汽车、铁 路等领域广泛应用,用于制造 各种结构件、零部件和工具等 。
铁化合物在工业上的应用
硫酸亚铁等铁化合物可用于制造 颜料、染料、农药和医药等。
氧化铁红等铁化合物可用作塑料 、橡胶和油漆等领域的着色剂和
填充剂。
铁化合物在工业中还用于电镀、 印刷、电子等领域,起到催化、
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案
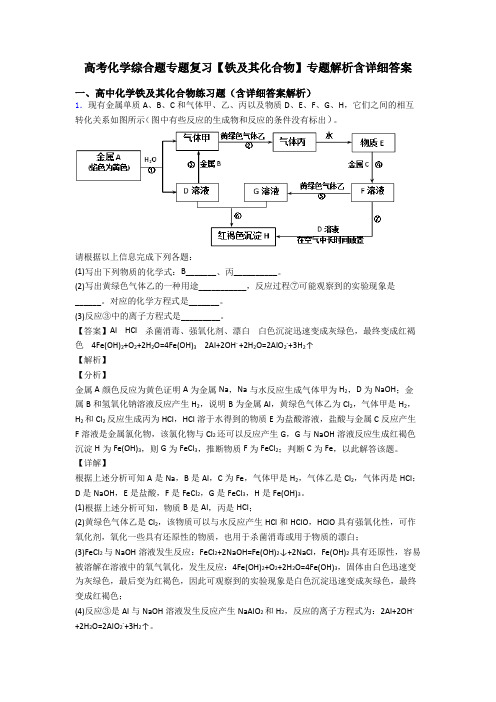
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
铁及其化合物知识点总结

铁及其化合物知识点总结铁是地球上最常见的元素,它是所有金属之中最丰富且最廉价的金属,其化合物用于各种工业用途,广泛应用于各行各业。
在过去的大约三十年里,铁化合物的应用越来越广泛,它们的重要性也越来越凸显。
本文将总结铁及其化合物的一些基本性质、应用及相关知识。
一、铁及其原子构造铁是一种稀土元素,质子数为26,相对原子质量为55.85,在常温下为固体,颜色为淡灰色,具有较高的氧化还原性;它的原子构造由26个质子和26个电子组成,由2s2 2p6 3s2 3p6 4s2 3d6组成,具有6种不同配位形式,形成6种不同的铁化合物。
二、铁及其化合物的性质(1)铁具有较高的熔点和沸点,比其他金属熔点和沸点都高;(2)铁熔点为1538℃,沸点1811℃,它的密度在所有金属中是最大的;(3)铁具有优良的导热性、导电性和磁性,可以用于制造各种机械设备;(4)铁具有较强的化学稳定性,不容易产生化学反应,是制造永久性金属制品的重要材料。
三、铁及其化合物的应用(1)铁及其化合物主要用于机械制造,可以用于制造电机、火车、汽车、家具等;(2)铁及其化合物可用于航空、航天、化工、冶金等领域,用于装配零部件、组装大型设备等;(3)铁及其化合物也可以用于环保、防护、电力等领域;(4)铁及其化合物的应用还可以扩展到人工智能、芯片等领域。
四、铁及其化合物的安全防护(1)使用铁及其化合物时,应按照规定使用防护用品,如防护眼镜、手套等;(2)运输铁及其化合物应采取安全措施,如将化合物封装好,避免发生灼伤或污染环境;(3)制造铁及其化合物过程中,应注意环境保护和安全,保证工厂安全,并确保排放的污染物按照法律法规规定管控。
本文总结的铁及其化合物的一些性质、应用及相关知识,有助于深入理解铁及其化合物的性质与应用。
此外,还应特别注意铁及其化合物的安全防护措施,以确保正确使用该类物质,减少造成污染和伤害的可能性。
思维导图整理铁及其化合物相关知识体系

思维导图是一种有效的组织思维和记忆的方式,它可以帮助我们整理铁及其化合物的
相关知识体系。
首先,铁是一种常见的元素,在原子序号为26的元素中排第四位,其原子量为
55.85,是地壳中最丰富的金属元素,在大气层、水层中都有分布,其具有高度磁性。
其次,铁的化合物具有广泛的应用,其中最常见的是氧化铁,它是一种铁的氧化物,
有三种形态:α-Fe2O3、γ-Fe2O3和δ-Fe2O3,其中α-Fe2O3常用于制造颜料,γ-Fe2O3
制作磁性材料,δ-Fe2O3制作电磁铁及磁铁等;此外,还有其他常见的铁化合物如氢氧化铁、硫酸铁等,这些都是具有重要用途的化合物,在工业生产中有着广泛的应用。
最后,铁及其化合物的分析和检测也是重要的内容,常见的分析方法有物理性质分析,包括熔点、沸点、溶解度、电导率等;化学性质分析,包括氧化性、水解性、碱解性、离
子交换性等;以及分光光度法、X射线衍射法、电化学分析法和核磁共振法等其他分析技术。
总之,铁及其化合物的相关知识体系是相当丰富的,通过使用思维导图的方式,我们
可以更加有效地整理这些知识之间的关系,更好地记忆和理解这些知识点。
铁重要化合物课后反思

铁重要化合物课后反思引言在铁重要化合物课程的学习过程中,我对铁及其化合物的性质和应用有了更深入的了解。
通过理论学习和实验实践,我对铁的重要性以及其在生活和工业中的广泛应用有了更加深刻的认识。
在本文中,我将结合自己的学习经历,进行课后反思和总结。
重要的铁铁是地球上最常见的金属之一,也是人类历史上最重要的金属之一。
它具有优良的物理和化学性质,包括良好的导电性和导热性,较高的熔点和磁性,使其在各个领域都有广泛的应用。
在生活中,铁是我们不可或缺的物质之一。
我们使用的大部分金属器具和工具都含有铁。
例如,锅、刀具、桌椅等都是由铁制成。
此外,铁在建筑和交通运输领域也发挥着重要的作用。
例如,大型建筑物的框架、桥梁和道路上的车辆都需要使用铁材料。
在工业领域,铁同样具有重要的地位。
钢铁工业是现代工业的基础,而铁是钢铁的主要成分。
由于铁具有良好的可塑性和强度,使得钢铁具有广泛的应用领域,如建筑、航空航天、汽车制造等。
铁化合物的应用除了纯铁外,铁还可以与其他元素形成多种化合物,这些化合物在各个领域也具有重要的应用。
铁氧化物铁氧化物是铁的重要化合物之一,常见的有三种:黑色的Fe3O4,红色的Fe2O3和棕色的FeO。
这些铁氧化物广泛用于颜料、磁性材料和催化剂等领域。
黑色的Fe3O4用于磁性材料,如磁铁、磁卡和磁带等。
它们具有良好的磁性,被广泛应用于电子和通信设备。
红色的Fe2O3是一种常见的颜料,被广泛应用于油漆、陶瓷和橡胶制品等。
它具有良好的遮盖性和稳定性,可以为产品提供持久的颜色。
棕色的FeO常用于催化剂,如催化转化和催化裂化。
它们可以促使化学反应的进行,并加速反应速度。
铁盐铁还可以形成多种盐,如铁酸盐、铁氯化物和铁硫酸盐等。
这些铁盐在医药、化学和环境等领域具有广泛的应用。
铁酸盐在医药领域具有重要的作用。
例如,硫酸亚铁被广泛用于治疗贫血,它可以补充身体所需的铁元素。
铁氯化物在化学实验中常被用作氯离子的源,同时也是一种常见的水处理剂。
人教版高中化学必修 化学1 第三章 第三节 用途广泛的金属材料(1课时)

硬铝
钛合金
金合金
含铜4%、 镁0.5%、 锰0.5%、 硅0.7% 含铝6% 钒4% 加入银、铜、 稀土元素等
硬度和强度都比 纯铝和纯镁大
火箭、飞机、轮 船等制造业
耐高温、耐腐蚀、 用于飞机、宇航、 高强度 化学工业
2014年5月22日星期四 34
二、正确选用金属材料
——南方:中重稀土资源,分布在江西 、广东、广西、福建、湖南等省,以罕 见的离子态赋存与花岗岩风化壳层中, 主要含钐、铕、钆、铽、镝、钬、铒、 铥、镱、镥、钇和镧、钕等元素。
2014年5月22日星期四
35
二、正确选用金属材料
稀土作为基体元素能制造出具有 特殊“光电磁”性能的多种功能材料, 如稀土永磁材料,稀土镍氢电池材料, 稀土荧光材料,稀土催化剂。稀土激 光材料,稀土精密陶瓷材料。生物工 程材料等,它们都是发展电子信息产 业,开发新能源,治理环保和国防尖 端技术等方面必不可缺少的材料。
低碳钢---含碳量低于0.3% 中碳钢---含碳量0.3%~0.6%
钢
高碳钢---含碳量高于0.6%
合金钢:在碳素钢中加 入铬、锰、钨、镍、钼、铬、钨---高速钢,硬度大,韧性很强 钴等合金元素
锰、硅---锰硅钢,韧性特强
镍、铬---不锈钢,抗腐性强,不易氧化
2014年5月22日星期四
14
一、常见合金的重要应用
塑钢
质轻高强、美观、 适中 耐腐蚀 保温隔热、隔音降 较高 噪
较高
2014年5月22日星期四
27
二、正确选用金属材料
选择方案:铝合金
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a
8
2.铁与稀HNO3反应的分析与产物判断 (1)分析关键
a
13
1.铁的氧化物
名称 (俗名)
氧化亚铁
化学式
FeO
铁的
化合价
+2
氧化铁(铁红)
四氧化三铁(磁性 氧化铁)
Fe2O3
+3
Fe3O4 +2( )、 +3( )
a
14
名称 (俗名) 色态 溶解性
氧化亚铁
四氧化三铁 氧化铁(铁红)
(磁性氧化铁)
黑色粉末 红棕色粉末 黑色晶体
都不溶于水,但溶于酸溶液
a
FeS
.
(2)与H2O(g)反应 化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2 .
a
5
(3)与酸反应
①铁与非氧化性酸(如稀H2SO4、盐酸等)反应生成Fe2+, 放出H2.其离子方程式为: Fe+2H+ === Fe2++H2↑ . ②铁与氧化性酸反应,不放H2. 常温下遇 浓H2SO4、 浓HNO3 发生钝化.
2.化学性质 铁是一种变价金属元素,通常显 +2价和+3 价.
a
4
(1)与非金属反应
铁和氧气反应:①常温下发生腐蚀生成 Fe2O3 .
②点燃条件下生成Fe3O4,化学方程式为:
3Fe+2O2
Fe3O4 .
铁和氯气反应,化学方程式为: 2Fe+3Cl2
2FeCl3 .
铁和硫反应,化学方程式为:Fe+S
Fe2O3+3CO2Fe +3CO2
四氧化三铁(磁性 氧化铁)
Fe3O4+4CO 3Fe+4CO2
a
17
名称 (俗名)
空气中 的稳定
性
氧化亚铁
四氧化三铁 氧化铁(铁红) (磁性氧化铁)
不稳定,空 气中加热, 生成Fe3O4
稳定
稳定
a
18
2.铁的氢氧化物
化学式
Fe(OH)2
Fe(OH)3
色态 与非氧
a
20
化学式
Fe(OH)2
易被氧化,受热分解, 稳定性
产物很复杂
制法
可溶性亚铁盐与碱溶液 反应:
Fe2++2OH- === Fe(OH)2↓
Fe(OH)3 受热易分解:
2Fe(OH)3 Fe2O3+3H2O
可溶性铁盐与碱溶液反 应:
Fe3++3OH- === Fe(OH)3↓
a
21
化学式
Fe(OH)2
3.采用新制备的亚铁盐溶液,溶解亚铁盐时要先将
蒸馏水煮沸除去氧气.
4.向亚铁盐溶液中滴加碱溶液时,将胶头滴管的尖
嘴插入亚铁盐溶液的深部,使Fe(OH)2生成于溶氧
少的部位.
a
23
Fe(OH)2的制备操作改进型设计,如下图:
a
24
根据Fe(OH)2氧化成Fe(OH)3的过程中的颜色变化可 用于物质的推断.
少量铁与稀HNO3反应:Fe+4HNO3 === Fe(NO3)3+NO ↑ +2H2O .
a
6
(4)与盐溶液反应 铁和CuSO4溶液反应:Fe+Cu2+ === Fe2++Cu. 铁和FeCl3溶液反应: Fe+2Fe3+ === 3Fe2+ .
a
7
铁反应的产物 1.铁与不同氧化剂反应的产物判断
2NO↑+4H2O
a
9
(3)产物判断
a
10
Fe若被强氧化剂氧化生成Fe3+,在Fe过量时,因 发生反应Fe+2Fe3+ === 3Fe2+,最终生成Fe2+.
a
11
1.下列关于铁的叙述正确的是
()
①铁能被磁铁吸引,但纯铁易腐蚀
②在人体的血红蛋白中含有铁元素
③铁位于元素周期表中第四周期第ⅧB族
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
色固体
白
色固体
红褐
化
性酸反 Fe(OH)2+2H+=== Fe2+ Fe(OH)3+3H+===
应 +2H2O
Fe3++3H2O
a
19
化学式
与氧化性 酸反应
Fe(OH)2
3Fe(OH)2+ 10HNO3(稀) === 3Fe(NO3)3+ NO↑ +8H2O
Fe(OH)3
Fe(OH)3+3H+=== Fe3++3H2O
①明确哪种物质过量
②根据两种物质的物质的量分析判NO3 === Fe(NO3)3+NO↑+2H2O ②Fe过量时:还发生反应Fe+2Fe(NO3)3 === 3Fe(NO3)2,两 者相加得总化学反应方程式:3Fe+8HNO3 === 3Fe(NO3)2 +
⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3
⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③
B.②④
C.②⑤
D.④⑥
a
12
解析:当铁中含有杂质时,在潮湿的空气中会发生电化
学腐蚀反应,所以,纯铁的抗腐蚀能力较强;铁位于元
素周期表的第Ⅷ族,而不是第ⅧB族;铁在氧气中可以 剧烈燃烧,而与水蒸气反应则看不到燃烧现象;Fe与 HNO3反应的产物可能因铁过量而生成Fe(NO3)2;FeCl2、 Fe(OH)3都可通过化合反应Fe+2FeCl3 === 3FeCl2,4Fe(OH)2+O2+2H2O === 4Fe(OH)3制得. 答案:B
a
1
【考纲点击】 1.了解金属铁及其重要化合物的主要性质及应用. 2.了解合金的概念及其重要应用.
a
2
【考情播报】 1.与生产、生活相联系考查铁及其化合物的重
要应用. 2.结合实验、推断考查Fe(OH)2的制备、Fe2+与
Fe3+的相互转化及检验. 3.常见铁、铜、铝合金的主要性能及应用.
a
3
1.物理性质 铁是 银白色 金属,熔沸点 较高 ,抗腐蚀性强,能被 磁铁吸引,具有金属的一般物理性质.
15
名称 (俗名)
与H+ 反应
氧化亚铁
氧化铁 (铁红)
四氧化三铁 (磁性氧化铁)
FeO+2H+ === Fe2+
Fe2O3+6H +=== 2Fe3+
+H2O
+3H2O
Fe3O4+8H+=== Fe2++2Fe3++4H2O
a
16
名称 (俗名)
氧化亚铁
与CO 反应
FeO+CO Fe+CO2
氧化铁(铁红)
Fe(OH)3
二者的 关系
空气中,Fe(OH)2能够非常迅速地被氧气氧化成
Fe(OH)3,现象是白色沉淀
迅速灰变绿成
色,
最后变红成褐
色,化学方程式4为Fe:(OH)2+O2+2H2O
=== 4Fe(OH)3
a
22
Fe(OH)2制备中的防氧化措施 1.赶尽空气,应在惰性或还原性气体气氛下反应(如
N2、H2等). 2.隔绝空气,如用苯、汽油、煤油覆盖在液面上.
