哈佛大学高等有机化学讲义Lecture34
合集下载
高等有机化学课件立体化学

C6H5
C -C10H7
C6H5 C10H7-
Chiral axial
[20oC =+437o [20oC =-437o
原因:
单键旋转受阻的联苯型化合物 在邻位上连接体积较大的取代基时,单键旋转 受阻;如果取代基又不相同,
则该分子具备了不对称条件而具有手性轴,这 样的分子也具有手性。
CH3 CH3
CH3
COOH H Br
CH3 (R)
CH3 HH
CH3
COOH HH R CH3 S
CH3 XH
CH3
COOH Br H
CH3 (S)
丙酸中被取代的两个氢原子的地位并不相等,分别处在一个为右旋的和另一个为左 旋的结构环境中。显然,丙酸中的C-2 原来是一个非手性中心,经 α-溴代后变成了一 个手性中心。因此 当一个碳原子连接着两个相同基团和两个不同基团时,如CX2YZ, 此碳原子称为前手性中心(预手性中心)(prochiral center).
O
HOOC 3 R-构型
H2C HOOC
H2C
CH2 COOH
CH2
R,S-构型
3 2 1O R-构型
3 2 1O S-构型
(1)手性面是苯环的平面。 (2)为了决定从哪个方向瞭望手性面,按下列规则选择参照原子。在与手性面
直接相连的面外的原子中,选择位次最高的原子作为参照原子。 (3)与参照原子直接相连的手性面上的原子开始,按位次规则编号。 (4)从参照原子方向开始,按顺序旋转,旋转方向为右,那么化合物的构型是
C 2' CH
H O
HO H3C H3C
CH2OH Br
2' CH2OH H Br
6'CH3
高等有机化学第三部分3-3.ppt
R-X + Y
. . R X
R +Y
R-X + Y(自由基离子形成)
.R + X
(电子转移)
RY
. or: R + Y-
RY
R Y +R X
R Y+ R X
10
SET的例证之一
.
Y
X +Y
.
(X=I, NO2等)
11
(四) 邻基参与机理(Neighboring-Group) 常有这样的情况: a.反应速度比预期的快 b.构型保留
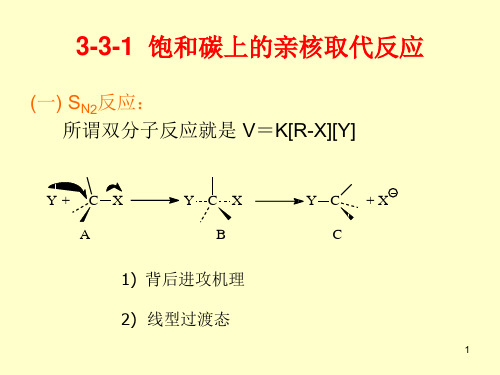
3-3-1 饱和碳上的亲核取代反应
(一) SN2反应: 所谓双分子反应就是 V=K[R-X][Y]
Y+ C X A
YCX B
Y C +X C
1) 背后进攻机理 2) 线型过渡态
1
1) 背后进攻机理
虽然SN2机理是在1937年由Hughs和Ingold 等人正式提出,但早在1893年Walden就发现了 这个取代反应中的构型翻转,所以现在人们又 称Walden翻转。
RX
RX
RX
R +X
紧密
松散
游离的离子
部分构型保留
消旋化
(溶液分隔)
部分保留和彻底的消旋化是SN1的特点。
注意:实际上很少纯粹的SN1或SN2反应,很多是二者都有。
9
(三)SET机理(Single Electron Transfer) 在亲核取代反应中有一类含有自由基或自由基
离子中间体,这类反应是通过SET机理进行的。
Allyl
40
Bn
120
* 位阻小的反应快,烯丙基反应快。
25
《高等有机化学基础》课件

1 2
官能团
决定有机化合物性质的原子或原子团。
系统命名法
按照一定的规则给有机化合物命名的方法。
3
俗名
根据有机化合物的来源或性质得来的名称。
04
有机化学反应机理
取代反应
总结词
取代反应是有机化学中常见的一 种反应类型,其中一个原子或基 团被另一个原子或基团所取代。
详细描述
在取代反应中,一个原子或基团被 另一个原子或基团所取代,生成新 的化合物。这种反应通常涉及电子 的转移和重排。
有机化学在材料科学中的应用
01
高分子材料
有机化学在高分子材料的合成、改性和加工中发挥重要作用,包括合成
功能性高分子材料、研究高分子链的构象和运动等。
02 03
纳米材料
有机化学在纳米材料的合成和修饰中具有广泛应用,如制备碳纳米管、 纳米颗粒和纳米纤维等,并研究它们在能源、催化、生物医学等领域的 应用。
06
有机化学的应用
有机化学在医药领域的应用
药物合成
有机化学在药物合成中发挥着重要作用,通过设计合成路 线和优化反应条件,制备出具有生物活性的药物分子。
药物代谢
有机化学研究药物在体内的代谢过程,包括药物的吸收、 分布、代谢和排泄等环节,有助于理解药物作用机制和优 化药物设计。
药物筛选
有机化学在药物筛选中发挥关键作用,通过高通量筛选和 虚拟筛选等方法,发现具有潜在生物活性的小分子化合物 ,为新药研发提供候选药物。
详细描述
我们日常生活中的许多物品,如衣物、食品、建筑材料和交通工具等,都与有机化合物密切相关。例 如,衣物中的纤维和染料、食品中的添加剂和防腐剂、建筑材料中的塑料和油漆等,都是有机化合物 。此外,许多医疗药物也是有机化合物,对人类的健康和疾病治疗具有重要作用。
哈佛大学高等有机化学讲义Lecture11
(2) CYCLOADDITION REACTIONS/CYCLOREVERSION REACTIONS:
A cycloaddition reaction is the union of two smaller, independent pi systems. Sigma bonds are created at the expense of pi bonds. A cycloaddition can occur in an intramolecular sense, but it must be between two independent pi systems. Cycloaddition reactions are referred to as [m + n] additions when a system of m conjugated atoms combines with a system of n conjugated atoms. A cycloreversion is simply the reverse of a cycloaddition. Examples:
s Woodward-Hoffmann Theory R. B. Woodward and R. Hoffmann, The Conservation of Orbital Symmetry, Verlag Chemie, Weinheim, 1970. s Frontier Molecular Orbital Theory I. Fleming, Frontier Orbitals and Organic Chemical Reactions, John-Wiley and Sons, New York, 1976. s Dewar-Zimmerman Theory T. H. Lowry and K. S. Richardson, Mechanism and Theory in Organic Chemistry, 3rd Ed., Harper & Row, New York, 1987. s General Reference R. E. Lehr and A. P. Marchand, Orbital Symmetry: A Problem Solving Approach, Academic Press, New York, 1972.
哈佛大学高等有机化学讲义Lecture12

Con
HOMO
disrotatory
Examples
Ground State Conrotatory
Excited State Disrotatory
Con
LUMO
HOMO
Disrotatory
Conrotatory
Activation Energy (kcal/mol) for electrocyclic ring opening
dis-out
favorable H Me R A
Three-Atom Electrocyclizations (4 electrons)
H H A H A Dis?? R C H A Con?? R H A A H
relative rate
1
4
40,000
Ψ3
Ring-fused Cyclopropyl Systems When the cis substiltutents on the cyclopropyl ring are tied together in a ring the following observsations have been made
D. A. Evans
Pericyclic Reactions: Part–2
s Other Reading Material:
Chem 206
/~chem206/
Chemistry 206 Advanced Organic Chemistry
Electrocyclic Processes-1
Chem 206
Controtation and on to the indicated bonding and anti-bonding orbitals of cyclobutene:
HOMO
disrotatory
Examples
Ground State Conrotatory
Excited State Disrotatory
Con
LUMO
HOMO
Disrotatory
Conrotatory
Activation Energy (kcal/mol) for electrocyclic ring opening
dis-out
favorable H Me R A
Three-Atom Electrocyclizations (4 electrons)
H H A H A Dis?? R C H A Con?? R H A A H
relative rate
1
4
40,000
Ψ3
Ring-fused Cyclopropyl Systems When the cis substiltutents on the cyclopropyl ring are tied together in a ring the following observsations have been made
D. A. Evans
Pericyclic Reactions: Part–2
s Other Reading Material:
Chem 206
/~chem206/
Chemistry 206 Advanced Organic Chemistry
Electrocyclic Processes-1
Chem 206
Controtation and on to the indicated bonding and anti-bonding orbitals of cyclobutene:
高等有机化学课件

H C. H2
R2
R1 R2
R1 H
HH
H R2
(构型保持,顺式) (构型翻转,反式)
2.2 对羰基的加成
R O + CH2N2
R
RO R C CH2
CH3CCH2CH2CH3 + CH2N2
CH3
O
O C CH2
CH2CH2CH3
3、重排反应:Wolff重排反应
O RCOOH SOCl2 RCOCl CH2N2 RCCHN2 Ag2O ,H2O RCH2COOH
R1 R C+
R2
碳正离子
R1 R C.
R2
自由基
R1 _ R C:
R2
碳负离子
R1 R C:
卡宾
..
R N:
乃春
第一节:卡宾(碳烯(Carbene)
卡宾是指电中性含二价碳的化合物,如:
: CCl2 :CBr2 :CHCOOR
RCH : R2C : CH2 :
R C C:
R
R C C C:
R
:C C:
2004年1版 6、洪琳编《有机反应活性中间体》高等教育出版社1999.6第一版 7、斯图尔特.沃伦著《有机合成――切断法探讨》丁新腾译,上海科学
技术文献出版社1986年1月第一版 8、黄宪、吴世晖、徐汉生《有机合成》(上、下)
第一章 有机反应活泼中间体及在合成上的应用
在有机反应中,经常出现的活泼中间体是卡宾、乃春、自由基、碳正离子、 碳负离子(包括苯炔、叶立德)
高等有机化学课件
第一章 有机反应活泼中间体 及在合成上的应用
第一节:卡宾(碳烯)(Carbene) 第二节: 乃春 第三节:自由基 第四节:碳正离子 第五节、碳负离子(Carbenion)(活泼亚甲基
哈佛大学高等有机化学讲义Lecture33A

33A-06 3/14/96 11:22 PM
Shea, K. J.; Zandi, K. S.; Staab, A. J.; Carr. R. Tetrahedron Lett. 1990, 31, 5885.
CO2Et
R=H 90
R = Me >99
: :
t-Bu t-Bu
Si
OO
10
<1
R
CO2Et
Note: Intermolecular variant gives 1:1 ratio with opposite regiochemistry.
Gillard, J. W.; Fortin, R.; Grimm, E. L.; Maillard, M.; Tjepkema, M.; Bernstein, M. A.; Glasser, R. Tetrahedron Lett. 1991, 32, 1145.
- Function of tether length and steric bulk of alkyl substituents on silicon
❏ Functional Group Protection
- Serves as protecting group before and after reaction ❏ Facile Refunctionalization
- Protodesilylation, Tamao oxidation, allylsilane additions, and transmetallations are possible
Diels-Alder To Form 5-Atom Tether Ring:
OH SiR2Cl
高等有机化学精品PPT课件

取向问题
单重态H2拉伸过程的电子密度差等值线动画
* 图中虚线代表相对于两原子都在孤
立状态时电子密度减小的区域,实 线代表增加的区域。可见,一开始 原子离得远,相互作用很弱,对原 始电子密度几乎没有影响,几乎没 出现等值线。随着它们离近,由于 Pauli互斥导致中间电子密度大幅减 少,电子纷纷转移向两端了
共振结构中需要注意的几个问题(2)
1) 在书写共振式时, 只允许电子的位置改变, 原子的位置不能变动。如烯丙基正
离子可以写成
但不能写成CH3- CH=CH.
2)含完整八隅体的结构比在价电子层上少于8 个电子的结构更稳定, 较稳定的共 振式对杂化体的贡献较
Ⅰ式中的正碳有6 个电子, 而Ⅱ式中的碳原子有8 个电子, 所以Ⅱ式较稳 3) 共价键的数目愈多, 结构中电荷分离数目愈小, 该共振 结构愈稳
* 随距离拉近后,电子密度迅速在原
子间聚集,表明共价键正在加强。 聚集的区域一开始逐渐变大并逐渐 变得扁长,但后来却开始收缩并变 得接近于球型,最后一帧电子密度 减少区域和增加区域都几乎变成了 球对称状,前者包着后者。这是因 为原子序数越大,核吸引势越强, 电子密度分布范围收缩得越厉害
4*1s
1*2s 3*2p
3:参与共振的所有原子必须得在同一平面 或近似平面,保证p轨道的最大交盖
(4)
-
4:共振结构配对电子数必须相同
5:共振结果的能量应大致相当
H 119.8° H
H
0.1438nm
H
122.4°
0.1373nm
H
H
0.154nm
CH3 CH3
0.1340nm
CH2 CH2
6:单双键共振后,单键变短,显示部分双键的性质,双键反之
单重态H2拉伸过程的电子密度差等值线动画
* 图中虚线代表相对于两原子都在孤
立状态时电子密度减小的区域,实 线代表增加的区域。可见,一开始 原子离得远,相互作用很弱,对原 始电子密度几乎没有影响,几乎没 出现等值线。随着它们离近,由于 Pauli互斥导致中间电子密度大幅减 少,电子纷纷转移向两端了
共振结构中需要注意的几个问题(2)
1) 在书写共振式时, 只允许电子的位置改变, 原子的位置不能变动。如烯丙基正
离子可以写成
但不能写成CH3- CH=CH.
2)含完整八隅体的结构比在价电子层上少于8 个电子的结构更稳定, 较稳定的共 振式对杂化体的贡献较
Ⅰ式中的正碳有6 个电子, 而Ⅱ式中的碳原子有8 个电子, 所以Ⅱ式较稳 3) 共价键的数目愈多, 结构中电荷分离数目愈小, 该共振 结构愈稳
* 随距离拉近后,电子密度迅速在原
子间聚集,表明共价键正在加强。 聚集的区域一开始逐渐变大并逐渐 变得扁长,但后来却开始收缩并变 得接近于球型,最后一帧电子密度 减少区域和增加区域都几乎变成了 球对称状,前者包着后者。这是因 为原子序数越大,核吸引势越强, 电子密度分布范围收缩得越厉害
4*1s
1*2s 3*2p
3:参与共振的所有原子必须得在同一平面 或近似平面,保证p轨道的最大交盖
(4)
-
4:共振结构配对电子数必须相同
5:共振结果的能量应大致相当
H 119.8° H
H
0.1438nm
H
122.4°
0.1373nm
H
H
0.154nm
CH3 CH3
0.1340nm
CH2 CH2
6:单双键共振后,单键变短,显示部分双键的性质,双键反之
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Carey & Sundberg, Advanced Organic Chemistry, 4th Ed. Part B Chapter 9, " C–C Bond Forming Rxns of Boron, Silicon & Tin", 595–680. Carey & Sundberg, Advanced Organic Chemistry, 4th Ed. Part B Chapter 10, "Reactions Involving Highly Reactive Electron-Deficient Intermediates", 595–680. Lecture 09A Simmons-Smith Reaction: Enantioselective Variants Lecture 26B Synthetic Applications of α-Diazocarbonyl Compounds
s the History of the Singlet-Triplet Gap
Year 1932 Method Qual. Thermochem Qual. QM Ab initio Kinetics SCF MINDO Expt An Initio Expt Expt Author Muliken Walsh Gallup Harrison Hase Pople Dewar Lineberger Schaeffer Zare Haydon HCH Angle Grnd State 90-100° 180° 160° 138° –– 132° 134° 138° ––– ––– ––– singlet triplet triplet triplet triplet triplet triplet triplet triplet triplet triplet S–T Splitting kcal/mol –– small 30 >33 8–9 19 8.7 19.5 19.7 8.1 8.5
Ligand Effects on the Chemoselectivity of Transition Metal Catalyzed Rxns of αdiazocarbonyl Compnds" Padwa et al.Angew Chem Int Ed. 1994, 33, 1797 Chiral DirhodiumCarboxamidates: Catalysts for Highly Enantioselective Syntheses of Lactones and Lactams, Aldrichchimica Acta. 1996, 29, 3 "Stable Carbenes–Illusion or reality"? Regitz, M. Angew. Chem. Int. Ed. Engl. 1991, 30, 674 O O
H H R N
filled
filled
1978 1982
Singlet (all e- paired)
s Nitrenium ion
M. Shair, D. A. Evans
Carbenes: Structure and Generation
s Bamford-Stevens Reaction: See Lecture 28 on Hydrazones
S1 8–10 kcal/mol T1
p triplet σ singlet
σ
Due to electron repulsion, there is an energy cost in pairing both electrons in the σ orbital. If a small energy difference between the σ and p orbitals exists, the electrons will remain unpaired (triplet). If a large gap exists between the σ and p orbitals the electrons will pair in the σ orbital (singlet).
D. A. Evans
Introduction to Carbenes & Carbenoids-1
Useful References to the Carbene Literature
Chem 206
/~chem206/
Chemistry 206 Advanced Organic Chemistry
Lecture Number 34
Books: Modern Catalytic methods for Organic Synthesis with Diazo Compounds; M. P. Doyle, Wiley, 1998. Carbene Chemistry, 2nd ed. Academic Press, Kirmse, W., 1971.
-N2
OH
s ketenes
R C R C O
heat or hν
O
carbenoid
O R1 R2 Rh
R2C
+
CO
R1 R2
O Rh
Rh
M. Shair, D. A. Evans
s "Stable Carbenes"
"Stable Carbenes–Illusion or reality"? Regitz, M. Angew. Chem. Int. Ed. Engl. 1991, 30, 674 Cl
Carbenes: Structure and Generation
s Cyclopropanation The Skell Rule:
1 CH 2
NaH, THF
Chem 206
R + R
R
N H N
N N
R
cat. tBuOK (89%)
Singlet carbenes add to olefins stereospecifically;
(Wentrup)
Carbenes: Electronic Structure s Carbene Configuration: Triplet vs. Singlet
1.078 Å
p σ
p
1947 1957
σ
H
133.8˚
H H
H
Triplet (two unpaired e-) Often has radical-like character
O 1. Rh2(OAc)4 N CH3 N2 CO2Et
2. MeO2C
O EtO2C CO2Me N CH3 MeO2C CO2Me
JACS 1990 2037
H O N2
150˚C (71%)
H O
Matthew D. Shair
Friday, December 13 , 2002
D. A. Evans
empty filled
1969 1971 1971
Singlet (all e- paired) Often has electrophilic or nucleophilic character: A-type (Ambiphilic)
empty
1974 1976 1976
roduction to Carbenes & Carbenoids-1
s Carbene Structure & Electronics s Methods for Generating Carbenes s Simmons-Smith Reaction s Carbene-Olefin Insertions s Carbene Rearrangements
s Alkyl Halides:
Cl Cl R R Cl C H Cl C H
R2
s metal-catalyzed decomposition Doyle Chem Rev. 1988, 86, 919.
OH
Cl C Cl R C R R2 R1 N N Me O Rh (ligands omitted for clarity) O Rh O Rh Rh2(OAc)4 R2 R1 N N Me O Rh Me Me O Rh
Me
s diazo compounds
C Singlet
R1 N N N N R2
hν or heat
Examples:
Cl
C
Singlet C6H5
R2 diazirines R1 N N
R1 C + N2 R2
hν or heat Chem. Soc. Rev. 1982, 11, 127.
Methods of Synthesis
Mandatory Reading: Doyle, Chem Rev. 1988, 86, 919. Kodadek, Science, 1992, 256, 1544.
Carbenes: An Introduction
s Carbene Configuration: Triplet vs. Singlet
p
Chem 206
Energy
Recent Review Article: Chemistry of Diazocarbonyls: McKervey et al. Chem Rev. 1994, 94, 1091. Books: Modern Catalytic methods for Organic Synthesis with Diazo Compounds; M. P. Doyle, Wiley, 1998. Carbenes and Nitrenes in "Reactive Molecules: The Neutral Reactive Intermediates in Organic Chemistry", Wentrup, C. W. 1984, Wiley, p. 162. Rearrangements of Carbenes and Nitrenes in Rearrangements in Ground & Excited States, Academic Press, DeMayo ed., Jones, W. M. 1980, p. 95. Carbene Chemistry, 2nd ed. Academic Press, Kirmse, W., 1971.
s the History of the Singlet-Triplet Gap
Year 1932 Method Qual. Thermochem Qual. QM Ab initio Kinetics SCF MINDO Expt An Initio Expt Expt Author Muliken Walsh Gallup Harrison Hase Pople Dewar Lineberger Schaeffer Zare Haydon HCH Angle Grnd State 90-100° 180° 160° 138° –– 132° 134° 138° ––– ––– ––– singlet triplet triplet triplet triplet triplet triplet triplet triplet triplet triplet S–T Splitting kcal/mol –– small 30 >33 8–9 19 8.7 19.5 19.7 8.1 8.5
Ligand Effects on the Chemoselectivity of Transition Metal Catalyzed Rxns of αdiazocarbonyl Compnds" Padwa et al.Angew Chem Int Ed. 1994, 33, 1797 Chiral DirhodiumCarboxamidates: Catalysts for Highly Enantioselective Syntheses of Lactones and Lactams, Aldrichchimica Acta. 1996, 29, 3 "Stable Carbenes–Illusion or reality"? Regitz, M. Angew. Chem. Int. Ed. Engl. 1991, 30, 674 O O
H H R N
filled
filled
1978 1982
Singlet (all e- paired)
s Nitrenium ion
M. Shair, D. A. Evans
Carbenes: Structure and Generation
s Bamford-Stevens Reaction: See Lecture 28 on Hydrazones
S1 8–10 kcal/mol T1
p triplet σ singlet
σ
Due to electron repulsion, there is an energy cost in pairing both electrons in the σ orbital. If a small energy difference between the σ and p orbitals exists, the electrons will remain unpaired (triplet). If a large gap exists between the σ and p orbitals the electrons will pair in the σ orbital (singlet).
D. A. Evans
Introduction to Carbenes & Carbenoids-1
Useful References to the Carbene Literature
Chem 206
/~chem206/
Chemistry 206 Advanced Organic Chemistry
Lecture Number 34
Books: Modern Catalytic methods for Organic Synthesis with Diazo Compounds; M. P. Doyle, Wiley, 1998. Carbene Chemistry, 2nd ed. Academic Press, Kirmse, W., 1971.
-N2
OH
s ketenes
R C R C O
heat or hν
O
carbenoid
O R1 R2 Rh
R2C
+
CO
R1 R2
O Rh
Rh
M. Shair, D. A. Evans
s "Stable Carbenes"
"Stable Carbenes–Illusion or reality"? Regitz, M. Angew. Chem. Int. Ed. Engl. 1991, 30, 674 Cl
Carbenes: Structure and Generation
s Cyclopropanation The Skell Rule:
1 CH 2
NaH, THF
Chem 206
R + R
R
N H N
N N
R
cat. tBuOK (89%)
Singlet carbenes add to olefins stereospecifically;
(Wentrup)
Carbenes: Electronic Structure s Carbene Configuration: Triplet vs. Singlet
1.078 Å
p σ
p
1947 1957
σ
H
133.8˚
H H
H
Triplet (two unpaired e-) Often has radical-like character
O 1. Rh2(OAc)4 N CH3 N2 CO2Et
2. MeO2C
O EtO2C CO2Me N CH3 MeO2C CO2Me
JACS 1990 2037
H O N2
150˚C (71%)
H O
Matthew D. Shair
Friday, December 13 , 2002
D. A. Evans
empty filled
1969 1971 1971
Singlet (all e- paired) Often has electrophilic or nucleophilic character: A-type (Ambiphilic)
empty
1974 1976 1976
roduction to Carbenes & Carbenoids-1
s Carbene Structure & Electronics s Methods for Generating Carbenes s Simmons-Smith Reaction s Carbene-Olefin Insertions s Carbene Rearrangements
s Alkyl Halides:
Cl Cl R R Cl C H Cl C H
R2
s metal-catalyzed decomposition Doyle Chem Rev. 1988, 86, 919.
OH
Cl C Cl R C R R2 R1 N N Me O Rh (ligands omitted for clarity) O Rh O Rh Rh2(OAc)4 R2 R1 N N Me O Rh Me Me O Rh
Me
s diazo compounds
C Singlet
R1 N N N N R2
hν or heat
Examples:
Cl
C
Singlet C6H5
R2 diazirines R1 N N
R1 C + N2 R2
hν or heat Chem. Soc. Rev. 1982, 11, 127.
Methods of Synthesis
Mandatory Reading: Doyle, Chem Rev. 1988, 86, 919. Kodadek, Science, 1992, 256, 1544.
Carbenes: An Introduction
s Carbene Configuration: Triplet vs. Singlet
p
Chem 206
Energy
Recent Review Article: Chemistry of Diazocarbonyls: McKervey et al. Chem Rev. 1994, 94, 1091. Books: Modern Catalytic methods for Organic Synthesis with Diazo Compounds; M. P. Doyle, Wiley, 1998. Carbenes and Nitrenes in "Reactive Molecules: The Neutral Reactive Intermediates in Organic Chemistry", Wentrup, C. W. 1984, Wiley, p. 162. Rearrangements of Carbenes and Nitrenes in Rearrangements in Ground & Excited States, Academic Press, DeMayo ed., Jones, W. M. 1980, p. 95. Carbene Chemistry, 2nd ed. Academic Press, Kirmse, W., 1971.
