溶液物质的量及摩尔质量
物质的量的浓度知识点整理

物质的量的浓度知识点整理一、物质的量的浓度概念和计算方法浓度(C)=物质的量(n)/溶液的体积(V)其中,物质的量通常用摩尔(mol)来表示,溶液的体积则可以用升(L)来表示。
对于溶液来说,还可以通过质量浓度(Cm)来表示,计量单位为g/L。
计算公式为:质量浓度(Cm)=溶质的质量(m)/溶液的体积(V)其中,溶质的质量通常用克(g)来表示,溶液的体积仍然用升(L)来表示。
二、摩尔浓度与质量浓度之间的关系1.摩尔浓度与质量浓度的转换由于摩尔质量可以通过元素的相对原子质量得到,因此可以通过摩尔浓度和质量浓度之间的转换来计算摩尔质量。
摩尔质量(M)=溶质的质量(m)/摩尔浓度(C)质量浓度(Cm)=摩尔浓度(C)×摩尔质量(M)2.摩尔浓度与质量浓度的关系摩尔浓度与质量浓度之间存在一定的关系,可以通过元素的相对原子质量和密度来计算。
摩尔浓度(C)=摩尔浓度(Cm)/摩尔质量(M)质量浓度(Cm)=摩尔质量(M)×摩尔浓度(C)三、摩尔浓度的应用1.定量分析中的应用摩尔浓度在定量分析中起着重要的作用,可以通过摩尔浓度的测定来计算出溶液中的物质的量,从而进行精确的定量测定。
2.摩尔浓度的转化摩尔浓度的转化对于化学反应和化学计算非常重要。
通过计算不同物质的摩尔浓度之比,可以确定反应的化学计量比例,从而计算出反应中所需的物质的量。
3.摩尔浓度的控制摩尔浓度可以通过控制溶质的添加量和溶液的体积来调节。
通过控制摩尔浓度,可以实现溶液中物质的量的精确控制,从而实现对反应速率和产物选择性的调节。
四、质量浓度的应用1.溶液的配置与稀释质量浓度在溶液的配置和稀释中起着重要的作用。
通过计算所需溶质的质量和溶液的体积,可以调节溶液的浓度,从而满足不同实验或工业生产的需求。
2.药剂的制备和应用质量浓度是药剂制备和应用过程中的重要参数之一、通过确定药物的质量浓度,可以实现药物的定量配制和使用,确保药物的疗效和安全性。
《物质的量及其单位-摩尔摩尔质量》课件

在化学反应过程中,实时监测反应物和生成物的物质的量变化,控制反应进程和产品质量 。
THANKS FOR WATCHING
感谢您的观看
对于某一分子,其摩尔质量在数值上等于该分子的相对分子质量。例如,水分 子的相对分子质量为18,则其摩尔质量也为18g/mol。
摩尔质量在化学方程式计算中应用
计算反应物的质量
计算生成物的质量
在化学反应中,已知反应物的物质的量和 摩尔质量,可以计算反应物的质量。
在化学反应中,已知生成物的物质的量和 摩尔质量,可以计算生成物的质量。
用于计算气体的密度
通过气体摩尔体积和气体的摩尔质量,可以计算出气体的密度。这对于了解气体的物理性质以及进行相关的实验 和计算具有重要意义。
05 溶液浓度表示方法及换算
溶液浓度常见表示方法介绍
质量百分比浓度
表示溶质质量与溶液质量 之比,常用于工业生产中。
体积百分比浓度
表示溶质体积与溶液体积 之比,常用于酒类等液体 溶剂的表示。
摩尔在化学计算中应用
化学反应计量关系
在化学反应中,各反应物和生成 物之间的物质的量之比等于其化 学计量数之比。通过摩尔可以方 便地表示和计算这种计量关系。
溶液浓度计算
溶液的浓度可以用物质的量浓度 来表示,即单位体积溶液中所含 溶质的物质的量。通过摩尔可以 方便地计算溶液的浓度和溶质的
物质的量。
化学方程式计算
不同浓度单位之间的换算
03
在实际应用中,可能需要将不同浓度单位之间进行换算,这时
需要根据具体的换算公式进行计算。
溶液浓度在化学实验和工业生产中应用
化学实验中的应用
在化学实验中,溶液浓度是影响化学反应速率和化学平衡的重要因素之一,因此需要对溶液浓度进行 精确控制。
氢氧化钠溶液的浓度、溶质的质量分数和密度
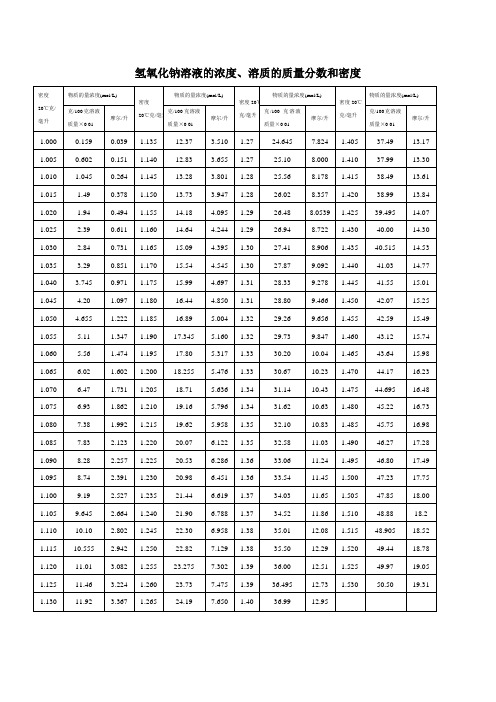
氢氧化钠溶液的浓度、溶质的质量分数和密度
HCl溶液的浓度和密度
常见气体在标准状况下的摩尔体积
标准溶液浓度的一升量值温度不正值表
水的体积和质量分数换算表
(供校准玻璃容量仪器体积用)
V20=W/Wt=1000(ml)(式中V20是指玻璃容器在20℃时所具有的容积)
滴定液的温度校正值
本表列出水和稀的水溶液在t℃时的观测体积换算为20℃时的体积校正值(单位毫升)。
反之,也可以从20℃时所需体积减去或加上校正值而获得的t℃时必须量出的体积。
表中玻璃器皿的体积膨胀系数假定为0.000025
对于某些标准溶液,使用上表换算为20℃的体积,如欲获得更准确的结果,可按下列
露点温度对应水分表
各种不同温度下空气中饱和水蒸汽的压力盒水蒸汽含量
0℃至60℃温度下
注:1mmHg=133.322Pa44
0℃至-60℃温度下
将气压由室温换算至0℃时校正值(Pa)
标准筛目
化学化工中常用的筛网标准又数种,下列是美国筛制和泰勒标准筛、日本。
溶液配制和浓度计算

一种以分子、原子或离子状态分散于另一种物质中构成的均 匀而又稳定的体系叫溶液。溶液由溶质和溶剂组成。用来溶 解别种物质的物质叫溶剂,能被溶剂溶解的物质叫溶质。溶 质和溶剂可以是固体、液体和气体。按溶剂的状态不同,溶 液可分为固态溶液(如合金)、液态溶液和气态溶液(如空 气),一般所说的溶液是指液态溶液。水是一种很好的溶剂, 由于水的极性较强,能溶解很多极性化合物,特别是离子晶 体,因此,水溶液是一类最重要、最常见的溶液。
1.纯度高。含量一般要求在99.9%以上,杂质总含量小于 0.1%。
第三十一页,讲稿共六十四页哦
SI基本单位
量的名称 单位名称
符号
量的名称 单位名称
符号
长度 米
质量 千克
时间 电流
秒 安倍
m 热力学 开尔文 K 温度
kg 物质的 摩尔 mol 量
s 光强度 坎德拉 cd
A
第三十二页,讲稿共六十四页哦
1985年9月6日第六届全国人大常委会通过了 《中华人民共和国计量法》。计量法自1986年 7月1日起实施。1991年起除个别领域外,不 允许再使用非法定计量单位。
第二十二页,讲稿共六十四页哦
为保证试剂不受沾污,应当用清洁的牛角勺从 试剂瓶中取出试剂,绝不可用手抓取,如试剂 结块可用洁净的粗玻璃棒或瓷药铲将其捣碎后 取出。液体试剂可用洗干净的量筒倒取,不要 用吸管伸入原瓶试剂中吸取液体,取出的试剂 不可倒回原瓶。打开易挥发的试剂瓶塞时不可 把瓶口对准脸部。在夏季由于室温高试剂瓶中 很易冲出气液,最好把瓶子在冷水中浸一段时 间,再打开瓶塞。取完试剂后要盖紧塞子,不 可换错瓶塞。放出有毒、有味气体的瓶子还应 该用蜡封口。
在溶解的同时,还进行着一个相反的过程,即 已溶解的溶质粒子不断运动,与未溶解的溶质 碰撞,重新被吸引到固体表面上,这个过程叫 做结晶。当溶解速度等于结晶速度时,溶液的 浓度不再增加,达到饱和状态,这时存在着动 态平衡。我们把在一定条件下达到饱和状态的 溶液叫做饱和溶液,称还能继续溶解溶质的溶 液为不饱和溶液。
溶液物质的量分数,密度,质量分数之间的关系

溶液物质的量分数,密度,质量分数之间的关系
溶液物质的量分数、密度和质量分数之间的关系可以用以下公式表示:
物质的量分数(X)= 物质的质量(m)/ 溶液的总质量(mixture)
物质的量分数(X)= 物质的摩尔质量(M)×物质的摩尔数(n)/ 溶液的总摩尔质量(Mixture)
密度(ρ)= 溶液的总质量(mixture)/ 溶液的体积(V)
物质的质量分数(w)= 物质的质量(m)/ 溶液的总质量(mixture)
由上述公式可以得出以下关系:
物质的质量分数(w)= 物质的量分数(X) ×物质的摩尔质量(M)/ 溶液的总摩尔质量(Mixture)
物质的质量分数(w)= 密度(ρ)/ 物质的摩尔质量(M)×溶液的总摩尔质量(Mixture)
物质的质量分数(w)= 密度(ρ)/ 溶液的体积(V)。
溶液的摩尔浓度和溶解度

溶液的摩尔浓度和溶解度溶液是由溶质溶解在溶剂中而形成的一种混合物。
溶液的摩尔浓度和溶解度是描述溶液性质的重要参数。
本文将分析摩尔浓度和溶解度的概念、计算方法,以及它们在化学实验和工业生产中的应用。
一、溶液的摩尔浓度溶液的摩尔浓度是指在一个单位体积的溶剂中所含溶质的物质的量。
通常用符号C表示,摩尔浓度的单位是mol/L或M(molar)。
计算摩尔浓度的公式为:C = n/V其中,C表示摩尔浓度,n表示溶质的物质的量,V表示溶液的体积。
摩尔浓度可以理解为溶质分子或离子在溶剂中的稀密程度,可以用来表示溶液中溶质的含量。
在实际计算中,可以通过称取溶质,加入足够的溶剂并搅拌均匀,然后用试剂瓶等容器进行稀释,最后取适量的溶液用比色计或滴定等方法测定溶液的摩尔浓度。
二、溶解度溶解度是指在一定温度下,溶质在溶剂中能够溶解成溶液的最大量。
溶解度通常用符号S表示,单位是g/L。
溶解度的值与溶质、溶剂的性质以及温度有关。
溶解度与溶质和溶剂之间的相互作用力有关。
溶质和溶剂之间的相互作用力越强,溶质越容易溶解,溶解度就越大;反之,相互作用力越弱,溶质的溶解度就越小。
三、摩尔浓度和溶解度的关系摩尔浓度与溶解度之间存在一定的关系。
一般情况下,溶质在溶剂中的摩尔浓度越高,溶质的溶解度也就越大。
根据摩尔浓度和溶解度的定义可以推导出它们之间的关系式:n = C * V (摩尔浓度与体积的关系)m = S * V (溶解度与体积的关系)其中,n表示溶质的物质的量,m表示溶质的质量,C表示摩尔浓度,V表示溶液的体积,S表示溶解度。
由上述关系式可以得出:m = S * C * V即溶质的质量等于溶解度、摩尔浓度和溶液体积的乘积。
这个关系式可以在实验中使用,通过测量溶质的质量和溶液的体积,可以计算出溶质的溶解度。
四、摩尔浓度和溶解度的应用摩尔浓度和溶解度在化学实验和工业生产中具有重要的应用价值。
1. 在化学实验中,摩尔浓度可以帮助确定反应物的计量比例,从而进行定量分析和反应条件的设计。
浅谈物质的量浓度和摩尔浓度

有关物质的量(mol)的计算公式

(mol)的计算公式
(1)物质的量(mol) 即n= ;M数值上等于该物质的相对分子(或原子)质量
(2)物质的量(mol)= 即n= NA为常数6.02×1023,应谨记
(3)气体物质的量(mol) 即n= Vm为常数22.4L·mol-1,应谨记
(4)溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)即nB=CBVaq
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的量
1、是国际单位制中七个基本量中的一个。
(长度、质量、时间、电流、热力学温度、物质的量、发光强度)
(× )
使用时要注明微粒名称,或后面带上微粒符号
③摩尔是物质的数量单位
(× )
④摩尔是物质的质量单位
(× )
物质的量是一整体,不能拆分或增添任何字
⑤1molH的数目为6.02×1023
(√ )
⑥1mol大米的数目约为6.02×1023
(× )
物质的量用于衡量化学上微观世界的粒子,不能用于衡量
宏观世界的物质
标准状况下 0℃、一个大气压
5. 22.4L/mol为近似值 6. 比较气体体积必须指明温度和压强
例:成人在平静呼吸时,每小时呼出的CO2气体 约为11.2L(标准状况),求每小时呼出的CO2的 质量是多少?
解: ∵ V=11.2L
Vm= 22.4 L/mol MCO2= 44 g/mol
∴ n= V = 11.2L = 0.5mol
Amedeo Avogadro 1776~1856
规定: 每摩尔物质含有 6.02×1023 个微粒。
NA = 6.02×1023 个/mol
阿佛加德罗常数:12克12c中含有的碳原子数,符号为NA 。
是
是
一
一
个
个
数
衡
值
量
标
准
[例题1] 在0.5 mol O2中含有的氧分子数目(N)约是多少?
解: N(O2) = n(O2) × NA =0.5 mol× 6.02 ×1023 个/mol
你知道吗?天然气的主要成分是
甲烷(CH4)
①0.5摩尔甲烷约含有3_._0_1_×__1_0_2_3_个 甲烷分子,含有 1_2_._0_4_×__1_0_2_3 个氢原子, 所含原子总数为 _1_5_._0_5_×__1_0_2_3 个 ②3.01×1024个甲烷分子是 5 摩尔。
物质的量和质量之间的关系?
谢谢观赏
在标准状况下,1摩尔任何气体的体积是否相同呢?
(标准状况:温度为0℃,压强为101KPa)
气体 物质
H2 O2 CO2
1mol 气体 所含分子数
6.02×1023 6.02×1023 6.02×1023
1mol气体 质量(g)
2.016 32.00 44.01
密度 标准状况 (g/L)
0.0899 1.429 1.977
一、 影响 物质 体积 大小 的因 素
内因:
外因:
(1)粒子数目多少 (2)粒子本身大小 (3)粒子间的平均距离
(1) 温度 (2) 压强
1.固体液体物质中,粒子紧密排列, 粒子的距离近似为零。所以固体液体 的体积主要决定于粒子的数目和粒子 的大小。
相同条件下,1摩尔不同固体或液体物质的体 积是不相同的。
固 6.02×1023
56
7.8
7.2
Al
固 6.02×1023
27
2.7
10
Pb
固 6.02×1023
207
11.3
18.3
H2O 液 6.02×1023
18
0.998
18
H2SO4 液 6.02×1023
98
(纯)
1.83
53.6
[结论] 相同条件下,1摩尔不同固体或液体物
质的体积是 不相同 的。
(4)1摩尔H2O在标准状况下的体积约为22.4L
错
(5)1摩尔SO2在20 ℃时的体积比22.4L大
错
(6)只有在标准状况下,气体的摩尔体积才约为
22.4L/mol
错
2、填写下列空白:
(1)标况下,0.5molH2占有的体积是 11.2 L (2)标况下,2molO2占有的体积是 44.8 L (3)标况下,4.48LCO2的物质的量是 2 mol (4)标况下,33.6LH2 的物质的量是 1.5 mol
物质的量(n)与物质的质量(m) 之间的 关系:
m=n×M
摩尔质量是把微观粒子和宏观物质联系起来的 一座桥梁。
三、有关物质的量的计算
[例 ] 2. 5 mol 铜原子的质量是 多少克? 解: ∵ n= 2.5mol MCu= 63.5g/mol
∴ m = n × MCu
= 2.5 mol × 63.5g/mol = 158.8g 答:2.5mol 铜原子的质量等158.8g 。
例2:求96 g O2中含多少个氧分子?
解: ∵ m= 96 g MO2= 32 g/mol
NA= 6.02 ×1023 个/mol
∴
m n= =
96g
= 3 mol
M 32g/mol
N= n×NA = 3 mol ×6.02 ×1023个/mol
= 18.6 ×1023个
答:96克O2中含有18.6 ×1023个氧分子
例如:
H 原子的摩尔质量是1g/mol Na原子的摩尔质量是23g/mol H2O分子的摩尔质量是18g/mol CO2分子的摩尔质量是44g/mol
相对原子质量与摩尔质量 的相互联系和区别
① 摩尔质量在数值上 = 物质的原子量或分子量
② 摩尔质量单位:g/mol ;相对原子(分子) 质量没有单位
反过来:
(1)若含有6.02×1023个碳原子,则碳原子 的物质的量约为 1 mol
(2)若含有12.04×1023个OH-离子,则OH-离 子的物质的量约为 2 mol
练一练 判断下列说法是否正确?
①摩尔是七个基本物理量之一 摩尔仅是一个单位,物质的量是一个物理量
(× )
②1mol氢约含6.02×1023个氢原子
Vm 22.4L/mol
m=n ×MCO2 = 0.5 mol ×44 g/mol=22 g
答:成人在平静呼吸时,每小时呼出的CO2质量是22g。
练习
1、判断下列说法是否正确?为什么?
(1) 在标准状况下,1mol任何物质体积为22.4L 错
(2)常温常压下任何气体的体积都约是22.4L
错
(3)标准状况下,1molO2和N2混合气体的体积约为22.4L。对
12
碳原子量
1个碳原子质量 1mol碳原子质量 12 g
=
=
=
氧原子量
1个氧原子质量 1mol氧原子质量 x g
16
x = 16
结论:1摩尔任何物质的质量如果以克为单位,
在数值上都等于该物质的相对原子量或分子量。
摩尔质量(M)
二、 摩尔质量
(1)定义:1mol 任何物质的质量
(2)符号:M (3)单位:g/mol (4)数值:数值上等于物质或粒子的原子量或分子量
(3)1摩氧气的质量是32克,所以氧气的摩尔质 量是32克。这句话对吗? 不对,应是:32克/摩
气体摩尔体积
摩尔体积:
1mol物质在一定条件下所具有的体积。
首先我们来计算一下1摩尔固体、液体物质的体积。
物质 Fe
状态
1mol 物质 1mol 物 密度(200 C ) 体积( 200 C) 所含微粒数 质质量(g) (g/cm3) (cm3)
练习:
(1)49克H2SO4的物质的量是 0.5 摩, 含有 3.01×1023个H2SO4分子, 含有 6.02×10个23 氢原子、含有 0.5 摩硫
原子和 32 克氧元素。
(2)142克硫酸钠(Na2SO4)的物质的量是__1_ 摩,含有 1 摩硫酸根离子,含有 12.04×10个23 个钠离子。
对于气体,粒子之间距离很 大,粒子本身的大小对物质的体 积影响很小,几乎可以忽略。
2、决定气体物质体积大小的因素
1.粒子的数目 2.粒子间的距离
思考:气体分子间的距离和什么有关?
①温度升高,气体分子间的平均距离增大, 体积增大 ②压强增大,气体分子间的平均距离减小。 体积减小。
结论:同温同压下,相同数目的气体所占的体积相同。
溶液物质的量及摩尔质量
一车砖5吨
一车砖有2000块
我一口喝18克水,
18克水 = 6000万亿亿 个水分子
问题提出 ?
水分子数
宏观
微观
(质量)
?
(微粒数目)
一、物质的量及其单位
(一)物质的量的概念
表示构成物质微观粒子数目的一个物理量, 符号为 n。物质的量是国际单位制中七个基本物 理量之一。 符号:n 单位:摩尔(mol),简称:摩
= 3.01 × 1023 个
答:0.5 mol O2的氧分子数约为3.01 × 1023个。
想一想 由以上练习你能不能总结出物质的量(n)、微粒
个数(N)和阿伏加德罗常数(NA)间的关系?
N= n×NA
或 n= N NA
注意:应用阿伏加德罗常数时,一定要注 意微粒的对应关系。例:
(1)1mol C 约含有 6.02×1023 个碳原子
资料
国际单位制(SI)的7个基本单位
物理量
长度 质量 m 时间 t 电流 I 温度
物质的量 n 发光强度
单位名称
米 千克 秒 安[培] 开[尔文]
摩[尔] 坎[德拉]
单位符号
m cm Kg g S A K
mol cd
注意事项:
(1)“物质的量”是一个整体,是个专用名词.
(2)只适用于微观的粒子——分子、原子、离子、电子、 质子等. (3)书写时应指明粒子的种类。(一般后面跟化学式)
