第9章 卤代烃
有机化学 第9章 醇、酚

CH3CH2OH
乙醇
CH3 CH CH3
OH
异丙醇
CH2OH
苄醇(苯甲醇)
➢ 系统命名法 ① 主链:含羟基所连碳原子在内的最长碳链;
② 编号:从靠近羟基端编起; ③ 命名:羟基的位次,取代基位次、数量及名称等标
于母体名称前;
④ 如具有特定构型,需在名称的最前面标明构型。
CH3 CH3CHCHCH2OH
醇在强酸中的溶解度比在水中大
溶质 溶剂 溶解情况
正丁醇 水 8%
正丁醇 浓HCl 互溶
ROH + HCl
ROH Cl
醇的质子化
H
醇配合物:CaCl2 ·4C2H5OH,CaCl2 ·4CH3OH MgCl2 ·6C2H5OH,MgCl2 ·6CH3OH
CaCl2 、MgCl2不能用来干燥醇
五.波谱性质
酸性:H2O > ROH > RH
碱性:OH- < RO- < R-
2 [(CH3)2CHO]3Al + 3 H2
异丙醇铝
CH3CH2OH + NaOH
醇不与NaOH反应
醇为弱酸,存在电离平衡:
ROH
RO + H
醇的酸性强弱的影响因素:
(1) 电子效应:R斥电子性越强,酸性越弱。 CH3OH > 1°> 2°> 3°
CH3
2,3-二甲基-1-丁醇
CH2CH2CH2 OH OH
1,3-丙二醇
CH2 CH CH2 OH OH OH
丙三醇
CH=CH2 H OH
CH2C6H5
(R)-1-苯基-3-丁烯-2-醇
C CH3
H C OH
CH2CHCH3
(E)-5-苯基-4-己烯-2-醇
《有机化学》第四章 卤代烃

9 第一节 卤代烃的分类和命名
第四章
二、 卤代烃的命名
‖
—
(一)习惯命名法
对于不饱和卤代烃,其命名方法是:选择含有卤素原子和不饱和键的最长碳链作为主链,
主链编号时使不饱和键的位次最小。顺反异构体用Z/E或顺/反标明其构型。例如:
— —
CH3—
CH2CH3
CC
Cl —
CH3
反-3-甲基-2-氯-2-戊烯
例如:
CH3CH2CHCH2Cl
—
2-苯基-1-氯丁烷
11
过 渡 页
1 卤代烃的分类和命名
2 卤代烃的性质
3 重要的卤代烃
12 第二节 卤代烃的性质
一、 卤代烃的物理性质
第四章
接下页
室温时,氯甲烷、氯乙烷、氯乙烯和溴甲烷为气体,其余卤代烃为液体 或固体。卤代烃难溶于水,而易溶于有机溶剂。一些卤代烃,如CH2Cl2、 CHCl3等本身就是有机溶剂。除一氯代烃的相对密度小于1外,溴代烷、碘 代烷以及多氯代烷的相对密度均大于1。
构造式
熔点(℃)
沸点(℃)
CH3Cl CH3Br CH3I
CH2Cl2
-97 -93 -66
-96
-24 4 42
40
三氯甲烷
CHCl3
-64
62
四氯化碳
CCl4
-23
77
氯乙烷
C2H5Cl
-139
12
溴乙烷
C2H5Br
-119
38
磺乙烷
C2H5I
-111
72
1-氯丙烷
CH3CH2CH2Cl
-123
卤代烃可分为饱和卤代烃(又称卤代烷)、不饱和卤代烃和芳香族卤代烃。例如:
第章卤代烃消除反应
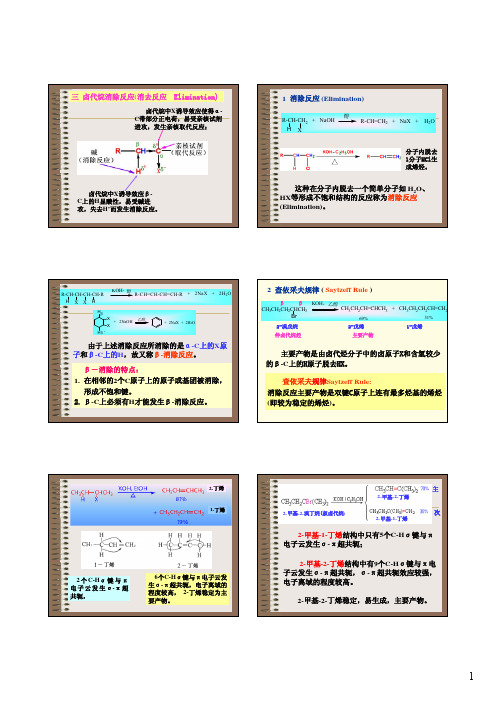
2-丁烯 1-丁烯
2 个 C-Hσ 键 与 π 电 子 云 发 生 σ-π 超 共轭,
6个C-Hσ键与π电子ቤተ መጻሕፍቲ ባይዱ发 生σ-π超共轭,电子离域的 程度较高, 2-丁烯稳定为主
要产物。
主
2-甲基-2-丁烯
2-甲基-2-溴丁烷(叔卤代烷)
次
2-甲基-1-丁烯
2-甲基-1-丁烯结构中只有5个C-Hσ键与π 电子云发生σ-π超共轭;
生成新的化合物。
3
小结 对E1反应而言,碳正离子的稳定性 叔碳正离子 > 仲碳正离子 > 伯碳正离子
对E2反应而言,生成的烯烃稳定性: 叔卤代烷 > 仲卤代烷 > 伯卤代烷
不论是E1机制和E2机制,不同卤代烷的消 除反应活性次序相同:
叔卤代烷 > 仲卤代烷 >伯卤代烷
五、卤烷的亲核取代反应与消除反应的关系
三 卤代烷消除反应(消去反应 Elimination)
卤代烷中X诱导效应使得αC带部分正电荷,易受亲核试剂 进攻,发生亲核取代反应;
卤代烷中X诱导效应βC上的H显酸性,易受碱进 攻,失去H+而发生消除反应。
1 消除反应 (Elimination)
R-CH-CH2 + NaOH 醇 HX
R-CH=CH2 + NaX + H2O
CH3CH2CH=CHCH3 + CH3CH2CH2CH=CH2
Br
69%
31%
2-溴戊烷
2-戊烯
1-戊烯
仲卤代烷烃
主要产物
主要产物是由卤代烃分子中的卤原子X和含氢较少 的β-C上的H原子脱去HX。
查依采夫规律Saytzeff Rule: 消除反应主要产物是双键C原子上连有最多烃基的烯烃 (即较为稳定的烯烃)。
高中化学第9章 第56讲 认识有机化合物---2023年高考化学一轮复习(新高考)

第56讲 认识有机化合物复习目标 1.能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
2.了解常见有机化合物的结构;了解有机化合物分子中的官能团,能正确地表示它们的结构。
3.了解确定有机化合物结构的化学方法和物理方法(如质谱、红外光谱、核磁共振氢谱等)。
4.能够正确命名简单的有机化合物。
考点一 有机化合物的分类和命名(一)有机化合物的分类 1.根据元素组成分类有机化合物⎩⎪⎨⎪⎧烃:烷烃、烯烃、炔烃、苯及其同系物等烃的衍生物:卤代烃、醇、酚、醛、酮、羧酸、酯等2.按碳骨架分类3.按官能团分类(1)官能团:决定有机化合物特性的原子或原子团。
(2)有机化合物的主要类别、官能团和典型代表物:类别官能团典型代表物名称、结构简式烷烃甲烷CH4烯烃(碳碳双键)乙烯CH2==CH2炔烃—C≡C—(碳碳三键) 乙炔CH≡CH芳香烃苯卤代烃(碳卤键)溴乙烷CH3CH2Br醇—OH(羟基) 乙醇CH3CH2OH酚苯酚醚(醚键)乙醚CH3CH2OCH2CH3醛(醛基)乙醛CH3CHO酮(酮羰基)丙酮CH3COCH3羧酸(羧基)乙酸CH3COOH酯(酯基)乙酸乙酯CH3COOCH2CH3胺—NH2(氨基)苯胺酰胺(酰胺基)乙酰胺CH3CONH2氨基酸—NH2(氨基)、—COOH(羧基)甘氨酸(二)有机化合物的命名1.有机化合物常用的表示方法有机化合物名称结构式结构简式键线式2-甲基-1-丁烯2-丙醇或CH3CH(OH)CH32.有机化合物的命名(1)烷烃(2)含官能团的有机物,与烷烃命名类似。
注意卤代烃中卤素原子作为取代基看待。
酯是由对应的羧酸与醇(或酚)的名称组合,即某酸某酯。
聚合物:在单体名称前面加“聚”。
(3)苯的同系物:苯环上的氢原子被烷基取代所得到的一系列产物。
①习惯命名:用邻、间、对。
②系统命名法将苯环上的6个碳原子编号,以某个甲基所在的碳原子的位置为1号,选取最小位次号给另一甲基编号。
有机化学第9章醇、酚、醚

–H2O
–H2O
△
重排
–H2O
△
偕二醇: 两个羟基在同一个碳原子上的二元醇, 很不稳定, 容易脱水变成羰基化合物: OH C C = O OH 邻二醇可加热脱水生成醛或酮 (中间经过烯醇的阶段): CH2–CH2 O OH OH CH2=CH–O–H CH3–C–H 1,4 –二醇 或 1,5 –二醇 加热脱水则生成环醚: CH2—CH2 CH2—CH2 CH2 CH2 CH2 CH2 OH OH O
5. 氧化和脱氢反应 常用的氧化试剂: KMnO4溶液 或 K2Cr2O7酸性溶液, 一般将伯醇直接氧化为羧酸 (很难停留在醛的阶段): H O O RCH–OH RC–H RC–OH 仲醇可被上述氧化剂氧化为酮 (酮不易继续被氧化): OH O R–CH–R′ R–C–R′ 叔醇一般不被上述氧化剂所氧化 (∵无α–H). 但如果用更 强的氧化条件, 如与酸性KMnO4溶液一起加热, 可使叔醇 氧化断链, 生成小分子氧化产物. (反应式见书, 了解) 采用特殊氧化剂 CrO3–吡啶的CH2Cl2溶液, 可使伯醇的氧化停留在醛的阶段: CH2=CHCH2OH CH2=CHCHO
9.1.1 醇的结构、分类和命名法 1. 醇的结构 (见图) 醇(alcohol)的官能团是直接与饱和碳原子相连的羟基 (–OH), 醇羟基中 O为 sp3 不等性杂化, 两个sp3杂化轨道分别与C和H形成σ 键, 其余两个sp3杂化轨道各有一对未共用电子, H–O–C的键角接近109.5°. 2. 醇的分类 根据羟基所连接的饱和碳原子的类型, 可分为 伯醇(1°)、仲醇(2°) 和 叔醇(3°). 根据所含羟基的数目, 可分为 一元醇 和 多元醇. 根据羟基所连的烃基结构, 可分为 饱和醇、不饱和醇 和 芳香醇.
有机化学第9章醇、酚、醚

RO–H + Na
C2H5ONa + 1/2 H2↑
说明醇的酸性比水弱, pKa(即 – ㏒ Ka)值: 醇 > 水
(∵ –R是给电子基团)
而RO–的碱性比OH–强. 因此醇钠遇水立即水解:
C2H5ONa + H2O
C2H5OH + NaOH
:
2. 酯化反应 (属于亲核取代反应)
醇与酸(无机酸和有机酸)之间脱水生成的产物 称为 酯.
R OR + NaX
醇钠
伯卤代烃
混合醚
5. 氧化和脱氢反应
• 常般用将的 伯氧 醇化直试接剂氧:化K为M羧nO酸4溶(很液难或停K留2C在r醛2O的7酸阶性段溶):液, 一
H
O
O
RCH–OH
RC–H
RC–OH
• 仲醇可被上述氧[O化] 剂氧化为酮[O(]酮不易继续被氧化):
OH
O
• R–CH–R′
只适用于碳数不多、结构简单的醇. (例子见书)
② 系统命名法:
命名原则(见书): 选主链、主链的编号
例: CH3CHCH2CHCH3
•不饱和醇的命名:
CH3 OH
4–甲基–2–戊醇
根据其不饱和键称为 某烯醇或某炔醇.
• 例: CH3CH=CHCH2OH 2–丁烯醇 (羟基位置为1时可省略) 多元醇的命名: CH3CHCH2CHCH3
R–C–R′
叔醇强醇的一氧般化不条被件上, 如[O述]与氧酸化性剂K所M氧nO化4溶(∵液无一α–起H加). 热但,如可果使用叔更
• 氧化断链, 生成小分子氧化产物. (反应式见书, 了解) 采氧用化特 停殊 留氧 在化醛剂的阶Cr段O:3–吡啶的CH2Cl2溶液, 可使伯醇的
有机化学第二版(高占先)(全14章答案完整版)_第8-14章

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH2OCCH3OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
C2H5CH3NaI+C2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH3H2Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
第九章 第一节 有机物的结构、分类和命名

[答案] (1)90
(2)C3H6O3
(3)—COOH —OH (4)4 (5)
常见官能团的检验
官能团种类 碳碳双键或 碳碳叁键 试剂 溴的四氯化碳溶液 酸性KMnO4溶液 NaOH溶液 AgNO3溶液、稀硝酸 判断依据 橙色退去 紫色退去 有沉淀产生
卤素原子
官能团种类 醇羟基 酚羟基
(1)主链选取不当——不是链最长支最多; (2)支链编号过大——位置号代数和不是最小; (3)支链主次不分——不是先简后繁。
1.有机物的种类繁多,但其命名是有规则的。下列有机物
命名正确的是 ( )
解析:A项主链错,应为正己烷;B项没有指明碳碳双键
的位置,应为3甲基- 丁烯,D项没有注明氯原子的位置, 1应为1,2二氯乙烷。 答案:C
到两种不同的编号系列,两系列中各位次和最小者即为正
确的编号,即同“近”、同“简”,考虑“小”。如
(3)写名称:
按主链的碳原子数称为相应的某烷,在其前写出支链的
位次和名称。原则是:先简后繁,相同合并,位号指明。
阿拉伯数字之间用“,”相隔,汉字与阿拉伯数字之间用 “”连接。如(2)②中有机物命名为3,4二甲基- 乙基辛烷。 6-
(2)定编号: 要遵循“近”、“简”、“小”原则。 ①以离取代基较近的主链一端为起点编号,即首先要考虑“ 近”。
②有两个不同的支链,且分别处于距主链两端同近的位置时,
则从较简单的支链一端开始编号,即同“近”考虑“简”。如
③若有两个相同的支链,且分别处于距主链两端同近的位 置,而中间还有其他支链,从主链的两个方向编号,可得
本章为有机化学部分,为方便系统复习,我们在编写 时把《化学2》中的有机化学部分与《有机化学基础》进行
了整合,本章供开设《有机化学基础》的学校使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) 醇与三卤化磷反应 通常用PBr3或PI3,有时直接用红磷和溴或碘 作试剂。 (3) 醇与二氯亚砜(SOCl2)反应 4. 卤素交换反应
通常用于伯碘代烷的制备。
卤代烃的物理性质physical properties
状态:除氯甲烷,溴甲烷,氯乙烷,氯乙烯等 少数卤代烃在室温下为气体外,大多为液体; 溶解性:不溶于水,易溶于有机溶剂; 相对密度:溴代烃、碘代烃和多卤代烃相对密 度大于1。卤代烷的相对密度随碳原子数增加而减 小; 沸点:比相应的烷烃大,比相应的醇小。 (为 什么?) 烃基相同的卤代烃:氯代烃<溴代烃<碘代 烃;(为什么?) 分子式相同的同分异构体:直链卤代烃>支 链卤代烃。(为什么?)
⑴ 物理性质:由于碳卤键的极性,卤代烷分子之间 的作用力以偶极-偶极作用力为主,因此卤代烷的熔 点,沸点等都较相应的烷烃高。 ⑵ 化学性质:碳卤键电子云偏向卤原子,所以卤原 子在一定的条件下可能带着一对电子离去,表现出 较高的反应活性,容易发生亲核取代反应和消除反 应。
⒉乙烯型卤代烃和苯基型卤代烃
结构特点:
基本性质:活泼,不太稳定
RM gX ≈ R
亲核试剂
碱
作为碱的反应——和活泼氢的反应 作为亲核试剂——发生亲核取代反以及亲核加成 反应
H H R MgX + H H H OH OR' O OCR' NR'(H)2 C CR' R H + MgX(OH) MgX(OR') O MgX(OCR') XMg NR'(H)2 XMg C CR'
p-π共轭体系
C H
2
C H
C l
C l
存在p-π共轭体系,碳 卤键键长缩短,强度加 强。 对化学性质的影响: 碳卤键不易断裂,反应 活性差。
⒊烯丙型卤代烃和苄基型卤代烃
C C C X C X
-X-
-X-
p-π共轭
结构特点:
烯丙型和苄基型卤代烃由于碳卤键的极性,卤原子带着一对电子 以卤负离子的形式离去后,形成的烯丙型或苄基型碳正离子可以 形成p-π共轭体系,从而使正电荷得以分散,碳正离子稳定性增 加。 对化学性质的影响: 烯丙型和苄基型卤代烃具有很好的反应活性。
① RX用伯卤代烷较好 ② 合成上增长碳链的方法之一 ③ 羧酸及其衍生物的间接合成法
实例:
C H B r 2 +N a C N
C H C N 2
+N a B r
H O 2 C H C O O H 2
⑷ Friedel-Crafts反应
A l X 3 + R X R + H X
① RX是良好的烷基化试剂 ② 可能产生重排产物
1-氯-3-碘苯
一些惯用名称:
C H C l C H C l 3 2
C H I 3
氯化苄或苄(基)氯
氯仿
碘仿
练习:徐寿昌《有机化学》(第四版)p208,1,2
卤代烃的结构structure
⒈卤代烷烃的结构
结构特点:
卤代烷烃碳卤键由于成键原子的电 负性差异而具有极性,电子云偏向 卤原子。
结构对性质的影响
实例:C
H
3 3
(C H C H
3 ) 3 2
2 ) 3
B r A g N O
3 3
加 热 / C
2
产 生 沉 淀 出 现 沉 淀 出 现 沉 淀
C H (C H
C H (B r )C H
H
5
O H 片 刻 立 刻
C B r
消除反应( Elimination reaction)
R H C H CH 2 X + NaOH 醇 R C H CH 2 + NaX + H 2O
② 反应的立体化学——外消旋化
③ 反应的能量变化曲线
④ 影响因素 烃基结构:苄基型,烯丙型,3oR->2oR->1oR->CH3碳正离子的稳定性决定反应速率
影响碳正离子稳定性的因素——电子效应
超共轭效应
共轭效应
离去基团X
反应活性:RI>RBr>RCl>RF
亲核试剂的亲核性,溶剂的极性等也对反应有影响。
亲核试剂 nucleophile
反应底物 substrate
亲核试剂(nucleophile):含有未共用电子对的物种, 可以是负离子,如OH-, RO-, HS-, RS-, RCOO-,CN-, X-等 ;也可以是中性分子,如NH3, H2O等。
亲核取代反应在合成中的应用举例 ⑴ 卤代烃的水解反应
① 按照不同的卤原子种类分为氟代烃、氯代烃 R X 、溴代烃、碘代烃。 Alkyl halides ② 按照卤原子数目不同可分为一卤代烃和多卤 代烃。
从烃基的结构分:
① 按照饱和程度分为饱和卤代烃(即卤代烷烃或烷基卤 )与不饱和卤代烃(包括卤代烯烃和卤代芳烃等); ② 卤代烷烃可根据卤素所取代的氢原子种类或者卤素所 连的碳原子种类分为一级卤代烃(或伯卤代烃,1o卤代烃 )、二级卤代烃(或仲卤代烃,2o卤代烃)、三级卤代烃 (或叔卤代烃,3o卤代烃);
① 反应条件:卤代烷与氢氧化钠或氢氧化钾的醇溶液作用 ② 消除方式:β-消除(消除卤素与β-碳上的氢原子) ③ 反应活性:3o 卤代烷> 2o 卤代烷> 1o 卤代烷 ④ 应用:制备烯烃的重要方法
2o 卤代烷和3o 卤代烷 发生β-消除反应时,可以有 两种不同的消除方向,得到两种不同的产物。
C H
+ R M g X C O 2
H R C O O H R C O O M g X H O 2
+
羧酸
该反应可用来制备增加一个碳原子的羧酸。
结论: 制备格氏试剂的条件除了必须无水无氧,在惰性 溶剂中进行外,反应体系中不能有二氧化碳以及 含活泼氢的化合物。
O + R M g X
+ H R C H C H O M g X R C H C H O H 2 2 2 2 H O 2
实例:
A l B r 3 ( C H ) C H B r + 3 2
C H ( C H ) 3 2 + H B r
⑸与硝酸银反应
C H O H 2 5 + R X R O N O A g X + A g N O 2 3
① 反应活性: RI > RBr > RCl 叔卤代烷 > 仲卤代烷 > 伯卤代烷 ② 鉴别卤代烷的简便方法
命名步骤:
① 选择主链,要求含有卤原子,最长碳链; ② 编号,要求取代基位号最小,同时必须遵守最 低系列原则,次序规则; ③ 取代基的列出按照次序规则先简后繁的次序。 实例:
5-甲基-2-溴庚烷
5,5-二甲基-1-氯己烷
1-乙基-2-碘环戊烷
1-甲基-2-氯-4-溴环己烷
4-氯-5-溴-1-庚烯
⒊SN1和SN2反应的竞争:
消除反应机理
⒈单分子消除反应历程(E1)
⒉双分子消除反应历程(E2)
⒊E1反应和E2反应的竞争
亲核取代反应和消除反应的竞争
比较:
结论:亲核取代反应和消除反应之间存在竞争。
比较:
结论:卤代烃和亲核试剂的空间体积大,有利于消除反应。
比较:
结论:亲核试剂碱性弱有利于亲核取代反应,碱性强有利 于消除反应。
第九章 卤代烃
Chapter 9. alkyl halides
内容提要
卤代烃的分类和命名 卤代烃的结构
卤代烷的制法 卤代烷的性质
两类反应机理
卤代烃的分类和命名classification and nomenclature
卤代烃分类
卤代烃——烃分子中的氢原子被卤素取代的产物。
从卤素的角度分:
③ 卤代烯烃和卤代芳烃按照不饱和基团与卤原子之间的距 离可分为乙烯型(苯基型)、烯丙型(苄基型)、隔离型 。 H
C H
2
C H
X
C H
2
C H
C X
R
C H
2
C H
(C H
2 ) n
X
乙烯型
烯丙型
隔离型(n≧2)
X
C H
2
X
(C H
2 ) n
X
苯基型
苄基型
隔离型(n≧2)
பைடு நூலகம்
卤代烃的命名
基本原则:以烃作母体,卤素作取代基。
另外,高温和弱极性溶剂有利于消除反应。
本章重点:
卤代烃的结构,结构对反应活性的影响 卤代烃的化学性质 ①亲核取代反应,两种反应机理(SN1和 SN2),影响因素(烃基,卤素,反应条 件) ②消除反应,消除反应机理(E1和E2), 消除反应和取代反应的竞争 ③与金属反应——格氏试剂的制备和应用
卤代烃的制法preparations
1. 自由基取代反应——卤代反应 缺点:烷烃的氯代得到复杂的产物,难以分离,合成中的应用 价值不大。 比较有意义的是某些烷烃的溴代,以及烯丙位和苄基位的卤代 :
2. 加成反应——不饱和烃与卤化氢的加成反应
3. 醇的卤代反应 (1) 醇与氢卤酸反应
说明: ① 反应可逆; ② HX通常是HBr或HI,用浓HCl时必须 在路易斯酸催化下进行,常用的路易斯酸为ZnCl2,这一试剂称 为卢卡斯(Lucas)试剂。
制备方法
醚 + M g R M g X R X
格林尼亚(Grignard)试剂 (简称格氏试剂)
① 卤代烷的反应活性:RI > RBr > RCl > RF ② 通常用RBr或RCl来制备格氏试剂 ③ 反应条件:无水无氧条件下在惰性溶剂( 如乙醚,四氢呋喃等)中反应。
Victor Grignard (1871 ~1935) 1912诺贝尔化学奖
