铝、镁、铁、锌与酸 反应
金属与稀盐酸和稀硫酸的反应规律。

金属与稀盐酸和稀硫酸的反应规律一、引言金属与稀盐酸和稀硫酸的反应一直是化学实验中常见的实验内容。
通过观察金属与稀盐酸和稀硫酸的反应,可以深入了解金属与酸反应的规律,为进一步学习金属与酸的化学性质奠定基础。
本文将系统介绍金属与稀盐酸和稀硫酸的反应规律,以便读者对此类反应有更深入的了解。
二、金属与稀盐酸的反应规律1. 钠与稀盐酸的反应规律钠是一种较活泼的金属,与稀盐酸反应会产生氢气和氯化钠,并伴有剧烈的放热现象。
化学方程式为:2Na + 2HCl → 2NaCl + H2↑。
2. 镁与稀盐酸的反应规律镁是一种较活泼的金属,与稀盐酸反应会产生氢气和氯化镁。
镁与盐酸的反应速度较快,但放热不如钠。
化学方程式为:Mg + 2HCl → MgCl2 + H2↑。
3. 铝与稀盐酸的反应规律铝是一种较活泼的金属,但铝表面的氧化膜会限制其与酸反应速度。
在稀盐酸中,铝表面的氧化膜会溶解,继而与盐酸发生反应,产生氢气和氯化铝。
化学方程式为:2Al + 6HCl → 2AlCl3 + 3H2↑。
4. 锌与稀盐酸的反应规律锌是一种活泼的金属,与稀盐酸会产生氢气和氯化锌。
锌与盐酸的反应速率较快,但放热不及钠。
化学方程式为:Zn + 2HCl → ZnCl2 +H2↑。
5. 铁与稀盐酸的反应规律铁是一种较活泼的金属,与稀盐酸会产生氢气和氯化铁。
铁与盐酸的反应速率较慢,但放热较大。
化学方程式为:Fe + 2HCl → FeCl2 +H2↑。
三、金属与稀硫酸的反应规律1. 钠与稀硫酸的反应规律钠与稀硫酸反应会产生硫化氢气和亚硫酸钠,并伴有放热现象。
化学方程式为:2Na + H2SO4 → Na2SO3 + H2S↑。
2. 镁与稀硫酸的反应规律镁与稀硫酸反应会产生硫化氢气、硫酸镁和水。
镁与硫酸反应速率较慢,但放热较大。
化学方程式为:Mg + H2SO4 → MgSO4 + H2S↑。
3. 铝与稀硫酸的反应规律铝与稀硫酸反应会产生硫化氢气、亚硫酸铝和水。
2020-2021备战中考化学 金属与酸反应的图像综合试题含答案解析

一、中考初中化学金属与酸反应的图像 1.如图表所示4个图象中,能正确反映变化关系的是A .足量镁和铝分别放入等质量、等浓度的稀盐酸中B .镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B【解析】【分析】【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。
故选B。
2.下列所示的四个图像,能正确反映对应变化关系的是A.向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉B.等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应C.向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸D.向一定量的含有盐酸的氯化铜溶液中滴加氢氧化钠溶液【答案】B【解析】【分析】【详解】A、铁的金属活动性比铜强,比镁弱,向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉,铁不能与硝酸镁溶液反应,铁能与硝酸铜溶液反应生成硝酸亚铁溶液和铜,参加反应的铁的质量小于生成铜的质量,则溶液的质量应减少,故错误;B、等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应,横坐标是硫酸的量,故等量的硫酸产生氢气的质量相等,当金属全部参加反应,生成氢气的质量与金属的相对原子质量成反比(+2价的金属),则镁产生的氢气的质量大于铁,故正确;C、向一定量氢氧化钠溶液中滴加pH=3的稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,随着反应进行,溶液碱性减弱,pH减小,恰好完全反应时pH=7,继续加入稀盐酸时,溶液pH小于7,但是不能减小到3,更不能小于3,故错误;D、向含有盐酸的氯化铜溶液中滴加烧碱溶液时,氢氧化钠先和稀盐酸反应,后和氯化铜反应,因此开始不能产生沉淀,故错误。
2023年浙江省中考科学一轮冲刺练习:金属与酸反应中考题精选

金属与酸反应中考题精选一、单选题1.(2022·山东济宁中考真题)相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面说法正确的是A.金属锌反应速率最大B.金属锌的活动性最强C.金属镁生成氢气质量最多D.金属铁消耗稀硫酸质量最多2.(2022·重庆中考真题)学会识图能发展科学思维,一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如下图。
下列猜想正确的有①0~t1阶段,可能是铝表面有层氧化膜①t1~t2阶段,可能是铝和稀盐酸反应放出热量①t3时刻,可能是稀盐酸过量①t3时刻,可能是稀盐酸不足A.1项B.2项C.3项D.4项3.(湖南株洲中考真题)金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示:则W、X、Y、Z的金属活动性顺序为A.X>W>Z>Y B.Z>X>W>Y C.W>X>Y>Z D.Y>Z>X>W4.(2021·甘肃甘南中考真题)用稀盐酸与大小相同的镁、锌、铜片反应探究金属活动性。
实验如下图所示。
下列说法正确的是A.铜片表面可以观察到气泡B.锌片比镁片反应更剧烈C.金属活动性由强到弱顺序为:镁>锌>铜D.三支试管中盐酸的溶质质量分数可以不同5.(湖北孝感中考真题)现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。
向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。
则下列结论正确的个数是①恰好完全反应时,一定没有固体剩余①x的值为0.2①铁样品中可能含有镁①M点对应的溶液中含有2种或3种溶质A.1个B.2个C.3个D.4个6.(2021·广西玉林中考真题)如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压,瓶内气压与时间关系如曲线所示。
有关说法正确的是A.反应结束后,稀盐酸可能有剩余B.曲线①表示锌粒与稀盐酸的反应C.比较b、c两点,说明影响反应速率的因素之一是反应物的接触面积D.a、b、c、d四点处的溶质成分相同7.(2022·河南中考真题)某种金属混合物样品由Mg、Al、Fe、Cu四种金属中的两种组成。
镁铁锌铝与稀盐酸反应生成氢气质量

镁铁锌铝与稀盐酸反应生成氢气质量一、简介镁铁锌铝是常见的金属元素,它们与稀盐酸反应能够生成氢气,这一反应在工业生产和实验室中具有重要的应用价值。
本文将对镁铁锌铝与稀盐酸反应生成氢气的质量进行探究和分析。
二、镁与稀盐酸的反应1. 反应方程式镁+ 2HCl → MgCl2 + H2↑2. 反应规律在常温下,镁与稀盐酸反应生成氢气,生成氢气的质量与反应中镁的质量、反应时间、反应温度等因素有关。
可以通过实验得到生成氢气的质量与反应条件的关系。
三、铁与稀盐酸的反应1. 反应方程式Fe + 2HCl → FeCl2 + H2↑2. 反应规律铁与稀盐酸反应同样能够生成氢气,生成氢气的质量与反应中铁的质量、反应时间、反应温度等因素也有关系。
实验可以进一步验证生成氢气的质量与反应条件的相关性。
四、锌与稀盐酸的反应1. 反应方程式Zn + 2HCl → ZnCl2 + H2↑2. 反应规律锌与稀盐酸反应同样产生氢气,生成氢气的质量与反应中锌的质量、反应时间、反应温度等因素也成正比关系。
实验可以进一步验证生成氢气的质量与反应条件的相关性。
五、铝与稀盐酸的反应1. 反应方程式2Al + 6HCl → 2AlCl3 + 3H2↑2. 反应规律铝与稀盐酸反应同样会产生氢气,生成氢气的质量与反应中铝的质量、反应时间、反应温度等因素也有关系。
实验可以进一步验证生成氢气的质量与反应条件的相关性。
六、结论通过对镁铁锌铝与稀盐酸反应生成氢气的质量进行分析和研究,可以得出以下结论:1. 反应中金属的质量越多,生成氢气的质量越大。
2. 反应时间和反应温度的增加会促进生成氢气的速度和质量。
3. 不同的金属和反应条件下,生成氢气的质量存在一定的差异,需要具体实验进行验证和分析。
七、展望进一步研究和探索镁铁锌铝与稀盐酸反应生成氢气的质量,可以深入了解金属与酸类物质的化学反应规律,为工业生产和实验室应用提供依据和参考。
同时可以通过改变反应条件和金属材料,探索新的反应路径和应用领域。
利用化学方程式计算、1、?

ρ=m/V ; m= ρV
[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁? 解:设可生成氧化镁的质量为X 点燃 2 Mg + O 2 ====== 2 Mg O 48 80 3g X 48 3g ------ = -----80 X 80×3g X = -----------48 = 5 g (1)设未知数 ….... …….….设
九年级化学
第五单元
化学方程式
课题3
利用化学方程式的 简单计算
复习提问: 以镁在空气中燃烧为例说明化学方程式的意义 2Mg + O2 ======
点燃
2 Mg O
48 : 32 : 若: 48g (32 )g 若: (24 )g
若 ( )g
80 80 ( )g ( 4 0)g
( )g
(16 )g
7.95g
5、实验室加热5g高锰酸钾使部分高锰酸钾分解,称得剩 余物质量为4.68g,此时有多少克二氧化锰生成?K:39; Mn:55; O:16; (2010县统考题)
6、在某些牙膏中常用纯净的轻质碳酸钙粉末作摩擦剂。 其生产流程是:煅烧石灰石得到生石灰,再将生石灰水洗 得到石灰乳,然后向纯净的石灰乳中通入二氧化碳得到轻 质碳酸钙粉末。某工厂现有含氢氧化钙14.8g的石灰乳, 至少通入多少千克二氧化碳气体才能使氢氧化钙全部转化 为碳酸钙沉淀?C:12;O:16;Ca:40(2011县统考 题)
C:12 O :16
2、氯酸钾和二氧化锰的混合物15.5g,充分加热反应后,
称得剩余物质量为10.7g,求 ①制得O2多少克? ②剩余物是什么?各多少克? ③原混合物中含KClO3多少克?
K:39 Cl:35.5 O :16 Mn:55
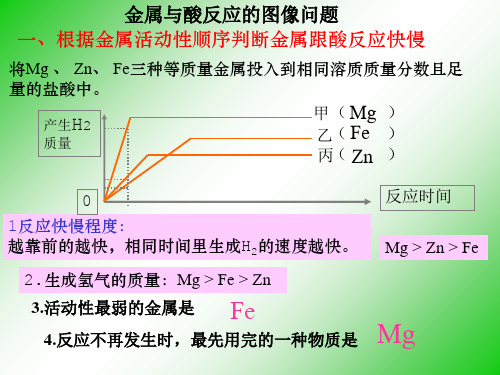
金属与酸反应多少、快慢

二.判断生成氢气的快慢
例1.右图是等质量的金属与足量
氢气 (g)
M N
的稀盐酸反应,且M与N的化合价
都是+2。试判断:
t
①M与N的活动性顺序 N>M
②M与N的相对原子质量大小是 N>M
练习1:等质量的锌、铁分别与足量的稀盐酸反 应生成氢气的质量与反应时间的关系图如下:
氢 气 质 量
A B
判断: B为 锌
一.等质量的不同金属与足量的酸反应的规律 例:相同质量的镁、铝、锌、铁,分别与足量 的稀盐酸反应,产生氢气的质量由大到小的顺
序是什么?
(相对原子质量:镁:24,铝:27,铁:56,锌:65)
2Al+6HCl=2AlCl3+3H2↑ 结论:等质量的不 54 6 同金属与足量的酸 Mg+2HCl=MgCl2+H2↑ 反应产生氢气的质 24 2 量: Fe+2HCl=FeCl2+H2↑ Al>Mg>Fe>Zn 56 2 Zn+2HCl=ZnCl2+H2↑ 65 2
时间
A为 铁 ;
。
练习2:相同质量的Mg、Zn、Fe和足量的稀盐
酸反应,产生氢气的总质量(m)随时间(t)变化 的关系如下图,则下图中a、b、c表示的金属分别 为:A: Mg ;B: Fe ; C: Zn 。 m
A B C
0
t1 t2
t3
t
中考链接
练习3.(2013.菏泽市)现有等质量的X、Y两种金属,分 别放入溶质质量分数相同的足量稀硫酸中,产生氢气的 质量与反应时间的关系如右图所示(已知X、Y在生成物 中化合价均为+2价)。则下列说法中不正确的是( B ) A.生成氢气的质量:X﹥Y B.相对原子质量:X﹥Y C.金属活动性:Y﹥X盐酸或 稀硫酸)反应,生成氢气的质量大小,取决于该 金属相对原子质量与元素化合价的比值。 相对原子质量 元素的化合价 的比值越小,生成氢气越多
金属与酸反应的图像问题
消耗金属的质量= 金属金相属对化原合子价质量×氢气质量 制取等质量的氢气消耗金属的质量
相对原子质量 ———————-(比值越大),消耗的金属越多。 化合价绝对值
相对原子质量
*制取1克氢气消耗金属的质量= ———————-
金属化合价绝对值
制取1克氢气消耗金属的质量 Mg:12g Al:9g Fe :28g
应生成H2的质量与反应时间的关系如图所示。根据图中
所提供的信息,得出的结论正确的是
( AD )
(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是A>B>C B.金属活动性顺序是A>B>C
C.反相同质量的Mg、Zn、Fe和足量的稀硫酸反 应,产生氢气的总质量(m)随时间(t)变化的 关系如下图,则下图中a、b、c表示的金属分 别为:a Mg 、 b Fe 、c Zn 。
y1
n
Mg 24
+2HCl=MgCl2+H22↑
y2 Fe 56
+2HCl=FeCl2 +H2n2↑
y3
n
y1= y2= y3=
27n
3
24n 2 56n 2
Zn +2HCl=ZnCl2 +H2↑
65
2
65n
y4
n y4= 2
27n×2 6
y1=
27n 3
y2=
24n 2
y3=
56n 2
65n y4= 2
2、等质量的金属A、B与相同质量的稀硫酸反 应,在反应中A、B均显+2价,产生氢气的质 量随时间变化的情况如右图。则: ⑴金属A、B的活动性:A__>__B__ ⑵金属A、B的相对原子质量_A_>__B_。 ⑶对于曲线A表示的反应,物质_稀__硫__酸__ 有剩余。 ⑷请你写出符合此图像的两种金属:A: _锌____B:__铁____,并分别写出它们与稀硫酸 反应的方程式。
铝镁铁锌四中金属,分别和稀盐酸、稀硫酸反应的化学方程式

铝镁铁锌四中金属,分别和稀盐酸、稀硫酸反应的化学方程式
答:
镁和稀盐酸反应生成氯化镁和氢气,和稀硫酸反应生成硫酸镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑,Mg+H2SO4═MgSO4+H2↑;
铝和稀盐酸反应生成氯化铝和氢气,和稀硫酸反应生成硫酸铝和氢气,反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑;
锌和稀盐酸反应生成氯化锌和氢气,和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,Zn+H2SO4═ZnSO4+H2↑;
铁和稀盐酸反应生成氯化亚铁和氢气,和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑,Fe+H2SO4═FeSO4+H2↑;
镁和稀盐酸反应生成氯化镁和氢气,和稀硫酸反应生成硫酸镁和氢气;
铝和稀盐酸反应生成氯化铝和氢气,和稀硫酸反应生成硫酸铝和氢气;
锌和稀盐酸反应生成氯化锌和氢气,和稀硫酸反应生成硫酸锌和氢气;
铁和稀盐酸反应生成氯化亚铁和氢气,和稀硫酸反应生成硫酸亚铁和氢气.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• (2008年咸宁市)有X、Y、Z三种金属,如果把X和 Y分别放入稀硫酸中,X溶解并产生氢气,Y不反 应;把Y和Z分别放入硝酸银溶液中,过一会儿, 在Z表面有银析出,而Y没有变化。根据以上实验 事实,回答下列问题: • (1)X、Y和Z的金属活动性由强到弱的顺序 为 ; • (2)举出符合上述金属活动性顺序的三种常见金属 (写化学式) ;并写出在Z表面有银析出 反应的化学方程式 。
滤渣与滤液
• 1、滤渣与滤液不反应 • 2、只有一种滤渣则是活动性最弱的金属 • 滤液中只有一种化合物则是活动性最强 的金属生成的物质 • 3、守恒原则:例如铁和硫酸铜溶液反应
• 我们已经知道,常见金属按其活动性强弱 可排成如下顺序: • K、Ca、Na、Mg、Al、Zn、Fe、 、 、 (H)、Cu、 、Ag、 、Au • (1) 请用相应的元素符号完成上述金属活动 性顺序表。 • (2) 向硝酸银和硝酸铜的混合溶液中加入一 些镁粉,完全反应后过滤。若向残渣中滴 加稀盐酸后有气泡冒出,则残渣中含有的 金属是 ;若残渣中无气泡生成,则 滤液中一定含有的金属离子是 。(填 符号)
• (2008年宜昌市)向氧化铜和铁粉的混合物中 加入一定量的稀硫酸,微热,分反应后过 滤。以下判断错误的是 ( ) • A.滤纸上可能含有铜 B.滤液中可能 含有硫酸亚铁 • C.滤液中可能含有硫酸铜 D.滤纸上可 能含有氧化铜
• 向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中 加入一些铁粉,反应完成后过滤,下列情况不可 能存在的是( ) • A、滤纸上有Ag、Cu、Fe,滤液中有Zn2+、 Fe2+ • B、滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+ • C、滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、 Fe2+ • D、滤纸上有Ag、Cu、Fe,滤液中有Cu2+、 Zn2+、Fe2+
• (2008年贵港市)下列说法正确的是 ( ) • A.铁在潮湿的空气中容易生锈 B. 金属的活动性:Zn>Ag>Cu • C.合金属于纯净物 D.铝是地 壳中含量最多的元素
• (2008年黄石市)埋在地下的铸铁管道在下列 哪种情况下腐蚀最慢 ( ) • A.在干燥、致密的土壤中 B. 在干燥、 疏松的土壤中 • C. 在潮湿、致密的土壤中 D. 在潮湿、 疏松的土壤中
• 往AgNO3和Cu(NO3)2的混合溶液中加入 一定量的铁粉,充分反应后,有金属析出, 过滤、洗涤后往滤渣中加入稀盐酸,有无 色气体放出,则滤液中一定存在的物质是 • A、AgNO3、Cu(NO3)2、Fe(NO3)2 B、Cu(NO3)2、Fe(NO3)2 • C 、Fe(NO3)2 D、 Fe(NO3)3
测定金属活动性顺序
• • • • • 1、先排顺序 2、中间单质,两头化合物; 或者中间化合物,两头单质 3、检验 例如:锌、铁、铜、
• 现有锌粉、铝粉和铜粉,某化学兴趣小组 为研究它们的活动性顺序,需用的试剂是 • A、稀盐酸 • B、氯化铝溶液 • C、硫酸铜溶液 • D、硝酸锌溶液
• (2008年黄石市)某学生为了验证铁、锌、铜三种 金属的活动性顺序,设计了四种方案: • ①将Zn、Cu分别加入到FeSO4溶液中 • ②将Zn、Cu分别加入到ZnSO4溶液中 • ③将Zn分别加入到FeSO4、CuSO4溶液中 • ④将Fe 分别加入到ZnSO4、CuSO4溶液中 ( ) • A. ①或④ B. ①或② • C. ②或③ D. ③或④
• (2008年汕头)把相同体积、相同质量分数的 稀盐酸,分别滴到等质量、颗粒大小相同 的X、Y、Z三种较活泼金属中,生成H2的 质量与反应时间的关系如右图所示。这三 种金属的活动性顺序为 ;假如X、 Y、Z都是+2价金属,则相对原子质量由大 到小的顺序为 。
• 5.6 g含杂质的铁片加到足量的稀硫酸中, 共收集到0.19 g氢气,该铁片中不可能含有 的杂质是( ) • A.铝和铅 B.镁和锌 C.锌和铜 D.镁和铝
铝、镁、铁、锌与酸反应
定理:等质量的铝镁铁锌与足量的酸反应,生成的氢气的质 量由多到少的顺序是铝镁铁锌
• (2008年临沂市)质量相同的下列金属,分别 加入到足量的稀盐酸中充分反应,放出氢 气最多的是 ( ) • A.Mg B.Al C.Cu D.Zn
将质量相等的A、B、C三种金属,同时 分别放入三份溶质质量分数相同且足 量的稀盐酸中,反应生成H2的质量与反应时 间的关系如图所示。根据图中所提供 的信息,得出的结论正确的是。 (已知:A、B、C在生成物中均为+2价) A.放出H2的质量是A>B>C B.金属活动性顺序是A>B>C C.反应速率最大的是A D.相对原子质量是C>B>A
•
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E 为非金属单质,下图是它们之间的相互转化关系。请回答: • (1)反应①的基本反应类型是 ; • (2)C的化学式为 ; • (3)写出物质E和B在加热条件下反应的化学方程式 • • (4)右图转化中产生无色气体E的原因是 • 。
往Cu(NO3)2溶液中加入一定量的铁粉, 充分反应后,有金属析出,过滤、 洗涤后往滤渣中加入稀盐酸,有无色气体 放出。下列分析正确的是 A.滤液中一定有Cu(NO3)2、Fe(NO3)2 B.滤液中一定有 Fe(NO3)2、一定没有Cu(NO3)2 C.滤液中一定有Fe(NO3)2 ,可能有 Cu(NO3)2 D.滤渣中一定有铁和铜
• (2008年攀枝花市)x、Y、z、W是四种不同的金属,为比 较金属活动性的强弱,某同学利用这四种金属单质、盐酸、 Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能 发生置换反应的记为“√”,不能反应的记为“一”,无 标记的表示未做该实验)。这四种金属的活动性顺序为 ( ) • A.X>W>Y>Z B.X>Y>W>Z • C.W>X>Y>Z D.Y>W>Z>X
• 将盛有等质量、等溶质质量分数的稀盐酸 的两只烧杯,放在托盘天平左右两盘上, 调节至平衡,再向两只烧杯中分别放入质 量相等的镁和铁,待反应停止后,请判断: • ①若天平仍保持平衡,烧杯中一定没有剩 余的物质是____________; • ②若天平失去平衡,则指针一定偏向放 _____________的一边。
Ag Ag(NO3)2 Cu(NO3)2 Zn(NO3)2
• 向只溶解有硝酸银和硝酸铜的溶液中加入 一定量的铁粉,充分反应后溶液中仍有金 属固体,过滤后往滤渣中加入盐酸,有无 色气体放出,则滤液中一定存在的溶质是 • A.硝酸亚铁,硝酸银 • B.硝酸亚铁,硝酸银 • C.硝酸亚铁,硝酸铜,硝酸银 D.硝酸亚铁
X
Y
Z
W
盐酸
Z的硝酸盐 W的硝酸盐
√
√
—
√
—
—
√
• 有X、Y、Z三种金属,把Y投入X(N03)2溶 液中,Y表面有X析出, 把X投入Z(N03)2 • 溶液中,X表面有Z析出。X、Y、Z三种 金属的活动性由强到弱的顺序是 • A.Z>Y>X B.Y>X>Z • C.X>Y>Z D.X>Z.Y
• (2008年恩施自治州)对甲、乙、丙三种金属活动 性的实验研究过程如下: • (1)取大小相等的三种金属片,分别放入CuSO4溶 液中,一段时间后,甲、丙表面出现红色物质, 乙没有现象。 • (2)取大小相等的甲、丙两种金属片,分别放入相 同的稀盐酸中,甲、丙表面都产生气泡,但甲产 生气泡的速度明显比丙的快。则甲、乙、丙三种 金属的活动性顺序是 ( ) • A.甲>丙>乙 B.丙>乙>甲 • C. 甲>乙>丙 D . 丙>甲>乙
• (2008年眉山市)金属材料在人类活动中已得 到越来越广泛的应用。下列性质属于金属 共性的是 ( ) • A.硬度很大、熔点很高 B.有良好 的导电性、传热性 • C.是银白色的固体 D.易与酸反 应产生氢气
• (2008年苏州市)关于金属物品的使用正确的是 ( ) • A.铝合金门窗变旧变暗后用砂纸或钢丝球打磨 • B.铁桶中加入硫酸铜溶液和石灰乳配制杀菌剂波 尔多液 • C.铝壶内的水垢用质量分数为18%的热盐酸长时 间浸泡 • D.校内用钢架制作的自行车防雨棚应定期喷涂油 漆防锈
定理:溶液质量相等、溶质质量分数相同的稀盐酸 与足量的铝镁铁锌反应生成的氢气的质量相同
• 某课外活动小组为探究实验室制取氢气的方案, 分别用金属A、B跟质量相同、质量分数相同的稀 硫酸反应,经实验发现:生成氢气的质量与反应 时间有下图所示关系。分析图像得到的以下结论 中,不合理的是 • A.反应得到氢气的质量相等 • B.反应后所得溶液的质量分数A >B • C.两种金属的活动顺序A >B • D.稀硫酸已完全反应,两种金属可能有剩余
• (200 8年河北省)为验证Fe、Cu、Ag三种金 属的活动性是依次减弱的,某化学兴趣小 组设计了图2所示的四个实验。其中不必进 行的是 ( )
鉴别题
• 黄金饰品中的假货常常鱼目混珠,社会上 有些不法分子时常以黄铜冒充黄金进行欺 诈活动。黄铜(铜锌合金)与黄金的外观 很相似,我们可用什么方法来鉴别它们呢?
例题2. 等质量的锌、铁与足量的稀硫酸反 应,下列产生氢气的质量与反应时间的关系 图,合理的是( )
A
B
C
D
• 将质量相等的A、B两块金属,分别放入溶质质量 分数相同的足量稀盐酸中,生成氢气的质量(m) 与反应时间(t)的关系如右图 • 所示(产物中A、B两种元素的化合价相同)。分 析右图,可以获得 • 的信息有(任写两条): • (1) • (2)
• 将Mg、Al、Zn分别放入相同溶质质量分数 的盐酸中,反应完成后,放出的氢气质量 相同,其可能原因是 A. 放入的三种金属质量相同,盐酸足量 B. 放入的Mg、Al、Zn的质量比为12︰9︰ 32.5,盐酸足量 C. 盐酸的质量相同,放入足量的三种金属 D. 放入的盐酸质量比为3︰2︰1,反应后无 盐酸剩余
