阴极极化曲线的测定
电化学基础实验指导书

实验一恒电流法测定阴极极化曲线、实验目的1、掌握恒电流法测定阴极极化曲线的基本原理和方法;2、学习分析极化曲线的方法。
、基本原理极化是电化学术语,含有偏离的意思,它是以热力学平衡电位为基点的偏离。
通常,阴极的电位偏离其自然腐蚀电位向负的方向移动,叫做阴极极化,反之为阳极极化。
使之偏离的方式可以不同,借外电路通以电流达到电极电位偏离平衡电位是常见的基本方式,这电流称为极化电流,电极电位与平衡电位之差称为极化过电位。
通常实验测量极化电流与极化过电位或者直接用电极电位)的关系曲线称为电极的极化曲线。
它是研究电极过程动力学的基本实验手段。
测量极化曲线通常采用两种方法:恒电流法和恒电位法。
本实验是用恒电流方法来测量碳钢在3%NaCI水溶液中的阴极极化曲线。
恒电流法是以电流为主变量,既通过调节电路电阻使某一恒定电流通过电极,并在电位达到稳定后读取电位值,然后在改变电流使之恒定在个一新数值,再记下新的电位,并以此类推,便可以得到一系列的电流和电位的对应值。
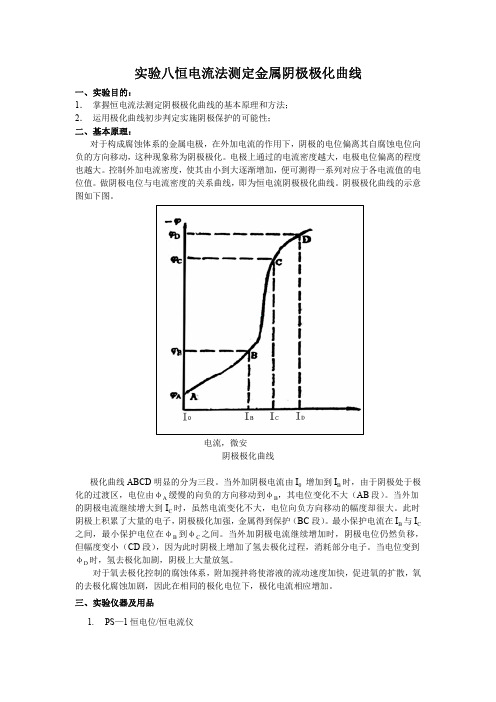
把极化电流密度i对阴极电位“作图即得到阴极极化曲线。
通过阴极极化曲线的测定,可以知道金属在该介质中的阴极极化性能,并提供保护电位和保护电流密度的参数数据。
三、实验仪器和线路1、实验用品数字万用表一台滑线变阻器一个电阻箱一个直流电源一个洗耳球一个鲁金毛细管一个饱和甘汞电极一个铂电极一个微安表、毫安表各一个自由夹与十字夹 游标卡尺玻璃缸(2000mL ) 台天平及砝码 导线碳钢试样,3%NaCI 水溶液,无水乙醇,脱脂棉球,滤纸,饱和氯化钾溶液,金刚纱布( 1#、0#、2#各一张)。
2、测量线路:极化回路由电源 B 变阻器R 、电流表A 换向开关 K 辅助电极和研究电极等组成,电位测量回路 由高阻抗电压表 D 参比电极、待测电极组成。
实验中用饱和甘汞电极作为参比电极,用铂电极作为辅助电极,铂电极是用铂片烧焊在玻璃管内, 由铜导线引出。
四、测量步骤:1、 电极处理:用金钢砂布1#至 2/0#打磨试样表面,测量其尺寸,然后用无水乙醇脱脂。
阴极极化曲线的测定

五、实验记录
镀液
Ⅰ号
电动势值(阴极相对于饱和甘汞电极)(V) 电镀面积(cm) 5mA 10mA 15mA 20mA 25mA 0mA (长×宽×2)
Ⅱ号
Ⅲ号
Ⅳ号
六、数据处理
1.计算电流密度DK和阴极电位φK
电流密度 DK
电流值 电镀面积
(mA /
cm2 )
阴极电位φK=饱和甘汞电极-所测得的电动势值
注意:
(1)判明光标移动方向与电动势值大小的关系;
(2)测量过程中,必须经常调整电动势值,保持光标最接 近零;
(3)读取电动势时,光标可能还会缓慢地朝一个方向移动 或左右摆动,只记下8min时的电动势值即可。
6.改变输出电流、测定电动势
(1)5mA的电动势测定完后,按第4-5步骤依次测定电流 输出值为10mA、15mA、20mA、25mA时的电动势,电流输出 值确定后按下秒表,4min后读取电动势值;
(2)依次调节工作电流调节“中”、“细”、 “微”键盘,使检流计光标最接近为零。
4.确定输出电流
调标准后,调节直流标准电压电流发生器,使输 出电流为5mA,对铜片进行电镀。
注意:直流标准电压电流发生器的“极性”转换开关 置于“+”处(红色为正极);“输出”转换开关置于 “准备”处;“量程”转换开关置于“100mA”处。
一、实验目的
1.测定铜电极在镀锌溶液中的阴极极化 曲线; 2.了解络合剂、添加剂对阴极极化的影 响;
二、实验原理
在有电流通过电极时,电极电势偏离可逆 平衡电位,阴极的电势表现得比可逆电极的电 势更负一些,这种现象称为阴极极化。阴极极 化曲线是指电流密度与阴极电势之间的关系曲 线。
本实验是通过在含不同成份的镀锌溶液中 被电镀的铜电极的阴极极化曲线的测定,来研 究络合剂、添加剂对阴极极化的作用。
1.阴极极化曲线的测量

北京理工大学能源与化学工程实验预习报告姓名班级学号实验日期2016年 4 月 27 日指导教师____________________ 同组姓名成绩_______________实验名称阴极极化曲线的测量一、实验目的1.掌握测量极化曲线的基本原理和测量方法2.测定铁电极在碱性溶液中的阴极极化曲线3.学会根据极化曲线分析溶液中添加剂作用的方法二、实验内容和原理在电化学研究中,很多电化学反应表现在电极的计划上,因此测量电极的极化曲线是很重要的研究方法。
在电流通过电极与电解液界面时,电极电位将偏离平衡电极电位,当电位向负向偏离时,称之为阴极极化,向正向偏离时,称之为阳极极化。
在电镀工艺中,用测定阴极极化的方法研究电镀液各组分及工艺条件对阴极极化的影响,而阳极极化可用来研究阳极行为或腐蚀现象。
所谓极化曲线就是电位与电流密度之间的关系曲线。
测量极化曲线的方法分为恒电流法和恒电位法,而每种方法又可分为稳流法和暂态法。
本实验是测量在碱性镀锌溶液中,香草醛光亮对阴极极化的影响。
三、主要仪器设备1.实验仪器CHI电化学工作站1台,电解池1个。
2.试剂及材料ZnO,NaOH,香草醛,低碳钢电极(表面积为1cm2),铂片电极1块,硫酸亚汞电极1个。
四、操作方法与步骤本实验采用CHI电化学工作站中的线性电位扫描法分别测量以下两种电解液中的阴极极化曲线:(1)ZnO 12g/L+NaOH 120g/L(2)ZnO 12g/L+NaOH 120g/L+香草醛 0.2g/L扫描速度:2mV/s;电位扫描范围:-1.18~ -2.18V。
1.接好线路。
2.测量阴极极化曲线(1)研究电极为低碳钢电极,表面积为1cm2(注意测试面积一定要准确,不测部分要用绝缘漆涂好)。
将待测的电极用金相砂纸打磨,除去氧化膜,用丙酮洗涤涂油。
再用脱脂棉蘸酒精擦洗,用蒸馏水冲洗干净,再用滤纸吸干,放进电解池中。
(2)电解池中的辅助电极为铂电极,参比电极为硫酸亚汞电极。
试验12阴极阳极极化曲线的测定及应用

湖南大学化学实验教学中心
四、实验步骤
1. 开启电脑,系统预热。 2. 电极处理:用金相砂纸将铁电极表面打磨 平整光亮,用蒸馏水清洗后滤纸吸干。每 次测量前都需要重复此步骤,电极处理得 好坏对测量结果影响很大。 3. 极化曲线测量。
湖南大学化学实验教学中心
五、实验注意事项
1. 测定前仔细阅读仪器说明书,了解仪器的 使用方法。 2. 电极表面一定要处理平整、光亮、干净, 不能有点蚀孔,这是该实验成败的关键。
其中:v-腐蚀速度(gm-2h-1);i-钝化电流密度(Am-2);M-Fe 的摩尔质量(gmol-1);F-法拉第常数(Cmol-1);n-发生1mol电极 反应得失电子的物质的量。 实验结果要求设计成表格形式给出。
湖南大学化学实验教学中心
七、思考题
1. 平衡电极电位、自腐蚀电位有何不同?
湖南大学化学实验教学中心
二、实验原理
湖南大学化学实验教学中心
二、化学实验教学中心
三、实验仪器与试剂
CS300电化学工作站1台;电解池1个;硫酸亚汞 电极或饱和甘汞电极(参比电极)、铁电极(研究 电极)、铂片电极(辅助电极)各1支。 0.10 mol/L、1.0 mol/L H2SO4溶液;1.0 mol/L 盐 酸;乌洛托品(缓蚀剂)
2. 写出作Fe阴极极化曲线时铁表面和铂片表面发生 的反应;写出作阳极极化曲线时Fe表面各极化电位 范围内可能的电极反应。 3. 分析H2SO4浓度对Fe钝化的影响。比较盐酸溶液 中加和不加乌洛托品 ,Fe电极上自腐蚀电流的大小。 Fe在盐酸中能否钝化,为什么?
湖南大学化学实验教学中心
八、其他事项说明
湖南大学化学实验教学中心
六、实验数据处理
1. 分别求出Fe电极在不同浓度的H2SO4溶液中的自腐蚀电 流密度、自腐蚀电位、钝化电流密度及钝化电位范围,分 析H2SO4浓度对Fe钝化的影响。 2. 分别计算Fe在HCl及含缓蚀剂的HCl介质中的自腐蚀电 流密度及按下式换算成腐蚀速率(v)。
实验八恒电流法测定金属阴极极化曲线
序号
I
dI
Φ
dΦ
现象
3.测自腐蚀电位
(1)预热 15 分钟
(2)“断”“ 恒电位”“ 电流”“ 参比”此时,电位显示为自腐蚀电位,但符号相反 。
加阴极电流
“恒电流”“ 参比”“ 通”“ 电流”(给定电流-50μA)2 min,重测自腐蚀电位 Φa 。
4.极化曲线测量
自腐蚀电位为原始,电流程 2 mA
“恒电流”、“给定”、“通”,I1=-10μA (表显示) dI=1μA “参比” 、“通”读数,逐点测定。 注意:电流表上“-”为阴极极化数据
实验八恒电流测定金属阴极极化曲线
一、实验目的: 1. 掌握恒电流法测定阴极极化曲线的基本原理和方法; 2. 运用极化曲线初步判定实施阴极保护的可能性; 二、基本原理:
对于构成腐蚀体系的金属电极,在外加电流的作用下,阴极的电位偏离其自腐蚀电位向 负的方向移动,这种现象称为阴极极化。电极上通过的电流密度越大,电极电位偏离的程度 也越大。控制外加电流密度,使其由小到大逐渐增加,便可测得一系列对应于各电流值的电 位值。做阴极电位与电流密度的关系曲线,即为恒电流阴极极化曲线。阴极极化曲线的示意 图如下图。
2. 饱和甘汞电极,铂电极,金属试件(碳钢) 3. 盐桥(饱和氯化钾溶液) 4. 试剂瓶 2 个 (一个放饱和 KCl,一个放 3% NaCl) 5. 铁夹 6. 1200#金相砂纸 无水乙醇棉球 四、实验步骤 1.将以打磨的试件用 1200#金相砂纸打磨,无水乙醇清洗,脱脂,测面积 1 cm2。 2.按下面接线
阴极极化曲线测定实验报告

阴极极化曲线测定实验报告阴极极化曲线测定实验报告引言:阴极极化曲线测定实验是电化学领域中常用的实验方法之一。
通过测定阴极电流与电位之间的关系,可以了解阴极在不同电位下的电化学反应过程,从而研究电极的耐蚀性、活性等性质。
本实验旨在通过测定不同电位下的阴极电流,绘制阴极极化曲线,并分析实验结果。
实验原理:阴极极化曲线实验基于极化现象的原理。
在电化学反应中,当电极电位发生变化时,电极表面的反应速率也会发生变化,从而导致电流的变化。
在阴极极化曲线实验中,通过改变电位,观察阴极电流的变化,可以推断出阴极反应的特性。
实验步骤:1. 准备工作:将实验所需的电化学池装置搭建好,并保证电极表面的洁净。
2. 测定开路电位:将电化学池接通电源,记录下电极在不施加外加电压时的电位,即开路电位。
3. 测定极化曲线:通过改变电位,记录下不同电位下的阴极电流值。
可采用逐步增加或逐步减小电位的方法,确保测定的数据准确可靠。
4. 绘制阴极极化曲线:将测定得到的电位和阴极电流数据绘制成图表,得到阴极极化曲线。
实验结果:根据实验数据,绘制出了阴极极化曲线。
曲线呈现出一定的特征,根据曲线的形状和趋势,可以分析出阴极反应的性质。
例如,曲线的斜率越大,说明阴极反应速率越快;曲线的平缓区域表示阴极反应基本停止;曲线的峰值处表示阴极反应达到最大速率。
实验讨论:阴极极化曲线实验是研究电极反应的重要手段之一。
通过该实验可以了解电极的耐蚀性、活性以及电极反应的速率等性质。
实验结果对于材料的选择、腐蚀防护、电池设计等方面都具有重要意义。
然而,阴极极化曲线实验也存在一定的局限性。
首先,实验结果受到实验条件的影响,如温度、溶液浓度等。
其次,实验结果只能反映出阴极反应的整体性质,无法提供关于反应机理的详细信息。
因此,在实际应用中,还需要结合其他实验方法和理论模型,进一步研究电极反应过程。
结论:通过阴极极化曲线测定实验,我们成功地绘制出了阴极极化曲线,并通过曲线的形状和趋势分析了阴极反应的性质。
极化曲线的测定
实验一极化曲线的测定一实验目的1.1掌握用“三电极”法测定金属沉积过程的电极电势。
1.2 通过对镍在玻碳电极上的沉积电势的测量加深理解过电位和极化曲线的概念。
1.3 了解控制电位法测量极化曲线的方法。
二实验原理2.1当把金属插入其盐溶液中时,金属表面上的正离子受到极性水分子的作用,有变成溶剂化离子进入溶液而将电子留在金属表面的倾向。
与此同时,溶液中的金属离子也有从溶液中沉积到金属表面的倾向。
当这种溶解与沉积达到平衡时,形成了双电层,在金属/溶液界面上建立起一个不变的电位差值,这个电位差值就是金属的平衡电位,E R表示。
当有电流通过电极时,电极电势偏离平衡电极电势,成为不可逆电极电势,用E IR表示;电极的电极电势偏离平衡电极电势的现象称为电极的极化。
通常把某一电流密度下的电势E R与E IR 之间的差值的绝对值称为超电势,即:η=│E IR-E R│。
影响超电势的因素很多,如电极材料,电极的表面状态,电流密度,温度,电解质的性质、浓度及溶液中的杂质等。
测定镍沉积超电势实际上就是测定电极在不同外电流下所对应的极化电极电势,以电流对电极电势作图I~E(阴极),所得曲线称为极化曲线。
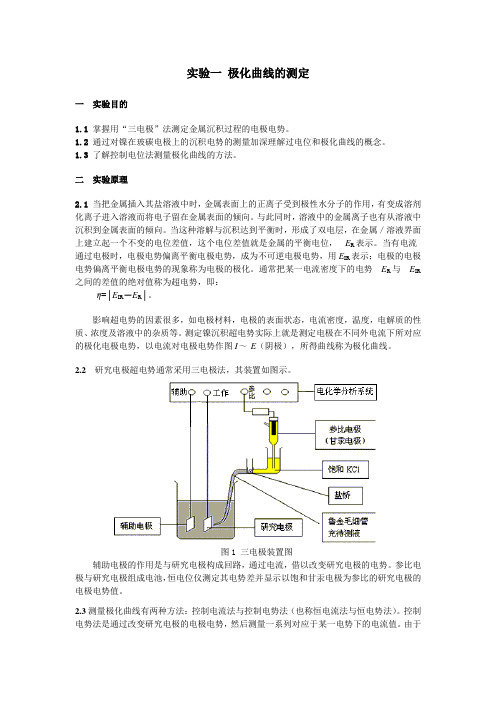
2.2研究电极超电势通常采用三电极法,其装置如图示。
图1 三电极装置图辅助电极的作用是与研究电极构成回路,通过电流,借以改变研究电极的电势。
参比电极与研究电极组成电池,恒电位仪测定其电势差并显示以饱和甘汞电极为参比的研究电极的电极电势值。
2.3测量极化曲线有两种方法:控制电流法与控制电势法(也称恒电流法与恒电势法)。
控制电势法是通过改变研究电极的电极电势,然后测量一系列对应于某一电势下的电流值。
由于电极表面状态在未建立稳定状态前,电流会随时间改变,故一般测出的曲线为“暂态”极化曲线。
本实验采用控制电势法测量极化曲线:控制电极电势以较慢的速度连续改变,并测量对应该电势下的瞬时电流值,以瞬时电流对电极电势作图得极化曲线。
图2 阴极极化曲线三仪器与试剂LK98A微机电化学分析系统一台;甘汞电极一枝;铂电极一枝;玻碳电极一枝;100ml 烧杯3个,500ml烧杯1个;瓦特型镀镍液50ml;稀硝酸50ml;乙醇50ml;蒸馏水500ml。
阴极极化曲线的测定

阴极极化曲线的测定The measurement of cathode polarization curve一、实验目的及要求1.测定氢在光亮铂电极上的活化超电势,并求出塔菲尔公式中的两个常数a和b以及交换电流密度i;2.了解超电势的种类和影响超电势的因素;3.掌握采用三电极恒电流法测定阴极极化曲线的实验方法。
二、实验基本原理本实验采用三电极恒电流法测定阴极极化曲线。
在电解H2SO4溶液时,阴极上产生H2,电极反应成为成为单向不可逆过程,电极表面产生极化,其氢超电势为η=ΦH+/H2-φc不可逆电极电势为φc=φ甘汞-E对于阴极极化的电化学极化,在一定电流密度范围内塔菲尔公式为η=a+b log i 式中,η为氢超电势,单位为V;a和b为常数,b为该线性方程的斜率,b值随电极性质等的变化影响不大;a为电流密度为1A•cm-1时的超电势值,a值的大小与电极材料、表面状态、电流密度、溶液组成和温度等有关,基本代表了电极反应的不可逆程度的大小。
a值越大,在所给电流密度氢超电势也越大。
铂电极材料属于低氢超电势金属,其a值在0.1-0.3V 之间。
当电流密度极低时,氢超电势不服从上述塔菲尔公式,此时η与电流密度i成正比关系。
所以,氢超电势的测量就是如何测量在一定范围内一系列不同电流密度下的电极电势,以及在实验中如何采取措施消除电阻超电势和浓差超电势等问题。
实验选择甘汞电极作辅助电极与被测电极组成一个电解池使氢在电极上电解;同时选择一个掺比电极与被测电极组成一个原电池,测量电动势,获得被测电极的电极电势。
对于电阻超电势可采用鲁金毛细管消除。
当η=0时,交换电流密度为log i0=-a/b同时,作i-φc图,可从图上获得氢在电极上显著析出时的最小析出电势。
三、仪器试剂恒电流法测定极化曲线装置一套。
标准电流电压发生器一台,数字式酸度计一台,电流表一个,饱和甘汞惦记、铂电极各一支。
四.实验步骤1.测量研究电极的面积后,清洗研究电极和辅助电极,清洗极化曲线测定装置。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工程学院电镀金刚石工具实验室
一 实验目的
掌握用“三电极”法测定金属沉积过程 的电极电势 通过对镍在玻碳电极上的沉积电势的测 量加深理解过电位和极化曲线的概念 了解控制电位法测量极化曲线的方法。
工程学院电镀金刚石工具实验室
二 实验原理
平衡电位 电极的极化 影响超电势的因素 三电极法 控制电流法与控制电势法
工程学院电镀金刚石工具实验室
实验数据处理 五 实验数据处理
1 近阴极质 量,g 镀前 镀后 镀层质量m 镀层质量m1 远阴极质 量,g 镀前 镀后 镀层质量m 镀层质量m2 2 3
分散能力, 分散能力, 测试值 % 平均值
工程学院电镀金刚石工具实验室
掌握用远近阴极法测定镀液的分散能力。 通过对镀镍液分散能力的测量加深理解 镀液分散能力的概念及影响分散能力的 因素。
工程学院电镀金刚石工具实验室
二 实验原理
分散能力 初次电流分布 远近阴极法 哈林槽尺寸及试验参数 分散能力计算
工程学院电镀金刚石工具实验室
二 实验原理
图1 哈林槽
工程学院电镀金刚石工具实验室
工程学院电镀金刚石工具实验室
二 实验原理
工程学院电镀金刚石工具实验室
三 仪器与试剂
LK98A微机电化学分析系统 甘汞电极 铂电极 玻碳电极 瓦特型镀镍液50ml 稀硝酸50ml 乙醇50ml
工程学院电镀金刚石工具实验室
四 实验步骤
电极准备与连接 实验方法选择与参数设定 启动测试并保存数据
工程学院电镀金刚石工具实验室
二 实验原理
T= K − m1 K + m1 m2 −2 × 100%
(1)
m2
式中: 镀液分散能力; 式中:T——镀液分散能力; 镀液分散能力 K——远、近阴极到阳极的距离之比; 远 近阴极到阳极的距离之比; m1、m2——阴极和远阴极上镀层的质量。 阴极和远阴极上镀层的质量。 阴极和远阴极上镀层的质量
四 实验步骤
工程学院电镀金刚石工具实验室
四 实验步骤
工程学院电镀金刚石工具实验室
实验数据处理 五 实验数据
求镍在玻碳电极上的析出电位 求极化度
工程学院电镀金刚石工具实验室
工程学院电镀金刚石工工程学院电镀金刚石工具实验室
工程学院电镀金刚石工具实验室
一 实验目的
工程学院电镀金刚石工具实验室
三 仪器与试剂
12V/50A直流稳压电源 直流稳压电源 哈林槽 150Ω滑线变阻器 Ω 5A直流电表一个 直流电表一个 镀镍液 稀盐酸
工程学院电镀金刚石工具实验室
四 实验步骤
在哈林槽中加入镀镍液,液面距槽口 在哈林槽中加入镀镍液,液面距槽口1cm 阴极试片经除油、酸洗、水洗、烘干后,称重, 阴极试片经除油、酸洗、水洗、烘干后,称重,记下 质量; 质量; 把阳极放入哈林槽中,距离比K值选 按图1接好线 值选2, 把阳极放入哈林槽中,距离比 值选 ,按图 接好线 开通稳压电源,阴极带电入槽,电流调到0.8A, 路,开通稳压电源,阴极带电入槽,电流调到 , 电镀时间15min; 电镀时间 ; 取出阴极试片,水洗干净、烘干后,称重,记下质量; 取出阴极试片,水洗干净、烘干后,称重,记下质量; 计算出远近阴极的增重, 计算出远近阴极的增重,按(1)式计算分散能力
