5.2. 气液相平衡关系
气液相平衡

ΔX=X*-X
Δc A
=
c
* A
−
cA
18
2)在x~y图
y
A·
y*
C
x
19
B AC = y − y * AB = x * − x
x*
例5-2-3 在一填料塔内用清水逆流吸收某二元混合 气体中的溶质A。已知进塔气体中溶质的浓度为0.03 (摩尔比,下同),出塔液体浓度为0.0003,总压为 101kPa,温度为 40℃,问: (1)压力不变,温度降为20℃时,塔底推动力
m
=
E p
=
7.6 × 104 200 × 103
= 0.38 ⇒
m
↓, x不变 ⇒
y* ↓
(2)T ↑, x不变,pA* ↑⇒ E = pA * / x = 9.1× 104 Pa ↑
H = 6.1×10−4 kmol /(m 3 .Pa) ↓ m = 0.9 ↑
讨论: (1)亨利定律是压力不太高,一定温度下,稀溶液
吸收过程:y > y* x* >x或 c*A > cA
15
y
y1
·A
y* = mx
y2*
y1* y2
·B
x2* x1 x2 x1* x
A点:平衡线上方,吸收 y1 > y1 * 或x1* > x1
B点:平衡线下方,解吸 y2* > y2或x2 > x2 *
16
二、指明过程进行的极限——相平衡
1)逆流,塔高无限
⇒ Y* =m X 1+Y * 1+ X
⇒ Y * = mX 1 + (1 − m)X
⎯稀⎯溶⎯液 X⎯⎯小→ Y * ≈ mX
气液相平衡关系

二、气液相平衡关系 平衡状态:在一定压力和温度下,当吸收和解吸速率相等时,气液两相达到平衡。
相平衡关系:吸收过程中气液两相达到平衡时,吸收质在气相和液相中的浓度关系1.气体在液体中的溶解度 (图8-1)平衡时溶质在气相中的分压称为平衡分压,用符号*A p 表示;溶质在液相中的浓度称为平衡溶解度,简称溶解度;它们之间的关系称为相平衡关系。
结论:①在相同的吸收剂、温度和分压下,不同溶质的溶解度不同;②分压一定时,温度越低,则溶解度越大。
较低的温度有利于吸收操作;③温度T 一定时,分压P 越大,溶解度越大。
较高的分压有利于吸收操作;④加压和降温对吸收操作有利。
2.亨利定律(1)亨利定律亨利定律内容:在总压不太高,温度一定的条件下,稀溶液上方溶剂的平衡分压*A p 与溶质在液相中的摩尔分数A x 成正比,比例系数为亨利系数E 。
即: A A Ex p =* 形式一E ——亨利系数, Pa讨论:①E 的来源:实验测得,查手册②E 的影响因素:溶质、溶剂、T 。
物系一定时, ③亨利系数表示气体溶解的难易程度。
E 大的,溶解度小,难溶气体;E 小的,溶解度大,易溶气体。
(2)亨利定律的其它形式① 溶质在液相中的浓度用量浓度A c 表示,气相用分压*A p 表示,则: Hc p A A =* 形式二 ↑↑⇒E TH ——溶解度系数,实验测定。
溶解度↓溶解度系数表示气体溶解的难易程度。
易溶气体,H ↑;难溶气体,H ↓。
溶解度系数H 和亨利系数E 的关系:剂剂EM H ρ=②溶质在气液相中的浓度均用摩尔浓度表示, 则:A A A mx x PE P p y ===** 形式三 m ——相平衡常数。
P E m = 是温度和压强的函数。
讨论:1)P 一定时, 溶解度↓。
升温不利于吸收;2)t 一定时, 溶解度↑。
加压有利于吸收。
③溶质在气液相中的浓度均用比摩尔分数表示时,AA A A X X m Y Y +=+**11 整理得: A A A X m mX Y )1(1-+=* 形式四 比摩尔分数表示的气液相平衡关系。
气液平衡关系的适用条件

气液平衡关系的适用条件引言气液平衡关系是研究气体和液体在一定条件下的平衡状态的重要课题。
在化工、生物学、环境科学等领域,有许多关于气液平衡的研究正在进行中。
本文将探讨气液平衡关系的适用条件,并解释为什么这些条件对于研究和应用气液平衡非常重要。
1.温度和压力条件气液平衡关系的适用条件之一是一定的温度和压力条件。
在实验和工业应用中,我们通常需要控制气体和液体的温度和压力,以实现气液平衡的条件。
当温度和压力处于适宜的范围内时,气体和液体之间的传质和反应过程可以达到平衡状态。
2.物质性质的相似性为了实现气液平衡关系,液体和气体的物质性质应该相似。
例如,溶液中的溶质分子应该与气体分子具有相似的性质,如极性、分子大小等。
只有在这种情况下,液体和气体之间的物质传递才能达到平衡状态。
3.界面表面积的稳定界面表面积的稳定也是气液平衡关系的适用条件之一。
当液体和气体接触时,液体表面会形成一个界面,该界面的表面积应该保持稳定。
如果界面表面积不稳定,即表面活性剂的存在或其他原因导致的表面紊乱,将阻碍气体和液体之间的传质和反应过程达到平衡。
4.气液相互作用力的平衡气液平衡关系的适用条件还包括气体和液体之间的相互作用力的平衡。
在气液界面处,气体分子和液体分子之间存在各种相互作用力,如吸附力、扩散力等。
这些相互作用力的平衡对于气液平衡的形成至关重要。
只有当气体分子和液体分子之间的相互作用力达到平衡状态时,气液界面才能保持稳定并且传质过程得以进行。
5.外界环境的稳定除了上述条件外,气液平衡关系还受到外界环境的影响。
外界环境的稳定包括温度、压力和湿度的稳定,以及其他可能影响气体和液体之间相互作用的因素的稳定。
只有在外界环境稳定的条件下,气液平衡关系才能得以实现和研究。
结论成功研究和应用气液平衡关系需要满足一定的条件。
温度和压力的控制、物质性质的相似性、界面表面积的稳定、气液相互作用力的平衡以及外界环境的稳定都是实现气液平衡关系的重要因素。
化工热力学 第五章 相平衡

A)汽相为理想气体混合物,液相为理想溶液。 B)汽相和液相都是理想溶液。 C)汽相是理想气体混合物,而液相是非理想溶液。 D)两相都是非理想溶液。 5.2.1、相平衡的处理方法 状态方程法:用状态方程来解决相平衡中的逸度系数
ˆ iv yi P li xi P ˆ
活度系数法:液相的逸度用活度系数来计算
s s i i
5.3.2.2) 泡点温度和组成的计算(BUBLT)
已知:平衡压力P,液相组成xi,求 平衡温度T,汽相组成 yi 假设T,确定Pis 计算yi 否
y
i
1
是
园整
5.3.2.3 露点压力和组成计算(DEWP)
已知 平衡温度T,汽相组成yi , 求平衡压力 P,液相组成xi 假设 P 计算Pis及xi
第5章
相 平 衡
在化工生产中,原料由于含有各种杂质,需要提纯进入反 应器;反应又常常是不完全的并伴有副产物,因而产物也是不 纯的,也需要进一步处理,才能得到产品。所有这些都离不开 分离操作,典型的分离操作有精馏(VLE)、吸收(GLE)、 萃取(LLE)、结晶(SLE)等,他们的投资常达整个工厂投 资的一半以上,对有些行业如石油和煤焦油加工等,甚至达到 80%--90%,这些分离都需要相平衡数据。 5.1 相平衡基础 5.1.1、相平衡的判据 何谓相平衡:
例:乙醇(1)----苯(2)溶液,含乙醇80%(mol%),求该溶液在 750mmHg时,的沸点及饱和蒸汽组成。已知乙醇---苯系统有一恒沸 混合物,此混合物含44.8%乙醇,在760mmHg时的沸点为68.24oC (忽略温度对活度系数的影响。 乙醇
苯
lg P1S 8.04494
1554 .3 222 .65 t
化工原理第五章气液相平衡

亨利简介
威廉·亨利于1774年12月12日出生在英国的曼彻斯特市。 他们祖孙三代都是医师兼有名的化学家。发明亨利定律的亨利的名字 是威廉·亨利(William Henry),他的父亲名托马斯·亨利( Thomas Henry ),他的儿子名威廉·查尔斯·亨利(William Charles Henry)。他们三代 是十八世纪到十九世纪的著名学者。 威廉·亨利在1795年进爱丁堡大学,一年之后。因为他父亲医务工作 上需要助手,他离开了大学,在家里做实医师。到1805年他又回到爱丁 堡大学,继续学业。1807年化完成了医学博士学位。 亨利定律是在1803年由威廉·亨利在英国皇家学会上宣读的一篇论文 里,加以详细说明的。从此以后,这个定律就被命名为亨利定律了。 1888年,在亨利发表他的定律八十多年后,法国化学家拉乌尔( Francois-Marie Raoult,1830-1901)发表了他在溶液蒸气压方面的发 现,这就是我们现在所称的拉乌尔定律。 亨利晚年因为严重的头痛和失眠,几乎无法工作,于1836年9月2日离 开人世,终年62岁。
2021/7/31
2、相平衡的理论依据 对单组分物理吸收的物系,根据相律:
F=K-Φ+2=3-2+2=3
(K=3,溶质A,惰性组分B,溶剂S,Φ=2,气、
液两相)
【结论】在温度T、总压P和气、液相组成共4个变量
中,有3个自变量(独立变量),另1个是它们的函
数。即:
yfT 、 P 、 x
2021/7/31
mE485023.94 p 20.26
从气相分析 y*=mx=23.94×0.01=0.24<y=0.3
故SO2必然从气相转移到液相,进行吸收过程。 【结论】增大压力(30℃,101.3kPa→202.6kPa)有 利于吸收。
双液系的气—液平衡相图

实验五双液系的气—液平衡相图一、实验目的1、绘制在标准压力下乙醇-正丙醇体系的沸点组成图,并确定其恒沸点及恒沸组成;2、熟练掌握测定双组分液体沸点的方法及用折光率确定二组分物系组成的方法;3、掌握超级恒温槽、阿贝折射仪、气压计等仪器的使用方法。
二、实验原理1、相图任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系,如环已烷-乙醇、正丙醇-乙醇体系都是完全互溶体系。
若只能在一定比例范围内溶解,称为部分互溶双液系,例苯-水体系。
在完全互溶双液系中,有一部分能形成理想液态混合物,如苯-甲苯系统,二者的行为均符合拉乌尔定律,但大部分双液系是非理想液态混合物,其行为与拉乌尔定律有偏差。
液体的沸点是指液体的蒸气压与外界压力相等时的温度。
在一定外压下,纯液体的沸点有其确定值,但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
双液系两相平衡时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点T(或t)-组成(x)图,即T(或t)—x图。
它表明了沸点与液相组成和与之平衡的气相组成之间的关系。
在恒定压力下,二组分系统气液达到平衡时,其沸点-组成(t-x)图分三类:(1)混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
如苯-甲苯系统,此时混合物的行为符合拉乌尔定律或对拉乌尔定律的偏差不大。
如图5-1(a)所示。
(2)有最低恒沸点体系,如环已烷-乙醇体系,t—x图上有一个最低点,此点称最低恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大正偏差,如图5-1(b)所示。
对于这类的双液系,用分馏法不能从溶液中同时分离出两个纯组分。
(3)有最高恒沸点体系,如氯仿-丙酮体系,t—x图上有一个最高点,此点称最高恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大负偏差,如图5-1(c)所示。
13 实验五 二元液体溶液的气—液平衡相图
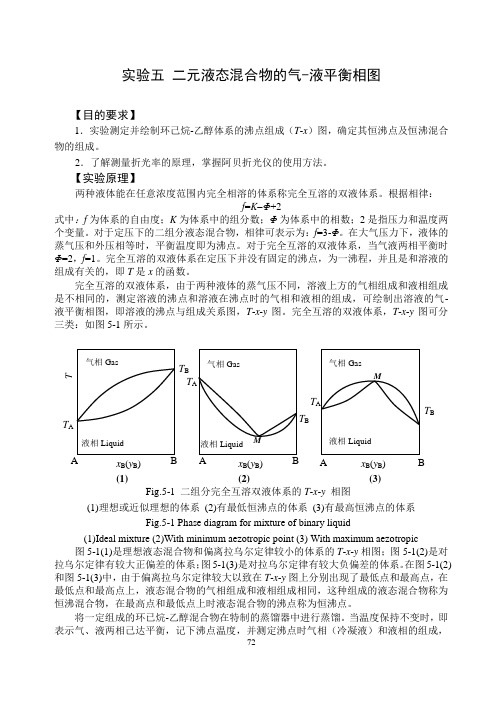
实验五 二元液态混合物的气-液平衡相图【目的要求】1.实验测定并绘制环己烷-乙醇体系的沸点组成(T -x )图,确定其恒沸点及恒沸混合物的组成。
2.了解测量折光率的原理,掌握阿贝折光仪的使用方法。
【实验原理】两种液体能在任意浓度范围内完全相溶的体系称完全互溶的双液体系。
根据相律:f =K Φ+2式中:f 为体系的自由度;K 为体系中的组分数;Φ为体系中的相数;2是指压力和温度两个变量。
对于定压下的二组分液态混合物,相律可表示为:f =3-Φ。
在大气压力下,液体的蒸气压和外压相等时,平衡温度即为沸点。
对于完全互溶的双液体系,当气液两相平衡时Φ=2,f =1。
完全互溶的双液体系在定压下并没有固定的沸点,为一沸程,并且是和溶液的组成有关的,即T 是x 的函数。
完全互溶的双液体系,由于两种液体的蒸气压不同,溶液上方的气相组成和液相组成是不相同的,测定溶液的沸点和溶液在沸点时的气相和液相的组成,可绘制出溶液的气-液平衡相图,即溶液的沸点与组成关系图,T -x -y 图。
完全互溶的双液体系,T -x -y 图可分三类:如图5-1所示。
图5-1(1)是理想液态混合物和偏离拉乌尔定律较小的体系的T -x -y 相图;图5-1(2)是对拉乌尔定律有较大正偏差的体系;图5-1(3)是对拉乌尔定律有较大负偏差的体系。
在图5-1(2)和图5-1(3)中,由于偏离拉乌尔定律较大以致在T -x -y 图上分别出现了最低点和最高点,在最低点和最高点上,液态混合物的气相组成和液相组成相同,这种组成的液态混合物称为恒沸混合物,在最高点和最低点上时液态混合物的沸点称为恒沸点。
将一定组成的环已烷-乙醇混合物在特制的蒸馏器中进行蒸馏。
当温度保持不变时,即表示气、液两相己达平衡,记下沸点温度,并测定沸点时气相(冷凝液)和液相的组成,Fig.5-1 二组分完全互溶双液体系的T -x -y 相图 (1)理想或近似理想的体系 (2)有最低恒沸点的体系 (3)有最高恒沸点的体系 Fig.5-1 Phase diagram for mixture of binary liquid(1)Ideal mixture (2)With minimum aezotropic point (3) With maximum aezotropic 液相Liquid 气相Gas T B x B (y B ) (3) M A B液相Liquid气相Gas T A T B x B (y B ) T (1) AB 液相Liquid 气相Gas T A T Bx B (y B ) (2) M A B T A图5-2 沸点仪示意图 1.温度计;2.接加热器;3.加液口;4.电热丝连接点;5.电热丝;6.分馏液;7.分馏液取样口 Fig.5-2 The sketch of ebulliometer 1.thermometer;2. connection pole;3. inlet orifice; 4. connection point of heater with wire;5.heater; 6. fractional liquid;7. sampling orifice 即可得到一组T -x -y 数据。
5.2气液相平衡关系

5.2.2. 相平衡关系在吸收过程中的应用
1.判断过程进行的方向
pA
p
* A
A由气相向液相传质,吸收过程
pA pA*
平衡状态
pA pA* A由液相向气相传质,解吸过程
吸收过程: y y*或x* >x或 cA* cA
y
y y*
A
P
··B
y* y
·C
ห้องสมุดไป่ตู้
x
x
2.指明过程进行的极限
过程极限:相平衡。
x*
例 在总压101.3kPa,温度30℃的条件下, SO2摩尔分 率为0.3的混合气体与SO2摩尔分率为0.01的水溶液相接 触,试问:
(1)SO2的传质方向; (2)其它条件不变,温度降到0℃时SO2的传质方向; (3)其它条件不变,总压提高到202.6kPa时SO2的传 质方向,并计算以液相摩尔分率差及气相摩尔率差表示
HM S
H的讨论:1)H大,溶解度大,易溶气体 2)P对H影响小,
T H
2)y* mx m——相平衡常数,无因次。
m与E的关系 :
p
* A
py*
y* p Ex
m E p
m的讨论:1)m大,溶解度小,难溶气体 2)T m
p m
3)Y * mX
例 某系统温度为10℃,总压101.3kPa,试求 此条件下在与空气充分接触后的水中,每立方 米水溶解了多少克氧气?
3)E的来源:实验测得;查手册
(2)亨利定律其它形式
1) p
* A
cA H
H——溶解度系数, kmol/(m3·kPa)
cA——摩尔浓度,kmol/m3;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图5-6 101.3kPa下SO2在水中的溶解度
由图5-6可知,当总压P、气相中溶质y 一定时,吸收温度下降,溶解度大幅度提高, 吸收剂常常经冷却后进入吸收塔。 结论: 加压和降温有利于吸收操作过程;而减 压和升温则有利于解吸操作过程。
图5-7 几种气体在水中的溶解度曲线
易溶气体:溶解度大的气体如NH3等称为易 溶气体; 难溶气体:溶解度小的气体如O2、CO2。 介乎其间的如SO2等气体称为溶解度适中 的气体。
结论: 降低操作温度,E、m,溶质在液相 中的溶解度增加,有利于吸收;
(y=mx)
压力不太高时,P, E变化忽略不计;但 m↓使溶质在液相中的溶解度增加,有利于吸 收。 (y=mx)
End
EM S
c HpA
c
* A
S pA
EM S
故
1000 21.27 -4 3 c 3.57 10 kmol/m 6 3.3110 18
* A
mA =3.57 10 32 1000=11.42g/m
-4
3
5.2.2. 相平衡关系在吸收过程中的应用
1.判断过程进行的方向与传质推动力:
x——溶质在液相中的摩尔分率。
讨论: T,E。
pA*一定时,E,x↓。
3)亨利定律的其他表达形式: (2) 式中: cA——溶质在液相中的摩尔浓度,kmol/m3; H——溶解度系数,kmol/ (m3· kPa); pA*——溶质在气相中的平衡分压,kPa。
cA p H
* A
( 5-25)
图5-10 吸收推动力示意图
2.指明过程进行的极限
图5-11
吸收过程的极限
塔无限高、溶剂量很小的情况下:
x1,max
y1 x1e m
无限高的塔内,大量的吸收剂和较小气体 流量:
y2,min y2 e mx2
x2=0时,y2,min=0,理论上实现气相溶质 的全部吸收。
例、在总压101.3kPa,温度30℃的条件下, SO2摩 尔分率为0.3的混合气体与SO2摩尔分率为0.01的水 溶液相接触,试问: (1)SO2的传质方向; (2)其它条件不变,温度降到0℃时SO2的传质方 向; (3)其它条件不变,总压提高到202.6kPa时SO2 的传质方向,并计算以液相摩尔分率差及气相摩 尔率差表示的传质推动力。
界面 液相 气相
y y>ye时 y<ye时
图5-8 A
解吸
x ye=mx
吸收
推动力y-ye A 推动力ye-y
传质推动力与方向用气相组成表示
y>ye时,溶质从气相向液相传递,为吸
收过程。
其传质推动力为(y-ye),这是以气相 摩尔分数差表示的推动力。 吸过程。
y<ye时,溶质从液相向气相传递,为解
解: (1)查得在总压101.3kPa,温度30℃条件 下SO2在水中的亨利系数E=4850kPa 所以
E 4850 m 47.88 p 101.3
从液相分析
y 0.3 x 0.00627< x=0.01 m 47.88
*
故SO2必然从液相转移到气相,进行解吸过程。
(2)查得在总压101.3kPa,温度0℃的条件下, SO2在水中的亨利系数E=1670kPa
2.亨利定律
1)亨利定律内容
总压不高(譬如不超过5×105Pa)时,在一 定温度下,稀溶液上方气相中溶质的平衡分压与
溶质在液相中的摩尔分率成正比,其比例系数为
亨利系数。
2)亨利定律的数学表达式
(1)
p Ex
* A
( 5-24)
式中: pA*——溶质在气相中的平衡分压, kPa; E——亨利系数,kPa;实验测定;
pe f t、p、x
当温度t,总压p,一定时:
pe f
x
相平衡关系:平衡时溶质组分在气液两相中的 浓度关系为相平衡关系。
溶解度曲线:气液相平衡关系用二维坐标绘成 的关系曲线称为溶解度曲线。
图5-4 氨在水中的溶解度
图5-5 20℃下SO2在水中的溶解度
由图5-5可见,在一定的温度下,气 相中溶质组成y不变,当总压p增加时,在 同一溶剂中溶质的溶解度x随之增加,这 将有利于吸收,故吸收操作通常在加压条 件下进行。
对单组分物理吸收的物系,根据相律, 自由度数F为:
F C 2 3 2 2 3
其中: C=3,溶质A,惰性组分B,溶剂S; Φ=2,气、液两相; 即在温度t,总压p,气、液相组成共4个 变量中,有3个自变量(独立变量),另1个是 它们的函数,故可将平衡时溶质在气相中的分 压pe表达为温度t,总压p和溶解度x的函数:
溶解度系数H与亨利系数E的关系为:
1 EM S H S
式中:
( 5-26)
ρs——为溶剂的密度,kg/m3。 讨论:
T ,H
(3)
y mx
*
(5-27)
式中: x——液相中溶质的摩尔分率; y*——与液相组成x相平衡的气相中溶质 的摩尔分率; m——相平衡常数,无因次。
相平衡常数m与亨利系数E的关系为:
从气相分析
y*=mx=23.94 0.01=0.24<y=0.3
故SO2必然从气相转移到液相,进行吸收过程。
y 0.3 x* 0.0125 m 23.94
以液相摩尔分数表示的吸收推动力为: ∆x=x*-x=0.0125-0.01=0.0025
以气相摩尔分数表示的吸收推动力为:
∆y= y - y*=0.3-0.24=0.06
E 1670 m =16.49 p 101.3
从气相分析
y*=mx=16.49 0.01=0.16<y=0.3
故SO2必然从气相转移到液相,进行吸收过程。
(3)在总压202.6kPa,温度30℃条件下, SO2在水中的亨利系数E=4850kPa
E 4850 m =23.94 p 202.6
5.2. 气液相平衡关系
5.2.1.气体在液体中的溶解度 5.2.2.相平衡关系在吸收过程中的应用
本节教学要求: 1、重点掌握的内容: 相平衡的影响因素及相平衡关系在吸收过 程中的应用; 2、熟悉的内容:
溶解度、平衡状态、平衡分压、亨利定律。
5.2.1.气体在液体中的溶解度
1.溶解度曲线 平衡状态: 一定压力和温度,一定量的吸收剂与 混合气体充分接触,气相中的溶质向 溶剂中转移,长期充分接触后,液相 中溶质组分的浓度不再增加,此时, 气液两相达到平衡。 饱和浓度:平衡时溶质在液相中的浓度。 平衡分压:平衡时气相中溶质的分压。
空气按理想气体处理,由道尔顿分压定律可 知,氧气在气相中的分压为:
p Py =101.3 0.21=21.27kPa
* A
氧气为难溶气体,故氧气在水中的液相组成 x很低,气液相平衡关系服从亨利定律,由表5-1 查得10℃时,氧气在水中的亨利系数E为 3.31×106kPa。
H
* A
S
E m P
讨论:
(5-28)
当物系一定时,T 或P,则m。
(4) 式中:
Y mX
*
(5-29)
X——液相中溶质的摩尔比;
Y*——与液相组成X相平衡的气相中 溶质的摩尔比;
例:某系统温度为10℃,总压101.3kPa,试求此
条件下在与空气充分接触后的水中,每立方米水
溶解了多少克氧气? 解:
其传质推动力为(ye-y)。
界面 气相
yHale Waihona Puke 液相xe>x时 xe<x时
xe=y/m A
解吸
x
吸收
推动力xe-x 推动力x-xe
A
图5—9 传质推动力与方向用液相组成表示
xe>x 时,溶质从气相向液相传递,为 吸收过程。
其传质推动力为( xe-x ),这是以液 相摩尔分数差表示的推动力。
xe<x 时,溶质从液相向气相传递,为 解吸过程。 其传质推动力为( x-xe )。 溶质的传质方向与推动力也可以在相平衡 曲线图上表示:
