有机化学电环化反应
高等有机化学周环反应
H R1
R1
H
C CH CH CH CH2
C CH CH CH CH2
R2 1 2 3 4 5 [1,5] s迁移 R2 1 2 3 4 5
H
1
2
hv
3
[1,3] s迁移
1) S-S 或 A-A相连, 且分子轨道能量尽可能相近,这是能量近似原则; 2)相同对称性的连线不能相交,即两条SS 或两条 AA不能在相关图上交叉。
m1 m2
m1 m2
C2 s 键: C2 对称,m1对称
C2 p 键: C2 反对称,m1对称
* 周环反应中顺旋保持C2对称性, 而对旋保持m1对称性.
COCH3
1 2 COCH3
3H
12 CH2 CH
CH2 CH
1
2
3 CH CH3
CH2
[3,3] s迁移
3
1 23 CH2 CH CH CH3
CH2 CH CH2 1 23
那么、为什么上述s 迁移反应有时需要加热,有时需要光照呢? [1, j] s 迁移:此反应经过环状过渡态,其中转移基团氢于迁移起点和终点都相
4n+2 p电子的环加成反应:
HOMO 2 (A)
LUMO 3 (S)
LUMO p* (A)
HOMO p (S)
m1
m1
对于第一种情况,两种分子的两个分子轨道对m1对称元素是反对称的,对 于后一种情况,两者是对称的。因此两种情况对称性是一致的,轨道对称性是
允许的,反应顺利进行。但是丁二烯的分子轨道理论计算结果表明:
有机化学的反应原理有哪些

有机化学的反应原理有哪些
有机化学中常见的反应原理包括:
1. 亲电取代反应:亲电试剂攻击碳原子上的亲核位点,将它取代为新的基团。
2. 亲核取代反应:亲核试剂攻击有机物中的亲电位点,将它取代为新的基团。
3. 加成反应:通过破裂某种化学键,将两个合成物中的原子或基团连接形成新的化学键。
4. 消除反应:通过破裂某种化学键,消除其中一个或多个原子或基团,形成新的化学键。
5. 偶极加成反应:带有局部正电荷和负电荷的合成物相互作用,将它们连接在一起形成一个环或链。
6. 环化反应:通过合成物中的两个原子或基团之间的化学键形成环结构。
7. 氧化还原反应:涉及电子的转移,其中一个物种被氧化,失去电子,而另一个物种被还原,获得电子。
8. 羰基化合物反应:涉及带有羰基(例如醛和酮)的化合物的化学反应,包括加成反应、氧化、还原、亲核加成反应等。
9. 烷基化反应:在有机化合物中引入烷基(碳链)基团。
10. 消除反应:通过破裂某种化学键,消除其中一个或多个原子或基团,形成新的化学键。
这只是有机化学反应原理的一小部分示例,有机化学的领域非常广泛,涉及众多反应原理和机制。
电环化反应的立体化学规则

电环化反应的立体化学规则1. 引言1.1 概述电环化反应是一类重要的有机合成方法,通过在分子之间形成新的键来构建环状化合物。
随着有机化学领域的发展,对于电环化反应中的立体化学规律的理解越来越深入。
了解这些规律不仅可以更好地预测反应产物的立体选择性,还可以为设计和优化合成路线提供指导。
1.2 文章结构本文将全面介绍电环化反应的立体化学规则。
首先,我们将简要概述电环化反应的基本原理和机制,包括电子流动方向和立体化学控制以及立体效应对反应速率的影响。
接下来,我们将重点讨论立体选择性控制策略及方法,包括空间位阻效应在反应中的作用、手性辅助剂的应用与设计理念以及过渡态分析和计算模拟在立体选择性研究中的作用。
然后,我们将通过解析典型的电环化反应实例和相关立体化学规律来进一步说明这些概念。
最后,在文章结尾部分,我们将总结引言部分所涉及内容,并展望电环化反应立体化学研究的前景与挑战,并提出未来研究方向和应用展望。
1.3 目的本文的目的是系统地介绍和阐述电环化反应的立体化学规则。
通过对基本原理、机制以及立体选择性控制策略和方法的详细讨论,我们旨在加深读者对这一领域中相关概念和规律的理解。
从而为有机合成领域中的研究人员和从业者提供一种有效而可靠的指导,帮助他们更好地设计和实现高立体选择性的电环化反应。
此外,我们还将展望未来电环化反应立体化学研究的发展方向,并探讨其在新材料合成、药物开发等领域中的广泛应用前景。
2. 电环化反应的基本原理和机制2.1 反应概述电环化反应是一类在有机合成中广泛应用的重要反应类型,它通过环内形成键和断裂键来构建新的环状结构。
这种反应通常发生在具有共轭体系的分子中,其中带电荷或未带电荷的试剂与该体系中的π电子系统发生相互作用。
电环化反应常见于天然产物合成、医药领域以及材料科学等领域。
2.2 电子流动方向和立体化学控制在电环化反应中,反应物分子的共轭体系可以接受或提供π电子。
该过程可以通过各种不同方式控制立体选择性,并且这种选择性对于产物结构和性质具有重要影响。
高等有机第七章-周环反应

H
H
第二节 环加成
一、Diels-Alder反应
(一) 一般特点 D-A反应中双烯与亲双烯体彼此平行同面接近:
亲双烯体
LUMO
双烯体
HOMO
亲双烯对双烯的加成有二种可能的立体化学取向, 内式(endo)和外式(exo).
内式:过渡态中亲双烯体上的取代基接近双烯体上的p轨道。 外式:过渡态中亲双烯体上的取代基远离双烯体上的p轨道。
由于角张力环丙基正离子不易形成,环丙基卤代烃和磺酸酯在一般溶剂解的条 件下都很不活泼。例如,环丙基磺酸酯在乙酸中溶剂解需在180oC进行,产物为 烯丙基乙酸酯而不是环丙基乙酸酯。反应中间体可能是先形成环丙基正离子, 然后开环成烯丙基正离子。
X -XH slow
fast H
YY
形成烯丙基产物是其它环丙基卤代烃和磺酸酯溶剂解的特征。 环丙胺在水溶液中重氮化给出烯丙醇。
反应变慢。 R O
R
H
Me t-Bu
+
O
KR
1
42
<0.05
注:R从H变为Me,电子效应使反应加快。
O
第二、双烯体自身取代基对其形成s-cis构象有影响。例如反式
1,3-戊二烯活性比4-甲基-1,3-戊二烯大103倍。
CH3
NC
CN
R
R
H
Me
H
+
NC
CN
H
KR
1
10 -3
双烯体C-2, C-3上取代基对D-A反应影响很小。例如,2,3-二甲基
COOMe
+
+
COOMe
无催化剂: 120℃,6h AlCl3催化: 20℃,3h
COOMe
电环化反应顺旋和对旋

电环化反应顺旋和对旋
电环化反应是有机化学中一种重要的反应,能够将非芳香化合物转化为芳香化合物。
这种反应常常用于合成农药、药物、染料等有机化合物。
电环化反应包括顺旋和对旋两种方式。
两者区别在于产物的结构不同。
顺旋电环化反应是一种从非芳香烷烃到芳香烃的反应。
也称为SEAr(电子亲和取代反应),即亲电取代加上自由基取代乙烯。
顺旋电环化反应的机制是通过在分子上加上氢氯酸和硝酸硫酸混合物,然后去除中间的酸和一个负离子,使烯烃中的电子体系向化学反应的中心移动。
因此,应用顺旋电环化反应可以获得具有六元环结构的芳香化合物。
一般来说,顺旋电环化反应相对容易实现,反应较快,而且反应物的选择性不太严格。
对旋电环化反应是一种从非芳香烷烃到配位的芳香烃的反应。
对旋电环化反应的机制主要是通过在烃分子中加入金属络合剂,使得烃分子的π电子向结构中心移动,然后产生具有配位能力的π电子,
并最终形成具有六元环的配位化合物。
因此,对旋电环化反应的反应速率通常取决于配位剂的选择。
业界普遍认为,对旋电环化反应难度较高,因为它涉及到更复杂的反应机理和选择性。
例如,成功进行对旋电环化反应需要选择正确的金属络合剂。
不同的金属络合剂会影响反应的产率和选择性。
总的来说,顺旋和对旋电环化反应都是有机化学中重要的合成方法。
在这些反应中,芳香化合物的生成通常需要一些条件,如催化剂和适当的反应条件。
尽管有些反应可能比其他反应更具挑战性,但这些反应对于有机化学家来说仍然具有非常大的研究意义。
有机合成:第六章 开环和关环

14
例如:
CH3
(1)
132 C
戊烷
CH3
H CH3 CH3
H
[加热反应,对旋成键(有机化学P479表19-1)]
15
6.4 开环反应 开环反应在有机合成中主要有以下两个方面的应用:
(1)在开环的产物中,被打破的键的每一端的原子上都 带有官能团。即通过开环反应合成双官能团分子; (2)在一个双环或多环分子中,破裂的两个环共用的键 可导致一个中环或大环分子的产生,而这个环难以用其它 方法制备。即通过开环反应合成中环或大环化合物。
反应特点:
(a)在单环化合物的合成中,闭环步骤常包括碳-杂 原子键的形成;
(b)如果系统中含有2个相邻的杂原子,则在闭环步骤 中很少涉及杂原子-杂原子键的形成;
(c)如果目标分子是双环的,并具有与苯环稠合的杂原 子,则原料几乎总是预先形成苯的衍生物。分有: (I)单环化合物的形成; (Ⅱ)苯并稠环化合物的形成。
位或对位二取代为主。
9
6.2.2 1,3-偶极环加成 1,3-偶极环加成也是一个[4π+2π]的过程,故与Diels-
Alder反应有关, 但4π电子不是二烯而是1,3-偶极,四个 电子分布在三个原子上,如重氮烷和叠氮化合物:
重氮烷: RHC N N
RHC N N
RHC N N
RHC N N
叠氮化合物: RN N N
第六章 开环和关环
关环和开环 涉及关环和开环的反应很多.
关环反应主要分三类 1. 分子内的变型:n个原子的链环化成n元环或n-1元环状化 合物,如Dieckmann反应(分子内Claisen酰基化反应); 2. 环加成反应:涉及两个不同分子间的反应,同时形成两 个键,如Diels-Alder反应; 3. 电环化反应:它是分子内反应,但其机理与环加成反应 有关。
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-周环反应【圣才出品】

HOMO 决定。
17.2 课后习题详解
1.推测下列化合物电环化反应产物的结构。
((11))
(2) HH
(1)
(2)(1)
(2)
HH
((12))
(2)
)
H H3C
H CH3
H
(3)
H3C
CH3
hv
(2)
HH
H CH3
hv
(3) H(4) H
(3) H3HC HCH3
(3) H3CHH3C CHHC3H3 (5)
8 / 18
圣才电子书
答:
十万种考研考证电子书、题库视频学习平台
9.通过什么反应和条件,完成下面的反应。
Ph
O
O
O
Ph
O
O
Ph
Ph
O
答:通过光照和加热能得到给出的结果,反应过程如下:
Ph
hv
对旋
Ph
Ph
O
O
O
Ph
Ph
Ph
O
O O
10.如何使反-9,10-二氢萘转化为顺-9,10-二氢萘?
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 17 章 周环反应
17.1 复习笔记
一、电环化反应 1.电环化反应 (1)电环化反应的概念 电环化反应是指在加热或光照条件下,共轭多烯烃环合形成环烯烃的反应及其逆反应。 (2)电环化反应的规律性 共轭多烯烃电环化反应有高度的立体选择性,反应与共轭体系的π电子数目有关,主要 分为 4n 型共轭多烯和 4n+2 型共轭多烯。其关系见表 17-1。
子的 HOMO 与另一个反应分子的 LUMO 对称性符合正正重叠或者负负重叠,形成化学键,
有机化学18第十八章周环反应

A BA B
顺旋
AA BB
BB AA
AA BB
A BA B
AA BB
对旋
BB AA
对称性不匹配,不能成键。
链状和环状共轭烯烃的判断
一个环状的共轭多烯是由三个单键连接两端的 双键的,应将其恢复为链状共轭多烯,再判断 它是4n或是4n+2电子体系。
由双键转化而来的单键
电环化反应形成的单键
由双键转化而来的单键
B
A
B AA B
A
B
A
B
以键轴为轴向同一方向(均为顺
时针,或均为逆时针)称为顺旋。 B
A
B
A
A
B
(dl)
以键轴为轴向不同方向(一为顺 时针,另一为逆时针)称为对旋。
B
B
B AA B
A
A
A
A
B
B
对称性不匹配,不能成键。
C. 4n电子体系在光照条件下的电环化反应
在光照条件下,4n电子体系参与电环化反应的 最高占有轨道(HOMO)是3,3在顺旋和对旋 时的成键状态如下:
18.3 -迁移反应
-迁移反应:一个以键与共轭多烯相连 的原子或基团,在加热条件下从共轭体 系的一端到另一端的迁移反应,同时伴 随单双键的互变。
分类:-迁移反应分为原子或基团从共 轭体系的一端到另一端的迁移称为[1,j]迁 移,又可进一步分为氢原子迁移和烷基 迁移;联结两段共轭体系的键在共轭体 系上的位移,称为[i,j]迁移,主要是 [3,3’]--迁移。
1.4n电子体系的电环化反应
A. 4n电子体系的分子轨道
反键轨道
HOMO
成键轨道
加热条件下电子填充
反键轨道
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教学目标:了解键状共轭多烯烃的电环化反应
教学重点:共轭二烯烃电环化反应的特点
教学按排:F
>F24;45min
19—
在化学反应过程中,化学键的断裂和形成同步进行的反应称做协同反应,通过环状过渡态的协同反应又称做周环反应。
周环反应有两个特点:第一,反应受加热或光照制约,加热和光照的反应结果不同,不受极性溶剂、试剂、酸、碱、催化剂和自由基引发剂的影响;第二,产物有高度的立体选择(立体专属)性。
产物的立体化学只与反应物的结构和加热或光照有关。
链状共轭多烯烃两端的π电子形成一个σ-键,其余的π电子进行相应地组合,形成环状不饱和化合物的反应或其逆反应称为电环化反应,电环化反应属周环反应。
一、共轭二烯的电环化反应
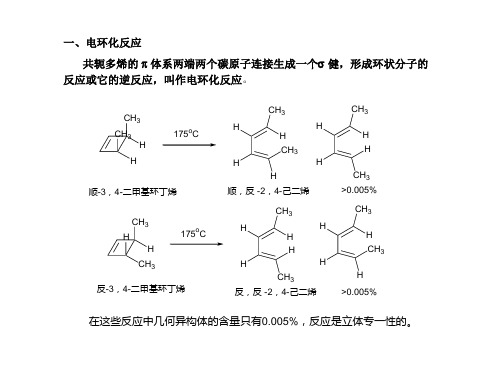
1,3-丁二烯在热或光的作用下发生电环化反应都得到环烯。
而两端二取代共轭二烯烃在热或光作用下,得到收式或反式环丁烯。
例如:
(2Z,4E)-2,4-己二烯在热作用下得到顺-3,4-二甲基环丁烯;在光作用下得到反-3,4-二甲基环丁烯。
(E,E)-2,4-己二烯在热作用下,得反-3,4-二甲基环丁烯,在光作用下得顺-3,4-二甲基环丁烯,两者的结果相反:
二、电环倾反应机理
1.分子轨道对称守恒原理
伍德和霍夫曼提出化学反应的分子轨道对称守恒原理认为:化学反应是分子轨道重亲组合的过程,对一些由分子轨道的对称性控制反应进行的周环反应过程来说,反应过程中分子轨道的对称性必须是守恒的,即反应分子轨道的对称性必须与产物分子轨道的对称性保持一致,才能容易进行,称为对称性允许,反之,不能保持一致,反应就难进行或不能进行,称为对称性禁阻。
2.分子前沿轨道学说
化学家福井谦一根据形成分子时只有原子介电子变化的概念,提出化学反应与分子前沿轨道有关的分子前沿轨道学说:在化学反应中,分子轨道要重新组合,这种组合主要发生在分子前沿轨道上,即发生在HOMO和LUMO之间。
分子前沿轨道学说和分子轨道对称守恒原理,是近代有机化学理论研究的重大成果之一,获得诺贝尔化学奖,这两个理论结合揭示了周环反应的机理问题。
3.电环化反应机理
在电环化反应中,共轭二烯的两端碳原子的P轨道变成环烯烃的σ键,因此应考察这两个P轨道在反应过程中的对称性与σ键的对称性。
2,4-己二烯的π分子轨道与1,3-丁二烯的π分子轨道相同:
2,4-己二烯的π电子轨道图
热反应只与基态有关,在反应过程中起关键作用的是HOMO轨道ψ
2。
(2,E)-2,4-己二烯热作用下顺旋形成顺-3,4-二甲基环丁烯
在顺旋时,C2的P轨道或SP3轨道与C5的P轨道或SP3轨道始终保持对称性不变,在两个SP3轨道距离最近时,轨道的相位相同,互相重叠最大,形成σ键,在两个π键开始断裂的同时σ键和新的π键开始形成,活化能小,共轭二烯烃顺利转化成环烯烃。
顺旋是轨道对称性允许的途径,形成σ键,对旋情况相反,两个P轨道不能保持守恒,两个SP3轨道接近时相位相反,不能形成σ键,是对称性禁阻的途径。
顺-3,4-二甲基环丁烯顺旋开环得到二烯也是对称性允许的反应。
在光照时,2,4已二烯的ψ2轨道中电子路迁到ψ3轨道中,这时基态的LUMO变成HOMO,
而ψ
4轨道变成LUMO,在电环化反应中起关键作用的是HOMO(ψ3轨道),两种旋转情况
如下图:
(Z,E)-2,4-己二烯在光照下形成反-3,4-二甲基环丁烯
(Z,E)-2,4-已二烯在光照下对旋形成反-3,4-二甲基环丁烯是对称性允许,C2和C5间形成
C5间不键,(Z,E)-2,4-已二烯转化成反-3,4-二甲基环丁烯:而顺旋是对称性禁阻反应C
2和
能形成σ键。
在光照时,反-3,4-二甲基环西烯对旋开环得到(Z,E)-2,4-已二烯也是对称性允许的反应。
在热作用下(E,E)-2,4-已二烯,对旋是对称性允许反应,形成反-3,4-二甲基环丁烯;在光照下,顺旋是对称性允许的反应,形成顺-3,4-二甲基环丁烯。
三、电环化反应规律
有4n(n=1,2,…)个π电子的链状共轭多烯烃,其HOMO和LUMO两端碳原子上的P轨道的相位分别为:
HOMO,热反应,顺旋对称性允许LUMO,光照,对旋对称性反应
热反应时,顺旋是对称性允许的,能进行电环化反应。
在光照时,HOMO轨道电子跃进到LUMO中,对旋是对称性允许的,能进行电环化反应。
有4n+2(n=1,2,3,…)个π电子的链状共轭多烯烃,其HOMO和LUMO两端碳原子上的P轨道的相位分别为:
HOMO LUMO
热反应时,对旋是对称性允许的反应,发生电环化反应;光照时,顺旋是对称性允许的反应,发生电环化反应。
共轭多烯烃的电环化反应概括如下规
律:
注意:这里讲的对称性禁阻反应是在协同反应过程中所需要的活化能很大,反应不易进行。
但并不排出其它途径,如自由基型机理进行的可能性。
四、关键词
电环化反应,分子轨道对称守恒原理,对称性允许,对称性禁阻,前沿轨道,前沿轨道学说,周环反应,反应机理顺旋,对旋,电环化反应规律。
