电化学保护基本原理(单页版)
电化学保护1..

电化学保护
阴极保护
(1)保护原理
金属—对被保护金属施加阴极极化,
使电位移动到阴极区,消除金属表面电 化学不均匀性,降低阳极溶解速度而得 到保护。因而金属腐蚀速度减小,称为 阴极保护效应。利用阴极保护效应减轻 金属设备腐蚀的防护方法叫做阴极保护 。
防护技术
直流电源
- +
辅助 阳极
缓蚀剂
缓蚀剂对电极反应的作用
E
Ecor E’cor
阴极极率Pc 增大
E
Ecor E’cor
阳极极化率 Pa增大
E
Ecor E’cor
阴极极化率 Pc阳极极化 率Pa都增大
I’cor
Icor
I
I’cor
Icor
I
I’cor
Icor
I
土壤
[阴极型缓蚀剂]
[阳极型缓蚀剂]
[混合极型缓蚀剂]
三种缓蚀剂保护膜
2.0
4.0
6.0
8. 0
1.0
钼酸铵对碳钢在碳化液中阳极行为的影响
电流(MA)
引自<催化电化> 1973.NO1 P14
(2) 阴极型缓蚀剂
阴极型缓蚀剂的作用在于增大腐蚀电池的阴极极 化,使阴极反应速度降低,从而减小金属的腐蚀。 有的阴极型缓蚀剂能减小氢离子还原反应的交换 电流密度,使析氢反应变得困难 。如硫化物、砷 化物等。这类化合物可能导致金属的氢损伤(氢鼓 泡、氢脆等),而且大都有毒,所以酸溶液中已很 少使用。有些阴极型缓蚀剂能够在腐蚀电池的阴 极区形成沉淀膜,使阴极区面积减小,阴极极化 增强。如Zn2+(常使用ZnSO4) 。
防护技术
辅助阳极材料的性能
电化学保护的原理及应用

电化学保护的原理及应用电化学保护是一种通过在金属表面形成保护膜或抑制电化学反应,从而防止金属腐蚀的方法。
它利用电化学反应的原理,在金属表面形成氧化物薄膜或与环境中的电解质反应生成可溶性盐,阻止金属继续腐蚀。
电化学保护主要有两种方式:阳极保护和阴极保护。
阳极保护是通过在金属表面形成一个相对于金属较不易氧化的阳极,使其成为电池的阳极,从而使金属处于保护状态。
常见的阳极保护方法有三种:阳极保护、阳极保护、自动阳极保护。
阳极保护是通过在金属表面放置一块与金属具有较大电位差的金属,使其成为电池的阳极,从而保护金属。
这种方法常用于一些金属结构的保护,如船舶的金属结构保护。
常用的金属有铝、锌等。
阴极保护是通过给金属提供足够的电子,使金属表面形成一个较低电位的阴极,从而减缓金属的腐蚀。
常见的阴极保护方法有两种:外加电流阴极保护和物理阴极保护。
外加电流阴极保护是通过在金属表面加上外加电流,使金属表面形成一个保护性的氧化膜或金属膜。
常见的外加电流阴极保护方法有阴极保护和阴极保护。
物理阴极保护是通过在金属表面涂覆一层保护性的涂层,使金属表面与环境隔离,减缓金属的腐蚀。
常见的物理阴极保护方法有金属涂层和有机涂层。
电化学保护的应用非常广泛。
它可以用于金属结构、管道、储罐等各类金属设备的保护,在海洋、油田、化工、电力等行业都有重要的应用。
在海洋环境中,金属结构容易受到海水中的氯化物、硫化物等腐蚀性物质的侵蚀。
电化学保护通过在金属表面形成保护膜,可以有效地减缓金属的腐蚀速度,延长金属的使用寿命。
在油田行业中,金属管道、储罐等设备经常处于潮湿、腐蚀性介质中,容易发生腐蚀。
电化学保护可以在这些设备表面形成保护膜,降低金属的腐蚀速度,提高设备的安全性能。
在化工行业中,各种化学介质对金属的腐蚀性较强。
电化学保护可以在金属表面形成厚度合适的保护膜,有效地阻止金属与化学介质的接触,减少金属的腐蚀。
在电力行业中,设备如输电塔、变压器、电缆等常常暴露在空气中,容易被氧气腐蚀。
10.九章电化学保护(11,12)
2011-10-18
4
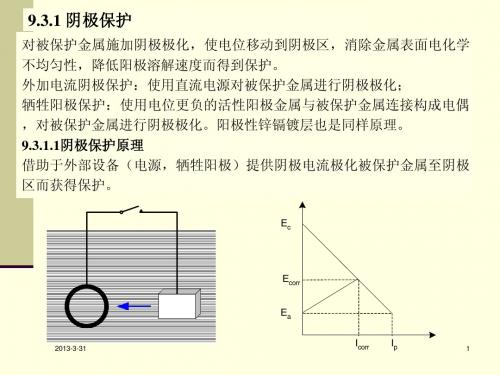
9.3.1.3 牺牲阳极阴极保护 使用电位负的活性金属合金与被保护金属电气连接,使被保 护金属电位负移阴极极化,牺牲阳极发生阳极溶解而消耗;不需 要外加电源。可靠性高,电流分散性好,施工容易,不干扰电器 设备;90%以上采油平台,小型船舶,闸门,海底输油气管线采 用阴极保护。 1. 牺牲阳极材质确定 . 要求: 要求: 阳极具有足够的负电位:驱动电位0.25V; 理论输出电量(单位重量阳极溶解电量):高 自腐蚀电流:小 电流效率:80~90%; 阳极电位:稳定,极化小; 表面形态:无腐蚀产物沉积,溶解均匀; 5 2011-10-18 材料:价格低廉;
8 2011-10-18 牺牲阳极布置: 牺牲阳极布置:原则为电流分布均匀;严重腐蚀区域增加数量。
3. 牺牲阳极安装 . 本体安装: 本体安装:水介质中大型结构设备,焊接和螺栓固 定,保证接触良好; 分体安装: 分体安装 : 土壤中保证电位分布均匀距离1.5~8米 两侧安装;采用导电性好的化学填料包,降低接触 电阻,增加电流输出,活化表面,防止腐蚀结垢, 减少极化,维持高稳定电流密度; 铝合金牺牲阳极化学填料包: 铝合金牺牲阳极化学填料包 : 高土壤电阻率—— 60%粗食盐,20%熟石灰,20%膨润土; 低土壤电阻率——40%粗食盐,10%熟石灰,50% 膨润土。
2011-10-18
10
9.3.1.4 外加电流阴极保护
牺牲阳极方法的不足: 牺牲阳极方法的不足 : 消耗大量金属材料;自动调节能力差;增加船体 阻力和平台稳定性;只适合应用于较高电导率介质。 外加电流阴极保护系统的优点: 外加电流阴极保护系统的优点 : 体积小,重量轻;能自动调节输出保护 电流和保护电压;使用寿命长。用于大型船舶油轮,舰艇,大型原料码头, 采油平台,地下石油管道,化工设备等。 外加电流阴极保护系统的组成: 外加电流阴极保护系统的组成:直流电源,辅助阳极,参比电极。 1.直流电源 . 低电压,大电流,输出稳定自动可调; 磁饱和电抗器控制的恒电位仪,晶体管恒电位仪,可控硅恒电位仪(功率 大,体积小,寿命长,成批系列化生产); 控制方式:控制电流,控制电位,控制槽压,间歇控制(较大断电流衰减 时间常数,节约电能90~95%,阳极材料消耗减少90~95%,显著延长阳极 使用寿命);
电化学保护1..

•阳极保护
(1)原理 对具有活态—钝态转变而不能自钝化的腐 蚀体系,通过阳极极化电流,使金属的电 位正移到稳定钝化区内,金属的腐蚀速度 就会大大降低,这种防护方法称为阳极保 护。
阴极保护中电流遮蔽作用的例
阴极保护适合的体系:
不是任何金属结构或设备都可以使用阴极保 护的,必须符合一定条件和范围。 在工程上作为一种腐蚀控制技术还要求保护 电流密度比较小,在经济上才合算。阴极保 护的经济指标可以用保护效益Z来衡量 腐蚀体系的阴极极化率大,阳极极化率小(即 阴极极化曲线陡而阳极极化曲线平),则随 着电位负移,金属腐蚀速度减小快,而保护 电流密度增加慢,保护效益也就较大,可以 满足经济指标方面的要求。
阴极保护举例:
测量阴极极化曲线 ,确定是否适宜采用阴极 保 护。 从极化曲线上确定保护电位,及相应的保护 电流密度。 计算保护度 :测量极化曲线得出保护电位的 大致范围后,将试样恒定在不同的极化电位, 经过适当的暴露时间,用失重法测量金属的 腐蚀速度,从而计算不同极化电位下的保护 度。
防护技术
第十二章 防护方法
电化学保护
阴极保护
(1)保护原理
金属—对被保护金属施加阴极极化,
使电位移动到阴极区,消除金属表面电 化学不均匀性,降低阳极溶解速度而得 到保护。因而金属腐蚀速度减小,称为 阴极保护效应。利用阴极保护效应减轻 金属设备腐蚀的防护方法叫做阴极保护 。
防护技术
直流电源
- +
辅助 阳极
辅助阳极和参比电极分布平面图
A1 R1 A3 R3 As
控制室
A7
R5
A9
船尾 三 货 舱
尾 轴 弄 A2 R2 A4
电化学中的原理和应用

电化学中的原理和应用引言电化学是研究电荷在电解质溶液中随时间和空间的变化规律以及与化学反应之间的关系的学科。
它在能源领域、环境保护、材料科学、生命科学等诸多领域都有广泛的应用。
本文将介绍电化学的基本原理和常见的应用领域。
一、基本原理1.电解质溶液:电解质溶液是指溶解了离子的溶液,其中离子是电荷的载体。
常见的电解质溶液有盐酸、硫酸、氢氧化钠等。
2.电解质的电离和溶解度:电解质在溶液中通过电离过程将分子转化为离子,溶解度是指单位体积溶液中电解质的溶解量。
3.电势差与电动势:电势差是指单位电荷在电场中所受到的力,电动势是电池或电化学反应提供给电荷的能量。
二、电化学的应用领域1.能源领域•锂离子电池:锂离子电池是一种常见的可充电电池,它通过正极材料(如钴酸锂)和负极材料(如石墨)之间的锂离子来储存和释放能量。
•燃料电池:燃料电池利用化学反应直接将化学能转化为电能,其中常见的燃料电池有氢燃料电池和甲醇燃料电池。
2.环境保护•废水处理:电化学处理可以利用电解质溶液中的离子来去除废水中的有机物、重金属离子等污染物。
•大气污染控制:电化学脱硫和脱氮技术可以通过电化学反应将煤烟中的二氧化硫和氮氧化物转化为无害的硫酸和硝酸。
3.材料科学•电镀:电镀是利用电解质溶液和电流在导电物体表面镀上一层金属,用于保护材料表面、改善外观和增强耐磨性。
•电解金属提取:电解法可以将金属从矿石中提取出来,常见的例子有铝的电解提取。
4.生命科学•DNA测序:电化学测序技术利用DNA在电解质溶液中的电荷特性,通过电流变化来测定DNA序列。
•生物传感器:电化学传感器利用电化学原理测量生物体内的化学物质,广泛应用于生物医学和环境监测。
结论电化学作为一门综合性学科,具有广泛的应用前景。
它在能源领域的电池技术、环境保护、材料科学和生命科学中都发挥着重要的作用。
随着科学技术的不断进步,电化学的应用会越来越广泛,为人类的生活和社会发展带来更多的创新和便利。
特殊环境下海工设 施电化学保护关键 技术及应用

特殊环境下海工设施电化学保护关键技术及应用随着我国海洋能开发利用的不断深入和扩大,海工设施的建设和运营管理愈发受到重视。
海洋环境的恶劣性和海工设施长期暴露在海水中容易受到腐蚀的特点,使得电化学保护技术成为海工设施保护的重点和难点之一。
本文将围绕特殊环境下海工设施电化学保护的关键技术及应用展开讨论。
1. 电化学保护的基本原理电化学保护是一种通过施加外加电流或电压的方式,使金属产生一种抑制腐蚀的保护措施。
其基本原理是利用外部电流或电压改变金属的电化学反应过程,使得阳极上的金属得到保护,从而达到减缓或抑制腐蚀的目的。
在海工设施中,电化学保护可以通过阴极保护和阳极保护两种方式来实现。
2. 海工设施电化学保护的关键技术(1)材料选择海工设施在电化学保护中,材料的选择是至关重要的一环。
有些特殊金属或合金在海水中容易受到腐蚀,因此需要选择能耐海水腐蚀的金属或合金作为建造材料。
(2)设计施工设计施工是保证电化学保护有效实施的关键。
在设计施工阶段,需要充分考虑海工设施的结构特点和外部环境,确定合理的保护措施和电极布置方案,以确保电流能够均匀分布到整个结构表面。
(3)电极设计电极是电化学保护的关键组成部分,直接影响保护效果的好坏。
在海工设施中,电极的设计需要考虑电极材料的选择、电极形式的确定以及电极布置的合理性,以提高电化学保护的效果。
(4)监测系统海工设施电化学保护的监测系统是保证保护效果稳定可靠的重要保障。
监测系统需要能够及时准确地监测电极电流密度、结构电位和腐蚀速率等关键参数,以便及时调整保护措施,保证海工设施的安全运行。
(5)维护管理海工设施电化学保护系统的维护管理工作直接关系到系统的稳定性和可靠性。
要做好海工设施电化学保护系统的维护管理工作,需要加强对系统的定期检查、维护和管理,及时发现问题并采取相应的措施。
3. 海工设施电化学保护的应用海工设施电化学保护技术已在我国的海洋工程建设和运营中得到广泛的应用。
电化学保护基本原理(4页版)

-850mV判据
土壤中钢铁的最小保护电位为: E=-0.541 V(SHE)
如果换算成相对于饱和硫酸铜电极,钢铁的最小保 护电位为: E=-0.857 V≈-850mV(CSE)
¾ 这就是钢铁在土壤等环境中的平衡电位,即金属表面腐 蚀原电池阳极的开路电位-最小保护电位
¾ 对钢铁阴极保护效果的一个重要的控制判据
4
阳极保护的主要参数
1. 致钝电流密度 2. 维钝电流密度 3. 钝化区的电位范围
维钝电流密度
稳定钝化区电位下的外电流密度,是使金 属在给定环境条件下维持钝态所需的电流 密度
维钝电流密度即金属的腐蚀电流密度,反 映出阳极保护的效果
钝化膜的生成需要一定的电量,维钝电流 密度反应耗电量的多少
钝化区电位范围
二、电化学保护技术
腐蚀与防护中心 柳伟 2009.10
电化学保护
定义: 通过外加电流或电位,升高或降低金属在电介质溶 液中的电极电位,即对被保护金属进行阳极或阴极 极化,从而抑制金属阳极溶解反应的进行,达到减 小金属电化学腐蚀速度的方法。
分两类: 阴极保护和阳极保护
目录
1. 电化学保护的基本原理 2. 阴极保护技术应用介绍 3. 阳极保护技术应用介绍
1
电化学保护的发展
阴极保护: 历史较长:1824年提出设想,二十世纪的三十
年代才开始应用,现在是一项成熟的商品化的保护 技术。
阴极保护的应用十分普遍。
阳极保护: 历史较短:比较新的腐蚀控制技术。1954年提出
可以用阳极保护技术以控制金属的腐蚀,到1958年 第一次应用,目前也是商品化的保护技术。
最佳保护参数
2、日常维持阴极保护的电流消耗小 保护电位低,电流密度高,保护度高, 电量消耗大 平衡电量消耗和保护度之间的关系
电化学原理(课件PPT)

原电池的负极→ 失去电子→电子流出→ 发生氧化反应 →氧化还原反应中的还原剂 原电池的正极→ 得到电子→电子流入→ 发生还原反应 →氧化还原反应中的氧化剂
电解池的阳极→ 失去电子→电子流出→ 发生氧化反应 电解池的阴极→ 得到电子→电子流入→ 发生还原反应
把a、b、c、d四块金属片浸泡在稀硫酸中, 用导线两两连接,可以组成各种原电池,若a、 b相连时,a为负极;若c、d相连时,d极表面 有气泡冒出;另将a投入c的盐溶液中,a的 表面有c析出;若将b投入d的盐溶液中, 无明显现象。则四种金属的活动性由强到弱 为( )
考点八:氯碱工业
在U型管里装人饱和食盐水,用一根碳棒作阳极, 一根铁棒作阴极。接通直流电源。
1.电解饱和食盐水反应原理
阳极反应:2Cl——2e— = Cl2↑
阴极反应:2H+ + 2e— = H2↑
a
b
总反应:2NaCl + 2H2O
2NaOH + Cl2↑+ H2↑
2.离子交换膜法制烧碱
1、电解槽组成: 阳极室:阳极材料为金属钛网,有钛、钌的氧化物涂层,
依反应式找出相关物质的关系式 依电子守恒进行计算。
1、在Cu-Zn原电池中,100mLH2SO4 溶液的浓度为 1mol/L , 若工作一段时间后,从装置中共收集到 1.12L 升气体,则流过导线的电子为———— mol,反应后溶液 的pH值为_________?(溶液体积变化忽略不计)
类题:资料244页举一反三第4题
书写注意事项:
①阴、阳极类似于原电池正、负极,电极反应式通常写离 子方程式,满足电子守恒
②总方程式通常写化学方程式,标条件:电解,若电解 的H+或OH-来自水,则反应物应写成水的形式,若来自 弱电解质,则应写弱电解质的分子形式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、电化学保护技术
腐蚀与防护中心柳伟
2009.10
目录
1.电化学保护的基本原理
2.阴极保护技术应用介绍
3.阳极保护技术应用介绍
电化学保护
定义:
通过外加电流或电位,升高或降低金属在电介质溶液中的电极电位,即对被保护金属进行阳极或阴极极化,从而抑制金属阳极溶解反应的进行,达到减小金属电化学腐蚀速度的方法。
分两类:
阴极保护和阳极保护
阳极保护和阴极保护
阳极保护:
通过外加电流,升高金属的电极电位,阳极电流高于阴极电流,金属以阳极反应为主,当电位高于致钝电位时,阳极极化曲线进入钝化区,阳极过程受到抑制或停止,金属发生钝化。
金属作为电解池系统的阳极。
阴极保护:
通过外加电流或电位,降低金属的电位,金属上的电极过程以阴极过程为主,阳极过程受到抑制,甚至停止。
金属为电解池的阴极或双金属电偶电池的阴极。
电化学保护的发展
阴极保护:
历史较长:1824年提出设想,二十世纪的三十年代才开始应用,现在是一项成熟的商品化的保护技术。
阴极保护的应用十分普遍。
阳极保护:
历史较短:比较新的腐蚀控制技术。
1954年提出可以用阳极保护技术以控制金属的腐蚀,到1958年第一次应用,目前也是商品化的保护技术。
阳极保护的应用领域显著小于阴极保护。
阴极保护
阴极电流的来源:
直流电源或具有低电极电位的金属或合金¾被保护的金属与直流电源的负极相连
-外加电流阴极保护法
¾被保护的金属与电极电位低的金属或合金相连-牺牲阳极的阴极保护法
阴极保护
+-
外加电流阴极保护法牺牲阳极的阴极保护法
阴极保护的基本原理
最小保护电流(密度)
最小保护电位
阴极保护的控制参数
最小保护电位:
阴极保护时使金属腐蚀停止时所需达到的绝对值最小的电位值
最小保护电流密度:
阴极保护时使金属的腐蚀速度降到最低程度所需的最小电流密度值
-850mV判据
土壤中钢铁的最小保护电位为:
E=-0.541 V(SHE)
如果换算成相对于饱和硫酸铜电极,钢铁的最小保护电位为:
E=-0.857 V≈-850mV(CSE)¾这就是钢铁在土壤等环境中的平衡电位,即金属表面腐
蚀原电池阳极的开路电位-最小保护电位
¾对钢铁阴极保护效果的一个重要的控制判据
最佳保护参数
确定最佳保护电位和电流密度
1、要有较高的保护效果
Z= ×100%
式中V 0—阴极保护前金属的腐蚀速度;
V—阴极保护后金属的腐蚀速度。
0V V
V −
最佳保护参数
2、日常维持阴极保护的电流消耗小
保护电位低,电流密度高,保护度高,电量消耗大平衡电量消耗和保护度之间的关系
3、防止“过保护”的产生
保护电位太负,会造成金属表面产生大量氢气,pH值升高,
-碳钢等金属发生氢脆而破坏
-金属表面涂层起泡、脱落
-两性金属如铝、锌等产生碱性腐蚀
应用阴极保护的基本条件
电流回路的要求:
1、介质导电-形成电流的回路
2、具有一定介质的量,覆盖金属的表面-电流分布均匀 经济性的要求:
1、易于阴极极化-否则电能消耗大
材料方面的要求:
1、钝化金属不采用
2、两性金属不采用
金属设备和构件的形状结构的要求:
简单,避免出现“遮蔽现象”,出现局部保护不足和过保护现象。
阳极保护
在一定的电解质溶液中,理论阳极极化曲线出现钝化区的金属,不处于自钝化状态,将该金属构件与外加直流电源的正极相连,将金属进行阳极极化至一定电位,使其建立并维持稳定的钝态,阳极过程受到抑制,金属得到了保护。
通过外加电流使能够钝化的金属处于电化学钝化状态通过阳极极化使金属的表面形成钝化膜:电化学钝化或阳极钝化
阳极保护的基本原理
阳极保护的主要参数
1.致钝电流密度
2.维钝电流密度
3.钝化区的电位范围
维钝电流密度
稳定钝化区电位下的外电流密度,是使金属在给定环境条件下维持钝态所需的电流密度
维钝电流密度即金属的腐蚀电流密度,反映出阳极保护的效果
钝化膜的生成需要一定的电量,维钝电流密度反应耗电量的多少
钝化区电位范围
钝化区的电位范围即是在阳极保护过程中允许被保护金属的电位变化的范围。
钝化区的范围越宽,在操作运行的过程中不会受外界电位的变化造成金属的活化或过钝化,阳极保护的可操作性好。
阳极保护的应用条件
致钝电流密度不应过小,否则钝化时间比较长,容易造成金属的活化溶解
钝化电位范围不应过小:难于控制金属的电位,受外界的影响大,对外电源的要求高
维钝电流密度应小:如维钝电流密度大,金属的腐蚀速度大,阳极保护的效果不好,且电能的消耗大。
