中英文对照欧洲医疗器械法规资料MDR2017_745 Part 1
中文版欧盟mdr法规

中文版欧盟mdr法规欧盟医疗器械法规(Medical Device Regulation, MDR)是欧洲联盟针对医疗器械领域制定的一份重要法规。
它于2017年5月发布,并于2020年5月正式生效。
本文将根据各项规定,为您详细介绍中文版欧盟MDR法规的内容。
第一部分:导言这一部分主要介绍了欧盟MDR法规的背景和目的,以及适用范围和基本定义。
MDR法规的目标是确保欧盟市场上的医疗器械的安全性、有效性和可靠性,以保障公众的健康和安全。
第二部分:一般要求1. 医疗器械分类和命名MDR法规对医疗器械进行了新的分类,以便更好地管理和监督不同风险等级的产品。
同时,对医疗器械的命名也有明确规定,以避免混淆和误导。
2. 表演的规定MDR法规要求制造商对其产品进行临床评价,并根据风险等级制定相应的技术文件和技术规格。
此外,MDR还提出了对制造商质量管理体系的要求,以确保其产品符合法规的要求。
3. CE标志的规定MDR法规明确了CE标志的使用规定,要求制造商在产品上正确使用并保持其可见性。
这是制造商将其产品引入欧盟市场的必要步骤。
第三部分:具体要求1. 临床评价和临床试验MDR法规对医疗器械的临床评价和临床试验进行了详细规定。
制造商需要对产品进行充分的临床评估,以确保其安全性和有效性符合要求。
2. 医疗器械监督和报告MDR法规明确了各方在市场监督和产品报告方面的责任。
制造商需要建立有效的市场监督和报告机制,并及时识别、评估和报告任何可能危害人类健康的事件。
3. 医疗器械技术文献和标签MDR法规要求制造商提供充分的技术文献和产品标签,以便医疗专业人员和最终用户正确使用和了解产品。
第四部分:认证和授权1. 医疗器械的市场准入MDR法规规定了医疗器械的市场准入程序,制造商需要满足一系列要求,包括提交技术文件、进行质量控制审核等。
只有通过认证的产品才能进入欧盟市场。
2. 第三方评估机构MDR法规对第三方评估机构的审核和授权进行了规定,确保其独立性和专业性。
欧盟医疗器械2017∕745 法规(MDR)(附录 XI 基于产品合规性验证的符合性评估 )

附录XI基于产品合规性验证的符合性评估1.基于产品合规性验证的符合性评估的目的是确保器械符合已发布EC 型式检验证书中所说明的形式,并满足本法规中的适用规定要求。
2.如已根据附录X 颁发EC 型式检验证书,制造商可申请表第A 部分所述流程(生产质量保证),或本附录第B 部分所述流程(产品验证)。
3.通过豁免上述第1 节和第2 节,本附录所述程序加上附录II 和III 所述技术文件也可适用于IIa 类器械制造商。
第A 部分:生产质量保证4.制造商应确保实施批准的相关器械生产质量管理体系,并按照第 6 节的规定进行最终验证,且接受第7 节所述的监管。
5.制造商应履行第4 节所规定的义务,并根据第19 条和附录IV 起草并保存符合性评估流程所涵盖器械型号的EU 符合性声明。
通过发布EC 符合性声明,制造商应确定并声明有关器械是否符合EC 型式检验证书中所说明的型式,以及是否满足本法规中的适用规定要求。
6.质量管理体系6.1制造商应向公告机构提出申请表,评估自己的质量管理体系。
申请表应当包括:- 附录IX 第2.1 节所列的所有要素;- 附录II 和III 所述批准型式的技术文件;- 附录X 第4 节所述EC 型式检验证书副本;若提出申请表后,EC 型式检验证书由同一公告机构颁发,则技术文件及其更新信息和所颁发证书的参考资料应包含在申请中。
6.2质量管理体系的实施应确保器械是否符合EC 型式检验证书中所说明的型式,以及是否满足本法规中的适用于各阶段器械的规定要求。
制造商为其质量管理体系而采用的所有要素、要求和规定,必须以系统和有序的方式记录在质量手册、书面政策和程序之中,例如质量程序、质量计划和质量记录。
该文件尤其应包括对附录IX 第2.2 节(a)、(b)、(d)和(e)所列所有要素的适当说明。
6.3附录IX 第2.3 节第一和第二段的规定适用。
若质量管理体系可确保器械符合EC 型式检验证书中所说明的形式,并满足本法规中的适用规定要求,则欧盟公告机构应出具欧盟质量保证证书。
MDR-EU-2017-745-欧盟医疗器械法规 -附录 16

附录16ANNEX XVI非条款1(2)中所涉及的预期医学目的的产品类别清单:LIST OF GROUPS OF PRODUCTS WITHOUT AN INTENDED MEDICAL PURPOSE REFERRED TO IN ARTICLE1(2)1.隐形眼镜或置于眼睛内部或表面的其他产品。
1.Contact lenses or other items intended to be introduced into or onto the eye.2.通过侵入型手术完全或部分导入人体的产品,目的是矫正人体某些部位的解剖学位置或者固定人体某些部位,不包括纹身类和穿孔类产品。
2.Products intended to be totally or partially introduced into the human bodythrough surgically invasive means for the purpose of modifying the anatomy or fixation of body parts with the exception of tattooing products and piercings.3.用于面部、其他表皮或者黏膜填充的物质或者组合物质,方式有皮下注射、黏膜下注射或表皮内注射等,不包括用于纹身的物质。
3.Substances,combinations of substances,or items intended to be used for facialor other dermal or mucous membrane filling by subcutaneous,submucous or intradermal injection or other introduction,excluding those for tattooing.4.用于减少、移除或者破坏脂肪组织的设备,比如用于抽脂、脂解或进行抽脂手术。
中文版欧盟mdr法规

中文版欧盟mdr法规一、欧盟MDR法规概述1.背景介绍近年来,随着医疗器械技术的不断发展,欧盟为了加强医疗器械监管,提高产品质量和安全性,于2017年5月5日发布了新的医疗器械法规(MDR,Medical Devices Regulation),取代了原有的医疗器械指令(MDD,Medical Devices Directive)。
新法规将于2021年5月26日正式生效,对欧洲市场的医疗器械产品进行全面监管。
2.法规适用范围欧盟MDR法规适用于所有在欧盟市场上销售的医疗器械,包括体外诊断医疗器械。
法规将医疗器械分为三类:一类为低风险产品,二类为中等风险产品,三类为高风险产品。
不同风险类别的产品在合规要求上有所不同。
二、欧盟MDR法规的主要变化1.监管要求与原有指令相比,MDR法规对医疗器械的监管要求更为严格。
新法规要求企业必须确保产品安全有效,并在整个供应链中建立完善的质量管理体系。
2.合规认证流程MDR法规对认证流程进行了调整,增加了认证机构的审核要求和产品的技术评估。
此外,新法规还要求企业进行上市前申请(MDR-CE认证),以确保产品符合欧盟市场准入要求。
3.产品标签要求根据MDR法规,所有医疗器械产品必须贴有CE标志,并附有产品说明书和标签。
此外,企业还需在标签上注明产品类别、规格型号、生产日期等信息。
4.责任与义务新法规明确了各相关方的责任和义务。
企业需对产品安全性负主体责任,政府部门负责监管和执法,认证机构负责产品认证,医疗机构负责产品使用。
三、我国应对欧盟MDR法规的策略1.产品分类与评估企业应对产品进行准确分类,并根据风险类别进行评估。
对于高风险产品,需提前准备技术文档,以确保产品符合MDR法规要求。
2.技术文档准备企业需准备完整的技术文档,包括产品设计、生产工艺、原材料采购、质量控制等方面的信息。
此外,还需关注产品说明书和标签的设计,确保符合法规要求。
3.合规测试与认证在产品合规测试方面,企业应选择具备资质的实验室进行检测,确保产品符合MDR法规的相关技术要求。
中英文对照新版欧洲医疗器械法规资料MDR2017_745 Part 6

Article 61 Clinical evaluation
In this case, the notified body shall check that the PMCF plan is appropriate and includes post market studies to demonstrate the safety and performance of the device.在这种情况下,公告 机构检查发现 PMCF计划很合适且其中包括上 市后研究,以证明器械的安全性能。 In addition, clinical investigations need not be performed in the cases referred to in paragraph 6. 此外,临床研究无需在第6段所所述的情况下 执行。
Article 61 Clinical evaluation
5. A manufacturer of a device demonstrated to be equivalent to an already marketed device not manufactured by him, may also rely on paragraph 4 in order not to perform a clinical investigation provided that the following conditions are fulfilled in addition to what is required in that paragraph: 依据第4段规定,制造商生产出的器械经证实等 同于已投放市场的器械(不属于同一制造商生 产),除此条所要求的内容外,若以下条件均 满足,则无需进行临床研究:
MDR EU 2017 745 Table of Contents
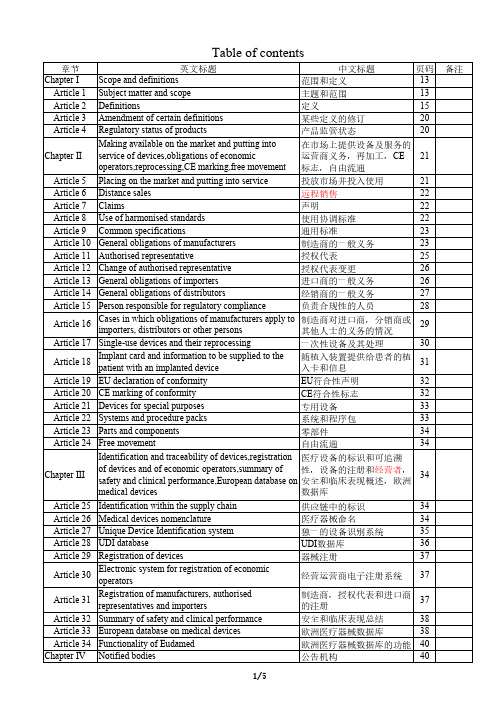
章节 Chapter I
Article 1 Article 2 Article 3 Article 4
英文标题 Scope and definitions Subject matter and scope Definitions Amendment of certain definitions Regulatory status of products
22
Article 8 Use of harmonised standards
使用协调标准
22
Article 9 Common specifications
通用标准
23
Article 10 General obligations of manufacturers
制造商的一般义务
23
Article 11 Authorised representative
安全和临床表现总结
38
欧洲医疗器械数据库
38
欧洲医疗器械数据库的功能 40
公告机构
40
备注
1/5
Article 35 Authorities responsible for notified bodies
负责公告机构的主管机构 40
Article 36 Requirements relating to notified bodies
EU符合性声明
32
CE符合性标志32Fra bibliotek专用设备
33
系统和程序包
33
零部件
34
自由流通
34
Chapter III
Identification and traceability of devices,registration 医疗设备的标识和可追溯
MDR-IVDR-欧盟立法-中文翻译版

MDR-IVDR-欧盟立法-中文翻译版简介本文是对欧盟医疗器械法规(MDR)和欧盟体外诊断器械法规(IVDR)的中文翻译版。
这两个法规是欧洲联盟针对医疗器械和体外诊断器械的法规框架。
它们于2017年发布,将于2021年生效。
这些法规对在欧洲市场销售的医疗器械和体外诊断器械的制造商、进口商和分销商有着重要影响。
MDR第一章:总则第一章包括了MDR的目的、范围和定义。
它强调了MDR 的主要目标是保护公共健康,确保医疗器械的安全和有效性。
此外,该章节还明确了哪些产品属于医疗器械的范畴,并给出了相关的定义。
第二章:一般要求第二章列出了制造商在生产医疗器械时必须遵守的一般要求。
这些要求包括但不限于:•标记和标识要求:医疗器械必须标明相关的信息,以便于识别和跟踪。
•说明书和标签要求:医疗器械必须提供符合规定的说明书和标签,以便用户正确使用。
•报告和注册要求:制造商必须按照规定提交相关报告,并将医疗器械注册到相应的数据库中。
第三章:验证与验证要求第三章明确了制造商必须进行验证和验证的要求。
这些要求包括但不限于:•技术文件:制造商必须编制技术文件,以证明医疗器械符合相关的要求。
•临床评估:制造商必须进行临床评估,并提供相应的数据来支持医疗器械的安全性和有效性。
•验证和验证的要求:制造商必须进行相应的验证和验证,以确保医疗器械符合相关的要求。
第四章:符合性评估第四章规定了制造商进行符合性评估的要求。
这些要求包括但不限于:•符合性审查:制造商必须通过符合性审查证明医疗器械符合相关的要求。
•合规证书:制造商必须获得合规证书,以证明其医疗器械符合相关的要求。
IVDR第一章:总则第一章包括了IVDR的目的、范围和定义。
它强调了IVDR的主要目标是保护公共健康,确保体外诊断器械的安全和有效性。
此外,该章节还明确了哪些产品属于体外诊断器械的范畴,并给出了相关的定义。
第二章:一般要求第二章列出了制造商在生产体外诊断器械时必须遵守的一般要求。
欧盟mdcg医疗器械法规中英文对照

欧盟mdcg医疗器械法规中英文对照全文共3篇示例,供读者参考篇1The European Union Medical Device Regulation (MDR) provides a comprehensive regulatory framework to ensure the safety and effectiveness of medical devices marketed in the EU. The MDR replaces the existing Medical Device Directive (MDD) and introduces several new requirements to enhance the oversight of medical devices throughout their lifecycle.In this article, we will provide a side-by-side comparison of key provisions in the MDR in both English and Chinese to help stakeholders understand the changes and implications of the new regulation.Title/标题欧盟医疗器械法规/ European Medical Device RegulationScope/范围The MDR applies to medical devices and in vitro diagnostic medical devices intended for use by humans for the purpose of diagnosis, prevention, monitoring, treatment or alleviation ofdisease./ 欧盟医疗器械法规适用于用于诊断、预防、监测、治疗或减轻疾病目的的医疗器械和体外诊断医疗器械。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 1. This Regulation shall enter into force on the twentieth day following that of its publication in the Official Journal of the European Union. 本法 规应在《欧盟官方公报》上公布后第20天生 效。
• (c) advanced therapy medicinal products covered by Regulation (EC) No 1394/2007;欧洲委员会第1394/2007号法规所涵盖的前沿疗法医药产品;
• (d) human blood, blood products, plasma or blood cells of human origin or devices which incorporate, when placed on the market or put into service, such blood products, plasma or cells, except for devices referred to in paragraph 8 of this Article;人类血液或血液制品、人源的血浆或血细胞, 或者在投放市场或投入使用时,包含此类血液制品、血浆或细胞的器 械,但本条第8段所述的器械除外(8. 包含物);
• 2. It shall apply from 26 May 2020. 自2020年5 月26日起适用。
• 3. By way of derogation from paragraph 2(略)
Sterimd
4
二、Scope范围
• 1. This Regulation lays down rules concerning the placing on the market, making available on the market or putting into service of medical devices for human use and accessories for such devices in the Union. This Regulation also applies to clinical investigations concerning such medical devices and accessories conducted in the Union. 本法规规定了有 关欧盟境内供人类使用的医疗器械极其附件的市 场投放、市场提供或投入使用方面的规则。本法 规也适用于在欧盟进行的有关该医疗器械及其附 件临床研究。
Sterimd
5
Devices with a non-medical intended
purpose非医疗目的的器械
• Devices with both a medical and a nonmedical intended purpose shall fulfil cumulatively the requirements applicable to devices with an intended medical purpose and those applicable to devices without an intended medical purpose.具有医疗和非医 疗预期目的器械应逐渐的满足适用于具有 预期医疗目的器械要求和适用于无预期医 疗目的器械的那些要求。
EU MDR 2017/745医疗器械法规
2017.09.15
Sterimd
1
主要内容
1. 法规立法和执行; 2. 适用范围; 3. 过渡期安排; 4. 法规结构。
Sterimd
2
一、REGULATION (EU) 2017/745法规
1. REGULATION (EU) 2017/745 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC) No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC. 欧洲议会和理事会于2017年4月5日 签发的关于医疗器械第2017/745号法规,修订 了第2001/83/EC号指令,第178/2002号(EU) 法规和第1223/2009号(EU)法规,并废除了 理事会第90/385/EEC号和第93/42/EEC号指令
Sterimd
6
This Regulation does not apply to
• (a) in vitro diagnostic medical devices covered by Regulation (EU) 2017/746;欧盟第2017/746号法规所涵盖的体外诊断医疗器械
• (b) medicinal products as defined in point 2 of Article 1 of Directive 2001/83/EC. In deciding whether a product falls under Directive 2001/83/EC or under this Regulation, particular account shall be taken of the principal mode of action of the product;如第2001/83/EC号指令第1条 第2点中所定义的医疗产品。在确定产品是否属于第2001/83/EC号指 令或本法规的范围时,应特别考虑产品的主要作用模式。
