南京大学《物理化学》考试第七章电解质溶液
物理化学电解质溶液PPT课件
总 反 应 :12O2H2H2O
6
可编辑课件PPT
负极 正极
正极
负极
7
可编辑课件PPT
原电池:化学能转化为电能的装置; 电解池:电能转化为化学能的装置。
正极(positive electrode)——电势高的电极 负极(negative electrode)——电势低的电极
34
可编辑课件PPT
4.求难溶盐的溶解度和溶度积★
难溶盐本身的电导率很低,这时水的电导率就不能忽略
κH溶2O液————难所溶用盐水饱的和电溶导液率的。电导率;
盐 溶 液H2O
Λm
c
Λm
35
c
盐
Λ m ,盐
可编辑课件PPT
步骤:
1.用已知电导率的高纯水配制难溶盐的饱和溶液; 2.测定此饱和溶液的电导率,从中扣去水的电导率后即为盐的 电导率; 3.用难溶液盐的 Λm∞ 代替 Λm 计算难溶盐的溶解度 c; 4.求 KSp 。
14
q V 1 q V
可编辑课件PPT
通入4mol电量
迁移过程:q+ + │q-│=q
15
q V 3 q V
可编辑课件PPT
定义:电解质溶液中各种离子的导电份额或导电百分数, 用tB 表示,tB无量纲。
def
tB
qB / q
qB—B种离子传输的电量 q—通过溶液的总电量
对于只含有一种正离子和一种负离子的电解质溶 液而言,正、负离子的迁移数分别为
由于溶液中导电物质的量已给定为1mol,所以,当浓度降低 时,粒子之间相互作用减弱,正、负离子迁移速率加快,溶液的 摩尔电导率必定升高。
物理化学电解质溶液

温度、浓度、同离子效应等。
02
电解质溶液的离子平衡
离子平衡的概念
离子平衡是指电解质溶液中正负离子浓度之间达 到相对稳定的状态。
在离子平衡状态下,正负离子的迁移速率相等, 溶液中不存在宏观电流。
离子平衡是动态平衡,当外界条件改变时,平衡 状态会发生改变。
离子平衡的建立
电解质溶解在水中后,正负离 子会受到水分子偶极的吸引,
02
电导率的计算公式为:K=σS/L ,其中K为电导率,σ为电导, S为横截面积,L为长度。
03
电导率的大小反映了电解质溶 液中离子迁移的速率和数量, 是电解质溶液的重要物理常数 之一。
电导率与浓度的关系
随着电解质浓度的增加,离子浓度也相应增加,导致电导 率增大。
在一定浓度范围内,电导率与浓度的关系呈线性关系,可 以用Arrhenius公式表示:K=K0exp(-Ea/RT),其中K0为 常数,Ea为活化能,R为气体常数,T为绝对温度。
202X-12-30
物理化学电解质溶液
汇报人:
目 录
• 电解质溶液的基本概念 • 电解质溶液的离子平衡 • 电解质溶液的导电性 • 电解质溶液的酸碱反应 • 电解质溶液的电化学性质
01
电解质溶液的基本概念
电解质的定义
电解质
在水溶液或熔融状态下能够导电 的化合物。
导电原理
电解质在水溶液中能够电离出自 由移动的离子,这些离子在电场 作用下定向移动,形成电流,使 电解质溶液具有导电性。
02
酸碱反应速率常数的大小反映了反应的快慢程度, 可以通过实验测定或计算得出。
03
酸碱反应的速率与浓度、温度等因素有关,可以通 过改变这些因素来调控反应速率。
南京大学《物理化学》考试-第七章-电解质溶液

第七章电解质溶液物化试卷(一)1. 离子电迁移率的单位可以表示成:(A) m·s-1 (B) m·s-1·V-1(C) m2·s-1·V-1 (D) s-12.水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D)离子水化半径小3.电解质溶液中离子迁移数 (t i) 与离子淌度 (U i) 成正比。
当温度与溶液浓度一定时,离子淌度是一定的,则25℃时,0.1 mol·dm-3 NaOH 中 Na+的迁移数 t1 与0.1mol·dm-3 NaCl 溶液中 Na+ 的迁移数t2,两者之间的关系为:(A) 相等(B) t1> t2(C) t1< t2 (D) 大小无法比较4.在 Hittorff 法测迁移数的实验中,用 Ag 电极电解AgNO3溶液,测出在阳极部AgNO3的浓度增加了 x mol,而串联在电路中的 Ag 库仑计上有 y mol 的 Ag 析出, 则Ag+离子迁移数为:(A) x/y (B) y/x (C) (x-y)/x (D) (y-x)/y5.298 K时,无限稀释的 NH4Cl水溶液中正离子迁移数t+= 0.491。
已知Λm(NH4Cl) = 0.0150 S·m2·mol-1 ,则:(A)λm(Cl-) = 0.00764 S·m2·mol-1(B) λm(NH4+) = 0.00764 S·m2·mol-1(C) 淌度 U(Cl-) = 737 m2·s-1·V-1(D) 淌度 U(Cl-) = 7.92×10-8 m2·s-1·V-16.用同一电导池分别测定浓度为 0.01 mol/kg和 0.1 mol/kg的两个电解质溶液,其电阻分别为 1000 W 和 500 W,则它们依次的摩尔电导率之比为:(A) 1 : 5 (B) 5 : 1 (C) 10 : 5 (D) 5 : 107. CaCl2 摩尔电导率与其离子的摩尔电导率的关系是:(A) Λ∞(CaCl2) = λm(Ca2+) + λm(Cl-)(B)Λ∞(CaCl2) = 1/2 λm(Ca2+) + λm(Cl-)(C)Λ∞(CaCl2) = λm(Ca2+) + 2λm(Cl-)(D)Λ∞(CaCl2) = 2 [λm(Ca2+) +λm(Cl-)]8. 在10 cm3 浓度为1 mol·dm-3 的KOH溶液中加入10 cm3水,其电导率将:(A) 增加(B) 减小(C) 不变(D) 不能确定9. 按国标(GB),如下单位不正确的是:(A) 摩尔电导率:S·m-1·mol-1(B) 离子摩尔电导率:S·m2·mol-1(C) 电导: S(D) 电导率:S·m-110. 电解质溶液的电导率k≡j/E =∑B│z B│F r B c B/E,式中z B、c B代表B种离子的电荷数及浓度。
物理化学答案——第七章-电化学

第七章 电化学(一)基本公式和内容提要1 Faraday (法拉第)定律定义:当电流通过电解质溶液时,通过每个电极的电量与发生在该电极上电极反应的物质的量成正比。
Q = nzF2 离子迁移数定义:每种离子所传输的电量在通过溶液的总电量中所占的分数,以t 表示 Q r t Q r r ++++-==+, Q r t Qr r ---+-==+3 电导G ,电导率κ,摩尔电导率m Λ1I G RU -==1κρ=, A G lκ=m m V cκκΛ== 1c e l ll K R R Aκρ===其中,cell l K A=为电导池常数,c 为电解质的浓度,单位是mol/m 34 离子独立运动定律m ∞Λ = v+()m A λ∞+ + v-()m B λ∞-对于强电解质,在浓度较低的范围内,有下列经验关系(科尔劳乌施经验关系):(1m m β∞Λ=Λ-对于弱电解质: m m α∞Λ=Λ (其中,α为解离度)5 离子平均活度a ±和离子平均活度系数γ±电解质的活度:(/)v v v va a a a m m θγ+-+-±±±===其中,1/()v v v γγγ+-±+-= , 1/()v v vm m m +-±+-=6 德拜-休克尔极限公式ln Az z γ±+-=-式中I 为溶液离子强度212i iI m z =∑;在298 K 的水溶液中,11221.172kg molA -=,上式适用于10.01m ol kg I -≤ 的稀溶液。
7 可逆电池热力学r m G n E Fθθ∆=- (只做电功) r mG nEF ∆=-(只做电功)ln R T E K nFθθ=()()r mr m p pG ES nF T T∂∆∂∆=-=∂∂式中,()p E T∂∂是电池电动势随温度的变化率,称为电池电动势的温度系数。
物理化学第七章课后答案完整版

第七章电化学用铂电极电解溶液。
通过的电流为20 A,经过15 min后,问:(1)在阴极上能析出多少质量的(2) 在的27 C,100 kPa下的解:电极反应为电极反应的反应进度为因此:在电路中串联着两个电量计,一为氢电量计,另一为银电量计。
当电路中通电1 h后,在氢电量计中收集到19 C、kPa的;在银电量计中沉积。
用两个电量计的数据计算电路中通过的电流为多少。
解:两个电量计的阴极反应分别为电量计中电极反应的反应进度为对银电量计对氢电量计用银电极电解溶液。
通电一定时间后,测知在阴极上析出的,并知阴极区溶液中的总量减少了。
求溶液中的和。
解:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阴极区溶液中的总量的改变等于阴极析出银的量与从阳极迁移来的银的量之差:用银电极电解水溶液。
电解前每溶液中含。
阳极溶解下来的银与溶液中的反应生成,其反应可表示为总反应为通电一定时间后,测得银电量计中沉积了,并测知阳极区溶液重,其中含。
试计算溶液中的和。
解:先计算是方便的。
注意到电解前后阳极区中水的量不变,量的改变为该量由两部分组成(1)与阳极溶解的生成,(2)从阴极迁移到阳极用铜电极电解水溶液。
电解前每溶液中含。
通电一定时间后,测得银电量计中析出,并测知阳极区溶液重,其中含。
试计算溶液中的和。
解:同。
电解前后量的改变从铜电极溶解的的量为从阳极区迁移出去的的量为因此,在一个细管中,于的溶液的上面放入的溶液,使它们之间有一个明显的界面。
令的电流直上而下通过该管,界面不断向下移动,并且一直是很清晰的。
以后,界面在管内向下移动的距离相当于的溶液在管中所占的长度。
计算在实验温度25 C下,溶液中的和。
解:此为用界面移动法测量离子迁移数已知25 C时溶液的电导率为。
一电导池中充以此溶液,在25 C时测得其电阻为。
在同一电导池中装入同样体积的质量浓度为的溶液,测得电阻为。
计算(1)电导池系数;(2)溶液的电导率;(3)溶液的摩尔电导率。
物理化学南京大学电解质溶液
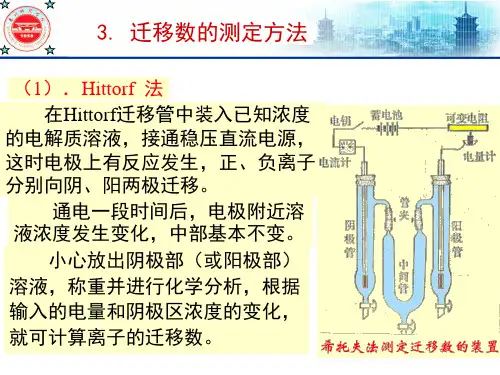
(1).Hittorf 法 在Hittorf迁移管中装入已知浓度
的电解质溶液,接通稳压直流电源, 这时电极上有反应发生,正、负离子 分别向阴、阳两极迁移。
通电一段时间后,电极附近溶 液浓度发生变化,中部基本不变。
小心放出阴极部(或阳极部) 溶液,称重并进行化学分析,根据 输入的电量和阴极区浓度的变化, 就可计算离子的迁移数。
n(终) 1.109 g/79.75 g mol1 1.3906102 mol
阴极上Cu2+ 还原,使 Cu2+ 浓度下降
Cu2+ 迁往阴极,迁移使阴极部 Cu2+ 增加,
n(终) n(始) n(迁) n(电)
求得 n(迁) 1.424104 mol
t(Cu2+ )
n(迁) n(电)
0.38
zcVF zcVF
Q总
I.t
见13页的例题。
§7.3 电 导
电导、电导率、摩尔电导率 电导的测定 电导率、摩尔电导率与浓度的关系 离子独立移动定律 几个有用的关系式 电导测定的一些应用
§7.3 电 导
1.电导、电导率、摩尔电导率(electric condutance) 电导是电阻的倒数,单位为 1 或 S (西门子)。
例题2:在Hittorf 迁移管中,用Cu电极电解已知浓度的 CuSO4溶液。通电一定时间后,串联在电路中的银库仑 计阴极上有 0.0405 g Ag(s) 析出。阴极部溶液质量为 36.434 g ,据分析知,在通电前其中含 CuSO4 1.1276 g , 通电后含 CuSO41.109 g 。
n(始) 1.1276 g/159.62 g mol1 7.0643103 mol
物理化学南京大学07章电解质溶液
(1)基本概念
研究对 象 电化学用途
两类导 体 正极、负极
阴极、阳 极 原电池
电解池
电流效 率
上一内容 下一内容 回主目录
(2)法拉第定律
定律的文字表示 法拉第常数 定律的数学式 粒子的基本单元
例题
返回
2019/11/11
电化学研究对象
电化学主要是研究电能和化学能之间的 相互转化及转化过程中有关规律的科学。
阳离子迁向阴极
C a tio n C a th o d e
上一内容 下一内容 回主目录
返回
2019/11/11
原电池(galvanic cell)
Zn电极:
Zn(S)→Zn2++2e发生氧化作用,是阳极。电 子由Zn极流向Cu极,Zn极电 势低,是负极。
Cu电极:
Cu2++2e-→ Cu(S) 发生还原作用,是阴极。电 流由Cu极流向Zn极,Cu极电 势高,是正极。
⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比。
上一内容 下一内容 回主目录
返回
2019/11/11
法拉第定律的数学表达式
MzzeM Az- zeA
取电子的得失数为 z,通入的电量为 Q,则电极 上发生反应的物质的量 n 为:
上一内容 下一内容 回主目录
返回
2019/11/11
法拉第定律的意义
⒈ 是电化学上最早的定量的基本定律,揭示了 通入的电量与析出物质之间的定量关系。 ⒉ 该定律在任何温度、任何压力下均可以使用。 ⒊ 该定律的使用没有什么限制条件。
上一内容 下一内容 回主目录
分析化学《电解质溶液》7-4
§7.3 电 导
(2)测定难溶盐的溶解度 ①难溶盐饱和溶液的浓度极稀,可认为Λ m (盐) ≈ Λ m∞ (盐) Λ ∞ m (盐)的值可从离子的无限稀释摩尔电导率的数据表中得 到。 ②难溶盐的饱和溶液本身的电导率很低,这时水的电导率 就不能忽略,所以:
(难溶盐) (溶液) (H O)
解: I=1/2[0.3×3×12+0.3×32)=1.8
离子平均活度系数与离子强度的关系符合下列经 验关系(在稀溶液中):
ln γ
±
=-Aˊ I
3.强电解质溶液的离子互吸理论
(1)离子分模型及德拜—休克尔极限公式 德拜—休克尔(Debye— Hü ckel) 在1923年提 出了强电解质溶液理论:认为强电解质在浓度很低时 是完全电离的,并且认为强电解质与理想溶液的偏差 主要是由离子之间存在静电引力所引起的。这一理论 就称为离子互吸理论。 从离子互吸理论的观点出发,德拜和休克尔提出 了一个能够反映离子在溶液中存在状态及其行为的离 子氛模型。
mB m
但对于电解质溶液来说, 电解质的整体活度与浓 度不具有上述关系,但 对正负离子来说,却仍 然符合这种形式。
当溶液很稀,可看作是理想 溶液, B,m 1 ,则:
a B,m mB m
m a m
1.平均活度和平均活度系数
电解质溶液的化学势表达式:
HCl(aHCl ) H+ (aH+ ) Cl (aCl )
B 0.3310 (mol kg) 2 m
10
1
1
1
1 aB 1(mol kg-1) 2
则
lg
A | z z | I 1 I / m
3.强电解质溶液的离子互吸理论
物理化学练习题与答案
物理化学练习题与答案第七章电解质溶液一、选择题1.用同一电导池分别测定浓度为0.01 mol·kg-1和0.1 mol·kg-1的两个电解质溶液,其电阻分别为1000 Ω和500 Ω,则它们依次的摩尔电导率之比为( B )(A) 1 : 5(B) 5 : 1(C) 10 : 5(D) 5 : 102. 298 K时,0.005 mol·kg-1的KCl 和0.005 mol·kg-1的NaAc 溶液的离子平均活度系数分别为γ±,1和γ±,2,则有( A )(A) γ±,1= γ±,2(B) γ±,1>γ±,2(C) γ±,1<γ±,2(D) γ±,1≥γ±,23. 在HAc解离常数测定的实验中,总是应用惠斯顿电桥。
作为电桥平衡点的指零仪器,结合本实验,不能选用的是:(D )(A) 耳机(B) 电导率仪(C) 阴极射线示波器(D) 直流桥流计4. 1-1型电解质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于:(C )(A) (A) 强电解质(B) (B) 弱电解质(C) (C) 无限稀释电解质溶液(D) (D) 摩尔浓度为1的溶液二、填空题( 共7题14分)11. 2 分(3892)3892CaCl2摩尔电导率与其离子的摩尔电导率的关系是:_____________________________。
12. 2 分(4069)40690.3 mol·kg-1Na2HPO4水溶液的离子强度是_____0.9_____________ mol·kg-1。
13. 2 分(4070)4070浓度为0.1 mol·kg-1的MgCl2水溶液,其离子强度为______0.3_____________ mol·kg-1。
南京大学物理化学选择题答案完整版讲解
第一章热力学第一定律及其应用物化试卷(一)1.物质的量为n的纯理想气体,该气体在如下的哪一组物理量确定之后,其它状态函数方有定值。
( )(A) p (B) V (C) T,U (D) T, p2. 下述说法哪一个正确? ( )(A) 热是体系中微观粒子平均平动能的量度 (B) 温度是体系所储存热量的量度(C) 温度是体系中微观粒子平均能量的量度 (D) 温度是体系中微观粒子平均平动能的量度3. 有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此时筒内温度将: ( )(A)不变 (B)升高 (C)降低 (D)无法判定4. 1 mol 373 K,标准压力下的水经下列两个不同过程变成373 K,标准压力下的水气, (1) 等温等压可逆蒸发, (2) 真空蒸发这两个过程中功和热的关系为: ( )(A) |W1|> |W2| Q1> Q2 (B)|W1|< |W2| Q1< Q2(C) |W1|= |W2| Q1= Q2 (D)|W1|> |W2| Q1< Q25. 恒容下,一定量的理想气体,当温度升高时热力学能将:( )(A)降低 (B)增加 (C)不变 (D)增加、减少不能确定6. 在体系温度恒定的变化中,体系与环境之间: ( )(A) 一定产生热交换 (B) 一定不产生热交换(C) 不一定产生热交换 (D) 温度恒定与热交换无关7. 一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机拖动的列车运行的速度:( )(A) 较快 (B) 较慢 (C) 一样 (D) 不一定8. 始态完全相同(p1,V1,T1)的一个理想气体体系,和另一个范德华气体体系,分别进行绝热恒外压(p0)膨胀。
当膨胀相同体积之后,下述哪一种说法正确?( )(A) 范德华气体的热力学能减少量比理想气体多 (B) 范德华气体的终态温度比理想气体低(C) 范德华气体所做的功比理想气体少 (D) 范德华气体的焓变与理想气体的焓变相等9.ΔH =Qp , 此式适用于下列哪个过程:( )(A) 理想气体从106 Pa反抗恒外压105 Pa膨胀到105 Pa (B) 0℃ , 105 Pa 下冰融化成水(C) 电解 CuSO4水溶液 (D) 气体从(298 K, 105 Pa)可逆变化到(373 K, 104 Pa) 110.在100℃和25℃之间工作的热机,其最大效率为: ( )(A) 100 % (B) 75 % (C) 25 % (D) 20 %11.对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条 (B) 二条 (C) 三条 (D) 三条以上12.某理想气体的γ =Cp/Cv =1.40,则该气体为几原子分子气体? ( )(A) 单原子分子气体 (B) 双原子分子气体(C) 三原子分子气体 (D) 四原子分子气体13.实际气体绝热恒外压膨胀时,其温度将: ( )(A) 升高 (B) 降低 (C) 不变 (D) 不确定14.当以5 mol H2气与4 mol Cl2气混合,最后生成2 mol HCl气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章电解质溶液物化试卷(一)1. 离子电迁移率的单位可以表示成:(A) m·s-1 (B) m·s-1·V-1(C) m2·s-1·V-1 (D) s-12.水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D)离子水化半径小3.电解质溶液中离子迁移数 (t i) 与离子淌度 (U i) 成正比。
当温度与溶液浓度一定时,离子淌度是一定的,则25℃时,0.1 mol·dm-3 NaOH 中 Na+的迁移数 t1 与0.1mol·dm-3 NaCl 溶液中 Na+ 的迁移数t2,两者之间的关系为:(A) 相等(B) t1> t2(C) t1< t2 (D) 大小无法比较4.在 Hittorff 法测迁移数的实验中,用 Ag 电极电解AgNO3溶液,测出在阳极部AgNO3的浓度增加了 x mol,而串联在电路中的 Ag 库仑计上有 y mol 的 Ag 析出, 则Ag+离子迁移数为:(A) x/y (B) y/x (C) (x-y)/x (D) (y-x)/y5.298 K时,无限稀释的 NH4Cl水溶液中正离子迁移数t+= 0.491。
已知Λm(NH4Cl) = 0.0150 S·m2·mol-1 ,则:(A)λm(Cl-) = 0.00764 S·m2·mol-1(B) λm(NH4+) = 0.00764 S·m2·mol-1(C) 淌度 U(Cl-) = 737 m2·s-1·V-1(D) 淌度 U(Cl-) = 7.92×10-8 m2·s-1·V-16.用同一电导池分别测定浓度为 0.01 mol/kg和 0.1 mol/kg的两个电解质溶液,其电阻分别为 1000 W 和 500 W,则它们依次的摩尔电导率之比为:(A) 1 : 5 (B) 5 : 1 (C) 10 : 5 (D) 5 : 107. CaCl2 摩尔电导率与其离子的摩尔电导率的关系是:(A) Λ∞(CaCl2) = λm(Ca2+) + λm(Cl-)(B)Λ∞(CaCl2) = 1/2 λm(Ca2+) + λm(Cl-)(C)Λ∞(CaCl2) = λm(Ca2+) + 2λm(Cl-)(D)Λ∞(CaCl2) = 2 [λm(Ca2+) +λm(Cl-)]8. 在10 cm3 浓度为1 mol·dm-3 的KOH溶液中加入10 cm3水,其电导率将:(A) 增加(B) 减小(C) 不变(D) 不能确定9. 按国标(GB),如下单位不正确的是:(A) 摩尔电导率:S·m-1·mol-1(B) 离子摩尔电导率:S·m2·mol-1(C) 电导: S(D) 电导率:S·m-110. 电解质溶液的电导率k≡j/E =∑B│z B│F r B c B/E,式中z B、c B代表B种离子的电荷数及浓度。
影响k值的下述分析哪个对?(A) 迁移速率r B愈大,则 k愈大(B) 电场强度 E 愈大,则 k愈小(C) 电流密度 j 愈大,则 k愈大(D) r B、E 及 j 的大小对 k值无影响11. 下列电解质水溶液中摩尔电导率最大的是:(A) 0.001 mol/kg HAc (B) 0.001 mol/kg KCl(C) 0.001 mol/kg KOH (D) 0.001 mol/kg HCl12. NaCl 稀溶液的摩尔电导率λm与 Na+、 Cl-离子的淌度(Ui)之间的关系为:(A)λm =(U+)+(U-)(B)λm =(U+/F)+(U-/F)(C)λm=(U+)F +(U-)F(D) λm= 2 (U+ +U-)13. 浓度均为 m 的不同价型电解质,设 1-3 价型电解质的离子强度为I1,2-2 价型电解质的离子强度为I2,则(A) I1 < I2 (B) I1 = I2(C) I1 = 1.5I2 (D) 无法比较 I1和I2大小14. 下列电解质溶液中,离子平均活度系数最大的是:(A) 0.01 mol·kg-1 NaCl (B) 0.01 mol·kg-1 CaCl2(C) 0.01 mol·kg-1 LaCl3 (D) 0.01 mol·kg-1 CuSO415. 0.1 mol·kg-1 氯化钡水溶液的离子强度为:(A) 0.1 mol·kg-1 (B) 0.15 mol·k g-1(C) 0.2 mol·kg-1 (D) 0.3 mol·kg-116. 浓度为0.1 mol·kg-1 的MgCl2 水溶液,其离子强度为:(A) 0.1 mol·kg-1 (B) 0.15 mol·kg-1(C) 0.2 mol·kg-1 (D) 0.3 mol·kg-117. 质量摩尔浓度为 m 的Na3PO4溶液, 平均活度系数为γ±,则电解质的活度为:(A) a(B)= 4 (γ±)(B) a(B)= 4(γ±)(C) a(B)= 27 (γ±)(D) a(B) = 27 (γ±)18. 0.001 mol/kg K2SO4和 0.003 mol/kg 的Na2SO4 溶液在 298 K 时的离子强度是:(A) 0.001 mol/kg (B) 0.003 mol/kg(C) 0.002 mol/kg (D) 0.012 mol/kg19. 在饱和 AgCl溶液中加入NaNO3,AgCl 的饱和浓度将:(A) 变大(B) 变小(C) 不变(D) 无法判定20. 298 K时, 0.005 mol/kg 的 KCl和 0.005 mol/kg 的NaAc溶液的离子平均活度系数分别为γ(±,1)和γ(±,2), 则有:(A) γ(±,1)= γ(±,2)(B) γ(±,1)>γ(±,2)(C) γ(±,1)<γ(±,2)(D)γ(±,1)≥ γ(±,2)第七章电解质溶液物化试卷(二)1. z(B)、r(B)及 c(B)分别是混合电解质溶液中 B 种离子的电荷数、迁移速率及浓度,对影响 B 离子迁移数 (t B) 的下述说法哪个对?(A) │z(B)│ 愈大, t B愈大(B) │z(B)│、r(B)愈大,t B愈大(C) │z(B)│、r(B)、c(B)愈大,t B愈大(D) A、B、C 均未说完全2.在一定温度和浓度的水溶液中,带相同电荷数的 Li+、Na+、K+、Rb+、… , 它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于:(A) 离子淌度依次减小(B) 离子的水化作用依次减弱(C) 离子的迁移数依次减小(D) 电场强度的作用依次减弱3.在 Hittorff 法测定迁移数实验中,用 Pt 电极电解AgNO3溶液,在 100 g 阳极部的溶液中,含 Ag+的物质的量在反应前后分别为 a 和 b mol,在串联的铜库仑计中有c g 铜析出, 则 Ag+的迁移数计算式为( Mr(Cu) = 63.546 ) :(A) [ (a - b)/c ]×63.6(B) [ c - (a - b) ]/31.8(C) 31.8 (a - b)/c(D) 31.8(b - a)/c4. 298K,当 H2SO4溶液的浓度从 0.01 mol/kg 增加到 0.1 mol/kg时,其电导率 k 和摩尔电导率Λm将:(A) k减小 , Λm增加(B) k增加 ,Λm增加(C) k减小 , Λm减小(D) k增加 , Λm减小5.在其它条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而:(A) 增大(B) 减小(C) 先增后减(D) 不变6.LiCl 的无限稀释摩尔电导率为0.011503 S·m2·mol-1,在 298 K 时,测得LiCl 稀溶液中 Li+的迁移数为 0.3364,则Cl-离子的摩尔电导率Λm(Cl-)为:(A) 0.007633 S·m2·mol-1(B) 0.011303 S·m2·mol-1(C) 0.003870 S·m2·mol-1(D) 7633 S·m2·mol-17.欲要比较各种电解质的导电能力的大小,更为合理应为:(A) 电解质的电导率值(B) 电解质的摩尔电导率值(C) 电解质的电导值(D) 电解质的极限摩尔电导率值8.在10 cm3 浓度为1 mol·dm-3 的KOH溶液中加入10 cm3水,其摩尔电导率将:(A) 增加(B) 减小(C) 不变(D) 不能确定9.25℃时,Λm(LiI)、λm(H+)、Λm(LiCl) 的值分别为0.0117,0.035 和0.0115 S·m2·mol-1。
LiCl 中的t+为 0.34,当假设其中的电解质完全电离时, HI 中的t+为:(A) 0.18 (B) 0.82 (C) 0.34 (D) 0.6610.有下列溶液,其中摩尔电导率最大的是:(A) 0.001 mol/kg KCl(B) 0.001 mol/kg KOH(C) 0.001 mol/kg HCl(D) 1.0 mol/kg KCl11. 有下列溶液, 其中摩尔电导率最小的是:(A) 0.001 mol/kg NaCl(B) 0.001 mol/kg KOH(C) 0.001 mol/kg HCl(D) 1.0 mol/kg NaCl12. 浓度为1.0 mol·dm-3 的强电解质溶液,它的摩尔电导率数值近似于:(A) 与电导率相等(B) 是电导率的 1000倍(C) 是电导率的 0.001倍(D) 是电导率的 100倍13. 下列不同浓度的 NaCl 溶液中(浓度单位mol·dm-3), 哪个溶液的电导率最大?(A) 0.001 (B) 0.01 (C) 0.1 (D) 1.014. 1 mol/kg K4Fe(CN)6 溶液的离子强度为:(A) 10 mol/kg (B) 7 mol/kg(C) 4 mol/kg (D) 15 mol/kg15. Al2(SO4)3的化学势μ与和离子的化学势μ+ ,μ-的关系为:(A) μ =(μ+)+(μ-)(B) μ = 3(μ+)+ 2(μ-)(C) μ = 2(μ+)+ 3(μ-)(D)μ = (μ+)·(μ-)16. 电解质i在溶液中的离子平均活度系数为γi ( = γ±),下列判断γi大小的说法哪个正确?(A) γi ≤ 1 (B) γi ≥ 1(C) A、B 都有可能(D) γi恒小于 117. 某一强电解质M v+ X v-,则其平均活度a± 与活度a B之间的关系是:(A) a± = a(B)(B) a± = a(B)的平方(C) a± = a(B)的V次方(D) a± = a(B)的1/V次方18. AgCl在以下溶液中溶解度递增次序为:(a) 0.1mol·dm-3 NaNO3(b) 0.1mol·dm-3 NaCl(c) H2O (d) 0.1mol·dm-3Ca(NO3)2(e) 0.1mol·dm-3 NaBr(A) (a) < (b) < (c) < (d) < (e)(B) (b) < (c) < (a) < (d) < (e)(C) (c) < (a) < (b) < (e) < (d)(D) (c) < (b) < (a) < (e) < (d)19. 有 4 个浓度都是 0.01 mol/kg 的电解质溶液,其中平均活度系数最大的是:(A) KCl(B) CaCl2 (C) Na2SO4 (D) AlCl320. 对于同一电解质的水溶液,当其浓度逐渐增加时,何种性质将随之增加?(A) 在稀溶液围的电导率(B) 摩尔电导率(C) 电解质的离子平均活度系数(D) 离子淌度。
