南京大学《物理化学》考试 第七章 电解质溶液
物理化学第7章 电化学参考答案

第7章 电化学 习题解答1. 将两个银电极插入AgNO 3溶液,通以0.2 A 电流共30 min ,试求阴极上析出Ag 的质量。
解:根据BItM m zF=得 Ag Ag 0.23060107.87g 0.4025 g 196500ItM m zF⨯⨯⨯===⨯2. 以1930 C 的电量通过CuSO 4溶液,在阴极有0.009 mol 的Cu 沉积出来,问阴极产生的H 2的物质的量为多少? 解:电极反应方程式为: 阴极 2Cu2e Cu(s)+-+→阳极 222H O(l)H (g)2OH 2e --→++在阴极析出0.009 mol 的Cu ,通过的电荷量为:Cu Q (0.009296500) C 1737 C nzF ==⨯⨯=根据法拉第定律,析出H 2的物质的量为2H Cu 19301737mol 0.001 mol 296500Q Q Q n zFzF --====⨯ 3. 电解食盐水溶液制取NaOH ,通电一段时间后,得到含NaOH 1 mol/dm 3的溶液0.6 dm 3,同时在与之串联的铜库仑计上析出30.4 g 铜,试问制备NaOH 的电流效率是多少? 解:根据铜库仑计中析出Cu(s)的质量可以计算通过的电荷量。
Cu Cu 30.4mol 0.957 mol 1163.52m n M ===⨯电 理论上NaOH 的产量也应该是0.957 mol 。
而实际所得NaOH 的产量为(1.0×0.6) mol = 0.6 mol所以电流效率为实际产量与理论产量之比,即0.6100%62.7%0.957η=⨯=4. 如果在10×10 cm 2的薄铜片两面镀上0.005 cm 厚的Ni 层[镀液用Ni(NO 3)2],假定镀层能均匀分布,用 2.0 A 的电流强度得到上述厚度的镍层时需通电多长时间?设电流效率为96.0%。
已知金属的密度为8.9 g/cm 3,Ni(s)的摩尔质量为58.69 g/mol 。
物理化学电解质溶液PPT课件
总 反 应 :12O2H2H2O
6
可编辑课件PPT
负极 正极
正极
负极
7
可编辑课件PPT
原电池:化学能转化为电能的装置; 电解池:电能转化为化学能的装置。
正极(positive electrode)——电势高的电极 负极(negative electrode)——电势低的电极
34
可编辑课件PPT
4.求难溶盐的溶解度和溶度积★
难溶盐本身的电导率很低,这时水的电导率就不能忽略
κH溶2O液————难所溶用盐水饱的和电溶导液率的。电导率;
盐 溶 液H2O
Λm
c
Λm
35
c
盐
Λ m ,盐
可编辑课件PPT
步骤:
1.用已知电导率的高纯水配制难溶盐的饱和溶液; 2.测定此饱和溶液的电导率,从中扣去水的电导率后即为盐的 电导率; 3.用难溶液盐的 Λm∞ 代替 Λm 计算难溶盐的溶解度 c; 4.求 KSp 。
14
q V 1 q V
可编辑课件PPT
通入4mol电量
迁移过程:q+ + │q-│=q
15
q V 3 q V
可编辑课件PPT
定义:电解质溶液中各种离子的导电份额或导电百分数, 用tB 表示,tB无量纲。
def
tB
qB / q
qB—B种离子传输的电量 q—通过溶液的总电量
对于只含有一种正离子和一种负离子的电解质溶 液而言,正、负离子的迁移数分别为
由于溶液中导电物质的量已给定为1mol,所以,当浓度降低 时,粒子之间相互作用减弱,正、负离子迁移速率加快,溶液的 摩尔电导率必定升高。
南京大学《物理化学》考试-第七章-电解质溶液

第七章电解质溶液物化试卷(一)1. 离子电迁移率的单位可以表示成:(A) m·s-1 (B) m·s-1·V-1(C) m2·s-1·V-1 (D) s-12.水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D)离子水化半径小3.电解质溶液中离子迁移数 (t i) 与离子淌度 (U i) 成正比。
当温度与溶液浓度一定时,离子淌度是一定的,则25℃时,0.1 mol·dm-3 NaOH 中 Na+的迁移数 t1 与0.1mol·dm-3 NaCl 溶液中 Na+ 的迁移数t2,两者之间的关系为:(A) 相等(B) t1> t2(C) t1< t2 (D) 大小无法比较4.在 Hittorff 法测迁移数的实验中,用 Ag 电极电解AgNO3溶液,测出在阳极部AgNO3的浓度增加了 x mol,而串联在电路中的 Ag 库仑计上有 y mol 的 Ag 析出, 则Ag+离子迁移数为:(A) x/y (B) y/x (C) (x-y)/x (D) (y-x)/y5.298 K时,无限稀释的 NH4Cl水溶液中正离子迁移数t+= 0.491。
已知Λm(NH4Cl) = 0.0150 S·m2·mol-1 ,则:(A)λm(Cl-) = 0.00764 S·m2·mol-1(B) λm(NH4+) = 0.00764 S·m2·mol-1(C) 淌度 U(Cl-) = 737 m2·s-1·V-1(D) 淌度 U(Cl-) = 7.92×10-8 m2·s-1·V-16.用同一电导池分别测定浓度为 0.01 mol/kg和 0.1 mol/kg的两个电解质溶液,其电阻分别为 1000 W 和 500 W,则它们依次的摩尔电导率之比为:(A) 1 : 5 (B) 5 : 1 (C) 10 : 5 (D) 5 : 107. CaCl2 摩尔电导率与其离子的摩尔电导率的关系是:(A) Λ∞(CaCl2) = λm(Ca2+) + λm(Cl-)(B)Λ∞(CaCl2) = 1/2 λm(Ca2+) + λm(Cl-)(C)Λ∞(CaCl2) = λm(Ca2+) + 2λm(Cl-)(D)Λ∞(CaCl2) = 2 [λm(Ca2+) +λm(Cl-)]8. 在10 cm3 浓度为1 mol·dm-3 的KOH溶液中加入10 cm3水,其电导率将:(A) 增加(B) 减小(C) 不变(D) 不能确定9. 按国标(GB),如下单位不正确的是:(A) 摩尔电导率:S·m-1·mol-1(B) 离子摩尔电导率:S·m2·mol-1(C) 电导: S(D) 电导率:S·m-110. 电解质溶液的电导率k≡j/E =∑B│z B│F r B c B/E,式中z B、c B代表B种离子的电荷数及浓度。
物理化学第七章课后答案完整版

饱和水溶液中 的浓度为
因此,
7.14已知25ØC时某碳酸水溶液的电导率为 ,配制此溶液的水的电导率为 。假定只考虑 的一级电离,且已知其解离常数 ,又25ØC无限稀释时离子的摩尔电导率为 , 。试计算此碳酸溶液的浓度。
解:由于只考虑一级电离,此处碳酸可看作一元酸,因此,
7.36将下列反应设计成原电池,并应用表7.7.1的数据计算25 ºC时电池反应的
解:(1)
(2)
(3)
7.37(1)应用表7.7.1的数据计算反应 在25 ºC时的平衡常
数 。
(2)将适量的银粉加入到浓度为 的 溶液中,计算平衡时Ag+的浓度(假设各离子的活度因子均等于1)。
解:(1)设计电池
(2)设平衡时Fe2+的浓度为x,则
解应,应用表7.7.1的数据计算25ØC时各电池的电动势及各电池反应的摩尔Gibbs函数变,并指明各电池反应能否自发进行。
解:(1)
,反应可自发进行。
(2)
,反应可自发进行。
7.26写出下列各电池的电池反应。应用表7.7.1的数据计算25ØC时各电池的电动势、各电池反应的摩尔Gibbs函数变及标准平衡常数,并指明的电池反应能否自发进行。
根据Nernst方程,
由于 ,该电池反应可以自发进行。
7.29应用表7.4.1的数据计算下列电池在25ØC时的电动势。
解:该电池为浓差电池,电池反应为
查表知,
7.30电池 在25ØC时电动势为 ,试计算HCl溶液中HCl的平均离子活度因子。
解:该电池的电池反应为
根据Nernst方程
7.31浓差电池 ,其中 ,已知在两液体接界处Cd2+离子的迁移数的平均值为 。
物理化学南京大学电解质溶液
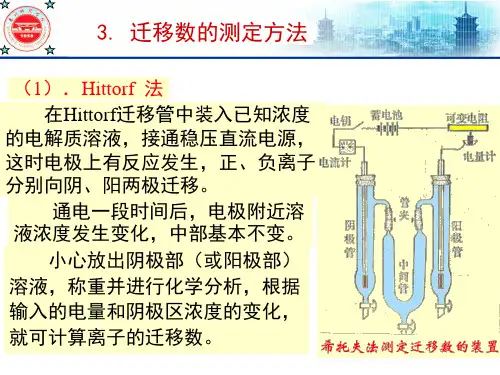
(1).Hittorf 法 在Hittorf迁移管中装入已知浓度
的电解质溶液,接通稳压直流电源, 这时电极上有反应发生,正、负离子 分别向阴、阳两极迁移。
通电一段时间后,电极附近溶 液浓度发生变化,中部基本不变。
小心放出阴极部(或阳极部) 溶液,称重并进行化学分析,根据 输入的电量和阴极区浓度的变化, 就可计算离子的迁移数。
n(终) 1.109 g/79.75 g mol1 1.3906102 mol
阴极上Cu2+ 还原,使 Cu2+ 浓度下降
Cu2+ 迁往阴极,迁移使阴极部 Cu2+ 增加,
n(终) n(始) n(迁) n(电)
求得 n(迁) 1.424104 mol
t(Cu2+ )
n(迁) n(电)
0.38
zcVF zcVF
Q总
I.t
见13页的例题。
§7.3 电 导
电导、电导率、摩尔电导率 电导的测定 电导率、摩尔电导率与浓度的关系 离子独立移动定律 几个有用的关系式 电导测定的一些应用
§7.3 电 导
1.电导、电导率、摩尔电导率(electric condutance) 电导是电阻的倒数,单位为 1 或 S (西门子)。
例题2:在Hittorf 迁移管中,用Cu电极电解已知浓度的 CuSO4溶液。通电一定时间后,串联在电路中的银库仑 计阴极上有 0.0405 g Ag(s) 析出。阴极部溶液质量为 36.434 g ,据分析知,在通电前其中含 CuSO4 1.1276 g , 通电后含 CuSO41.109 g 。
n(始) 1.1276 g/159.62 g mol1 7.0643103 mol
物理化学-第七章

料,溶剂的性质影响; 法拉第定律是实验归纳而得,但从电解质溶液的导电机理来看,法拉第 定律是必然结果; 对一个不同的电解质溶液,通过一个法拉第电量时,电极上就发生 1mol电子得失物质的反应,但不一定有1mol物质发生反应,与基本单元 的选取有关。
7.1
定 例题:通电于Au(NO3)3溶液,电流强度I=0.025A,析出Au的 导 质量为1.20 g,已知M(Au)=197.0 g· -1。 mol 律电电 求: ⑴ 通入电量Q; 机解 ⑵ 通电时间t; ⑶ 阳极上放出氧气的物质的量。
7.1
一、电化学的基本概念:
1、电化学: 2、电解池和原电池: 3、阴极和阳极: 4、正极和负极: 5、两类导体: 6、离子迁移方向:
定导 律电电 机解 理质 及溶 法液 拉的 第
7.1
两类导体
1. 第一类导体
又称电子导体,如金属、石墨、某些金属氧化物(如PbO2、 Fe3O4 )和碳化物(WC0)等。
一般离子电荷相同,离子半径↘, 离子电迁移率↗,但 r Li+ < r Na+ < r k+ 而u Li+ < u Na+ < u k+ 这主要是离子半径愈小,水化程度愈大, 水化离子半径r’ Li+ > r’ Na+ > r’ k+ 之故。
水溶液中H+、OH- 的电迁移率最大;
浓度↗,离子相互作用力↗,电迁移率↘;温度↗升高,溶液粘度 ↘,离子迁移阻力↘,电迁移率↗。
7.2
一、离子的电迁移现象:
r 1.设正、负离子迁移的速率相等, r ,则导电任务各分担2mol, 在假想的AA、BB平面上各有2mol正、负离子逆向通过。
江苏高考化学二轮复习专题七电解质溶液课件
6.难溶电解质的溶解平衡的判断 (1)正误判断,正确的打“√”,错误的打“×”
①为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀( √ ) ②Ksp越小,其溶解度越小( × ) ③Ksp大的容易向Ksp小的转化,但Ksp小的不能向Ksp大的转化( × )
④在0.1 mol·L-1的AlCl3溶液中滴加少量NaOH溶液,再滴加0.1 mol·L-1的FeCl3溶液, 其 现 象 为 先 产 生 白 色 沉 淀 , 后 白 色 沉 淀 转 化 成 红 褐 色 沉 淀 , 则 Ksp[Fe(OH)3] <
(3)外界条件对FeCl3溶液水解平衡的影响Fe3++3H2O Fe(OH)3+3H+ ΔH>0
体系变化 平衡移
条件
动方向
升温
向右
通HCl
向左
加H2O 加FeCl3固体
向右 向右
n(H+)
增多 增多 增多 增多
加NaHCO3
向右 减小
pH 水解程度
现象
减小 减小 增大 减小
增大
增大 减小 增大 减小
(2015·江苏,11B)
(3)25 ℃时,等体积、等浓度的硝酸与氨水混合后,溶液pH=7( × )
(2015·重庆理综,3B)
(4)常温下,pH为2的盐酸与等体积pH=12的氨水混合后所得溶液呈酸性( × )
1 2 3 4 5 6 7 8 9 10 11 12
(5)常温下,pH为2的盐酸由H2O电离出的c(H+)=1.0×10-12 mol·L-1( √ ) (6)同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7( × )
Ksp[Al(OH)3]( √) ⑤ 0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液c(Cl-)=c(Br-)( × )
XX大学《物理化学》第七章单元测试题及答案
第七章单元测试题专业___________姓名___________ 学号___________一、填空题。
在题中“____”处填上答案。
1、25℃时,0.1 mol·kg-1的BaCl2水溶液的γ±=0.496,则该溶液的平均离子活度=_____a±______。
2、一水溶液中有0.05 mol·kg−1的Na2SO4和0.05 mol·kg−1的CuSO4,则离子强度为_______ _。
3、300 K,101.325 kPa条件下,用5A直流电电解H2SO4水溶液,如欲制备1dm3O2(g),需通电的时间为______h。
4、电解电池的槽电压E(电解)与可逆电池的电动势E、阳极超电势ηa、阴极超电势ηc、电解液电阻引起的电势降IR之间的关系是__________________。
5、浓差电池 Ag|AgNO3溶液(b1)|| AgNO3溶液(b2)|Ag,其中b1>b2,则电池表示式的左边应为_________极。
(填正、负)二、是非题。
在题后括号内,正确的打“√”,错误的打“×”。
1、金属导体的电阻随温度升高而增大,电解质溶液的电阻随温度升高而减少。
是不是?()2、原电池的正极即为阳极,负极即为阴极。
是不是?( )3、电解池中阳极发生氧化反应,阴极发生还原反应。
是不是?( )4、在等温等压下进行的一般化学反应,ΔG<0,电化学反应的ΔG可小于零,也可大于零。
是不是?( )5、 ZnCl2 水溶液的质量摩尔浓度为b,其离子平均活度系数(系数)为γ±,则其离子平均活度a±=γ± b /b。
是不是?()6、用Λm对c作图外推的方法,可以求得HAc的无限稀释摩尔电导率。
是不是?()7、根据电池的电动势和电动势的温度系数求的的反应焓变ΔH,也就是电池工作时所吸收或放出的热量。
是不是?( )8、在一定电流密度下,氢在镀Pt黑的Pt电极上比在光亮的Pt电极上较易析出。
物理化学练习题与答案
第七章电解质溶液一、选择题1.用同一电导池分别测定浓度为0.01 mol·kg-1和0.1 mol·kg-1的两个电解质溶液,其电阻分别为1000 Ω和500 Ω,则它们依次的摩尔电导率之比为( B )(A) 1 : 5(B) 5 : 1(C) 10 : 5(D) 5 : 102. 298 K时,0.005 mol·kg-1的KCl 和0.005 mol·kg-1的NaAc 溶液的离子平均活度系数分别为γ±,1和γ±,2,则有( A )(A) γ±,1= γ±,2(B) γ±,1>γ±,2(C) γ±,1<γ±,2(D) γ±,1≥γ±,23. 在HAc解离常数测定的实验中,总是应用惠斯顿电桥。
作为电桥平衡点的指零仪器,结合本实验,不能选用的是:(D )(A) 耳机(B) 电导率仪(C) 阴极射线示波器(D) 直流桥流计4. 1-1型电解质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于:(C )(A) (A) 强电解质(B) (B) 弱电解质(C) (C) 无限稀释电解质溶液(D) (D) 摩尔浓度为1的溶液二、填空题( 共7题14分)11. 2 分(3892)3892CaCl2摩尔电导率与其离子的摩尔电导率的关系是:_____________________________。
12. 2 分(4069)40690.3 mol·kg-1Na2HPO4水溶液的离子强度是_____0.9_____________ mol·kg-1。
13. 2 分(4070)4070浓度为0.1 mol·kg-1的MgCl2水溶液,其离子强度为______0.3_____________ mol·kg-1。
14. 2 分(3822)3822有下列溶液:(A) 0.001 mol·kg-1 KCl(B) 0.001 mol·kg-1 KOH(C) 0.001 mol·kg-1 HCl(D) 1.0 mol·kg-1 KCl其中摩尔电导率最大的是( C );最小的是( D )。
南京大学《物理化学》每章典型例题讲解
第一章 热力学第一定律与热化学例题1 1mol 理想气体于27℃ 、101325Pa 状态下受某恒定外压恒温压缩到平衡,再由该状态恒容升温到97 ℃ ,则压力升到1013.25kPa 。
求整个过程的W 、Q 、△U 及△H 。
已知该气体的C V ,m 恒定为20.92J ∙mol -1 ∙K -1。
解题思路:需先利用理想气体状态方程计算有关状态: (T 1=27℃, p 1=101325Pa ,V 1)→(T 2=27℃, p 2=p 外=?,V 2=?)→(T 3=97℃, p 3=1013.25kPa ,V 3= V 2)例题2水在 -5℃ 的结冰过程为不可逆过程,计算时要利用0℃ 结冰的可逆相变过程,即H 2O (l ,1 mol ,-5℃ ,θp )(s ,1 mol ,-5℃,θp )↓△H 2 ↑△H 4H 2O (l ,1 mol , 0℃,θp ) O (s ,1 mol ,0℃,θp )∴ △H 1=△H 2+△H 3+△H 4例题3 在 298.15K 时,使 5.27 克的甲醇(摩尔质量为32克) 在弹式量热计中恒容燃烧,放出 119.50kJ 的热量。
忽略压力对焓的影响。
(1) 计算甲醇的标准燃烧焓 θm c H ∆。
(2) 已知298.15K 时 H 2O(l) 和CO 2(g)的标准摩尔生成焓分别为-285.83 kJ·mol -1、-393.51 kJ·mol -1,计算CH 3OH(l)的θm f H ∆。
(3) 如果甲醇的标准蒸发焓为 35.27kJ·mol -1,计算CH 3OH(g) 的θm f H ∆。
解:(1) 甲醇燃烧反应:CH 3OH(l) +23O 2(g) → CO 2(g) + 2H 2O(l) Q V =θm c U ∆=-119.50 kJ/(5.27/32)mol =-725.62 kJ·mol -1Q p =θm c H ∆=θm c U ∆+∑RT v)g (B= (-725.62-0.5×8.3145×298.15×10-3)kJ·.mol -1 =-726.86 kJ·mol-1(2) θm c H ∆=θm f H ∆(CO 2) + 2θm f H ∆(H 2O )-θm f H ∆ [CH 3OH(l)] θm f H ∆[CH 3OH (l)] =θm f H ∆ (CO 2) + 2θm f H ∆ (H 2O )-θm c H ∆= [-393.51+2×(-285.83)-(-726.86) ] kJ·mol -1=-238.31 kJ·mol -1(3) CH 3OH (l) →CH 3OH (g) ,θm vap ΔH= 35.27 kJ·.mol -1θm f H ∆[CH 3OH (g)] =θm f H ∆[CH 3OH (l)] +θmv ap H ∆= (-38.31+35.27)kJ·.mol-1=-203.04 kJ·mol -1第二章 热力学第二定律例1. 1mol 理想气体从300K ,100kPa 下等压加热到600K ,求此过程的Q 、W 、U 、H 、S 、G 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章电解质溶液物化试卷(一)1. 离子电迁移率的单位可以表示成:(A) m·s-1 (B) m·s-1·V-1(C) m2·s-1·V-1 (D) s-12.水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D)离子水化半径小3.电解质溶液中离子迁移数 (t i) 与离子淌度 (U i) 成正比。
当温度与溶液浓度一定时,离子淌度是一定的,则25℃时,0.1 mol·dm-3 NaOH 中 Na+的迁移数 t1 与0.1mol·dm-3 NaCl 溶液中 Na+ 的迁移数t2,两者之间的关系为:(A) 相等(B) t1> t2(C) t1< t2 (D) 大小无法比较4.在 Hittorff 法测迁移数的实验中,用 Ag 电极电解AgNO3溶液,测出在阳极部AgNO3的浓度增加了 x mol,而串联在电路中的 Ag 库仑计上有 y mol 的 Ag 析出, 则Ag+离子迁移数为:(A) x/y (B) y/x (C) (x-y)/x (D) (y-x)/y5.298 K时,无限稀释的 NH4Cl水溶液中正离子迁移数t+= 0.491。
已知Λm(NH4Cl) = 0.0150 S·m2·mol-1 ,则:(A)λm(Cl-) = 0.00764 S·m2·mol-1(B) λm(NH4+) = 0.00764 S·m2·mol-1(C) 淌度 U(Cl-) = 737 m2·s-1·V-1(D) 淌度 U(Cl-) = 7.92×10-8 m2·s-1·V-16.用同一电导池分别测定浓度为 0.01 mol/kg和 0.1 mol/kg的两个电解质溶液,其电阻分别为 1000 W 和 500 W,则它们依次的摩尔电导率之比为:(A) 1 : 5 (B) 5 : 1 (C) 10 : 5 (D) 5 : 107. CaCl2 摩尔电导率与其离子的摩尔电导率的关系是:(A) Λ∞(CaCl2) = λm(Ca2+) + λm(Cl-)(B)Λ∞(CaCl2) = 1/2 λm(Ca2+) + λm(Cl-)(C)Λ∞(CaCl2) = λm(Ca2+) + 2λm(Cl-)(D)Λ∞(CaCl2) = 2 [λm(Ca2+) +λm(Cl-)]8. 在10 cm3 浓度为1 mol·dm-3 的KOH溶液中加入10 cm3水,其电导率将:(A) 增加(B) 减小(C) 不变(D) 不能确定9. 按 国标(GB ),如下单位不正确的是:(A) 摩尔电导率: S·m -1·mol -1(B) 离子摩尔电导率: S·m2·mol -1(C) 电导: S(D) 电导率: S·m -110. 电解质溶液的电导率k≡j/E =∑B│z B│F r B c B/E ,式中z B 、c B 代表B 种离子的电荷数及浓度。
影响k 值的下述分析哪个对?(A) 迁移速率 r B 愈大,则 k 愈大(B) 电场强度 E 愈大,则 k 愈小(C) 电流密度 j 愈大,则 k 愈大(D) r B 、E 及 j 的大小对 k 值无影响11. 下列电解质水溶液中摩尔电导率最大的是:(A) 0.001 mol/kg HAc (B) 0.001 mol/kg KCl(C) 0.001 mol/kg KOH (D) 0.001 mol/kg HCl12. NaCl 稀溶液的摩尔电导率 λm 与 Na+、 Cl-离子的淌度(Ui)之间的关系为 :(A)λm =(U+)+(U-)(B)λm =(U+/F)+(U-/F)(C)λm=(U+)F +(U-)F(D) λm= 2 (U+ +U-)13. 浓度均为 m 的不同价型电解质,设 1-3 价型电解质的离子强度为I1,2-2 价型电解质的离子强度为I2,则(A) I1 < I2 (B) I1 = I2(C) I1 = 1.5I2 (D) 无法比较 I1和I2大小14. 下列电解质溶液中,离子平均活度系数最大的是:(A) 0.01 mol·kg-1 NaCl (B) 0.01 mol·kg-1 CaCl2(C) 0.01 mol·kg-1 LaCl3 (D) 0.01 mol·kg-1 CuSO415. 0.1 mol·kg-1 氯化钡水溶液的离子强度为:(A) 0.1 mol·kg-1 (B) 0.15 mol·kg-1(C) 0.2 mol·kg-1 (D) 0.3 mol·kg-116. 浓度为0.1 mol·kg-1 的MgCl2 水溶液,其离子强度为:(A) 0.1 mol·kg-1 (B) 0.15 mol·kg-1(C) 0.2 mol·kg-1 (D) 0.3 mol·kg-117. 质量摩尔浓度为 m 的Na3PO4溶液, 平均活度系数为γ±,则电解质的活度为:(A) a(B)= 4(γ±)(B) a(B)= 4(γ±)(C) a(B)= 27(γ±)(D) a(B) = 27 (γ±)18. 0.001 mol/kg K2SO4和 0.003 mol/kg 的Na2SO4 溶液在 298 K 时的离子强度是:(A) 0.001 mol/kg (B) 0.003 mol/kg(C) 0.002 mol/kg (D) 0.012 mol/kg19. 在饱和 AgCl溶液中加入NaNO3,AgCl 的饱和浓度将:(A) 变大(B) 变小(C) 不变(D) 无法判定20. 298 K时, 0.005 mol/kg 的 KCl和 0.005 mol/kg 的NaAc溶液的离子平均活度系数分别为γ(±,1)和γ(±,2), 则有:(A) γ(±,1)= γ(±,2)(B) γ(±,1)>γ(±,2)(C) γ(±,1)<γ(±,2)(D)γ(±,1)≥ γ(±,2)第七章电解质溶液物化试卷(二)1. z(B)、r(B)及 c(B)分别是混合电解质溶液中 B 种离子的电荷数、迁移速率及浓度,对影响 B 离子迁移数 (t B) 的下述说法哪个对?(A) │z(B)│ 愈大, t B愈大(B) │z(B)│、r(B)愈大,t B愈大(C) │z(B)│、r(B)、c(B)愈大,t B愈大(D) A、B、C 均未说完全2.在一定温度和浓度的水溶液中,带相同电荷数的 Li+、Na+、K+、Rb+、… , 它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于:(A) 离子淌度依次减小(B) 离子的水化作用依次减弱(C) 离子的迁移数依次减小(D) 电场强度的作用依次减弱3.在 Hittorff 法测定迁移数实验中,用 Pt 电极电解AgNO3溶液,在 100 g 阳极部的溶液中,含 Ag+的物质的量在反应前后分别为 a 和 b mol,在串联的铜库仑计中有c g 铜析出, 则 Ag+的迁移数计算式为( Mr(Cu) = 63.546 ) :(A) [ (a - b)/c ]×63.6(B) [ c - (a - b) ]/31.8(C) 31.8 (a - b)/c(D) 31.8(b - a)/c4. 298K,当 H2SO4溶液的浓度从 0.01 mol/kg 增加到 0.1 mol/kg时,其电导率 k 和摩尔电导率Λm将:(A) k减小 , Λm增加(B) k增加 ,Λm增加(C) k减小 , Λm减小(D) k增加 , Λm减小5.在其它条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而:(A) 增大(B) 减小(C) 先增后减(D) 不变6.LiCl 的无限稀释摩尔电导率为0.011503 S·m2·mol-1,在 298 K 时,测得LiCl 稀溶液中 Li+的迁移数为 0.3364,则Cl-离子的摩尔电导率Λm(Cl-)为:(A) 0.007633 S·m2·mol-1(B) 0.011303 S·m2·mol-1(C) 0.003870 S·m2·mol-1(D) 7633 S·m2·mol-17.欲要比较各种电解质的导电能力的大小,更为合理应为:(A) 电解质的电导率值(B) 电解质的摩尔电导率值(C) 电解质的电导值(D) 电解质的极限摩尔电导率值8.在10 cm3 浓度为 1 mol·dm-3 的KOH溶液中加入10 cm3水,其摩尔电导率将:(A) 增加(B) 减小(C) 不变(D) 不能确定9.25℃时,Λm(LiI)、λm(H+)、Λm(LiCl) 的值分别为0.0117,0.035 和0.0115 S·m2·mol-1。
LiCl 中的t+为 0.34,当假设其中的电解质完全电离时, HI 中的t+为:(A) 0.18 (B) 0.82 (C) 0.34 (D) 0.6610.有下列溶液,其中摩尔电导率最大的是:(A) 0.001 mol/kg KCl(B) 0.001 mol/kg KOH(C) 0.001 mol/kg HCl(D) 1.0 mol/kg KCl11. 有下列溶液, 其中摩尔电导率最小的是:(A) 0.001 mol/kg NaCl(B) 0.001 mol/kg KOH(C) 0.001 mol/kg HCl(D) 1.0 mol/kg NaCl12. 浓度为1.0 mol·dm-3 的强电解质溶液,它的摩尔电导率数值近似于:(A) 与电导率相等(B) 是电导率的 1000倍(C) 是电导率的 0.001倍(D) 是电导率的 100倍13. 下列不同浓度的 NaCl 溶液中(浓度单位mol·dm-3), 哪个溶液的电导率最大?(A) 0.001 (B) 0.01 (C) 0.1 (D) 1.014. 1 mol/kg K4Fe(CN)6 溶液的离子强度为:(A) 10 mol/kg (B) 7 mol/kg(C) 4 mol/kg (D) 15 mol/kg15. Al2(SO4)3的化学势μ与和离子的化学势μ+ ,μ-的关系为:(A) μ =(μ+)+(μ-)(B) μ = 3(μ+)+ 2(μ-)(C) μ = 2(μ+)+ 3(μ-)(D)μ = (μ+)·(μ-)16. 电解质i在溶液中的离子平均活度系数为γi ( = γ±),下列判断γi大小的说法哪个正确?(A) γi ≤ 1 (B) γi ≥ 1(C) A、B 都有可能(D) γi恒小于 117. 某一强电解质M v+ X v-,则其平均活度a± 与活度a B之间的关系是:(A) a± = a(B)(B) a± = a(B)的平方(C) a± = a(B)的V次方(D) a± = a(B)的1/V次方18. AgCl在以下溶液中溶解度递增次序为:(a) 0.1mol·dm-3 NaNO3(b) 0.1mol·dm-3 NaCl(c) H2O (d) 0.1mol·dm-3Ca(NO3)2(e) 0.1mol·dm-3 NaBr(A) (a) < (b) < (c) < (d) < (e)南京大学《物理化学》考试 第七章 电解质溶液11 / 1111 /11 (B) (b) < (c) < (a) < (d) < (e)(C) (c) < (a) < (b) < (e) < (d)(D) (c) < (b) < (a) < (e) < (d)19. 有 4 个浓度都是 0.01 mol/kg 的电解质溶液,其中平均活度系数最大的是:(A)KCl (B)CaCl 2 (C) Na 2SO4 (D) AlCl 320. 对于同一电解质的水溶液,当其浓度逐渐增加时,何种性质将随之增加?(A)在稀溶液范围内的电导率 (B) 摩尔电导率(C) 电解质的离子平均活度系数(D) 离子淌度。
