Q9风险管理工具详解
ICH-Q9质量风险管理

INTERNATIONAL CONFERENCE ON HARMONISATION OF TECHNICAL REQUIREMENTS FOR REGISTRATION OF PHARMACEUTICALS FORHUMAN USE人用药注册技术要求国际协调会议ICH Harmonised Tripartite Guideline人用药注册技术要求国际协调会议三方协调后的指南Quality Risk Management质量风险管理Current Step 4 version现行第四步版本dated 9 November 20052005 年十一月 9日This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process. At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of theEuropean Union, Japan and USA.本指南由人用药注册技术要求国际协调会议专家工作组根据人用药注册技术要求国际协调会议程序开发并提交各方的药政部门咨询。
根据人用药注册技术要求国际协调会议程序第四步,推荐给欧盟、日本和美国药的政部门采用的最终文本。
Document History文件历史Having reached Step 4 of the ICH Process at the ICH Steering Committee meeting on 9 November 2005, this guideline is recommended for adoption to the three regulatory parties to ICH在 2005 年 11 月 9 日的人用药注册技术要求国际协调会议上,本指南已经通过人用药注册技术要求国际协调会议第四步程序,本指南已经推荐给人用药注册技术要求国际协调会议三方的药政部门采用。
质量风险管理

•定义ICH Q9中关于质量风险管理(Quality Risk Management, QRM)的定义为:质量风险管理是质量管理方针、程序及规范在评估、控制、沟通和回顾风险时的系统应用。
•风险构成“风险(R isk)”由两个关键因素构成:危害发生的可能性;危害发生的严重性。
“风险”是危害发生的可能性和严重性的组合,有效地管理风险就是对风险的这两个因素的控制。
【实施指导】质量风险管理(QRM )是通过掌握足够的知识、事实、数据后,前瞻性地推断未来可能会发生的事件,通过风险控制,避免危害发生。
质量风险管理方法的应用,针对不同的风险所用的方法和文件可以有所不同。
对质量风险的评估应该基于科学性和保护患者的出发点,质量风险管理流程和文件的复杂程度应该与所对应的风险程度相一致。
质量风险管理方法的应用,针对不同的风险所用的方法和文件也可以有所不同。
5.1 职责决策者应负责本组织内各部门间的质量风险管理协调。
决策者应确保质量风险管理机制已建立,确保相应的资源保障。
质量风险管理工作通常由各领域成员组成的专项小组完成。
必要时质量风险管理工作小组的成员还应包括其他适合领域的专家及风险管理的专业人士。
5.2 质量风险管理模式图质量风险管理的模式由三部分组成(图5-1) :•风险评估(Risk Assessment)•风险控制(Risk Control)•风险审核,文件和沟通5.3 质霣风险管理流程根据质量风险管理的模式图,质量风险管理流程可以概括为以下基本步骤:•风险识别•风险分析•风险评价•风险控制,包括风险降低和风险接受•风险沟通•风险回顾5.4 质量风险管理步骤的详细说明A .风险识别(Risk identification)确定事件并启动质量风险管理。
风险管理是一个系统化的流程,以协调、改善与风险相关的科学决策。
启动和规划一个质量风险管理可能包括下列步骤:•确定风险评估的问题(Define the risk question) /或风险提问,包括风险潜在性的有关假设•收集和组织信息(Collect and organize information), 评估相关的潜在危害源,或对人类健康影响的背景资料与信息•明确& 策者如何使用信息、评估和结论•确立领导者和必要的资源•制定风险管理进程的日程和预期结果在此阶段清楚地确定风险的问题或事件对QRM的结果有很重要的影响。
ICH指南指导原则Q9质量风险管理

风险程度=危害概率×危害严重度×可预见性×干预度
1.质2量.X风XX险XX管X理概述 质量风险管理的原则
质量风险管理的两个基本原则为:
• 风险评估应该基于科学知识并最终与保护患者利益相联系。
• 质量风险管理过程的投入水准、形式和文件,应与风险级别 相适应。
2.质2量.X风XX险XX管X理程序 典型的质量风险管理示意图
3.质2量.X风XX险XX管X理方法和工具 失效模式、效应和危害性分析
- 失效模ticality Analysis, FMECA) - 针对产品所有可能的故障,并根据对故障,式的分析,确定每种故障
模式对产品工作的影响,找出单点故障,并按故障模式的严重度及其 发生概率确定其危害性。
-
产品或工艺的功能性故障的方法。 投诉或 是找出一个
- FTA可用于偏差调查,以彻底查明投诉或偏差的 施能 原因,并保证拟
定的改进措解决这些问题。
中国药科大学ICH政策研究中心
3.质2量.X风XX险XX管X理方法和工具 故障树分析
- 实施故障树分析的步骤: - 1、确定所分析的系统 - 2、熟悉所分析的系统 - 3、调查系统发生的事故 - 4、确定故障树的顶事件 - 5、确定原因事件
析的过程。 - 分析报告:
会议记录、对工艺过程的描述、重要结果的讨论、表格或逻辑模型、对拟 采取的重要措施作简要的解释。
2.质2量.X风XX险XX管X理程序 风险评估(Risk Assessment)
- 风险评价(Risk Evaluation)
- 风险评价是指将已经辨识和分析的风险与给定的风险标准进行比较。 定性评 价: 根据人们的经验和判断能力对生产工艺、设备、环境、人员、管理等 方面。 的状况进行评价。 定量评价: 用系统事故发生概率和事故严重 程度来评价。
风险管理在制药企业质量管理中的应用

风险管理在制药企业质量管理中的应用摘要:风险管理被有效地应用于多个行业和领域,实施质量风险管理能够提供主动的方法识别、科学评估以及控制产品质量和患者安全的潜在风险。
本文详细阐述质量风险管理的概念、质量风险管理流程、质量风险管理工具以及风险管理在制药企业质量管理中的应用。
关键词:质量风险管理1质量风险管理的概念质量风险管理是在整个产品生命周期中采用前瞻或回顾的方式,对质量风险进行评估、控制、沟通、审核的系统过程。
概念明确了质量风险管理的范围应涵盖产品生命周期,可以运用于药物质量的所有方面,包括药物研发、生产、流通、使用环节。
实施质量风险管理能够提供主动和方法识别、科学评估以及控制产品质量和患者安全的潜在风险。
2质量风险管理流程ICHQ9中提供了典型的质量风险管理的流程,包含风险评估、风险控制、风险评审、风险沟通四个阶段,下面具体阐述每个阶段需要做的工作:2.1风险评估:1)风险识别,是指参考风险描述,基于历史数据、产品知识、行业经验等信息确定可能的危害因素的过程。
此阶段应系统的考虑各方面因素,尽可能的发现风险因素,常用的风险识别方法有鱼骨图法、头脑风暴等等,从人、机、料、法、环五大要素入手,逐一识别。
2)风险分析,风险分析是在识别出可能的风险因素以后,组织有经验的技术人员、QA,对风险发生的的可能性、严重性、可检测性进行评估。
3)风险评价,是将所确定和分析的风险与风险标准进行比较,确定风险等级。
整个风险评估环节,评估人员的专业知识和经验至关重要,会影响最终风险等级的评定。
2.2风险控制:风险控制的目的是将风险降低到一个可接受的水平,在降低风险的同时,应考虑投入资源与风险水平相适应,控制风险的同时,保障经济效益。
如风险不可接受,需采取措施降低风险时,注意不要因此引入新的风险。
对于不可接受的风险,此阶段应当制定风险降低的措施以及行动计划,确保每一项风险落实。
1)风险降低,是着眼于当前风险超过了某个特定可接受水平后降低和消除质量风险的过程。
ICH Q9 质量风险管理

风险评估的所得结果是对风险的定量估计,或是对风险范围的定性描述。当对风险进行定量描 述时,将会用从 0 到 1(0%到 100%)的可能性数值来表示。另外,也可以对风险进行定性描述, 比如“高”,“中”或“低”,且它们需要定义的尽可能的详细。在定量风险评估中,风险估计提 供了在一系列风险生成条件下某一后果的可能性。因此,定量风险估计对于某一时间的某一特 定后果是很有用的。另外,有些风险管理工具使用有关风险测量将危害性的可能性的多个水平 结合成有关风险的整体估计。在计分过程中,用时候会用使用定量风险估计。
(1) 什么将会出现问题?
(2) 将会出现问题的可能性是什么?
(3) 后果将是什么?
风险确认 是系统使用信息以确认关于风险问题的危害。这些资料可以包括历史资料,理论分 析,合理的意见和涉众方的利益。风险确认说明了“什么将会出现问题?”这个问题,包括确
Prepared and translated by HU Kai
通常,风险被理解定义为危害出现的可能性和危害严重性的结合。然而,难于在不同的风险涉 众(Stakeholder)之间获得风险管理应用的共同理解,因为不同的风险涉众会觉察到不同的潜在危 害,会对危害出现的可能性及危害的严重性有不同的认识。关于药品,尽管有众多的风险涉众 (Stakeholder),其中包括患者,医药众业者及政府和工业,但通过管理质量风险以保护患者应 该被认为是最重要的。
2
4.1 责任
3
4.2 启动质量风险管理程序
3
4.3 风险评估
3
4.4 风险控制
4
4.5 风险交流
5
4.6 风险审查
5
5.
风险管理工具
5
5.1 常用风险评估简易方法
【ICH文件】Q9风险管理(中文版)

人用药品注册技术要求国际协调会ICH三方协调指导原则Q9—质量风险管理目录1 介绍2 范围3 质量风险管理的原则4 常规的质量风险管理程序4.1 职责4.2 质量风险管理流程启动4.3 风险评估4.4 风险控制4.5 风险通报4.6 风险回顾5 风险管理方法学6 质量风险管理在企业和管理机构的应用7 定义8 参考资料附件I 风险管理的方法和工具I 1基本风险管理简明方法I 2失败模式与影响分析(FMEA)I 3失败模式、影响及关键点分析(FMECA)I 4过失树状分析(FTA)I 5危害分析和关键控制点(HACCP)I 6危害操作分析(HAZOP)I 7初步危害源分析(PHA)I 8风险分级和筛选I 9辅助的数理统计工具附件II进行质量风险管理的潜在机会II 1 全面质量管理中的质量风险管理II 2 政府管理中的质量风险管理II 3 研发中的质量风险管理II 4 厂房、设备和设施的质量风险管理II 5 物料管理中的质量风险管理II 6 生产中的质量风险管理II 7 实验室控制和稳定性研究中的质量风险管理II 8 包装和贴签中的质量风险管理质量风险管理1 介绍风险管理的理念已被有效地运用到经济和政府管理的众多领域和部门中,如金融、保险、职业安全、公共健康、和药物警戒(pharmacovigilance)等。
虽然质量风险管理在现今的医药工业领域里已有所应用,但仍有局限性,尚未充分发挥风险管理所应起的作用。
质量体系在医药工业中的重要性无庸置疑,而质量风险管理显然正在成为一个有效的质量体系的重要组成部分。
众所周知,“风险”是危害发生的可能性和该危害严重性的组合。
然而,要使各利益相关者对风险管理的应用达成共识是不容易的,这是因为各个利益相关者认识到的潜在危害可能不同,并对危害发生的可能性和严重性有不同的判断。
在医药领域中,尽管存在着诸如患者、医疗机构以及政府管理部门和制药企业等多个利益相关者,但通过质量风险的管理来保护患者无疑是应被关注的首要问题。
ICH-Q9质量风险管理
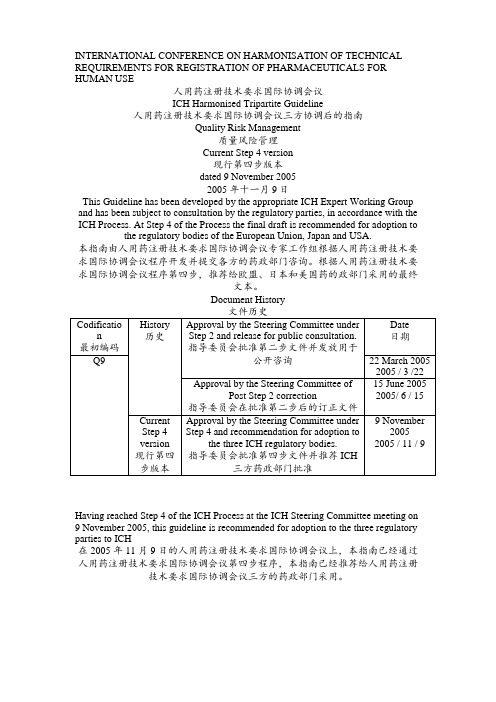
INTERNATIONAL CONFERENCE ON HARMONISATION OF TECHNICAL REQUIREMENTS FOR REGISTRATION OF PHARMACEUTICALS FOR HUMAN USE人用药注册技术要求国际协调会议ICH Harmonised Tripartite Guideline人用药注册技术要求国际协调会议三方协调后的指南Quality Risk Management质量风险管理Current Step 4 version现行第四步版本dated 9 November 20052005 年十一月 9日This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process. At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of the European Union, Japan and USA.本指南由人用药注册技术要求国际协调会议专家工作组根据人用药注册技术要求国际协调会议程序开发并提交各方的药政部门咨询。
根据人用药注册技术要求国际协调会议程序第四步,推荐给欧盟、日本和美国药的政部门采用的最终文本。
Document HistoryHaving reached Step 4 of the ICH Process at the ICH Steering Committee meeting on 9 November 2005, this guideline is recommended for adoption to the three regulatory parties to ICH在 2005 年 11 月 9 日的人用药注册技术要求国际协调会议上,本指南已经通过人用药注册技术要求国际协调会议第四步程序,本指南已经推荐给人用药注册技术要求国际协调会议三方的药政部门采用。
质量风险管理

中等风险: - 高风险: 中等风险:6-9 高风险: 10-25 -
风险来源
QRM
设施与人: 设施与人:例 如操作风险、 如操作风险、 环境、设备、 环境、设备、 IT、设计要素
系统风险
体系风险
组织: 组织:质量体 控制、 系、控制、测 量、法规符合 性
QRM
工艺操作与质 量参数
过程风险
产品风险
安全性与有效 性:质量属性
QRM
评价风险的参数
概率
严重性
风险管理
有什么风险? 有什么风险? 从哪儿来? 从哪儿来? 对什么有影响? 对什么有影响? 严重程度怎样? 严重程度怎样? 我们如何应对? 我们如何应对?
严重程度
QRM
严重
应急方案
积极管理
轻微
忽略
过程控制
根据风险管理方法和工具, 根据风险管理方法和工具,制定出基于风 险因素考虑的更为有效的决策---利用有限 险因素考虑的更为有效的决策--利用有限 的资源,最大化的减小风险。 的资源,最大化的减小风险。
质量风险管理( 质量风险管理(QRM) )
质量保证篇
NKF
2011.04.01
质量风险管理
沟通
QRM
初步危害分析 故障树分析 故障模式影响与危害性分析 故障模式影响分析 危害与可操作分析 危害分析及关键控制点 FTA FMECA FMEA 生产
TOOLS
ICH Q9 质量风险管理
物料
质量系统
什么是风险
第十四条
应当根据科学知识及经验对质量风险进行评估, 应当根据科学知识及经验对质量风险进行评估,以保证产 品质量。 品质量。
第十五条
质量风险管理过程所采用的方法、措施、 质量风险管理过程所采用的方法、措施、形式及形成的文 件应当与存在风险的级别相适应。 件应当与存在风险的级别相适应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Q9风险管理工具详解第一讲Basic Risk Management Facilitation Methods 风险管理的基本简化方法ICH Q9的附录I风险管理和工具中的第一个环节就是这个环节,介绍一些简单的数据组织技术被常用于构架风险管理,并使决策制定简化清晰,以下就是这些工具的例子:●Flowcharts; 流程图●Check Sheets; 核对清单●Process Mapping; 工艺过程图(罗兰·贝格流程绘制工具)●Cause and Effect Diagrams (also called an Ishikawa diagram or fish bone diagram).因果图(石川分析图/鱼骨分析图)FDA和其他药监部门不会限制你只使用以上四种工具,我们大家在实际生活中可能都已经或多或少的使用了这些工具。
这里实际上引入的是项目管理工具,包括了所谓的西方称为七件基本工具(Seven Basic Tools),分别是:1.基准比较(Benchmarks),在竞争的市场环境中,取胜关键是你做得比竞争者更好。
孙子兵法曰知己知彼,百战不殆。
所以必须对客户和市场做调查,找出行业的基准是什么,然后确定自己的目标,当然你宁肯高估也不要低估了行业基准,否则你会很被动。
GMP管理中的应用实例:常见的应用实例就是非专利药开发过程中,产品杂质/生物利用度和RLD产品进行对比的例子。
我们对于非专利药的产品质量和规格标准的设立是以发明商已上市有的产品为参照的,这是非专利药被FDA采纳的基础,没有这些基准比较,不会有非专利药上市。
所以在设定非专利药的规格标准时,所谓的USP标准不是我们的设立基准,而是上市的产品,尤其是那些发明商的制剂产品的质量是我们的比较基准。
随着非专利药市场的竞争加剧,我们已经更多的使用所有已知上市品种的质量作为基准了。
同样的在实际的设备维护、生产车间操作工生产效率、人员培训效率、发酵产品染菌率的基准设立都将对提高风险和效绩管理产生实际的影响。
例如A厂是发酵生产厂,其两个产品的染菌率2000-2006分别如下:年度2000 2001 2002 2003 2004 2005 2006 A厂a产品染菌率23% 25% 24% 28% 20% 22% 23% A厂b产品染菌率14% 15% 11% 16% 14% 13% 14% B厂a产品染菌率5% 4% 6% 5% 4% 6% 5% B厂b产品染菌率5% 6% 5% 7% 6% 4% 5% C厂a产品染菌率8% 7% 6% 7% 7% 8% 6% C厂b产品染菌率11% 10% 11% 9% 10% 11% 10% D厂b产品染菌率7% 8% 6% 7% 8% 7% 8% D厂b产品染菌率8% 9% 7% 8% 8% 7% 9% E厂a产品染菌率11% 12% 12% 11% 13% 11% 12% E厂b产品染菌率5% 4% 6% 5% 5% 4% 5% F厂a产品染菌率10% 9% 11% 10% 9% 9% 9% F厂b产品染菌率5% 5% 6% 5% 6% 5% 7% G厂a产品染菌率11% 10% 10% 9% 10% 11% 9% G厂b产品染菌率6% 6% 5% 5% 6% 5% 7%H厂a产品染菌率10% 9% 9% 8% 9% 10% 11% H厂b产品染菌率5% 5% 6% 5% 6% 5% 5% F厂a产品染菌率7% 7% 8% 7% 6% 7% 7% F厂b产品染菌率11% 12% 12% 12% 13% 11% 11% G厂a产品染菌率5% 6% 5% 5% 6% 6% 5% G厂b产品染菌率6% 6% 7% 6% 7% 6% 6%我们通过简单的计算就可以知道除了A厂以外,其它发酵厂这两个产品的平均染菌率为8%,但是A厂这两个产品的平均染菌率却高达19%,这就意味着A厂对于染菌控制的能力低于发酵行业绝大多数企业的平均控制能力,其质量控制能力是非常低下的。
我们可以设定我们质量改进的目标为行业平均水平8%作为我们染菌控制的“基准”。
通过这样的目标设定我们可以明确我们在同行业中的位置和我们提高的目标。
这个工具从实际上将是你管理底线设置的问题,决定了你在市场竞争时所拥有的实际筹码。
好的风险管理部门必须时刻收集行业基准,并有效的将其设定为企业内部的基准。
2.因果图(Cause-and-Effect Diagram),亦称鱼骨图(Fishbone Diagram)、石川图(Ishikawa Diagram)。
一般它是用来从不良结果反推其可能产生的原因。
如图所示。
通常一个质量问题不外由人、机、料、法、环五个因素引起,进行逐项研究找出影响因素。
GMP管理中的应用实例:A厂展开GMP培训多年了,但是一直以来效果就不好,公司浪费了大量的金钱和人力物力,但是没有任何的收效。
为了分析和解决某公司不能有效的培训员工的问题,质量部门召集相关部门的管理经理召开了为期一天的因果分析。
首先他们进行了“头脑风暴”活动,要求各个经理自由发挥把他们认为的造成这个现象的原因分别单独罗列在小的纸张上。
自由讨论和分析了两个小时后,他们分别得出了以下的理由:用因果分析图整理汇总如下图,我们可以清楚地发现我们第一感觉的可能原因“资金的原因”实际上并不是“培训效果不好”的关键原因,而是“考核的原因”是这个工厂培训效果不佳的原因。
必须结合合适的有针对性地整改来改善这个问题。
3.核对清单(Checklists)。
核对单是简便易行又极有效的工具,如飞机起飞前飞行员例行检查需带的物品清单,这是安全工作需要,当一个过程必须严格如要求时,应当用核对单。
爱4.控制图(Control Charts),这是最早应用的工具之一,最初是哈特帮助工人测量他们的工作过程,在这个图中你可以找到系统偏差和特殊偏差。
系统偏差是正态分布而特殊偏差则随其原因变动。
使用这个图要利用管理统计的一些原则或结果。
如连续7个点在同一侧属于不正常,连续7点在两侧但趋势一致属于不正常,出现有规律的周期震荡属于不正常等等。
总之要找出改进原因,直到所有偏差都是系统偏差,完全是随机出现,毫无规律可循,那就是上帝在玩掷骰子游戏,我们无能为力了,也就是不需要调整了。
GMP管理中的应用实例:某公司分析人员在不同天尿素标准品的测试结果分析。
日期04.4.1 04.4.2 04.4.3 04.4.4 04.4.5 04.4.6 04.4.7 04.4.8 04.4.9 04.4.10 04.4.11 04.4.12 04.4.13 04.4.14 尿素7.42 7.41 7.29 7.18 7.36 7.49 7.33 7.51 7.42 7.29 7.36 7.36 7.19 7.4 日期04.4.15 04.4.16 04.4.17 04.4.18 04.4.19 04.4.20 04.4.21 04.4.22 04.4.23 04.4.24 04.4.25 04.4.26 04.4.27 04.4.28 尿素7.31 7.38 7.23 7.56 7.3 7.21 7.3 7.45 7.34 7.44 7.5 7.3 7.21 7.19批号BL040101 均值A 7.3475 标准差S 0.104938图中Series 1是实际测试值,Series 2是平均值,Series 3是失控限下限(使用的是A-3S),Series4是警告限下限(使用的是A-2S),Series 5是警告限上限(使用的是A+2S),Series 6是失控限上限(使用的是A+3S)[注意,如果测试符合正态分布的规律,A±2S涵盖了总体95%范围;A±3S涵盖了总体99.73%的范围。
]如果发现测试值连续偏离平均值(一般来说7次以上,无论是往上还是往下的趋势),说明检测发生了明显的变化,需要调查其原因,防止数据继续偏离超过警告限甚至是失控限。
对于异常的数据测试点,也可以进行调查。
如果所有的测试结果都在合适的范围内无规律的波动,说明其控制良好,不需要采取任何的措施了!这类的控制图谱已经被很多厂家广泛的应用于产品年度质量考核中,对于监控产品质量的趋势有实际的意义。
我以后有机会可以给大家专门介绍这个专题的时候详细具体进行讨论。
5.流程图(Flow-Charts),你不能指望一个不熟悉系统过程的人提出正确的改进意见,流程图可以展示系统的全部过程的衔接关系和鱼骨图一起用可以对事故原因有更有效的分析。
我一直将Flow chart和process mapping (工艺流程图)认为是类似的工具,目的就是明确流程。
实际上在我们日常管理中这个管理工具已经是大量使用了,我们一般会有所谓的“工艺流程图”来表示我们的工艺过程。
我在很多公司也强调希望大家使用简单的流程图来表示那些管理规程,这样在培训和执行中就比较直观和简单了。
为了和统一的流程图符号保持一致,有必要介绍ISO 9004-4标准中规范的几种主要的描绘流程图的符号:1)端点符或2)处理符表示一项或一组操作(如工序、工作步骤等等),也可以表示一个具体的动作。
3)判断符点作为进口(输入),但是可以有若干个可以选择的出口(输出),对同一事件而言只能有一个出口(输出)是有效的。
4)停顿符表示工作的暂时中断(停留),指需要时间的工作停顿,在工艺流程中表示产品的待加工或仓储状态。
5)流线符表示行程,指工作的流转,具有方向性。
其中单线流线符表示按顺序展示活动与活动之间的流向,只是一种联结的符号并不占有时间。
而双线流线符表示需要时间的活动与活动之间的流转,在工艺流程图中表示非加工的活动,例如产品的搬运。
6)注释符表示对活动的注解说明的内容7)省略符或表示在图中可以省略的部分,或重复次数不确定的活动。
描述现有过程流程图的程序如下:I 确定过程的开始和结束II 观察从开始到结束的整个过程III 确定过程中的步骤(活动、输入、判定、输出等)IV 绘制表示该过程的流程图草图;V 与该过程有关的人员共同讨论、分析审核流程图草图VI 根据审核结果改进流程图VII 与实际情况相比较,验证流程图的准确性,确定正式的流程图VIII 注明正式流程图的形成日期,以备将来使用时参考。
GMP管理中的应用实例:某公司内部质量审核流程图6.直方图(Histogram),广泛应用于质量管理工作中,用矩形高度表示数据,使不同组的数据容易互相比较。
这个实际上是非常简单的工具。
也是我们已经习惯使用的工具,所以没有必要详细解释。
GMP管理中的应用实例:某公司对3年来内部审计中出现的缺陷数量进行了按照部门的分类整理。
部门2003 2004 2005QA 14 12 10QC 8 9 10生产 4 4 5物控 5 5 3设备设施7 6 6包装标签 3 3 4直方图如下:7.帕累托图(Pareto Chart)。
