金属腐蚀性
金钛铁铜耐腐蚀性排序

金钛铁铜耐腐蚀性排序
铁的耐腐蚀性小于铜,铜小于钛,钛小于金。
耐腐蚀性一定要指名腐蚀环境,在大部分腐蚀环境中,黄金的耐腐蚀性要优于钛,例如高温氧化性气体,比较纯的盐酸,硫酸,硝酸,熔融碱等等,但金在含强氧化剂的高浓度氯离子的酸性溶液能被腐蚀,而钛虽然电位只有-1.6V左右,对这种环境却具有高度的耐蚀性。
在一般的腐蚀环境中,目前已知最耐腐蚀的金属是铱,但铱在高温下会被氧化,这一点比不过黄金
酸腐蚀:(左到右耐腐蚀能力增强)铯、钾、钙、钠、镁、铝、锌、铁、锡、铅、铜、汞、银、铂、金
碱腐蚀:(左到右耐腐蚀能力增强)铝、锌、铅、锡、镁、铜、
铁(其他金属耐碱腐蚀能力都比铁强)
海水腐蚀:(左到右耐腐蚀能力增强)镁、锌、铁、铅、铜、铝、镍、钛、银、铂、金。
金属腐蚀类型

金属腐蚀类型金属腐蚀是指金属在一定的环境条件下,由于与外界介质的作用而发生的一种不可逆转的化学或电化学反应。
金属腐蚀的类型多种多样,下面将详细介绍几种常见的金属腐蚀类型。
1. 酸性腐蚀酸性腐蚀是指金属在酸性介质中受到侵蚀和破坏的过程。
酸性腐蚀主要是由于酸性介质中的氢离子与金属表面的金属离子发生反应,导致金属表面产生腐蚀。
酸性腐蚀对金属的侵蚀速度较快,常见的酸性腐蚀有硫酸腐蚀、盐酸腐蚀等。
2. 碱性腐蚀碱性腐蚀是指金属在碱性介质中受到侵蚀和破坏的过程。
碱性腐蚀主要是由于碱性介质中的氢氧根离子与金属表面的金属离子发生反应,导致金属表面产生腐蚀。
碱性腐蚀对金属的侵蚀速度较慢,常见的碱性腐蚀有氢氧化钠腐蚀、氢氧化钾腐蚀等。
3. 氧化腐蚀氧化腐蚀是指金属在氧气介质中受到侵蚀和破坏的过程。
氧化腐蚀主要是由于金属与氧气反应生成金属氧化物,导致金属表面产生腐蚀。
氧化腐蚀对金属的侵蚀速度较快,常见的氧化腐蚀有铁锈的形成。
4. 电化学腐蚀电化学腐蚀是指金属在电解质溶液中受到电化学反应的影响而发生腐蚀的过程。
电化学腐蚀通常涉及两个电极,一个是阳极,受到腐蚀;另一个是阴极,不受腐蚀。
电化学腐蚀的速度与电解质中的离子浓度、温度等因素有关。
5. 浸蚀腐蚀浸蚀腐蚀是指金属在液体中长时间浸泡而导致的腐蚀。
浸蚀腐蚀通常是由于液体中的化学物质对金属表面的侵蚀而引起的,常见的浸蚀腐蚀有酸浸蚀、碱浸蚀等。
6. 废品腐蚀废品腐蚀是指金属在废弃物堆放场等环境中受到腐蚀的过程。
废品腐蚀通常是由于废弃物中的化学物质对金属表面的侵蚀而引起的,废品腐蚀的速度较快。
7. 金属间腐蚀金属间腐蚀是指不同金属在一定条件下接触而引起的腐蚀。
金属间腐蚀通常是由于不同金属之间的电位差引起的,常见的金属间腐蚀有铝与不锈钢的接触腐蚀。
8. 微生物腐蚀微生物腐蚀是指微生物对金属的腐蚀作用。
微生物腐蚀通常是由于微生物在金属表面形成生物膜,产生酸性物质等导致的,常见的微生物腐蚀有铁细菌腐蚀、硫酸盐还原菌腐蚀等。
金属材料的抗腐蚀性能评估方法

金属材料的抗腐蚀性能评估方法正文:一、引言金属材料在各行各业中被广泛应用,但由于长期暴露于恶劣环境中,容易受到腐蚀的影响。
因此,评估金属材料的抗腐蚀性能至关重要。
本文将介绍几种常用的金属材料抗腐蚀性能评估方法。
二、重量损失法重量损失法是评估金属材料腐蚀程度的常用方法之一。
该方法通过将待测金属材料置于腐蚀介质中一段时间后,测量其前后质量变化,从而计算出金属材料的腐蚀速率。
该方法简便易行,要求设备简单,但需要一定的测试时间和周期。
三、电化学测试法电化学测试法是评估金属材料腐蚀性能的常见方法之一。
该方法基于金属材料在电化学介质中的行为,决定了其腐蚀程度。
常用的电化学测试法包括极化曲线法、交流阻抗法等。
通过测量电化学参数的变化,可以评估金属材料的抗腐蚀性能。
电化学测试法具有高精度、快速获取结果的优势,被广泛应用于实际生产中。
四、硬度测试法硬度测试法是一种间接评估金属材料腐蚀性能的方法。
腐蚀会导致金属材料的硬度降低,因此通过测量金属材料的硬度变化情况,可以推测其腐蚀情况。
硬度测试法操作简单、成本较低,适用于大批量金属材料抗腐蚀性能的评估。
五、X射线衍射法X射线衍射法是一种分析金属材料晶体结构的方法。
腐蚀过程会对金属材料的晶体结构产生影响,因此通过X射线衍射可以观察到腐蚀引起的晶体结构变化。
该方法对于深入研究金属材料腐蚀机理及评估抗腐蚀性能具有重要意义,但需要较为专业的仪器和操作技术。
六、红外热成像法红外热成像法是一种无损检测的方法,通过观察金属材料表面温度分布,评估其腐蚀情况。
腐蚀过程会导致金属材料表面温度异常,因此可通过红外热成像技术进行检测。
该方法操作简便、非接触性强,可以在实时监测中使用,适用于金属材料腐蚀性能的在线评估。
七、总结金属材料的抗腐蚀性能评估是确保其在各个领域安全运行的关键。
本文介绍了几种常用的金属材料抗腐蚀性能评估方法,包括重量损失法、电化学测试法、硬度测试法、X射线衍射法和红外热成像法。
各种金属材料耐硫酸腐蚀性能参考

实验时候温度会升高么?有以下金属材料,并且有硫酸的浓度和温度配置,你看下。
不锈钢(SUS316 、SUS316L) :温度40 ℃以下,浓度20% 左右;904 钢(SUS904 、SUS904L) :适于温度40~60 ℃、浓度20~75% ;温度80 ℃、浓度60% 以下;高硅铸铁(STSi15R) :室温至90 ℃之间各种浓度;纯铅、硬铅:室温的各种温度;S-05 钢(0Cr13Ni7Si4) :90 ℃以下的浓硫酸,高温浓硫酸(120~150 ℃);普通碳钢:室温70% 以上的浓硫酸;铸铁:温度为室温的浓硫酸;蒙乃尔、金属镍、因可耐尔:中温中等浓度的硫酸;钛钼合金(Ti-32Mo) :沸点以下、60% 的硫酸和50 ℃以下、98% 的硫酸;哈氏合金B 、D :100 ℃以下、75% 的硫酸;哈氏合金C :100 ℃左右的各种温度;镍铸铁(STNiCr202) :室温60~90% 的硫酸。
硫酸是一种价格便宜的强酸,它的水溶液对热的稳定性良好,在工业清洗中硫酸应用得很广泛。
它的缺点是硫酸在清洗中生成的盐类有许多是水溶性较低的,比如用硫酸去除含钙盐的锅炉污垢时,由于与硫酸反应生成水溶性差的硫酸钙,所以去垢效果不好。
相反改用盐酸处理,由于生成水溶性很好的氯化钙而除垢效果良好(在25℃时,100cm3水中只能溶解0.208g 硫酸钙,而可溶解74.5g时氯化钙)。
稀硫酸容易与钢铁反应并产生氢气,常温下,60%(质量)及以上浓度的硫酸会在钢铁表面形成钝化膜而使钢铁对它有耐蚀性93%(质量)以上时即使加热到煮沸条件也几乎不腐蚀钢铁。
而铅与钢铁正相反,可溶于浓硫酸中,但对稀硫酸有良好的耐蚀性。
其余金属与硫酸的反应情况归纳如下。
铝:易溶于10%(质量)的硫酸中,但对80%(质量)以上的硫酸有耐蚀性。
锌、镁:易溶于各种浓度的硫酸中。
锡:对稀硫酸才有耐蚀性。
镍:常温下,对80%(质量)以下的硫酸有耐蚀性。
铬:可被浓硫酸氧化生成钝化膜,所以它不被浓硫酸腐蚀。
史上最全主要金属材料的耐腐蚀性能表
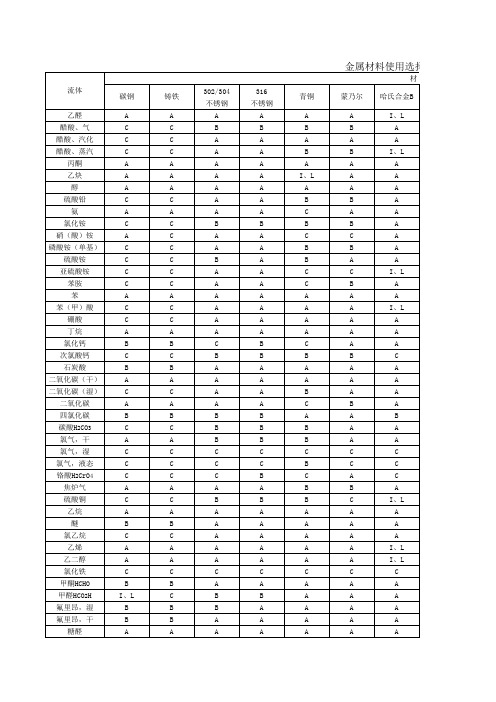
材料使用选择表
材料
哈氏合金C
A A A A A A A A A A A A A A A A A A A A A A A A A A A A B A A A A A A A A I、L B A A A A A
不锈钢 20# A A A B A A A A A A A B A A A A A A A A A A A A A A A A C B C A A A A A A A C A A A A A
A
二硫化氧干
A
A
A
A
A
A
B
二氧化硫干
A
A
A
A
A
A
B
硫酸,汽化
C
C
C
C
C
C
A
硫酸,游离
C
C
C
C
B
B
A
亚硫酸
C
C
B
B
B
C
A
焦油
A
A
A
A
A
A
A
三氟乙烯
B
B
B
A
A
A
A
松节油
B
B
A
A
A
B
A
醋
C
C
A
A
B
A
A
水,锅炉供水
B
C
A
A
C
A
A
水,蒸馏水
A
A
A
A
A
A
A
海水
B
B
B
B
A
A
A
氯化锌
C
C
C
C
C
C
A
硫酸锌 符号:
金属的腐蚀与防护

金属的腐蚀与防护金属在我们的日常生活中无处不在,我们使用金属制成的物品,例如汽车、建筑物、家具等。
然而,金属经常会遭受腐蚀,这会导致它们的性能下降甚至失效。
为了保护金属,我们需要了解腐蚀的原因和预防方法。
1.什么是金属腐蚀?金属腐蚀是指金属在与环境中的化学物质接触时发生的氧化反应。
这种反应会导致金属表面的腐蚀物产生,使金属变得破损、变脆,并最终造成金属的失效。
2.腐蚀的原因金属腐蚀有多种原因,其中最常见的是氧气和水的存在。
当金属与氧气和水分子接触时,氧气将与金属发生氧化反应,形成金属氧化物,同时水分子中的离子也参与到化学反应中,加速金属的腐蚀过程。
除了氧气和水的影响,其他因素如酸、盐等也会对金属腐蚀起促进作用。
例如,当金属暴露在盐水中时,盐中的离子会加速金属的腐蚀速度,使金属更容易被腐蚀。
3.金属腐蚀的危害金属腐蚀不仅仅影响了金属的外观,还会对金属的性能和使用寿命造成不可逆的损害。
例如,腐蚀可能导致金属的力学性能下降,如强度、韧性和硬度的减弱。
腐蚀还会导致金属的电导率降低,对电气设备的性能产生不利影响。
金属腐蚀还可能引发环境问题。
一些金属腐蚀产物可能对生态系统和人体健康造成危害。
因此,金属腐蚀的防护显得尤为重要。
4.金属腐蚀的防护方法为了有效防止金属腐蚀,我们可以采取以下几种方法:4.1金属涂层金属涂层是一种常见的金属腐蚀防护方法。
涂层作为一层保护层覆盖在金属表面,可以阻断金属与环境中物质的接触,减缓金属腐蚀的进程。
常见的金属涂层包括涂漆、涂蜡和镀层等。
4.2阳极保护阳极保护是一种利用金属之间的电化学原理来防止金属腐蚀的方法。
通过在金属表面放置一个更容易被腐蚀的金属,将其作为阳极,并将被保护的金属作为阴极,以形成一个电池系统,从而减缓金属的腐蚀速度。
4.3合金化合金化是通过将金属与其他元素或化合物进行混合,形成具有更好腐蚀抵抗性的金属。
通过改变金属的成分,可以改善其腐蚀性能,延长金属的使用寿命。
史上最全主要金属材料的耐腐蚀性能表

17-4PH
A B B B A A A I、L I、L I、L I、L I、L I、L I、L I、L A A I、L A I、L I、L I、L A A I、L I、L A C C C C A A A A I、L A A I、L A B I、L I、L I、L
A
A
A
A
A
A
A
B
C
C
B
C
C
C
B
C
C
B
A
二硫化氧干
A
A
A
A
A
A
B
二氧化硫干
A
A
A
A
A
A
B
硫酸,汽化
C
C
C
C
C
C
A
硫酸,游离
C
C
C
C
B
B
A
亚硫酸
C
C
B
B
B
C
A
焦油
A
A
A
A
A
A
A
三氟乙烯
B
B
B
A
A
A
A
松节油
B
B
A
A
A
B
A
醋
C
C
A
A
B
A
A
水,锅炉供水
B
C
A
A
C
A
A
水,蒸馏水
A
A
A
A
A
A
A
海水
B
B
B
B
A
A
A
氯化锌
C
C
C
C
C
金属常见的金属腐蚀形式

TTS曲线清楚地表明被试验不锈钢敏化处理的温 度和时间范围。
1100
温 1000 度
点蚀的控制
缓蚀剂的应用:加入点蚀缓蚀剂是有 效手段之一。通常,点蚀的严重程度不 仅与溶液中的侵蚀性离子的浓度有关之 外,还与非侵蚀性离子的浓度有关。
点蚀的控制
电化学保护:对金属设备、装置采用 电化学保护是防止点蚀发生的较好措施。 阴极极化使电位低于保护电位Ep,使设 备材料处于稳定的钝化区。
点蚀的控制
镍:增加敏感性。
防止晶间腐蚀的措施
生产中常通过合金化、热处理及冷加工等 措施来控制合金晶界的吸附及晶界的沉淀,以 提高耐晶间腐蚀性能。如降低含碳量;加入适 量的钛和铌;适当热处理;采用适当的冷处理, 采用双向合金等。
晶间腐蚀的控制
基于奥氏体不锈钢的晶间腐蚀是晶界产生贫铬 而引起的,控制晶间腐蚀可以从控制碳化铬在晶 界上沉积来考虑。通常可采用下述几种方法。 1、重新固溶处理 2、稳定化处理 3、采用超低碳不锈钢 4、采用双相钢
新钝化。使小孔腐蚀停止成长。
形核
在钝态金属表面上,点蚀核优先在一些敏感位 置上形成,这些敏感位置(即腐蚀活性点)包括: 晶界(特别是有碳化物析出的晶界),晶格缺陷 。 非金属夹杂,特别是硫化物,如FeS、MnS是 最为敏感的活性点。 钝化膜的薄弱点(如位错露头、划伤等)。
成长
影响点蚀的因素 材料因素 环境因素
镍在含有Cl- 、 Br- 、 I-的溶液中阳极极化时, 发生小孔腐蚀。不锈钢中Cr、Mo、N及Ni含量 增加,会提高对其对小孔腐蚀的耐蚀性。Cr提 高钝化膜的稳定性, Mo抑制金属溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.2.4 消毒剂对金属腐蚀性的测定
2.2.4..1 目的
测定消毒剂对各种金属的腐蚀程度,以能注明在使用时是否需给予应有的注意。
2.2.4.2 常用器材
(1) 金属片
圆形,直径24.0 mm,厚1.0 mm,穿一直径为2.0mm 小孔,表面积总值约为9.80 cm2 (包括上、下、周边表面与小孔侧面)。
光洁度为6。
原料如下:
碳钢(规格见GB 700-65);铜(规格见GB 2060-80);
铝(规格见GB 1173-74);不锈钢(规格见GB 1220-75)。
碳钢易氧化生锈,应保存于油中。
(2) 浸泡容器(玻璃制,带盖,容积为800 ml~1000 ml)。
(3) 砂纸(120号粒度水砂纸,GB 2477)。
(4) 称量杯。
(5) 天平(感量0.1 mg)。
2.2.4.3 操作程序
(1)在有表面活性作用的清洁剂中浸泡10 min,充分去油,洗净;亦可用氧化镁糊剂涂抹除油后洗净;以120号粒度水砂纸磨去金属片两面和周边表面的氧化层,再用自来水冲净。
测量片的直径、厚度、孔径(精确至0.1 mm)。
用无水丙酮或无水乙醇再次脱脂。
置50℃恒温箱中干燥1 h,待其温度降至室温后称重(每金属片待天平回零后称重3次,精确至0.1 mg,取其平均值作为试验前重量。
称重时,应戴洁净手套,勿以手直接接触样片。
(2) 按消毒剂最高使用浓度配制试验用消毒液,用以浸泡试验样片。
浸泡时,每一金属片需浸泡在200 ml 消毒液中。
(3) 金属样片用塑料线系以标签,编号和注明日期,悬挂于消毒液中。
一次性浸泡72 h。
易挥发性或有效成分不稳定的消毒剂,根据情况,酌情定时更换消毒液,直至浸泡72 h。
(4) 每种金属每次试验放置3片样片。
浸泡时,若同种金属每一样片相隔1 cm以上,可在同一容器内(含600 ml消毒液) 进行。
(5) 浸泡到规定时间后,取出金属片,先用自来水冲洗,再用毛刷或其它软性器具去除腐蚀产物。
如仍有清除不掉的腐蚀产物,可按GB 10124-88所介绍的下列方法清除: 铜片: 在室温下浸泡于盐酸溶液(500ml 36%~38% 盐酸加蒸馏水至1000ml,盐酸比重为1.19)中1min~3min。
碳钢片:置含锌粉200 g/L的氢氧化钠溶液中,煮沸5 min~30 min。
铝片:浸泡于三氧化铬磷酸溶液(三氧化铬20 g,磷酸500ml,加蒸馏水至1000ml。
磷酸比重为1.69)中,升温至80℃,持续5min~10min。
如还未清除干净,可在室温浸于硝酸(比重1.42)溶液中1min。
不锈钢:浸泡于60℃硝酸溶液(66%~68%硝酸100 ml加蒸馏水至1000 ml) 20 min。
或浸于70℃柠檬酸铵溶液(柠檬酸铵150 g 加蒸馏水至1000 ml)中10 min~60 min。
(6) 金属样片除去腐蚀产物并清洗后,用粗滤纸吸干水分,置于垫有滤纸的平皿中,放入50℃温箱,干燥1h,用镊子夹取,待其温度降至室温后分别在天平上称重。
天平回零后称3 次,以其平均值作为试验后重量。
称重时,与试验前相同,应戴洁净手套,勿以手直接接触样片(下同)。
(7) 样片在用化学法去除腐蚀物时,需设相应空白对照以校正误差。
空白对照样片与试验组样片同样进行表面处理、洗净和称重,但不经消毒剂浸泡。
事后随同试验组样片用相同
方法进行化学处理、水冲洗、干燥、称重,并计算其平均失重值。
(8) 试验的全过程应同时设不锈钢片浸泡蒸馏水的对照,浸泡前后的重量差应 <0.3 mg 。
否则,在找出原因后,全部试验重做。
(9) 试验结果,观察与纪录金属片颜色变化,并以金属腐蚀速率(R)平均值表达,在计算时应减去空白对照组样片的失重值。
计算公式如下
[R 为腐蚀速率,mm/a (毫米/年);m 为试验前金属片重量,g ;m t 为试验后金属片重量,g ;m k 为化学处理去除腐蚀产物样片失重值,g ,试验中未进行化学清除处理者,计算时在公式中删去m k 值;S 为金属片的表面积总值,cm 2;t 为试验时间,h ;d 为金属材料密度,kg/m 3]。
2.2.4.4 腐蚀性分级标准
腐蚀速率R (mm/a )
级 别 <0.0100
基本无腐蚀 0.0100~<0.100
轻度腐蚀 0.100~<1.00
中度腐蚀 ≥1.00
重度腐蚀
2.2.4.5 注意事项
(1) 每张砂纸只能磨一种金属材料。
一个容器盛的消毒液只能浸泡同一种金属。
(2) 称重关系到结果的准确性,必须认真进行。
接触样片的器具不得带有油垢。
(3) 所用金属片大小、厚薄应严格一致,表面需磨光。
(4) 试验期间,需换消毒剂溶液时,操作应迅速,勿使样片暴露空气中过久。
(5) 金属样片仅可使用一次,否则影响试验的准确性。
(1) 试验在20℃~25o C 条件下进行。
(7)在报告其结果时应对试验后金属样片的外观变化等现象进行描述。
d
t S m m m R k t ⨯⨯--⨯⨯=)(1076.87。
