EDTA与螯合剂
edta二钠的作用与功效

edta二钠的作用与功效EDTA二钠是一种广泛应用于工业和化学实验室的一种化学试剂,其作用和功效主要分为以下几个方面:1. 螯合剂:EDTA二钠是一种强螯合剂,可与金属离子形成稳定的络合物。
其稳定络合能力在很大程度上取决于金属离子的价态和电荷密度。
EDTA二钠可以与多种金属离子形成络合物,如钙、铁、镁、锌、铜、铅等。
由于金属离子在生物化学中起到重要的催化和凝集作用,EDTA二钠被广泛应用于工业和医学领域。
例如,EDTA二钠可用于溶解石灰石中的钙离子,用于软化水质、净化饮用水和制备实验室纯水。
2. 螯合剂:EDTA二钠可通过螯合过程中与重金属离子的络合,防止其过早沉淀和析出,从而减少对环境的污染和对健康的危害。
EDTA二钠可用于清洗废水和净化污染的土壤。
它可以与汞、铅、镉、铬等重金属形成稳定的络合物,并防止它们从土壤中渗透到地下水中。
此外,EDTA二钠还可以用于工业废水的处理,并减少金属离子的浓度。
3. 配位试剂:EDTA二钠具有较高的配位能力,可以与多种金属离子形成具有稳定结构的络合物。
这些络合物可用作分析试剂、标准物质和参比物质。
例如,EDTA二钠可以用于测定水中钙、镁、铁、锌等金属离子的含量。
通常它们会形成明亮的色彩,便于准确测量。
EDTA二钠还可以用作标准物质,用于比较和检验其他化学物质的含量。
4. 食品添加剂:EDTA二钠也可以作为食品添加剂,起到增加食品的口感和延长保质期的作用。
它可以与铁离子结合,使之失去活性,从而阻止氧化反应的发生。
这有助于防止食品腐败和变质。
它还可以防止食品中的色素失去鲜艳的颜色,从而保持食物的美观和诱人的外观。
总结起来,EDTA二钠作为一种强螯合剂具有广泛的应用。
它不仅可以用于工业和化学实验室中的分析和配位试剂,还可以用于清洗废水和净化污染土壤。
此外,EDTA二钠还可以作为食品添加剂,延长食品的保质期并改善其口感。
它在环境保护、食品工业和化学研究等领域中发挥着重要作用。
常用螯合剂

常用螯合剂螯合剂是一类能与金属离子形成稳定络合物的化合物。
螯合剂可以通过给予金属离子一个或多个配体上的电子对来形成配位键。
常用的螯合剂有以下几种。
1. 乙二胺四乙酸(EDTA)乙二胺四乙酸(EDTA)是一种多功能螯合剂,广泛用于化学分析和工业生产中。
它能与多种金属离子形成稳定的络合物,并能有效螯合和去除金属离子,起到去污和稳定作用。
EDTA还可用作破坏细胞壁、抑制酶活性等方面的实验试剂。
2. 氰化物(CN-)氰化物(CN-)是一种强碱性的螯合剂,它能与金属离子形成氰化物络合物。
氰化物络合物通常具有较高的稳定性和溶解度,在金属提取和电镀等领域有广泛应用。
然而,氰化物具有强毒性和致命性,需在使用时小心操作,避免接触和吸入。
3. 亚硝酸盐(NO2-)亚硝酸盐(NO2-)也是一种常用的螯合剂,它能与金属离子形成亚硝酸盐络合物。
亚硝酸盐络合物通常具有较高的稳定性和溶解度,广泛用于水处理、金属腐蚀抑制和环境污染治理等领域。
亚硝酸盐还可用作爆炸物和药物的原料。
4. 有机酸有机酸是一类含有羧基的有机化合物,它们可以与金属离子形成稳定的络合物。
常用的有机酸螯合剂包括乙酸、苯甲酸、柠檬酸等。
有机酸络合物在食品、化妆品和医药等领域有广泛应用,可以起到抗氧化、保存、稳定等作用。
5. 胺类化合物胺类化合物是一类含有氮原子的有机化合物,它们可以与金属离子形成稳定的络合物。
常用的胺类螯合剂包括乙二胺、三乙矿、二乙矿等。
胺类螯合剂在化学分析、金属提取和催化反应等领域有广泛应用,可以提高反应的选择性和效率。
螯合剂在化学、生物和环境科学等领域发挥着重要作用。
通过与金属离子形成稳定络合物,螯合剂可以改变金属的性质和行为,扩展其应用范围。
不同的螯合剂适用于不同的金属离子和应用领域,选择合适的螯合剂可以提高实验和生产的效果。
然而,在使用螯合剂时,需要注意其毒性和环境影响,并遵循安全操作规程,以确保实验和生产的安全性和可持续性。
EDTA与螯合剂

3.与金属离子形成配合物的稳定性 必须小于EDTA与金属离子形成螯合 物的稳定性。
常用的指示剂有铬黑T,钙指示 剂,二甲酚橙,PAN等。现以铬黑T 为例,说明金属指示剂的变色原理。 铬黑T为弱酸性偶氮染料,能随溶液 pH值变化而显示不同的颜色。如用 符号NaH2ln表示铬黑T。在溶液中 有下列平衡:
二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点 氨羧螯合剂中最重要同时应用最
广的是乙二氨四乙酸(EDTA)及其 二钠盐 (EDTA-2Na),统称为 EDTA。结构如下:
EDTA在水中溶解度小,故配制 标准溶液时,常用它的二钠盐。 EDTA的分子或离子中含有2个氨基 氮和4个羧基氧可与金属离子配合, 生成具有5个五元环的稳定性很高的 螯合物。如下图:
4.由于EDTA与金属离子螯合可形成5个五 元环,故生成的螯合物十分稳定。常见 金属离子的EDTA螯合物的lgKs 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳 定常数对数值
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
螯合物:由中心原子与多齿配体形
螯合剂EDTA简介

螯合剂EDTA简介螯合剂EDTA简介概述:螯合剂是一种通过分子结构中的官能团与金属离子形成稳定络合物的化合物。
这些络合物能够改变金属离子的性质和化学活性,广泛应用于医药、环境、冶金、食品工业等领域。
在这些应用中,螯合剂EDTA(乙二胺四乙酸)是最为常见和重要的一种螯合剂。
本文将对EDTA的性质、应用和制备方法进行详细介绍。
性质:EDTA是一种白色结晶粉末,具有无味无臭的特点。
其化学式为C10H16N2O8,分子量为292.24。
EDTA具有强螯合能力,可以与许多过渡金属离子形成稳定的络合物。
它是一种弱碱性化合物,在水中能够溶解得很好。
其络合物的形成常数很大,使得EDTA成为理想的螯合剂。
应用:1. 医药应用:EDTA可以与铁、铜、钙等金属离子形成络合物,被广泛应用于药物配方中。
它可以被用来治疗重金属中毒,如铅中毒和铜中毒。
EDTA能够与这些有害物质形成络合物,提高其溶解度,从而加速其排出体外。
此外,EDTA也可以用于治疗缺铁性贫血和血液病。
2. 环境应用:EDTA在环境领域被广泛应用于土壤修复和废水处理。
由于它对金属离子有良好的螯合能力,EDTA可以与土壤中的重金属形成稳定的络合物,减少其毒性和迁移性,从而改善土壤质量。
在废水处理中,EDTA可以被用来去除废水中的重金属离子,减少对环境的污染。
3. 食品工业:EDTA被广泛用于食品工业中作为抗氧化剂和金属螯合剂。
食品中往往含有一定量的金属离子,这些金属离子容易与食品中的其他成分产生反应,导致食品品质的下降。
EDTA可以与这些金属离子形成络合物,防止其与其他成分发生反应,并延长食品的保质期。
制备方法:制备EDTA一般采用合成法。
首先将乙二胺与乙醇作用形成二乙胺,然后再与氯乙酸反应得到乙二胺四乙酸的初步产物。
最后,通过水解、精制和结晶等步骤得到高纯度的EDTA结晶粉末。
结论:螯合剂EDTA是一种重要而多功能的化学物质,广泛应用于医药、环境和食品工业等领域。
EDTA的特性与用途

EDTA的特性与用途EDTA(乙二胺四乙酸)是一种常用的螯合剂,可以与金属离子形成稳定的络合物。
EDTA具有多种特性和广泛的应用,下面将详细介绍。
1.螯合能力强:EDTA可以与许多金属形成稳定的1:1或1:2络合物,并能有效抑制金属离子的活性。
2.稳定性高:由于EDTA与金属离子之间形成了化学键,络合物具有较高的热稳定性和化学稳定性。
3.溶解性良好:EDTA在水中溶解度高,能够与溶液均匀混合。
4.酸碱性弱:EDTA在水溶液中能够稳定在大部分pH范围内。
5.较低的毒性:EDTA对人体和环境相对较安全,没有明显毒副作用。
1.金属离子的螯合剂:由于EDTA与金属离子形成稳定络合物,因此广泛用于金属离子的螯合和去除。
特别是在工业废水处理中,EDTA被用来去除废水中的重金属离子,减少对环境的污染。
此外,EDTA还可用于金属蠟浸出、电镀、催化剂制备等方面。
2.医药工业:EDTA广泛应用于药物的制备和稳定性改进。
例如,EDTA可以与一些药物形成配合物,增强药物的稳定性、水溶性和生物利用度等。
同时,EDTA也被用作药物注射液的稳定剂,延长药物的保质期。
3.食品工业:EDTA可用作食品的螯合剂,防止金属离子的存在对食品的氧化、变质产生不良影响。
此外,EDTA还能够在食品加工过程中稳定乳化液、色素和维生素等。
4.化妆品工业:EDTA可作为化妆品的抗氧化剂和稳定剂,延长化妆品的使用寿命。
此外,EDTA还能够调节乳化剂和表面活性剂的配方,增加产品的稳定性和可扩展性。
5.化学分析:EDTA常用作分析化学试剂,用于金属离子的定量分析。
例如,EDTA滴定法可用于测定钙、镁、铜、锌等金属离子的含量。
6.医学检验:EDTA血液采样管广泛用于临床医学的血液检验。
EDTA在采集血液时能够与细胞外的金属离子结合,阻止血液凝固,并保持血液样品稳定。
7.其他领域:EDTA还可应用于纺织工业、造纸工业、园林绿化等方面,用于脱除金属离子的存在,减少对产品的损害。
螯合剂之EDTA及其钠盐

EDTA 普遍应用于生物学各个领域,常用在电泳缓冲体系中,金属依赖性的蛋白水解酶或者核酸酶反应,细胞消化或者样品解聚过程等等。
EDTA 溶液已被用于一项帮助阐明抗原修复在乙醇固定涂片的免疫染色中作用的研究。
EDTA 溶液也被用于研究中以评估生物素标记的荧光素(b-FITC)的摄取和释放。
EDTA 常以二钠或者三钾盐的形式用作抗凝剂,作用机制在于它能够螯合血液中的钙离子从而阻止凝血发生。
Absin 供应的EDTA 是一种重要络合剂/螯合剂,常用做核酸酶、蛋白酶的抑制剂;也可用于消除重金属离子对酶的抑制作用。
1. 乙二胺四乙酸(EDTA) abs44059861生化研究中用作钙螯合剂,消除微量重金属导致的酶催化反应中的抑制作用。
常用络合剂试剂,也用作洗涤剂、血液抗凝剂等。
2. EDTA, 0.5 M, pH 8.0 abs9133本品是用DEPC(diethyl pyrocarbonate ,焦碳酸二乙酯)处理过的EDTA 溶液, 是一种螯合剂,用来消除重金属离子对酶的抑制作用,常用于分子生物学应用。
3. EDTA 二钠盐二水合物 abs44059863科研试剂,用于重金属定量分析剂,用作氨羧络合剂,还用于制药工业、彩色显影等。
4. EDTA 二钠盐 abs42222235是一种重要络合剂,用于络合金属离子和分离金属。
常用于分子生物学及电泳实验5. 10%EDTA 脱钙液 abs9223EDTA 是一种相对较好的螯合脱钙剂,对组织结构影响最小,可以较好的保存组织的某些酶类,经EDTA脱钙后的组织可以进行免疫组化和原位杂交染色。
但是该法脱钙速度太慢,一般脱需要数周至数月。
不适合常规标本脱钙使用。
对含钙组织最好固定之后,再进行脱钙或二者同时进行。
然后进行下游的实验,如脱水、透明、浸蜡、包埋、切片。
EDTA与螯合剂 ppt课件
ppt课件
10
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
ppt课件
11
例如,在Mg2+离子和Zn2+离子的混合
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
ppt课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
ppt课件
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
ppt课件
19
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
螯合剂EDTA简介

螯合剂EDTA简介螯合剂EDTA简介螯合剂是指能够与金属离子形成稳定的络合物的化合物。
它们在许多领域中起着重要作用,包括医学、环境保护和工业化学等。
其中,以螯合剂EDTA(乙二胺四乙酸)最为著名和广泛使用。
EDTA是一种多羧酸化合物,其化学结构如下:乙二胺四乙酸(EDTA)由乙二胺和乙醇(甲醇)以甲基化反应的方式生成。
它的结构中有四个羧酸基团,分别位于乙胺上的四个空间方向,这使得EDTA能够有效地与金属离子形成络合物。
EDTA具有许多优异的性质,使其成为广泛使用的螯合剂。
首先,EDTA具有良好的水溶性,因此可以在溶液中方便地使用。
其次,EDTA在溶液中能够稳定金属离子的存在,形成络合物,从而阻止金属离子与其他物质发生反应。
此外,EDTA还具有选择性,即它能够选择性地与某些金属离子形成络合物,而对其他金属离子不产生影响。
这种选择性使得EDTA在许多分析方法中得到了广泛应用。
EDTA的络合反应是以配位键形式进行的,其中羧酸基团中的氧原子与金属离子之间形成了共价键。
由于EDTA与金属离子的配位能力较强,形成的络合物具有较高的稳定性。
这种稳定性使得EDTA能够有效地去除水中的金属离子,从而在环境保护和水处理中具有重要的应用价值。
EDTA在医学领域中被广泛用作抗凝剂。
它能够与钙离子配位,阻止凝血过程的发生。
因此,EDTA被用于血液采集和某些外科手术中,以减少出血问题的发生。
此外,EDTA还被用作某些疾病的治疗药物,如重金属中毒和铅中毒的治疗等。
在工业化学中,EDTA被广泛应用于金属表面处理,如镀铝、镀锌和电镀等。
在这些过程中,金属离子在溶液中稳定存在,并与EDTA形成络合物,从而进行有序的金属离子沉积和形成均匀的金属涂层。
此外,EDTA还被用作某些化学反应的催化剂,从而提高反应的效率和选择性。
尽管EDTA在许多领域中有着广泛的应用,但也存在一些潜在的问题。
首先,EDTA是一种难降解的有机物,因此在环境中的寿命较长。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精选课件
17
对于含有两种或两种以上金属离子 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 如,在Mg2+离子和Zn2+离子的混合溶液
中,可首先调节溶液pH ≈ 6.8,用铬黑
T作指示剂,用EDTA滴定Zn2+离子,
此时Mg2+离子不干扰。然后再调节溶液
pH ≈ 10,用EDTA滴定Mg2+离子。
精选课件
3
二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点
氨羧螯合剂中最重要同时应用最 广的是乙二氨四乙酸(EDTA)及其 二钠盐 (EDTA-2Na),统称为 EDTA。结构如下:
精选课件
4
精选课件Biblioteka 5EDTA在水中溶解度小,故配制 标准溶液时,常用它的二钠盐。 EDTA的分子或离子中含有2个氨基 氮和4个羧基氧可与金属离子配合, 生成具有5个五元环的稳定性很高的 螯合物。如下图:
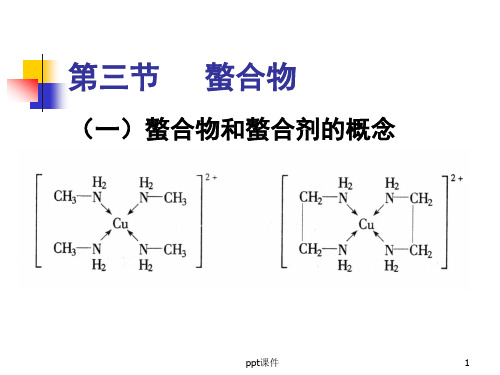
第三节 螯合物
(一)螯合物和螯合剂的概念
精选课件
1
螯合物:由中心原子与多齿配体形
成的环状配合物
螯合剂:能与中心原子形成螯和物 螯合效应:这种由于螯和物的生成 而使配合物的稳定性大大增加的作 用配合物中形成的鏊合环数目越多 其稳定性越强。
精选课件
2
形成的螯合环以五元环和六元环 最稳定。常见的螯合剂大多是有机 化合物,特别是具有氨基N和羧基O 的一类氨羧螯合剂使用得更广。
精选课件
15
精选课件
16
铬黑T能与许多金属离子如Ca2+ Mg2+ Zn2+Cd2+ 等形成红色的配合物。 在pH为7~11时,铬黑T显兰色,与 形成配合物的红色有明显区别,则 终点时颜色变化明显。因此,用铬 黑T作指示剂时最适宜的pH值为
9~10.5,一般用NH3-NH4Cl缓冲溶液 控制溶液pH值在10左右进行滴定。
精选课件
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
精选课件
19
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
精选课件
9
4.由于EDTA与金属离子螯合可形成5个五 元环,故生成的螯合物十分稳定。常见 金属离子的EDTA螯合物的lgKs 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳 定常数对数值
精选课件
10
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
滴定终点前:
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
精选课件
21
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
精选课件
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
精选课件
13
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
精选课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
精选课件
6
CaY2-的结构
精选课件
7
EDTA与金属离子的配合有以下特点: 1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
精选课件
8
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
精选课件
11
例如,在Mg2+离子和Zn2+离子的混合
溶液中,调节溶液的pH ≈ 6.8, 这时
EDTA仍可与 Zn2+离子完全螯合,而与 Mg2+离子则完全不螯合,即Mg2+离子 的存在不会干扰EDTA 对Zn2+离子的螯 合滴定。
由于滴定时不断有离子的生成,为了 保持合适的pH值,使反应进行完全,滴 定前必须加入合适的缓冲溶液控制溶液 的pH值。
2.与金属离子形成的有色配合物具 有足够的稳定性;
3.与金属离子形成配合物的稳定性 必须小于EDTA与金属离子形成螯合 物的稳定性。
精选课件
14
常用的指示剂有铬黑T,钙指示 剂,二甲酚橙,PAN等。现以铬黑T 为例,说明金属指示剂的变色原理。 铬黑T为弱酸性偶氮染料,能随溶液 pH值变化而显示不同的颜色。如用 符号NaH2ln表示铬黑T。在溶液中 有下列平衡:
精选课件
22
此课件下载可自行编辑修改,此课件供参考! 部分内容来源于网络,如有侵权请与我联系删除!感谢你的观看!
