微生物限度检查记录表格
纯化水微生物限度检查记录
RF-08-099 A/0
第 1 页 共 1 页
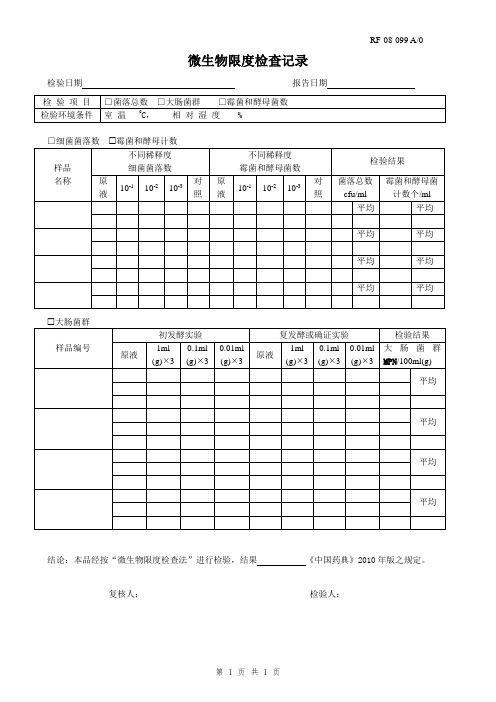
微生物限度检查记录
检验日期 报告日期 检 验 项 目
□菌落总数 □大肠菌群 □霉菌和酵母菌数
检验环境条件 室 温 0
C , 相 对 湿 度 %
□细菌菌落数 霉菌和酵母计数 样品 名称 不同稀释度 细菌菌落数
不同稀释度 霉菌和酵母菌数 检验结果
原液 10-1 10-2 10-3 对照 原液
10-1 10-2 10-3 对照
菌落总数cfu/ml 霉菌和酵母菌计数个/ml
平均 平均 平均 平均 平均 平均
平均
平均
大肠菌群
样品编号 初发酵实验
复发酵或确证实验 检验结果
原液
1ml (g) 3 0.1ml (g) 3 0.01ml (g) 3 原液 1ml (g) 3 0.1ml (g) 3 0.01ml (g) 3 大肠菌群MPN /100ml(g)
平均
平均
平均
平均
结论:本品经按“微生物限度检查法”进行检验,结果 《中国药典》2010年版之规定。
复核人: 检验人:。
微生物限度、控制菌检查记录

产品名称
批号
数量
供货单位
取样量
检验日期
温度
湿度
报告日期
检验依据
供试液制备
取供试品(g),加pH7.0无菌氯化钠蛋白胨缓冲液至ml,混匀,作为1:10的供试液;细菌检查:吸取本品1ml至5个平皿,每个平皿0.2ml;霉菌和酵母菌检查:吸取本品1ml至平皿
平皿号
细菌
培养基/批号
营养琼脂培养基/
供试品
阳性对照
阴性对照
结果
□检出□未检出(规定:)
备注
结论
本品按进行检验,结果。
检验人
复核人
2天
3天
3天
4天
4天
5天
5天
5
1天
1天
2天
2天
3天
3天
4天
4天
5天
5天
每组菌落总数
平均数
平均数
结果
(规定:)
结果
(规定:)
备注
结论
本品经按进行检验,结果。
检验人
复核人
控制菌检查记录
检验编号:
产品名称
批号
数量
供货单位
取样量
检验日期
温度
湿度
报告日期
检验依据
一、大肠埃希菌检查
供试品制备:取供试品(g/ml/cm2),加PH7.0无菌氯化钠蛋白胨缓冲液至ml,混匀,作为的供试液。
培养基信息:①营养肉汤培养基配制批号:②四硫磺酸钠亮绿培养基配制批号:
③胆盐硫乳琼脂培养基配制批号:④EMB配制批号:
培养温度:培养时间:培养箱编号:
营养肉汤预增菌(18~24h)
四硫磺酸钠亮绿增菌(18~24h)
07微生物限度检查记录(稀释法)

微生物限度检查记录(稀释法)文件编码:SOP-JHJY00301-07样品名称批号检验编号规格检验日期报告日期检验目的培养时间结束时间检验依据《中国药典》年版部供试液制备取供试品10g,加胰酪大豆胨液体培养基至 ml,用匀浆仪或其他适宜方法混匀,制成1:10供试液,进一步稀释成1:100,1:1000等适宜的稀释级。
一、需氧菌(30~35℃,3-5天);胰酪大豆胨琼脂,批号,温度:℃二、霉菌和酵母菌(20~25℃,5-7天);沙氏葡萄糖琼脂,批号,温度:℃培养时间1:10 1:100 1:1000 阴性对照1:10 1:100 1:1000 阴性对照皿1 1天2天3天4天5天6天/ / / / 7天/ / / /皿2 1天2天3天4天5天6天/ / / / 7天/ / / /皿3 1天2天3天4天5天6天/ / / / 7天/ / / /皿4 1天2天3天4天5天6天7天接下页样品名称批号1:10 1:100 1:1000 阴性对照1:10 1:100 1:1000 阴性对照皿5 1天2天3天4天5天6天/ / / / 7天/ / / /菌落总数结果计数: cfu/g;(规定:≦cfu/g)计数: cfu/g;(规定:≦cfu/g)三、大肠埃希菌培养内容胰酪大豆胨液体(30-35℃;18-24h)温度:℃,培养时间:h麦康凯液体(42-44℃;24-48h)温度:℃,培养时间:h麦康凯琼脂培(30-35℃;18-72h)温度:℃,培养时间:h供试品阳性对照阴性对照结果□检出□未检出大肠埃希菌(规定:不得检出cfu/g)四、耐胆盐革兰阴性菌培养内容肠道菌增菌液体培养基(30-35℃;24-48h)温度:℃,培养时间:h紫红胆盐葡萄糖琼脂(30-35℃;24-48h)温度:℃,培养时间:h供试品1:10 1:100 1:1000阳性对照阴性对照结果每1g为cfu (规定:≦ cfu/g)五、沙门菌检查培养内容胰酪大豆胨液体(30-35℃;18-24h)温度:℃,时间:hRV沙门菌增菌液体(30-35℃;18-24h)温度:℃,时间:h木糖赖氨酸脱氧胆酸盐琼脂(30-35℃;18-48h)温度:℃,时间:h三糖铁琼脂斜面(30-35℃;18-24h)温度:℃,时间:h供试品阳性对照阴性对照结果□检出□未检出沙门菌(规定:不得检出10g)结论本品按《中国药典》年版部检验,结果。
内包材微生物限度检查记录表
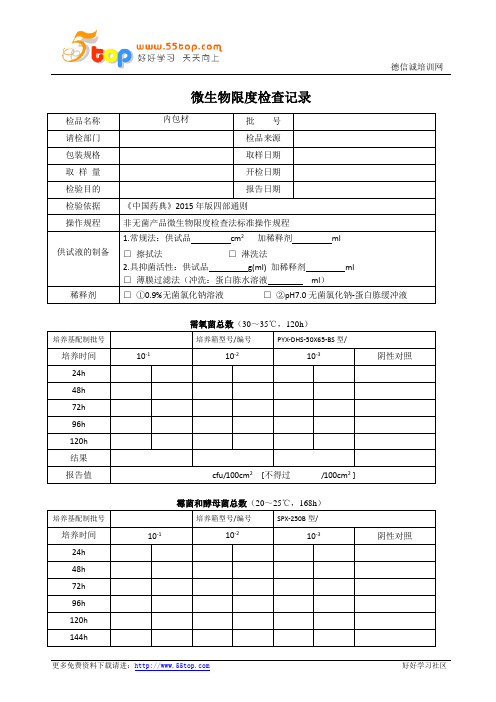
结果判定:本品按《中国药典》2015年版四部通则检验,结论为:□合格□不合格
检验人:复核人:
稀释剂
□①0.9%无菌氯化钠溶液□②pH7.0无菌氯化钠-蛋白胨缓冲液
需氧菌总数(30~35℃,120h)
培养基配制批号
培养箱型号/编号
PYX-DHS-50X65-BS型/
培养时间
10-1
10-2
10-3
阴性对照
24h
48h
72h
96h
120h
结果
报告值
cfu/100cm2[不得过/100cm2]
霉菌和酵母菌总数(20~25℃,168h)
培养基配制批号
培养箱型号/编号
SPX-250B型/
培养时间
10-1
10-2
10-3
阴性对照
24h
48h
72h
96h
120h
144h
168h
结果
报告值
cfu/100cm2[不得过/100cm2]
控制菌检查记录
大肠埃希菌
试验名称
培养基配制批号
阳性对照
供试品
阴性对照
胰酪大豆胨液体
麦康凯液体
麦康凯琼脂平板
分离、纯化、鉴定试验
微生物限度检查
检品名称
内包材
批号
请检部门
检品来源
包装规格
取样日期
取样量
开检日期
检验目的
报告日期
检验依据
《中国药典》2015年版四部通则
操作规程
非无菌产品微生物限度检查法标准操作规程
供试液的制备
1.常规法:供试品cm2加稀释剂ml
(2020版)药品片剂微生物限度检查法验证记录

(2020版)药品片剂微生物限度检查法验证记录文件编号:XXX-XX-XXXXXX制药有限责任公司XX年XX月XX日XX片微生物限度检查法标准起草说明XX片由XXXXXXXX药材制成,有XXXXX作用。
根据其用药途径和处方,应进行需氧菌总数、霉菌数和酵母菌总数的测定及控制菌大肠埃希菌检查。
本品参照2015版药典进行过方法适用性验证没有发现抑菌性,所以确定需氧菌总数、霉菌数和酵菌总数及大肠埃希菌采用常规法测定。
经对所采用的方法适用性进行试验,符合《中国药典》2020版四部1105非无菌产品微生物限度检查的微生物计数法和1106非无菌产品微生物限度控制菌检查法与1107非无菌药品微生物限度标准,方法可行。
XX片微生物限度检查法标准正文微生物限度:按微生物限度检查法(《中国药典》2020版四部1105非无菌产品微生物限度检查的微生物计数法和1106非无菌产品微生物限度控制菌检查法与1107非无菌药品微生物限度标准。
取样品10克,加PH7.0无菌氯化钠蛋白胨缓冲液稀释至100ml,制备成溶解均匀的1:10供试液。
需氧菌总数、霉菌与酵母菌总数取本品1:10供试液1ml,注皿,平行制备平皿(2个平皿需氧菌总数和2个平皿霉菌与酵母菌总数),按平皿法测定。
大肠埃希菌取本品1:10供试液10ml直接接至100ml胰酪大豆胨液体培养基中,依法检查。
《中国药典》非无菌制剂项下标准规定:需氧菌总数103cfu/g ; 霉菌和酵母菌总数102cfu/g ; 不得检出大肠埃希菌(1g)。
XX片生物限度检查方法适用性试验1、样品名称:XX片批号XXX、XXX、XXX2、验证用菌种:铜绿假单胞菌CMCC﹙B﹚10104、、枯草杆菌CMCC﹙B﹚63501、金黄色葡萄球菌CMCC﹙B﹚26003、白色念珠菌CMCC﹙F﹚98001、黑曲霉CMCC ﹙F﹚98003 大肠埃希菌CMCC﹙B﹚44102.3.实验方法:《中国药典》2015版四部微生物限度方法适用性检查验证实验。
微生物限度检查记录 版

表:微生物限度检查记录(通用)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)三、控制菌检查(30-35℃)表:胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)(30℃~35℃)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:)表:(含药材原粉的片剂)胰酪大豆胨液体培养基(配制批号: )、麦康凯液体培养基(配制批号: )麦康凯琼脂培养基(配制批号: )(30℃~35℃)胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号: )、三糖铁琼脂(配制批号: )五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号: )、肠道菌增菌液体培养基(配制批号: ),紫红胆盐葡萄糖琼脂培养基(配制批号: )表:微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)表:微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)表:微生物限度检查记录(内包材)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)。
纯化水检验微生物限度记录

(cfu/ml)
平均(cfu/ml)
阴性对照
结论
平皿1
(cfu)
平
平皿2
(cfu)
检验人:复核人:
纯化水检验记录
启用日期:2011年3月20日编号:REC-SOP.QC-ZL-054a-02
检验项目
微生物限度检查
检验日期
年月日
检验依据
《中国药典》2010年版二部
报告日期
年月日
检查方法:
薄膜过滤法:先用少量0.9%无菌氯化钠溶液将滤膜润湿,然后将供试品液经薄膜过滤,过滤后取出滤膜,菌面朝上贴于培养基上培养。细菌、霉菌和酵母菌总数不超过100cfu/ml为合格。
细菌总数检查:营养琼脂培养基。培养温度:℃培养时间(3天):月日时至月日时
霉菌和酵母菌总数检查:玫瑰红钠琼脂培养基。培养温度:℃培养时间(5天):月日时至月日时
细菌总数检查设备编号:
霉菌和酵母菌总数检查设备编号:
取样点
平皿1
(cfu/ml)
平皿2
(cfu/ml)
平均(cfu/ml)
阴性对照
平皿1
(cfu/ml)
微生物限度检查记录(口服给药)培养基稀释法

微生物限度检查记录(口服给药)
检验编号: 检品名称: 批号 第 页 共 页
检验者 月 日~ 月 日 校对者: 月 日
培养基名称: 营养琼脂培养基 (批号: 生产单位 )灵敏度
玫瑰红钠琼脂培养基 批号: 生产单位 )灵敏度
供试液制备 常规法 取供试品 g(ml),加PH7.0无菌氯化钠-蛋白胨缓冲液至 ml 。
①匀浆仪 转速 转/分钟 min ②研钵法 ③保温振摇法: ℃,保温 min,并适时振摇
细菌数:取本品1:10的供试液1 ml 注入2个平皿(0.5ml/皿),平行制备4个平皿
霉菌(酵母菌):取本品1:10的供试液1 ml 注入1个平皿,平行制备2个平皿
检查方法:照《中国药典2005年版一部》(附录XIII C )或二部(附录XI J )微生物限度检查法检查
细菌数: ℃, hr 霉菌(酵母菌)总数: ℃, hr
控制菌检查 培养温度 ℃
大肠埃希菌检查:对照菌: 大肠埃希菌[CMCC (B )44102] 沙门菌检查:对照菌: 乙型副伤寒沙门菌[ CMCC (B )50094]
结论: 本品按《中国药典2005年版 部》检查微生物限度,结果 规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10-1
10-2
10-3
10-4
阴性对照
10-1
10-2
阴性对照
1
2
平均
结果
cfu/g(规定:≤cfu/g)
cfu/g(规定:≤cfu/g)
大肠埃希菌检查□培养条件:30~35℃18~24h
胆盐乳糖培养基
(批号:)
MUG培养基
(批号:)
靛基质
(批号:)
EMB培养基
(批号:)
营养琼脂培养基(批号:)
霉菌和酵母菌数(23~28℃5天)
玫瑰红钠琼脂培养基(批号:)
10-1
10-2
10-3
10-4
阴性对照
10-1
10-2
阴性对照
1
2
平均
结果
cfu/g(规定:≤cfu/g)
cfu/g(规定:≤cfu/g)
大肠埃希菌检查□培养条件:30~35℃18~24h
胆盐乳糖培养基
(批号:)
24h
供试品
阴性对照
阳性对照
结果
□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出)
大肠菌群检查□培养条件:30~35℃
乳糖胆盐发酵培养基(18~24h)
(批号:)
EMB培养基(18~24h)
(批号:)
乳糖发酵培养基(24~48h)
(批号:)
供试品
10-1
10-2
10-3
阴性对照
阳性对照
结果
个/g(规定:<个/g)
微生物限度检查(根据需要在表头补充产品名称、批号,日期等)
(1)批号:
供试液制备
取供试品g,加入pH7.0无菌氯化钠-蛋白胨缓冲液至ml,混匀。
□研钵法□振摇法
细菌、霉菌和酵母菌计数□
平皿号
细菌数(30~35℃3天)
营养琼脂培养基(Βιβλιοθήκη 号:)霉菌和酵母菌数(23~28℃5天)
玫瑰红钠琼脂培养基(批号:)
10-1
10-2
10-3
10-4
阴性对照
10-1
10-2
阴性对照
1
2
平均
结果
cfu/g(规定:≤cfu/g)
cfu/g(规定:≤cfu/g)
大肠埃希菌检查□培养条件:30~35℃18~24h
胆盐乳糖培养基
(批号:)
MUG培养基
(批号:)
靛基质
(批号:)
EMB培养基
(批号:)
镜检、
生化试验
5h
24h
5h
镜检、
生化试验
5h
24h
5h
24h
供试品
阴性对照
阳性对照
结果
□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出)
大肠菌群检查□培养条件:30~35℃
乳糖胆盐发酵培养基(18~24h)
(批号:)
EMB培养基(18~24h)
(批号:)
乳糖发酵培养基(24~48h)
(批号:)
供试品
10-1
10-2
10-3
MUG培养基
(批号:)
靛基质
(批号:)
EMB培养基
(批号:)
镜检、
生化试验
5h
24h
5h
24h
供试品
阴性对照
阳性对照
结果
□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出)
大肠菌群检查□培养条件:30~35℃
乳糖胆盐发酵培养基(18~24h)
(批号:)
EMB培养基(18~24h)
(批号:)
乳糖发酵培养基(24~48h)
阴性对照
阳性对照
结果
个/g(规定:<个/g)
活螨检查□
检查方法
□直接法□漂浮法□分离法
结果
□检出活螨□未检出活螨(规定不得检出)
结论
□符合规定□不符合规定
(3)批号:
供试液制备
取供试品g,加入pH7.0无菌氯化钠-蛋白胨缓冲液至ml,混匀。
□研钵法□振摇法
细菌、霉菌和酵母菌计数□
平皿号
细菌数(30~35℃3天)
(批号:)
供试品
10-1
10-2
10-3
阴性对照
阳性对照
结果
个/g(规定:<个/g)
活螨检查□
检查方法
□直接法□漂浮法□分离法
结果
□检出活螨□未检出活螨(规定不得检出)
结论
□符合规定□不符合规定
活螨检查□
检查方法
□直接法□漂浮法□分离法
结果
□检出活螨□未检出活螨(规定不得检出)
结论
□符合规定□不符合规定
(2)批号:
供试液制备
取供试品g,加入pH7.0无菌氯化钠-蛋白胨缓冲液至ml,混匀。
□研钵法□振摇法
细菌、霉菌和酵母菌计数□
平皿号
细菌数(30~35℃3天)
营养琼脂培养基(批号:)
霉菌和酵母菌数(23~28℃5天)
