AMI合并心源性休克的诊断及治疗
【TCT2017】CULPRIT-SHOCK研究:合并多支病变的AMI伴心源性休克患者,急。。。
【TCT2017】CULPRIT-SHOCK研究:合并多⽀病变的AMI伴⼼源性休克患者,急。
5%~10% 的急性⼼肌梗死(AMI)患者合并⼼源性休克,其死亡率⾼达40%~50%。
此类患者80%合并多⽀⾎管病变(MVD),其最佳经⽪冠状动脉介⼊治疗(PCI)策略尚⽆定论。
2017年10⽉30⽇,在美国丹佛召开的经导管⼼⾎管治疗学术会议(TCT 2017)上,Holger Thiele教授报告的CULPRIT-SHOCK研究结果提⽰,合并多⽀病变的AMI伴⼼源性休克患者急诊PCI时仅处理靶⾎管获益更⼤。
CULPRIT-SHOCK是迄今规模最⼤的探究合并MVD的AMI伴⼼源性休克患者最佳PCI策略的前瞻性、多中⼼、随机对照试验。
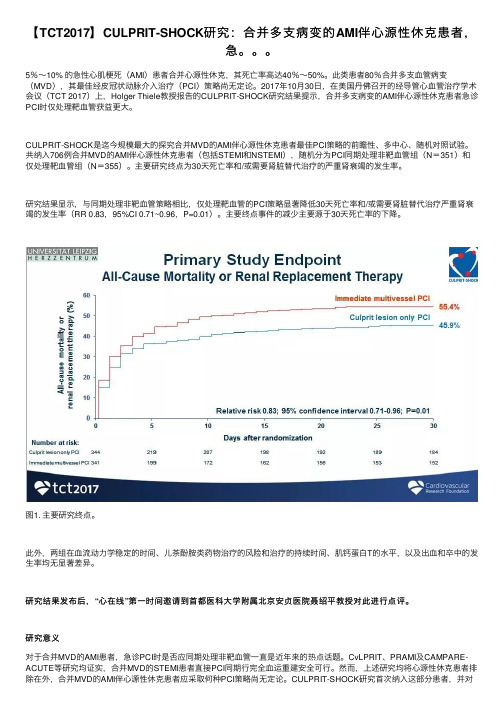
共纳⼊706例合并MVD的AMI伴⼼源性休克患者(包括STEMI和NSTEMI),随机分为PCI同期处理⾮靶⾎管组(N=351)和仅处理靶⾎管组(N=355)。
主要研究终点为30天死亡率和/或需要肾脏替代治疗的严重肾衰竭的发⽣率。
研究结果显⽰,与同期处理⾮靶⾎管策略相⽐,仅处理靶⾎管的PCI策略显著降低30天死亡率和/或需要肾脏替代治疗严重肾衰竭的发⽣率(RR 0.83,95%CI 0.71~0.96,P=0.01)。
主要终点事件的减少主要源于30天死亡率的下降。
图1. 主要研究终点。
此外,两组在⾎流动⼒学稳定的时间、⼉茶酚胺类药物治疗的风险和治疗的持续时间、肌钙蛋⽩T的⽔平,以及出⾎和卒中的发⽣率均⽆显著差异。
研究结果发布后,“⼼在线”第⼀时间邀请到⾸都医科⼤学附属北京安贞医院聂绍平教授对此进⾏点评。
研究意义对于合并MVD的AMI患者,急诊PCI时是否应同期处理⾮靶⾎管⼀直是近年来的热点话题。
CvLPRIT、PRAMI及CAMPARE-ACUTE等研究均证实,合并MVD的STEMI患者直接PCI同期⾏完全⾎运重建安全可⾏。
然⽽,上述研究均将⼼源性休克患者排除在外,合并MVD的AMI伴⼼源性休克患者应采取何种PCI策略尚⽆定论。
心源性休克诊疗

上述并发症的共同血流动力学
后果是收缩期有较多的血液发生 分流、返流或郁积在室壁瘤中, 导致心搏出量和射血分数比较显 著降低乃致休克
五.临床表现 早期: 心率增快、面色苍白、烦躁不 安、出汗、四肢皮肤温度正常或稍低、尿量 稍减少 原因:心脏泵功能衰竭,心脏排血量 下降,动脉血压开始降低,使交感神经兴奋, 儿茶酚胺释放增多并出现早期血灌注不足所 致 特点:神志尚清晰、动脉压变化尚不 明显,收缩压正常或偏低,舒张压略升高, 脉压小
心原性休克的诊治进展
卜培莉
概念 心原性休克(Cardiogenic Shock CS)是由于各种原因所致 心功能异常从而导致动脉血压下降、 组织灌流不足的一种状态。心源性 休克的临床概念是心脏输出功能降 低及血管容量不足出现的组织低氧 血症表现,床旁诊断包括少尿、皮 肤花斑、四肢皮肤湿冷等。
血液动力学标准是
二、病因 (一)急性心肌梗死 心原性休克最 常见的病因是 AMI(广泛性),而原梗 塞血管再阻塞、梗死范围扩大或因代谢 异常非梗死区域心肌功能减退时休克可 延迟发生。 (二)其它原因 心原性休克也可由 其它机械性并发症原因引起——如急性 二尖瓣返流、室间隔穿孔或游离壁破裂 或大面积右室梗死。见表1
表1 心原性休克常见原因 急性心肌梗死 左室心肌大面积坏死 右室泵衰竭 急性心肌梗死机械并发症 二尖瓣关闭不全 乳头肌功能不全 乳头肌断裂 室间隔穿孔 游离壁穿孔 左室室壁瘤 其它 终末心肌病 心肌炎
心肌挫伤 左室流出道梗阻 主动脉瓣狭窄 肥厚型梗阻性心肌病 左室流入道梗阻 二尖瓣狭窄 左房粘液瘤 二尖瓣球状血栓 严重心律失常 急性心脏压塞 急性大块肺栓塞 心肺移植的并发症 慢性心衰的终末期
1).乳头肌功能不全或断裂 通常发生在起病后第一周内, 前者较多见,后者较少见但病情 严重,多见于下壁心肌梗死,断 裂的累及部位(乳头肌身或头部) 可引起不同程度二尖瓣返流
心源性休克诊治要点,一篇文章全面掌握

心源性休克诊治要点,一篇文章全面掌握心源性休克的诊断标准是什么?心源性休克的诊断标准包括临床和血流动力学两方面。
不过不同临床试验和指南中心源性休克的诊断标准有所差异,详见下表。
表1 不同临床试验和指南中心源性休克的诊断标准诱发心源性休克的原因都有哪些?心源性休克是一组临床综合征,其中包括多种病因,临床上应该特别重视病因的识别。
急性心肌梗死、急性心衰失代偿期、左室流出道梗阻、右室泵衰竭、急性瓣膜返流、心脏破裂、心包切开术后综合征等均可诱发心源性休克,其中左室衰竭相关疾病占到了心源性休克病因的 78.5%,急性心肌梗死是首位病因。
表2 心源性休克的病因/诱因及其处理原则治疗心源性休克的常用药物包括?心源性休克的药物治疗主要包括血管收缩药物和正性肌力药物,血管扩张药疗效尚未得到广泛的认可,存有较大争议。
常用的升压/正性肌力药物包括多巴胺(中等及大剂量)、多巴酚丁胺、去甲肾上腺素、肾上腺素、米力农及左西孟旦等。
表3 血管活性药物的作用机制和血液动力学作用其中多巴胺是一种很常用的药物,使用剂量不同作用也不同。
如果使用小剂量,可以兴奋多巴胺受体,改善肾脏灌注,加强利尿的作用;如果用于改善心肌收缩力,可以使用中等剂量(3-5μg/kg·min);如果是用于升压,则需要大剂量多巴胺,需要大于5μg/kg·min的剂量,甚至达到10μg/kg·min以上。
多巴酚丁胺也是常用的药物之一,特点是增加心肌收缩力作用比较强,而升压作用弱。
如果应用多巴胺等药物仍不能使血压上升,则应使用肾上腺素和去甲肾上腺素。
说了这么多,有没有指南共识可以参考?2015年7月,法国重症监护学会(FICS)发布了《成人心源性休克治疗管理专家建议》。
FICS推荐:➤通过正性肌力药物和(或)血管活性药物将平均动脉压(MAP)升至至少65 mmHg,高血压患者允许更高;➤心源性休克患者应用去甲肾上腺素来维持有效灌注压(强烈推荐);➤肾上腺素作为多巴酚丁胺及去甲肾上腺素的替代治疗(弱推荐);➤多巴酚丁胺用于心源性休克时低心排量治疗(强烈推荐);➤磷酸二酯酶峰抑制剂或左西孟旦不作为一线用药;硝酸酯类药物可致血压降低,不推荐应用。
急性心肌梗死并发心源性休克的处理要点(全文)

急性心肌梗死并发心源性休克的处理要点(全文)急性心肌梗死(Acute myocardial infarction)并发心源性休克的发生率5%-10%,多见于急性广泛前壁心肌梗死,梗死面积超过40%,或出现室间隔穿孔、乳头肌断裂等机械并发症的AMI患者。
右室梗死后低血压状态未得到及时纠正,之后进展和发生的休克也应属于广义的心源性休克之列。
仅使用药物治疗AMI和合并心源性休克的死亡率高达70%-80%。
AMI发生心源性休克的机制是由于大面积心肌受损、心肌收缩力下所致的急性、严重泵衰竭,由此导致的心输出量明显减少使得组织灌注不足、缺血缺氧等微循环障碍。
心源性休克的诊断标准:①收缩压《90mmHg,或平均动脉压下降》30mmHg,或高血压患者较原收缩压下降60mmHg,至少持续30分钟;②心排血量(CI)《1.8L/min/m2或支持治疗下《2.2L/min/m2;③肺毛细血管楔压(PCWP)》15mmHg;④肢体低灌注:肢体发冷、全身发紺、尿量减少(每小时<30ml或0.5ml/kg.h)、血清乳酸水平>2.0mmoL/L、精神状态异常。
AMI并发的心源性休克的患者具有以下特点,高龄、前壁心肌梗死、既往有心肌梗死、严重心绞痛心力衰竭病史,造影发现为左主干或前降支近端闭塞,严重的三支血管病变。
AMI合并心源性休克治疗的重点在于①迅速开通梗死相关血管挽救心肌,在开通血管的策略上强调在严重低血压休克的情况下,溶栓药物效果不佳。
急诊冠脉造影及球囊扩张、支架植入比药物溶栓具有更好的效果,在病变血管的同期还是分期处理的策略上,2018ESC AMI救治指南认为合理的原则是AMI急诊PCI的原则是只开通梗死相关动脉(IRA),其余严重狭窄病变血管的处理延期分次进行。
其依据是近期大规模临床试验发现,急性期只开通梗死相关血管,心梗后30天死亡率低于同期处理多支严重狭窄病变,但在左室辅助装置辅助下的心源性休克患者急诊处理冠脉血管时例外。
[医药卫生]心源性休克
![[医药卫生]心源性休克](https://img.taocdn.com/s3/m/183b39713b3567ec102d8a9a.png)
血流动力学监测
(2)静脉导管监测 目前国内外广泛采用的是 Swan2Ganz 带气囊的三腔漂浮导管进行血液动力 学监则. ①肺毛细血管楔压(PCWP ) : PCWP 正常值为 6~ 12 mmHg。PCWP <18 mmHg 罕有肺充 血;18~ 20 mmHg 时开始出现;21~ 25 mmHg 时 发生轻度到中度肺充血;26~ 30 mmHg 时中到重度 肺充血;>30 mmHg时发生肺水肿。
33
心源性休克处理
总之 ,AMI合并心源性休克治疗主要有药 物、 IABP、溶栓治疗、 PCI和 CABG。在上 述方法的基础上 ,尤其是在 IABP等机械辅助 装置的支持下 ,切实有效的早期再灌注才是治 疗AMI合并顽固性心源性休克的希望。
34
Thank’S
35
25
心源性休克处理
及时纠治酸中毒 治疗目标是使血 pH值恢复 至7.130以上 ,切忌用碱过量和钠盐过多。
26
心源性休克处理
二、机械辅助治疗
(1)再灌注治疗 在急性心肌梗死时 ,再灌注治 疗是最有效的治疗措施。早期采取紧急的血管再通 术能使AMI心源性休克病死率降低60%。溶栓治疗: 溶栓治疗对发病早期(6~12h以内) 确诊为急性心肌 梗死可实施 RTPA、 UK等纤维蛋白溶解药静脉注 射。注意不良反应。对未控制的高血压和消化道溃 疡的患者禁用。
21
心源性休克处理
(2)充分通气给氧 低氧血症加重梗死边缘缺 血组织的损害,吸氧可减少梗死边缘的心肌功能进 一步受损 ,缩小梗死面积 ,尽快纠正严重低氧血症 ,打 断心衰低氧血症恶性循环。考虑鼻导管或面罩供氧。 若一般供氧措施不能使动脉血氧分压维持60mmHg 以上,给予经鼻气管内插管,给予辅助通气和正压供 氧。
心源性休克的监测及治疗(完整版)

心源性休克的监测及治疗(完整版)1、心源性休克的概述心源性休克(Cardiogenic shock,CS)是指心脏原因引起的心输出量显著下降,导致组织低灌注从而发生临床和生化改变的一种状态。
心肌梗死相关的左心室功能障碍是心源性休克的主要病因,尽管心梗后再灌注治疗率提高,但心梗相关的心源性休克院内死亡率仍高达27%~51%。
2、心源性休克的临床表现根据血容量状态和外周循环将心源性休克分为四种类型,其中三分之二的心梗所致心源性休克是湿冷型。
CI(心脏指数):为反应每分钟心脏搏血的供需关系,正常值约3-7L/min/m2。
PCWP(肺毛细血管楔压):反应肺毛细血管内的压力,通常此压力与左房压基本相等。
是左心前负荷的重要指标。
正常值:0.80~1.60kPa(6~12mmHg)。
SVRI(全身血管阻力指数):反映左心室后负荷大小。
a.湿冷型是心源性休克最常见的表现,约占心肌梗死相关心源性休克的2/3。
b. 干冷型是对利尿剂尚有反应的慢性心衰亚急性失代偿期患者的常见症状,但28%急性心梗相关心源性休克也表现为干冷型。
与湿冷型心源性休克相比,干冷型心源性休克通常PCWP 较低,且既往常无心梗史或慢性肾脏疾病史。
c. 暖湿型可见于心肌梗死后全身炎症反应综合征和血管舒张反应后,此型心源性休克体循环血管阻力较低,脓毒血症和死亡的风险较高。
d. 血压正常型心源性休克尽管SBP ≥90 mmHg,但存在外周灌注不足的表现,与血压降低型心源性休克相比,体循环血管阻力显著升高。
e. 右心室梗死型心源性休克占心梗相关心源性休克的5.3%,其具有较高的中心静脉压。
3、心源性休克监测指标无创监测包括心电、脉搏血氧、呼吸频率监测;有创监测包括动脉压、中心静脉压,中心静脉血氧饱和度肺动脉导管监测等;影像学检查包括心电图、X线、CT和经食管超声心动图等;实验室检查包括血常规、离子、肝肾功、动脉血气、乳酸、心肌标志物等。
4、心源性休克的药物治疗心源性休克患者的主要治疗药物为升压药物和正性肌力药。
2020急性心肌梗死合并心源性休克的诊断与治疗指南解读(完整版)

2020急性心肌梗死合并心源性休克的诊断与治疗指南解读(完整版)急性心肌梗死合并心源性休克,由于其治疗难度大、死亡率高,是心血管医生需要面对的最严重的考验之一。
然而,关于这类患者的治疗,其临床证据又十分有限,最优临床策略依然存在争议。
2020年ESC就急性心肌梗死合并心源性休克的诊断及治疗发布了最新指南,总结了目前主要循证证据,为心血管医师的临床决策提供依据。
本文就这一最新指南进行总结与解读。
明确了心源性休克的定义及诊断标准(1)心源性休克是指在心输出量下降的同时在血容量充足的情况下存在外周组织缺氧。
(2)新的定义将心源性休克分为五个阶段:(a)存在心源性休克风险;(b)初始或休克前期(指临床存在低血压或心动过速,但尚无组织低灌注表现);(c)典型休克期;(d)恶化期;(e)终末期(3)明确了心源性休克的诊断标准,包括低血压(a)、组织低灌注(b)、左室充盈压增高(c)及心脏泵功能受损(d),必须满足上诉四个条件,方可诊断心源性休克。
具体标准见下表:心源性休克的风险评估推荐使用IABP-SHOCK II评分对心肌梗死合并心源性休克的患者进行风险评估,根据评分将患者分为低、中、高危三组,其30天死亡率分别为20-30% 、40-60%以及70-90%。
具体评分见下表:再血管化治疗策略SHOCK研究为首个关于心肌梗死合并心源性休克患者侵入性再血管化治疗效果的临床研究,同药物治疗相比,侵入性的再血管化治疗能够显著降低患者6个月及长期死亡率。
因此,指南推荐对于心肌梗死合并心源性休克患者早期启动侵入性再血管化治疗。
在SHOCK研究中,不论PCI 或CABG作为再血管化策略,其临床结局无显著差异。
指南推荐PCI治疗作为再血管化首选策略,对于PCI失败或冠脉解剖结构不适合PCI的患者,建议CABG治疗。
由于对于合并心源性休克患者,溶栓疗效有限,因此仅推荐用于无法接受PCI治疗的STEMI患者,推荐等级IIa C。
一例急性心肌梗死合并心源性休克成功溶栓患者的护理

一例急性心肌梗死合并心源性休克成功溶栓患者的护理急性心肌梗死(acute myocardial infarction,AMI)是一种常见的心血管疾病,一旦发生,常常会危及患者的生命。
心源性休克则是严重的心功能不全,是一种使心排血量显著降低的状况。
护理对于这类患者非常重要,下面是一例急性心肌梗死合并心源性休克成功溶栓患者的护理措施。
一、体格检查:对患者进行全面的体格检查,包括血压、心率、呼吸、皮肤、精神状态等方面的观察,以了解患者的生命体征和病情变化。
二、监测心电图:心电图是诊断心肌梗死和判断病情变化的重要指标,对患者进行24小时持续心电图监测,及时发现异常的心律、心室扩张或出现新的传导阻滞等情况。
三、监测血压及血氧饱和度:因心源性休克患者心排血量降低,会导致低血压和低氧血症,及时监测血压和血氧饱和度,调整药物治疗,维持血液循环和供氧。
四、常规心脏药物的给药:根据患者的具体情况,给予抗心绞痛、降压、抗凝等常规心脏药物,如硝酸甘油、阿司匹林、普通肝素等,以缓解心绞痛症状、降低血压和抑制凝血功能。
五、抗心律失常药物的给药:如果患者出现室性心律失常,应及时给予抗心律失常药物,如胺碘酮、利多卡因等,以维持正常的心律。
六、给予吗啡:心肌梗死合并心源性休克的患者常常会有剧烈的心绞痛,给予吗啡可以缓解疼痛,减轻心肌负荷并扩张冠状动脉。
七、溶栓治疗:对于心肌梗死患者,如果症状符合溶栓治疗的指征,应尽早给予溶栓药物,如尿激酶、重组组织型纤溶酶原激活剂等,溶解血栓,恢复血流,保护心肌。
八、卧床休息:在溶栓治疗后的初期,应让患者卧床休息,避免剧烈活动和过度劳累,以减轻心脏负荷,促进心肌恢复。
九、心理护理:心肌梗死合并心源性休克的患者往往会有严重的心理压力,护理人员需要进行心理疏导,提供安全、温暖的护理环境,帮助患者缓解焦虑和恐惧。
十、教育宣教:对患者进行疾病相关知识的教育宣教,包括合理饮食、规律生活、药物的正确使用等方面的知识,让患者有良好的生活习惯,预防病情恶化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 机械并发症
– 急性二尖瓣关闭不全 – 游离壁破裂 – 室间隔穿孔
• 急性失代偿性心衰 • 流出道梗阻 • 心包填塞 • 心脏骤停后顿抑 • SIRS时的心肌抑制 • 心脏挫伤
左心泵衰竭是AMI合并CS最常见的原因
孤立性右室心梗 3.4%
心脏破裂 1.7%
其他 7.5%
室间隔穿孔 4.6%
急性二尖瓣返流 8.3%
泵衰竭
74.5%
Adapted From Sanborn T. et al, JACC. 2000
3% 5%
心源性休克是急
25%
性心肌梗死直接
PCI后早期死亡的
最主要原因
1% 2%1% 22%8%3%
10%
12%
39%
2% 39%
心源性休克的死亡率
• 中国急性心肌梗死注册研究(CAMI)2013 年统计:心源性休克患者住院死亡率36.4% (227/623)
是否存在心脏骤停与预后相关
Cardiac Arrest
(+)
Cardiogenic Shock (+)
184 Patients In-hospital Mortality:
ml/h) • 神志淡漠 • 低氧血症 • 代酸
血流动力学 异常
• CI<2.2 L/min/m2 • PCWP>15 cmH2O • CVP>12 cmH2O • SVR> 1400 dyn.s.cm-5
排除其他原因 所致血压下降
• 心律失常 • 容量不足 • 剧烈疼痛 • 心肌抑制药 • 过敏 • 感染 • 出血性休克
2. Acute Cardiac Assist Report, Health Research International – August 2015 3. Jeger, et al. Ann Intern Med. 2008
AMI合并心源性休克血运重建比例及住院死亡率
NRMI注册数据
Mayo Clin Proc Innov Qual Outcomes. 2017 Jun 8;1(1):26-36.
• 293,633例STEMI患者 • 775家美国中心 • 心源性休克25311例,
8.6% • 发生率7-10%,且每年
变化不大 • CAMI 2013年统计:心
源性休克发生率 4.2%
Babaev et al JAMA 2005 294:448
预后很差:30天死亡率高
USIK 1995, USIC 2000, FAST-MI France National Registry 2005 Aissaoui et al. Eur Heart J 2012; 33:2535–2543
3%
3%
22%
宋雷、杨跃进等,中华心血管病杂志,2012年,40(7),554-58
心源性休克 机械并发症 介入操作并发症 药物相关并发症 其它合并症
心源性休克 心脏破裂 室间隔穿孔 乳头肌断裂 无再流 支架血栓 冠脉穿孔 穿刺并发症 过敏性休克 脑出血 严重感染 脑梗死
心源性休克的发生率-NRMI注册研究
47.3% 1 – Year Mortality:
51.6%
259 Patients In-hospital Mortality:
25.1% 1 – Year Mortality:
33.6%
Cardiogenic Shock (–)
317 Patients In-hospital Mortality:
AMI合并心源性休克的诊断及治疗
Cardiogenic Shock
由于心脏泵血功能严重受损,不能维持最低限度心 输出量,导致血压下降,重要脏器和组织供血不足,引 起全身性微循环功能障碍,从而出现一系列缺血、缺氧、 代谢障碍及重要脏器损害为特征的病理生理过程,是心 泵衰竭的最严重的表现形式
病因
• 急性心肌梗死
死亡率下降趋势不明显
US AMI/CGS cases per year1,2
74355
78954 78500 79823
89923 86692
82626 80585
N = 23,696
2009 2010 2011 2012 2013 2014 2015 2016
1. Sandhu A, McCoy l, Negi S, et al. Use of Mechanical Circulatory Support in Patients Undergoing Percutaneous Coronary Intervention; Insights from the National Cardiovascular Data Registry. Circulation, 2015;132:1243-1251
➢ 糖尿病 ➢ 曾有心梗史 ➢ PCI延误时间长 ➢ 前降支完全闭塞 ➢ 二尖瓣返流 ➢ 多支血管病变
病生理机制
临床表现与诊断标准
低血压
• 血压正常者 SBP<80度≥60mmHg
• 至少30分钟
低灌注
• 四肢湿冷 • 呼吸浅促 • 少尿(≤30
20.2% 1 – Year Mortality: 22.7%
4157 Patients In-hospital Mortality:
1.7% 1 – Year Mortality: 5.5%
Cardiac Arrest
(–)
心源性休克死亡预测因素
➢ 高龄 ➢ 女性 ➢ LVEF<35% ➢ 慢性肾功能不全 ➢ 初始、最终TIMI血流1级 ➢ 收缩压低
Forrester JS et al 1976; 295:1404-13 Hollenberg Ann Int Med 1999; 131:47-99
心源性休克死亡率在介入时代有所下降
AM
C
SHOCK Trial AMC
Euro Heart Survey
IABPSHOCK
2
pre-Thrombolysis
Thrombolysis
Primary PCI ↑ IABP↑
Goldberg et al. NEJM 1999; Hochman et al. NEJM 1999; Sjauw, Henriques et al. NHJ 2012 Zeymer et al. Eurointervention 2011; Thiele NEJM 2012
