血红蛋白资料整理
以血红蛋白为例,说明蛋白质结构与功能的关系

以血红蛋白为例,说明蛋白质结构与功能的关系
血红蛋白是一种复杂的蛋白质,它的结构与功能有着密切的关系。
以下是血红蛋白的结构与功能的关系:
1. 分子结构:血红蛋白是由四个亚基组成的,每个亚基都由一
条多肽链和一个血红素辅基组成。
多肽链的氨基酸序列决定了血红蛋白的构象,而血红素辅基则是血红蛋白与氧气结合的关键部分。
2. 氧结合:血红蛋白的主要功能是运输氧气。
在肺部,血红蛋
白与氧气结合,形成氧合血红蛋白,然后将其运输到身体各处。
在组织中,氧合血红蛋白释放氧气,供组织利用。
3. 构象变化:当血红蛋白运输氧气时,其构象会发生变化。
这
种构象变化使得血红蛋白能够与氧气紧密结合,并将其运输到身体各处。
4. 酸碱性质:血红蛋白还具有酸碱性质,能够缓冲血液中的酸
碱变化。
这有助于维持血液pH的恒定。
5. 运输其他物质:除了氧气外,血红蛋白还能运输其他气体,
如二氧化碳、一氧化碳和氮气等。
总之,血红蛋白的结构决定了其功能。
其分子结构、氧结合能力、构象变化、酸碱性质以及运输其他物质的能力都与其复杂的结构和功能密切相关。
血红蛋白的主要成分

血红蛋白的主要成分
血红蛋白是人体循环系统的重要组成部分,主要是在血液中存在,它的
主要成分是蛋白质和铁离子Fe2+,还含有一定量的维生素和氨基酸。
蛋白质是血红蛋白的主要成分,占血红蛋白总量的百分之八十五到九十。
血红蛋白蛋白质属于四聚体结构,主要是称为α和β亚基的α和β结构
域组成,它们由多种不同的氨基酸组成。
α亚基共有148个氨基酸残基组成,β亚基共有141个。
α和β结构域相连,由氨基酸稠密床结构连接,
产生共价键和非共价键,使其形成一个稳定的四聚体结构。
它的稳定性帮助
血红蛋白将氧气从肺部输送到其他组织和器官。
另一个血红蛋白的主要成分是铁离子Fe2+。
它占血红蛋白的百分之十到
十五,参与血红蛋白蛋白的修饰和聚集,并参与氧转运的过程。
血红蛋白内
的铁离子与血红蛋白蛋白质6个氨基基团形成鍵结,使蛋白质具有足够的稳
定性,能够将单个氧分子直接结合,将其输送到组织和器官中去。
血红蛋白的结构中,还含有一定量的维生素和氨基酸。
其中,维生素是
血红蛋白的重要营养成分,主要有维生素B6、维生素B12、烟酸等。
氨基酸
主要是亮氨酸、苏氨酸和缬氨酸。
它们不仅有助于改善血红蛋白的结构,还
可以帮助铁离子与血红蛋白蛋白质结合。
总之,血红蛋白是人体循环系统中重要的成分。
它由蛋白质、铁离子
Fe2+、维生素和氨基酸组成,能够将氧气从肺部输送到其他组织和器官,从
而维持人体的健康。
血红蛋白化学结构

血红蛋白化学结构【原创版】目录1.血红蛋白的定义与功能2.血红蛋白的组成3.血红蛋白的结构4.血红蛋白的结构与功能的关系5.血红蛋白在医学上的应用与意义正文血红蛋白是一种负责运载氧的蛋白质,主要存在于高等生物体内。
在本文中,我们将详细讨论血红蛋白的化学结构。
1.血红蛋白的定义与功能血红蛋白是一种红色含铁的蛋白质,主要存在于红细胞内,负责将氧气从肺部输送到身体各部位,同时也将二氧化碳从身体各部位带回肺部排出体外。
2.血红蛋白的组成血红蛋白由四个亚基组成,每个亚基包含一个血红素分子和一条多肽链。
血红素分子是一种具有卟啉结构的小分子,在卟啉分子中心,由卟啉中四个吡咯环上的氮原子与一个亚铁离子配位结合。
3.血红蛋白的结构血红蛋白的结构可以分为四级,其中一级结构是由氨基酸组成的多肽链,二级结构是由多肽链中的氢键形成的稳定结构,三级结构是由多肽链的盘绕和折叠形成的球状结构,四级结构是由四个亚基组成的总体结构。
4.血红蛋白的结构与功能的关系血红蛋白的结构决定了其功能。
血红蛋白的四个亚基可以自动组装成22 的形态,这种结构可以使血红蛋白在肺部结合氧气,然后将氧气输送到身体各部位。
同时,血红蛋白的结构还可以使其在二氧化碳浓度较高的部位释放氧气,从而保证身体各部位氧气供应的平衡。
5.血红蛋白在医学上的应用与意义血红蛋白在医学上具有重要的应用价值。
通过检测血红蛋白的水平,医生可以了解患者的健康状况,例如,血红蛋白偏高可以见于高原民,激烈运动,情绪激动等生理性原因,也可见于乙肝患者,肺心病患者,肿瘤或肾脏疾病等。
因此,了解血红蛋白的化学结构对于医学研究和临床诊断具有重要意义。
总结:血红蛋白是一种负责运载氧的蛋白质,其化学结构决定了其功能。
血红蛋白的结构和功能介绍

血红蛋白氧合时和去氧时结构明显不同,特别是α 和β亚基的相互作用发生变化 按接触界面分2种 装配接触: α1β1和α2β2中α β的接触 BGH 滑动接触: α1β2和α2β1中α β的接触C G FG
二聚体半分子
• 当Hb因氧合作用而发生构象变化时,主要是 滑动接触发生改变。
• 血红蛋白可看成是两个相同的二聚体半分子 组成:α1β1-甲基对和α2β2-甲基对。
HisE7
•称为远端组氨 酸。
•它在血红素基 于氧结合的一侧, 不与Fe (II)成 键,但与O2分 子紧密接触,形 成一个空间位阻 区域。
这个位阻区域对降低血红素对CO的亲和力起重 要作用
血红蛋白
α-亚基(2) β-亚基(2)
α-珠蛋白 血红素 β-珠蛋白
血红蛋白是杂四聚体
• 血红蛋白分子由2个α亚基和和2个β亚基构成 • 血红蛋白的三维结构近似球形,4个亚基占据相当
鲍林是著名的量子化学家,他在化学的多 个领域都有过重大贡献。曾两次荣获诺贝 尔奖(1954年化学奖, 1962年和平奖)
Kendrew J.C.(1917) 英国生物物理和分子生 物学家,在1957年和 1960年用X衍射分析了 肌红蛋白的三维结构。
英国剑桥医学研究院Max Perutz 通过分析血红蛋白 晶体的X射线衍射结果,确 定了人类血红蛋白的三维结 构。
主要类型:
(1)镰状细胞病 (2)不稳定血红蛋白病 (3)血红蛋白M病 (4)氧亲和力改变的血红蛋白病
异常血红蛋白病的分子基础 ——珠蛋白基因突变
主要类型: (1)单个碱基置换 (2)移码突变 (3)密码子的缺失和插入 (4)融合基因
地中海贫血
——珠蛋白链合成数量不平衡
最初发现在地中海地区居住的人群发病率特别 高而得名,实际上世界各地都有发生,非洲和东 南亚也比较常见。
简述血红蛋白的结构及其结构与功能的关系

血红蛋白的结构及其结构与功能的关系1. 引言血红蛋白是存在于人体红细胞中的一种重要蛋白质,它负责运输氧气到全身各个组织和器官。
血红蛋白的结构与功能密切相关,通过对血红蛋白结构的研究,可以更好地理解其功能机制以及与疾病的关系。
本文将从血红蛋白的结构入手,详细探讨血红蛋白的结构及其与功能的关系。
2. 血红蛋白的结构血红蛋白是由四个亚基组成的复合物,每个亚基都含有一个血红素分子。
血红蛋白的结构可以分为四个层次:初级结构、二级结构、三级结构和四级结构。
2.1 初级结构血红蛋白的初级结构是指其氨基酸序列。
人体血红蛋白由两个α链和两个β链组成,每个链上有约140个氨基酸残基。
这些氨基酸残基中,有一部分是与血红素结合的位点,起到固定血红素的作用。
2.2 二级结构血红蛋白的二级结构是指氨基酸链的局部折叠形式。
血红蛋白中存在α螺旋和β折叠这两种常见的二级结构。
α螺旋主要存在于α链中,而β折叠主要存在于β链中。
2.3 三级结构血红蛋白的三级结构是指整个蛋白质分子的折叠形式。
血红蛋白的四个亚基通过非共价键相互连接,形成一个四聚体结构。
这种四聚体结构的形成是由于亚基之间存在的电荷相互作用、氢键和疏水效应等。
2.4 四级结构血红蛋白的四级结构是指多个蛋白质分子之间的相互组合形成的超级结构。
在血红蛋白中,四个亚基的结合形成了一个稳定的四聚体结构,这种四聚体结构使血红蛋白具有高度的稳定性和特异性。
3. 血红蛋白的功能血红蛋白的功能主要是运输氧气到全身各个组织和器官。
血红蛋白的结构与其功能密切相关,下面将详细介绍血红蛋白结构与功能的关系。
3.1 血红蛋白与氧气结合血红蛋白的四个亚基中,每个亚基都含有一个血红素分子。
血红素分子中的铁离子能够与氧气发生结合,形成氧合血红蛋白。
血红蛋白的结构决定了其与氧气结合的能力和速度。
具体来说,血红蛋白中的氨基酸残基可以通过氢键和静电作用与氧气分子相互作用,从而实现氧气的结合和释放。
3.2 血红蛋白的氧气运输血红蛋白通过与氧气的结合,将氧气从肺部运输到全身各个组织和器官。
血常规检查指标:血红蛋白

血常规检查指标:血红蛋白血常规检查血液检验是临床应用最广泛,蕴涵信息量最大的基础检验项目,是评价患者及健康体检者身体素质状况的最基本内容。
各组织器官的生理、病理变化累及血液系统时,可引起相关血细胞的数量、形态、比例异常,也可引起血液生化成分及血液流动行为的改变。
同时,血液系统本身的疾病也会影响全身各组织器官生理功能。
红细胞计数红细胞(RBC)是血液中数量最多的有形成分,在正常情况下约占血容量的一半。
多种原因可引起红细胞生成和破坏的平衡失调,使红细胞在质和量上发生改变,从而引起一系列疾病。
参考区间:成年人:男性(40~5∙5)X1012∕1.,女性(3.5~5.0),新生儿:(6・0~7.0)X1012/1.。
血红蛋白血红蛋白(Hb或HGB)是红细胞的主要成分,由血红素和珠蛋白组成。
参考区间成年人:男性12O76Og∕1.,女性11O75Og∕1.0新生儿:170-200g∕1.°临床意义血红蛋白含量与红细胞数量密切相关,临床意义基本相同,但二者增减的程度有时不一定成比例。
同时测定对贫血的诊断有重要意义。
1.生理性变化①新生儿、高原生活、剧烈运动等,红细胞、血红蛋白偏高;②6个月至2岁婴儿、老年人、妊娠中、晚期等,红细胞通常降低;③静脉血较毛细血管血低10%-15%;④同一天内上午7时检测结果最高;⑤某些药物(如毛果芸香碱钻、肾上腺素、糖皮质激素等)和情绪波动也可引起红细胞增加。
这些差异造成的数值浮动一般在±20%以内。
2.病理性升高(1)绝对性升高:指血浆容量不变,红细胞和血红蛋白浓度绝对值增加。
①原发性升高:见于真性红细胞增多症,RBC可达(770)X1012/;Hb>180g/1.;②继发性升高:是由于机体长期缺氧,刺激促红细胞生成素(EPO)大量分泌所致。
见于慢性心、肺疾病,异常血红蛋白病,肾上腺皮质功能亢进等。
也可见于某些疾病引起的EPO病理性分泌增加。
⑵相对性升高:是各种原因导致血液暂时性浓缩所致,见于剧烈呕吐、高热腹泻、多尿、多汗、大面积烧伤等。
血红蛋白异常所致的贫血及其实验诊断考点总结
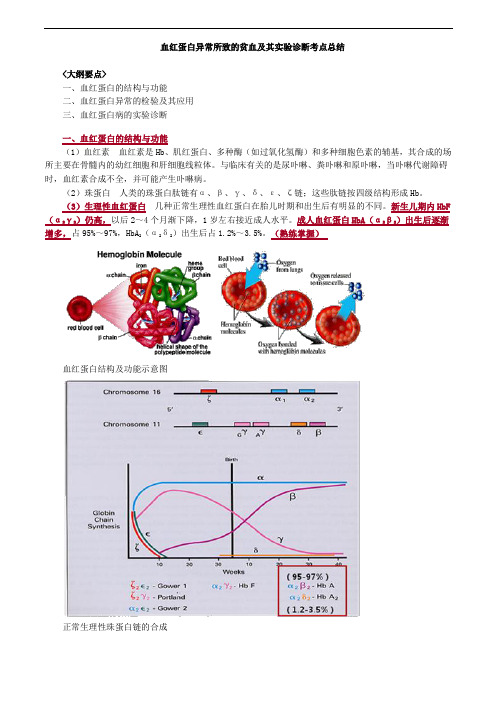
血红蛋白异常所致的贫血及其实验诊断考点总结<大纲要点>一、血红蛋白的结构与功能二、血红蛋白异常的检验及其应用三、血红蛋白病的实验诊断一、血红蛋白的结构与功能(1)血红素血红素是Hb、肌红蛋白、多种酶(如过氧化氢酶)和多种细胞色素的辅基,其合成的场所主要在骨髓内的幼红细胞和肝细胞线粒体。
与临床有关的是尿卟啉、粪卟啉和原卟啉,当卟啉代谢障碍时,血红素合成不全,并可能产生卟啉病。
(2)珠蛋白人类的珠蛋白肽链有α、β、γ、δ、ε、ζ链;这些肽链按四级结构形成Hb。
(3)生理性血红蛋白几种正常生理性血红蛋白在胎儿时期和出生后有明显的不同。
新生儿期内HbF (α2γ2)仍高,以后2~4个月渐下降,1岁左右接近成人水平。
成人血红蛋白HbA(α2β2)出生后逐渐增多,占95%~97%,HbA2(α2δ2)出生后占1.2%~3.5%。
(熟练掌握)血红蛋白结构及功能示意图正常生理性珠蛋白链的合成二、血红蛋白异常的检验及其应用1.血红蛋白电泳(原理了解,其余掌握)2.抗碱血红蛋白测定(熟练掌握)3.异丙醇沉淀试验(掌握)4.红细胞包涵体试验(掌握)5.HbA2测定(熟练掌握)6.珠蛋白肽链分析(掌握)7.红细胞镰变试验(掌握)1.血红蛋白电泳原理:根据不同的血红蛋白带有不同的电荷,等电点不同,在一定的pH缓冲液中,缓冲液的pH大于Hb的等电点时其带负电荷,电泳时在电场中向阳极泳动,反之,Hb带正电荷向阴极泳动。
经一定电压和时间的电泳,不同的血红蛋白所带电荷不同、相对分子质量不同,其泳动方向和速度不同,可分离出各自的区带,同时对电泳出的各区带进行电泳扫描,可进行各种血红蛋白的定量分析。
参考值:pH8.6TEB缓冲液醋酸纤维膜电泳,正常血红蛋白电泳区带:HbA>95%、HbF<2%、HbA2为1.0%~3.1%。
pH8.6TEB缓冲液适合于检出HbA、HbA2、HbS、HbC,但HbF不易与HbA分开,HbH与HbBarts不能分开和显示,应再选择其他缓冲液进行电泳分离。
血红蛋白的结构与功能

血红蛋白的结构与功能蛋白质功能的多样性蛋白质的而生物化学功能1.催化:酶酶的催化效率远远高于合成的催化剂2.调节:激素:胰岛素——调节血糖,糖代谢生长激素——促进人的生长,且能调节体内的物质代谢促甲状腺激素——刺激甲状腺激素的合成和甲状腺素的释放3.转运:血红蛋白——通过血液循环转运物质,运输氧气,存在与红细胞肌红蛋白——贮存和分送氧的蛋白质,存在于肌肉细胞4.贮存:铁蛋白——贮存Fe,用于含铁蛋白质如血红蛋白的合成5.运动:前面学过的肌动蛋白和肌球蛋白,微丝微管。
6.结构成分:纤维状蛋白质——α-角蛋白,胶原蛋白、7.支架作用:支架蛋白——在细胞应答激素和生长因子的复杂途径中起作用的8.防御和进攻:抗体等血红蛋白的结构血红蛋白(HB)分子由4个多肽亚基组成,一般成人血红蛋白主要是HbA,其亚基组成为α2β2,每个亚基都有一个辅基,称为血红素。
血红素是原卟啉IX与还原型铁Fe(II)的络合物。
原卟啉IX是由4个吡咯环组成,与之相连的有四个甲基,2个乙烯基和2个丙酸基。
亚铁离子有六个配位键,4个与吡咯环的N原子结合,另外两个与卟啉环面垂直,配体的4个N原子有助于抑制血红素铁原子转变为三价态,如果铁二价态变为三价态,血红蛋白就变成高铁血红蛋白,无载氧功能。
血红蛋白的三维结构近似球形,4个亚基占据相当于四面体的4个顶角,整个分子形成C2点群对称。
4个血红素基分别位于每个多肽链的E和F螺旋之间的裂隙处,并暴露在分子表面。
4个氧结合部位彼此保持一定距离,两个最近的铁离子(α1和β2血红素或α2和β1血红素Fe)之间的距离为2.5nm。
两个不同链之间的亚基相互作用最大,而两个α链之间或两个β链之间的相互作用很小。
两个不同类型的亚基是为了获得协同性氧结合必需的。
珠蛋白的三级结构肌红蛋白的脱辅基蛋白质称为珠蛋白。
血红蛋白α(α-珠蛋白)、β(β-珠蛋白)链的结构与肌红蛋白的结构很相似,尽管这三种氨基酸仅有27个是相同的,比较了多种不同的血红蛋白的氨基酸序列,证明残基是可以调换的,但有9个位置的残基是所有研究过的血红蛋白所共有的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
血红蛋白整理资料汇总
血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为Hb或HGB)。
是使血液呈红色的蛋白。
郎伯定律:一束一定波长的单色光通过一定浓度的均匀溶液时,光强度的减弱与液(光吸收层)厚度b的增加成正比。
其数学表达式如下式ln(I0/I t)=a1b
比尔定律:一束一定波长的单色光通过溶液层厚度一定且均匀的可吸收光的溶液时,光强度的减弱与溶液浓度的增加C和入射光强度成正比:ln(I0/I t)=a2c
将两定律合并,即为朗伯一比尔定律,可以将它看作是上述分子振动原理的宏观表示,对于含n种物质成分的混合溶液而言,其完整的数学表示式为:
吸收系数a是物质本身的固有性质。
实验证明,不同浓度的同一物质在相同波长处具有相同的吸收系数;对于每一物质,不同波长处其吸收系数不同。
公式的适用条件为:
(1)吸收过程中各物质间无相互作用,但各物质的吸光度具有可加合性;
(2)辐射与物质的作用仅限于吸收过程,无荧光、散射光等化学现象;
(3)吸收物是一种均匀分布的连续体系。
血红蛋白最佳测量测量位置:食指屈侧第二关节处。
波长选择:660.730.735.760,805.810.850.940。
通常在600-1000nm之间,人体皮肤的透光性最好,组织对光的吸收最小。
测量方法:有创,微创,无创。
无创:1.光电容积脉搏波描记法;
2.动态光谱法;
3.近红外光谱法;
4.稳态空间分辨方法
5.现如今世界各个国家对于无创血糖检测的研究有很多,研究的方法也很多,主要方法包括近红外光谱法、中红外光谱法、拉曼光谱法、光散射法、偏振光旋光法、毫米波检测法、光声谱法、颜色法、无线电阻抗法、超声法和代谢热整合法等。
EMD(经验模态分解)算法进行光电采集数据的预处理可以提高光谱数据的信噪比,可以提高血红蛋白测量的准确度。
EMD方法是由H uang等于1998年提出的一种数据消噪算法,具有分解模态少、不用选择基函数等优点,己越来越多地应用于非线性、非平稳信号的线性化和平稳化处理。
应用S-G平滑,移动窗口平滑及EMD分解方法进行数据预处理,有效抑制噪声,提高脉搏波数据信噪比。
建立BP-ANN定量分析模型并预测,经EMD去燥后所建模型预测效果最优。
光源:溴钨灯;接收:频谱仪;
影响因素:升高的血胆红素水平能够对无创血红蛋白的测量产生影响。
虽然血胆红素浓
度与无创血红蛋白测量误差之间没有直接的关系,但高胆红素血症存在时,无创血红
蛋白的测量误差将随总血红蛋白浓度的降低而增大。
难关:消除个体差异
PPG
光子在人体组织中会吸收和散射,一部分光子多次散射会改变原始的传输路径。
当心脏收缩时,动脉血被泵入周围血管,此时被血液吸收的光子增多,出射光强变弱;
当心脏舒张时,血液流回心脏,此时被血液吸收的光子减少,出射光强变强。
随时间变化的光强部分定义为AC成分;未穿过动脉血的光子,会被软组织、骨骼、静脉血吸收与散射,出射光强平稳,将出射光强度的平均值定义为DC成分。
光电探测器在组织表面得到随心脏搏动变化的光强信号(舒张-变强、收缩-变弱),此信号为PPG信号。
透射方法
1.单波长905nm的光源、超声波测距仪(测量因动脉搏动而引起的手指直径变化,此变化量可以间接地反应出光程长的该变量)使用光程长归一化PPG方法此方法可以消除个体间不同光程长之间的差异
2.电感位移传感器测手指直径变化选用5波长无结果
3.在耳垂血氧仪上加平行板电容传感器耳垂作为两电容极板间的介质电容大小会随着动脉血搏动而变化
4.人为调制血流(阻塞光谱法)
5.普通溴钨灯作光源用光谱仪进行信号检测选取600.22~951.38之间的471个波长进行分析利用人工神经网络进行校正
透射光谱方法是一种基于PPG信号的无创测量技术,一般采用600 nm一1300 nm之间的多个波长作为光源。
此技术与目前广泛使用的脉搏血氧仪类似,实现起来比较方便。
当受测者低灌注情况下,有用信息可能会淹没在背景噪声中,通过人为干预血液流动的方法可以提高信噪比。
然而,该方法仍然面临着一些难题,例如运动伪迹、个体差异、环境光干扰等。
反射方法
1.测量点:眼睑结膜光源:可见光谱利用光纤探头阵列接收反射波长
2.测量点:舌底粘膜
3.测量点:胳膊背部采用温度控制方法
4.采用植入式传感器8波长
5.测量点:手指波长:760nm、850nm 朗伯比尔定律
光谱成像法:常用表面粘膜组织作为测量位置,由于表面粘膜组织层薄,血管清晰,较小外层不相干组织,减小个体差异。
缺点是:成像设备复杂,成本高,无法实现便携式。
光声光谱法:使用近红外激光脉冲照射人体组织,局部热膨胀产生机械压力,通过声波扩散,使用皮肤表面的超声传感器对声波进行接收,通过对收到的声波信息进行分析并获取血液信息。
该方法避免了散射作用,提高时间分辨力,但是声波容易淹没在噪声中,所以要提高信噪比。
PPG的研究方法一般采用低成本的可见一近红外发光二极管(LED)作为光源,通过采集人体末端或者浅表组织的PPG信号来实现血红蛋白浓度的测量。
该方法可以集成到目前广泛使用的脉搏血氧仪上,具有硬件实现简单、成本低廉等优点。
产品可以做到小型化、便携式。
目前市面上的两款产品(Rainbow系列和NBM 200系列)均是采用该方法实现的。
但该方法仍然面临着一些难题,例如个体差异、运动伪迹、病态血红蛋白影响等问题。
