电解质溶液与缓冲溶液
无机化学第五章 电解质溶液(学生内容)
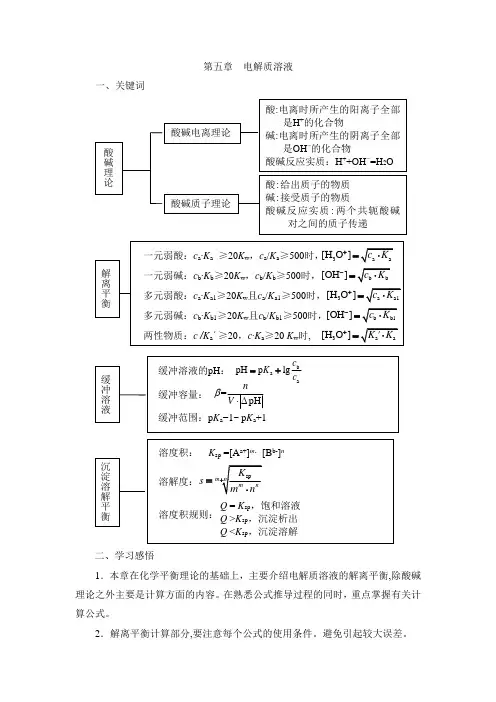
第五章电解质溶液一、关键词二、学习感悟1.本章在化学平衡理论的基础上,主要介绍电解质溶液的解离平衡,除酸碱理论之外主要是计算方面的内容。
在熟悉公式推导过程的同时,重点掌握有关计算公式。
2.解离平衡计算部分,要注意每个公式的使用条件。
避免引起较大误差。
3.本章的重点是弱电解质溶液和缓冲溶液的pH计算及难溶电解质溶度积规则的应用。
三、难点辅导1. 为什么任何物质的水溶液中都含有H3O+和OH−,而且在常温时,[H3O+]∙[OH−]=K w=1.0×10−14?无论是酸性还是碱性的物质,一旦与水形成溶液后,由于水发生的质子自递平衡中,会产生H3O+和OH−,所以任何物质的水溶液都含有H3O+和OH−。
在水溶液中,按照酸碱质子理论,酸会给出质子,碱会接受质子,这样必定会引起水的解离平衡发生移动,但水的解离平衡常数不会因平衡的移动发生改变,其解离平衡常数只与温度有关,在常温时,[H3O+]∙[OH−]=K w=1.0×10−14。
对酸性溶液来说,H3O+主要来自酸性物质(水的极少量解离可忽略),OH−则来自水的少量解离;对碱性溶液来说,OH−主要来自碱性物质(水的极少量解离可忽略),H3O+则来自水的少量解离。
2. 酸碱的强弱由哪些因素决定?酸碱的强弱首先取决于酸碱本身给出和接受质子的能力,其次取决于溶剂接受和给出质子的能力。
同一种物质在不同溶剂中的酸碱性不同,如HCl 在水中是强酸,在冰醋酸中是弱酸,这是因为水接受质子的能力比冰醋酸强;NH3在水中是弱碱,在冰醋酸中是强碱,冰醋酸给予质子的能力比水强的缘故。
所以在比较不同酸碱的强弱时,应在同一溶剂中进行,一般以水为溶剂比较其酸碱性的强弱,即比较在水溶液中的离解平衡常数K a或K b。
3. 缓冲溶液通常由一对共轭酸碱组成,那么HCl-NaCl这对共轭酸碱可组成缓冲溶液吗?为什么?缓冲溶液是由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分。
电解质溶液和缓冲溶液 PPT

四、共轭酸碱解离常数的关系
在水溶液中,共轭酸碱对HB–B—分别存在如下的质子传递反应:
HB + H2O
H 3O+ + B
B + H2O
Ka=
HAc + H2O 醋酸的解离常数表达式为:
H3O+ + Ac
[H] [Ac ] K a = [HAc]
根据化学平衡原理,解离常数与弱电解质的本性及温度有关,
而与其浓度无关,其数值的大小可以反映弱电解质解离的趋势。 因而,对于同一类型的弱酸(或弱碱),可以通过比较在同等条 件强下弱的,K解a(离或常K数b)Ka值(大或的Kb酸)性值(的碱大性小),较判强断。弱酸(或弱碱)的相对
HAc + H2O
H3O+ + Ac
(二)解离平衡常数 在一定温度下,当弱电解质达到解离平衡时,溶液中已解离的
离子浓度幂次方的乘积与未解离的弱电解质分子浓度的比值为一常 数,称为解离平衡常数,简称解离常数(dissociation constant ), 用Ki表示。
弱酸的解离平衡常数用Ka表示。如醋酸的解离平衡可表示如下:
Kw = [H+][OH-] Kw称为水的质子自递平衡常数,又称为水的离子积(ion-product constant for water)。水的质子自递反应是吸热反应,温度升高, Kw值随之增大。实验测得,在25℃时,纯水的Kw = 1.00×10—14。 水的离子积Kw不仅适用于纯水,也适用于所有稀水溶液。在一定温 度下,只要知道溶液中的[H3O+],就能计算其中的[OH-],反之亦 然。
酸给出质子后,剩余的部分是碱,碱接受质子后形成酸。如HCl、 H2O、NH4+、H2CO3和HCO3- 等能给出质子的都是酸,Cl-、OH-、 NH3、HCO3-、CO32-等能接受质子的都是碱。
第四章 解离平衡

— + + — +
—
+ —
—
+
+
+
—
+
—
+
—
— +
—
+ —
离子氛示意图
表观电离度 强电解质的解离度与弱电解质的解离度的 意义完全不同,它仅表示溶液中离子间相互 牵制作用的强弱程度,称强电解质的解离度 为表观电离度。
4.1.3活度
活度:单位体积电解质溶液中,表观上所含 有的离子“浓度”,称有效“浓度”,也称活度。 活度与实际浓度间的关系如下:
K 酸愈强,K a 愈大, b 愈小,其共轭碱愈弱。反之 亦然。
例:NH3 ~ NH4+
NH3 +
H 2O
NH4+
+ OH-
已知NH3的 K b为1.78×10-5,则NH4+的 K a 为:
K a , NH 4
Kw 1.0 10 10 5.6 10 5 K b , NH 3 1.7810
4.1.2 强电解质溶液理论
一般认为强电解质的解离度是100%,
但根据溶液的导电性等实验证明强电解质 在溶液中的解离度小于100%,什么原因造 成强电解质溶液解离不完全的假象呢?
1923年,德拜和休克尔提出离子氛的概念 (ionic atmosphere)。认为:强电解质在溶 液中是完全解离的,但由于离子间的相互 作用,每一个离子都受到相反电荷离子的 包围,形成“离子氛”。这种离子间的相 互作用使溶液中的离子并不完全自由。其 表现是:溶液导电能力下降,产生一种解 离不完全的假象。
实验四---电解质溶液

实验四 电解质溶液一、实验目的1.掌握并验证同离子效应对弱电解质解离平衡的影响;2.学习缓冲溶液的配制,并验证其缓冲作用;3.掌握并验证浓度、温度对盐类水解平衡的影响;4. 了解沉淀的生成和溶解条件以及沉淀的转化。
二、实验原理弱电解质溶液中加入含有相同离子的另一强电解质时,使弱电解质的解离程度降低,这种效应称为同离子效应。
弱酸及其盐或弱碱及其盐的混合溶液,当将其稀释或在其中加入少量的酸或碱时,溶液的pH 值改变很少,这种溶液称作缓冲溶液。
缓冲溶液的pH 值(以HAc 和NaAc 为例)可用下式计算:)Ac ()HAc (lg p )()(lg p pH θa θa --=-=c c K c c K 盐酸 在难溶电解质的饱和溶液中,未溶解的难溶容电解质和溶液中相应的离子之间建立了多相离子平衡。
例如在PbI 2饱和溶液中,建立了如下平衡:PbI 2 (固) Pb 2+ + 2I -其平衡常数的表达式为θsp K = c (Pb 2+) · c (I -)2,称为溶度积。
根据溶度积规则可判断沉淀的生成和溶解,当将Pb(Ac)2和KI 两种溶液混合时 如果: c (Pb 2+)· c (I -)2 >θsp K 溶液过饱和,有沉淀析出。
c (Pb 2+)· c (I -)2 =θsp K 饱和溶液。
c (Pb 2+)· c (I -)2<θsp K 溶液未饱和,无沉淀析出。
使一种难溶电解质转化为另一种难溶电解质,即把一种沉淀转化为另一种沉淀的过程称为沉淀的转化,对于同一种类型的沉淀,溶度积大的难溶电解质易转化为溶度积小的难溶电解质。
对于不同类型的沉淀,能否进行转化,要具体计算溶解度。
三、仪器和药品仪器:试管,试管架,试管夹,离心试管,小烧杯(100mL 或50mL ),量筒(10mL ),洗瓶,点滴板,玻璃棒,酒精灯(或水浴锅),离心机(公用)。
药品:醋酸HAc(0.1mol·L-1,1mol·L-1,2mol·L-1),盐酸HCl (0.1mol·L-1,2 mol·L-1,6mol·L-1)。
药学专科自考-酸碱平衡的缓冲溶液

实
100 mL HCl 1mol·L-1HCl pH=2.00 滴加1ml 1mol · L-1NaOH pH=12.00 滴加1ml 1mol·L-1HCl pH=4.98 滴加1ml 1mol · L-1NaOH
100 mL HAc ~ NaAc pH = 5.00
pH=9.17
缓冲能力与总浓度的关系
缓冲溶液总浓度 (c总) c总 = ca+cb
对于同一缓冲对组成的缓冲溶液,当缓冲比一定时, 缓冲溶液的总浓度越大,溶液中抗酸抗碱成分越多,缓 冲能力越大。
缓冲能力与缓冲比的关系 对于同一缓冲对组成的缓冲溶液,当缓冲溶液的总 浓度一定时,缓冲比越接近1,缓冲容量越大;缓冲比等 于1时,缓冲能力最大。
(一)缓冲公式
HB + H 2O H 3O + + B-
NaB
[H 3O ] K a
Na+
[ HB ] [B ]
+
B-
缓冲比
[B ] [共轭碱] pH pK a lg pK a lg [HB ] [共轭酸]
缓冲溶液的pH计算式,或称亨德生公式
[B ] pH pK a lg [ HB ]
配制外,还可选用弱酸与强碱或弱碱与强酸进行
配制。弱酸或弱碱的物质的量一定要大于强碱或 强酸的物质的量,根据二者之间的化学反应,计 算出剩余的弱酸或弱碱的物质的量及生成的共轭 碱或共轭酸的物质的量。
例 欲配制pH为 5.05的缓冲溶液500 ml,计算应向100ml 0.20 mol/L NaOH溶液中加入0.20 mol/L HAc溶液的体积,已 知HAc的pKa = 4.75。
加入HCl后,
na=0.020 +1.0×10‾3=0.021(mol) nb=0.030-1.0×10‾3=0.029(mol)
实验报告电解质溶液的pH测定

实验报告电解质溶液的pH测定实验报告:电解质溶液的 pH 测定一、实验目的本次实验旨在掌握使用 pH 计准确测定电解质溶液 pH 值的方法,深入理解电解质溶液的酸碱性质以及 pH 值对化学反应的影响。
二、实验原理pH 是衡量溶液酸碱度的指标,其定义为溶液中氢离子浓度的负对数,即 pH = lgH⁺。
在常温下(25℃),纯水的 pH 值约为 70,酸性溶液的 pH 值小于 70,碱性溶液的 pH 值大于 70。
pH 计是通过测量电极系统与溶液之间的电位差来确定溶液的 pH 值。
通常使用的电极是玻璃电极和参比电极,玻璃电极对氢离子敏感,其电位随溶液中氢离子浓度的变化而变化,参比电极提供稳定的电位参考。
三、实验仪器与试剂1、仪器pH 计电极容量瓶移液管烧杯玻璃棒2、试剂标准 pH 缓冲溶液(pH = 400、686、918)盐酸溶液(01 mol/L)氢氧化钠溶液(01 mol/L)醋酸溶液(01 mol/L)醋酸钠溶液(01 mol/L)四、实验步骤1、 pH 计的校准将电极插入 pH = 686 的标准缓冲溶液中,待读数稳定后,调节pH 计上的“定位”旋钮,使显示值与标准缓冲溶液的 pH 值一致。
用蒸馏水冲洗电极,再将电极插入 pH = 400 的标准缓冲溶液中,待读数稳定后,调节 pH 计上的“斜率”旋钮,使显示值与标准缓冲溶液的 pH 值一致。
重复上述步骤,直至 pH 计校准准确。
2、溶液的配制用移液管准确移取 1000 mL 01 mol/L 的盐酸溶液,放入 100 mL 容量瓶中,用蒸馏水稀释至刻度,摇匀,得到 001 mol/L 的盐酸溶液。
用同样的方法配制 001 mol/L 的氢氧化钠溶液、001 mol/L 的醋酸溶液和 001 mol/L 的醋酸钠溶液。
3、溶液 pH 值的测定用蒸馏水冲洗电极,并用滤纸吸干。
将电极插入 001 mol/L 的盐酸溶液中,待读数稳定后,记录溶液的pH 值。
电解质溶液-同离子效应实验报告(最新)
【其它】一、实验目的(1)加深对弱电解质的解离平衡、同离子效应、盐类水解等基本概念的理解。
了解缓冲溶液的缓冲作用及配制。
(2)掌握难溶电解质的多相离子平衡及沉淀的生成和溶解的条件(转载于 : : 电解质溶液-同离子效应实验报告)。
二、实验原理在弱电解质的解离平衡或难溶电解质的沉淀一溶解平衡体系中,加入与弱电解质或难溶电解质具有相同离子的易溶强电解质,则平衡向左移动,产生使弱电解质的解离度或难溶电解质的溶解度明显降低的现象,叫做同离子效应。
三、实验用品(仪器、药品)试管、药匙、氨水、醋酸铵固体、酚酞。
甲基橙、碘化铅。
碘化钾。
四、实验内容及操作步骤(l)在小试管中加入1cm30.lmol·dm-3NH3水溶液和1滴酚酞指示剂,观察溶液颜色。
再加入少许NH4Ac晶体,振荡使其溶解,观察溶液颜色的变化并进行解释(2)自己设计一实验,验证同离子效应使HAc溶液中的H+浓度降低。
(3)在试管中加入3滴PbI2饱和溶液,加入2滴0.lmol·dm-3KI溶液。
观察现象,解释之。
五、实验现象及结论(l)在小试管中加入1cm30.lmol·dm-3NH3水溶液和1滴酚酞指示剂,观察溶液颜色。
再加入少许NH4Ac晶体,振荡使其溶解,因同离子效应OH-浓度降低,碱性降低,红色溶液颜色变浅或褪去,(2)自己设计一实验,验证同离子效应使HAc溶液中的H+浓度降低。
在小试管中用滴管加入1毫升0.1摩尔/升醋酸水溶液和1滴甲基橙指示剂,因醋酸溶液呈酸性,使甲基橙溶液有无色变为红色。
再用药匙向小试管中加入少许醋酸铵晶体,振荡使其溶解,因同离子效应,氢离子浓度降低,酸性降低,橙红色溶液颜色变为橙黄色或黄色。
(3)在试管中加入3滴PbI2饱和溶液,加入2滴0.lmol·dm-3KI溶液。
有黄色沉淀碘化铅生成。
一、实验目的二、实验原理三、实验用品(仪器、药品)四、实验内容及操作步骤五、实验现象及结论六、思考:根据PbI2的溶度积,计算(298K时):(1)PbI2在纯水中的溶解度(mol·dm-3);(2)PbI2在0.010mol·dm-3KI 溶液中的溶解度;(3)PbI2在0.010mol·dm-3Pb(NO3)2 纯水中的溶解度;(4)对以上计算结果进行分析、解释。
第六章 电解质溶液(8)
【例1】 计算0.010mol· -1 NaCl溶液的离子强度,活度 kg 系数以及活度。
解: I = 1/2[ b(Na+)z2(Na+)+b(Cl-)z2(Cl-)]
= 1/2[0.010×(+1)2+0.010× (-1)2]
= 0.010 mol· -1 kg
0.01 lg γ 0.509 (1) 0.30 0.01 1 0.01 γ 0.90
θ a
c α 或α
2
θ Ka c
θ K b c α 2或α
θ Kb c
稀释定律:弱电解质溶液的电离度与其浓度的平方 根成反比,浓度越小,电离度越大。
第27页
④一元弱酸、弱碱的近似计算 以弱酸HA为例,设HA的起始浓度为c酸,则平衡 时:cH+= cAcHA= c酸 - cH+ H+(aq) + A-(aq) 0 cH+ 0 cH+
0.372 K
如果NaCl百分之百电离,则i =2:
T f 0.2 1.86 2 0.774 K
而实验测得的ΔTf却是0.694K
第14页
二、离子氛与离子强度 中心离子周围的那些异号离子群叫做离子氛。
+ -
ห้องสมุดไป่ตู้
+
-
+
+
+
+
第15页
离子强度:溶液中存在的离子所产生的电场强度 稀溶液中,bB CB 的量度,表示当溶液中含有多种离子时,每一种
θ a
Ac- (ag) + H+ (ag)
K
医用化学第4章电解质溶液
(二)一元弱碱
与一元弱酸相似,可以推导出[OH-]
离子浓度的计算公式。 当cB×Kb≥20Kw ,cB/Kb>500时,
[OH ] c K B b
例6、计算0.10mol/L NH3的pH值。(已知 Kb=1.8×10-5) 解:因为cB×Kb≥20Kw ,cB/Kb>500,所 以
医学上常用氢离子浓度的负对数值
来表示溶液的酸碱度,即:
pH=-㏒[H3O+]
∵水溶液中:[H3O+][OH-] =1.0×10-14 ∴pH+pOH=14
pH=7,溶液呈中性 pH>7,溶液呈碱性 pH<7,溶液呈酸性 pH值越小,溶液酸性越强;pH值越 大,溶液碱性越强
·
·当溶液中的[H3O+]或[OH-]大于 1mol/L时,仍以其浓度表示溶液的 酸碱度
CN- + H2O NH3 + H2O
H+3O + HCO3HCN + OHNH4+ + OH-
17
HA + H2O
A- + H3O+
[A-] [H3O+] Ki= [ HA ] [H O] 2
ka=
[A-] [H3O+] [ HA ]
B- + H2O
HB + OH[ B- ]
18
kb=
[HB] [OH-]
α<100%。
4
一、Debye-Hü ckel 理论要点
1、强电解质在水中全部解离
5
2、离子间通过静电引力相互作用,每
个离子都被周围带相反电荷的离子包围, 形成离子氛(ion atmosphere),此外,还可 能:离子对.
电解质溶液(实验内容、现象和解释)
实验四电解质溶液(实验内容、现象和解释)1、同离子效应(1)NH3+H2O ⇌ NH4++OH-K b=1.77×10-5;现象:加入酚酞指示剂:溶液由无色变为红色。
NH4Cl=NH4++Cl-现象:加入NH4Cl后:平衡向左移动,溶液红色变浅。
(2)HAc ⇌ H++Ac-Ka=1.78×10-5;现象:加入甲基橙指示剂:溶液由无色变为红色。
NaAc=Na++Ac-现象:加入NaAc后:平衡向左移动,溶液红色变浅。
2、缓冲溶液(1) HCl = H++Cl- pH<7NaOH = Na++OH- pH>7H2O ⇌ H++OH- pH=7(2) HAc ⇌ H++Ac-NaAc=Na++Ac-5滴0.1mol〃L-1HCl;5滴0.1mol〃L-1NaOH;5滴H2O;加入茜红素指示剂的溶液的颜色基本不变。
(3) 配制方法:5.4ml0.1mol〃L-1HAc溶液+9.6ml 0.1mol〃L-1NaAc溶液配制依据:设需0.1mol〃L-1HAc溶液Xml,则需0.1mol〃L-1NaAc溶液(15-X)mlHAc ⇌ H++ Ac-C酸-X ≈C酸 X C盐+X≈C盐Ka=([ H+]×[ Ac-])÷[ HAc]=( X×C盐)÷C酸=10-5×[(15-X)×0.1÷15]÷( X×0.1÷15)=1.78×10-5X=0.54 ml实验方法:在三支试管里分别滴加5滴0.1mol〃 L-1HCl;5滴0.1mol〃 L-1NaOH;5滴H2O;加入茜红素指示剂的溶液的颜色基本不变。
3、酸(碱)的解离平衡及其移动(1) a、NaCl = Na++Cl- pH=7b、NH4++H2O ⇌ NH3+H3O+ pH<7c、Ac-+H2O ⇌ HAc+OH- pH>7d、CO32-+H2O ⇌ HCO3-+OH- pH>7e、PO43-+H2O ⇌ HPO42-+OH- pH>7f、HPO42-+H2O ⇌ H2PO4-+OH-HPO42-+H2O ⇌ PO43-+H3O+K水解=1.6×10-7>K电离=2.2×10-13; pH>7g、H2PO4-+H2O ⇌ HPO42-+H3O+H2PO4-+H2O ⇌ H3PO4+OH- K电离=6.23×10-8>K水解=1.33×10-12;pH<7 (2)Fe3++3H2O ⇌ Fe(OH)3+3H+;加热促进水解,得到红棕色胶体溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、水的质子自递平衡
适用于纯水 和水溶液
Kw随温度的升高而增大
第二节 水溶液的酸碱性
二、水溶液的酸碱性(酸度)
[H+]>[OH-]或 [H+]>1.00×10-7(25℃)
[H+]=[OH-]或 [H+]=1.00×10-7 (25℃)
酸性;[H+]越 大,酸性越强
中性
[H+]<[OH-]或
碱性;[OH-]越
第一节 酸碱质子理论
一、酸碱电离理论
酸 在水中电离产生的阳离子全部是H+的化合物
HCl H+ + Cl- HAc
H+ + Ac-
碱 在水中电离产生的阴离子全部是OH-的化合物
NaOH
Na+ + OH- NH4OH
NH4+ + OH-
酸碱反应实质 H+ + OH- H2O
第一节 酸碱质子理论
一、酸碱电离理论
回顾
一、质子 原子的组成
回顾
一、质子
原子的组成
原子
原子核 质子(一个单位正电荷) 中子(不带电)
核外电子(一个单位负电荷)
原子是由带正电荷的原子核和带负电荷的电子构成的,原
子核所带的正电荷数和核外电子所带的负电荷数相等,整个 原子显电中性。原子核又是由质子和中子构成的。
回顾
一、质子
原子中各种粒子间的关系
失电子
氢离子(H+)
回顾
二、化合价
规定
化合价是元素 在形成化合物 时表现出的一 种性质。,反 应了原子形成 化学键的能力
(1)单质中元素的化合价等于零。 H2 、 Cl2、Na、Mg (2)单原子离子中元素的化合价等于离 子的荷电数。Na+、Mg2+、Cl-
(3)氧(O)的化合价在大多数化合物
中为—2价,氢(H)的化合价在大多数
二、酸碱质子理论
酸 能给出质子的(H+)物质
质子给予体
碱 能接受质子的(H+)物质
质子接受体
第一节 酸碱质子理论
二、酸碱质子理论
共轭关系
酸和碱依赖质子的给出与获得相互依存、 相互转化
共轭酸: 碱得到质子后形成的酸
共轭碱: 酸得到质子后形成的碱
共轭酸碱对
酸与其共轭碱 碱与其共轭酸
只相差一 个质子
第一节 酸碱质子理论
2X=0 2X+7(-2)=-2 3X+4(-2)=0
第一节 酸碱质子理论
1663年 波义耳(R.Boyle)提出酸碱概念。 1889年 阿累尼乌斯提出酸碱电离理论。 1905年 富兰克林酸碱溶剂理论。 1923年 布朗斯特和费莱(T.M.Lowry)几乎同时各 自独立地提出了酸碱的质子理论。同年,路易斯 提出了酸碱的电子理论。 1963年 皮尔逊提出硬软酸碱原则。
[H+]<1.00×10-7 (25℃) 大,碱性越强
第二节 水溶液的酸碱性
NaHSO4可电离为Na+、H+、SO42是酸还是碱
第一节 酸碱质子理论
一、酸碱电离理论
评价
酸碱电离理论是人们对酸碱认识从现象到 本质的一次飞跃,对化学学科的发展起了 重要作用。 但该理论将酸碱限定在以水为溶剂的体系, 而且将碱限定为氢氧化物。
CH3CH2ONa、Na2CO3
NH3 + HCl
NH4Cl
HCO3CO 2- 给出质子 接受质子
3
H2CO3
第一节 酸碱质子理论
二、酸碱质子理论
关于盐 没有盐的概念
酸碱电离理论中的盐在酸碱质子理 论中是酸、碱或者酸和碱的混合物
N为aNNANHHca44在+A+和水和c在A中Ac水c全--,中,部为全为解碱部酸离解和离碱为的 混合物
第一节 酸碱质子理论
三、酸碱反应的实质
二、酸碱质子理论
HAc、HCl、PO43-、HCO3-、NH4+、OH-、NH3
酸 HAc、HCl、 HCO3-、 NH4+ 碱 PO43-、 HCO3-、OH-、NH3 共轭酸碱对 NH4+-NH3
第一节 酸碱质子理论
二、酸碱质子理论
两性物质
既有给出质子的能力,又有接受质子的能力 既可以是酸又可以是碱
第一节 酸碱质子理论
二、酸碱质子理论
HAc
H+ + Ac-
NH4+ H+ + NH3
H2CO3
HCO3-
HCO3- + H+
2_ CO3 + H+
H3PO4 H2PO4-
2-
HPO4
H+ + H2PO4-
H+
+
2-
HPO4
H+ + PO4 3 -
H3O+ H2O
H+ + H2O H+ + OH-
第一节 酸碱质子理论
酸越弱,其共轭碱碱性越强
第二节 水溶液的酸碱性
一、水的质子自递平衡
H+
H2O + H2O
H3O+ + OH-
在同种分子之间所发生的质子传递反应 称为质子自递反应
第二节 水溶液的酸碱性
一、水的质子自递平衡
一定温度下,水的质子自递反应达到平衡时
=
Kw成为水的离子积常数,简称水的离子积
第二节 水溶液的酸碱性
化合物中为+1价
(4)电中性的化合物中所有元素的化合
价的代数和为零。多原子 离子中所有元
素的化合价的代数和等于离子的荷电数。 NaOH、Na2SO4、ClO3-
回顾
二、化合价
表示方法 +1 —2
H2O
+7 —2
MnO4-
例题:求HO4中Fe的 化合价
弱碱电离 NH3 + H2O 弱酸电离 HAc + H2O
NH4+ + OHH3O+ + Ac-
盐的水解 H2O + Ac-
HAc + OH-
第一节 酸碱质子理论
三、酸碱反应的实质
4、酸碱反应的方向: 取决于酸碱的相对强度
较强酸 + 较强碱
较弱碱 + 较弱酸
第一节 酸碱质子理论
四、酸碱的强度
酸越强,给出质子能力越强,其共 轭碱接受质子能力越弱,即碱性越 弱
酸1 + 碱2
碱1 +酸2
H+
1、酸碱反应的实质是在两对共轭酸碱对之 间的质子传递 2、水溶液、非水溶剂和无溶剂时均可进行
第一节 酸碱质子理论
三、酸碱反应的实质
NH3(g) + HCl(g)
NH4Cl(s)
得到质子
给出质子
NH4+ Cl-
第一节 酸碱质子理论
三、酸碱反应的实质
3、电离作用、中和反应、水解反应都属于酸 碱反应
(1) 原子核的核电荷数是由质子数决定的,原子 是电中性的,所以:
核电荷数(Z)= 核内质子数 = 核外电子数
若按核电荷数由小到大的顺序给元素编号,得
到的 序号称为原子序数。原子序数在数值上与该元素
原子的核电荷数相等,即与质子数相等。
回顾
一、质子 原子结构示意图
回顾
一、质子
氢原子结构示意图
氢原子中有一个质子和 一个电子,当氢原子失 去这个电子时,就成了 氢离子H+,这样氢离子 就相当于一个质子,所 以 通常所说的质子就是氢 离子
