单克隆抗体下游分离制备工艺手册
单克隆抗体制备流程

单克隆抗体制备流程1.鼠标免疫:选择合适的抗原,并将其注射到小鼠或其他啮齿动物的体内。
这样可以激发小鼠体内的免疫系统产生特异性的抗原抗体。
2.细胞融合:在小鼠免疫周期结束后,收集其脾细胞,并将其与癌细胞(如骨髓瘤细胞)进行融合。
这一步骤将产生一组称为杂交瘤细胞的细胞群体,具有免疫系统的特异性。
3.筛选和扩增:将融合细胞在含有抗生素的培养基中进行筛选,以去除非融合细胞和未融合的B细胞。
然后,将融合细胞转移到含有较低抗生素浓度的培养基中,以扩增单克隆细胞株。
4.克隆:通过稀释稀释法或限稀稀释法,将单个细胞分离成单个细胞,并将其分别培养在微孔板中。
培养一段时间后,进行测序和酶联免疫吸附试验(ELISA)等测试,以筛选出产生特异性抗体的克隆。
5.生产和纯化:确定产生特异性抗体的克隆后,可以进行大规模的生产和纯化。
将克隆细胞移植到大容量培养器中,进行大规模培养。
然后,通过收集和离心等步骤收集细胞上清液,获取抗体。
6.特性和稳定性测试:对生产的抗体进行特性和稳定性测试,以确定其特异性、亲和力、稳定性和纯度等参数。
这些测试通常包括ELISA、Western blot、免疫组织化学(IHC)等。
7.应用:将制备好的单克隆抗体用于特定的应用,如免疫组化、免疫印迹、流式细胞术等。
根据需要,可能需要对抗体进行标记,如荧光标记或酶标记,以便在特定实验中进行检测。
总之,单克隆抗体制备流程是一个复杂而耗时的过程,需要经过多个步骤来获得特异性和高亲和力的抗体。
这些抗体可以用于研究、诊断和治疗等领域,对于科学研究和临床应用有着重要的意义。
单克隆抗体纯化工艺流程

单克隆抗体纯化工艺流程
单克隆抗体纯化工艺流程是一个复杂且精细的过程,主要涉及到细胞发酵培养后的处理以及后续的纯化步骤。
以下是对这一工艺流程的详细解释。
首先,在细胞发酵培养结束后,会采用深层过滤或连续流离心深层过滤的方法来去除发酵液中的细胞及细胞碎片。
这一步是至关重要的,因为它能有效地去除杂质,为后续纯化步骤提供高质量的上清液。
接着,上清液会进入纯化工艺。
整个纯化工艺主要包括ProteinA亲和色谱、低PH病毒灭活、阴/阳离子交换色谱(或复合模式色谱)、除病毒过滤、超滤浓缩换液以及除菌过滤等步骤。
在ProteinA亲和色谱步骤中,利用抗体结构中的Fc区域能特异性结合色谱填料偶联配基ProteinA蛋白的特性,进行色谱分离。
大部分杂蛋白等杂质因无法与色谱填料结合而流穿,而抗体则与ProteinA蛋白结合,随后以低PH溶液洗脱柱子,收集粗纯后的抗体,达到初步纯化的效果。
随后,阴离子交换色谱利用等电点的差异进行分离。
病毒、HCP、DNA等杂质因PI相对较低,呈酸性,在较高PH条件下与填料结合,而抗体PI一般相对较高,呈碱性,直接流穿,从而达到进一步分离去除杂质的效果。
除病毒过滤则采用特定规格的滤膜,如20nm左右的滤膜,进行纳滤,截留病毒颗粒,而蛋白则顺利流穿,从而实现病毒的去除。
最后,经过超滤浓缩换液和除菌过滤步骤,即可获得高质量的抗体原液。
这些步骤确保了抗体的纯度、活性和安全性,为后续的应用提供了保障。
整个单克隆抗体纯化工艺流程虽然复杂,但每一步都至关重要,不可或缺。
它充分展示了现代生物技术的精细和高效,为抗体药物的研发和生产提供了坚实的基础。
单克隆抗体技术手册

单克隆抗体技术手册一、什么是单克隆抗体技术单克隆抗体技术,简单来说,就是一种能够生产出大量高纯度、高特异性抗体的生物技术。
在生物医学领域,它就像是一把精准的钥匙,能够准确地打开特定疾病的“锁”。
抗体,大家都知道,是我们身体免疫系统产生的用来对抗病原体的“武器”。
但传统方法得到的抗体往往是混合物,纯度不高,特异性也有限。
而单克隆抗体技术则改变了这一局面。
二、单克隆抗体技术的原理要理解单克隆抗体技术,得先从免疫系统说起。
当我们的身体受到病原体入侵时,免疫系统中的 B 淋巴细胞会被激活,产生抗体来对抗病原体。
每个 B 淋巴细胞产生的抗体都略有不同。
单克隆抗体技术的核心就是要从众多的 B 淋巴细胞中,筛选出一个能够产生我们所需要的特定抗体的细胞。
这个过程就像是在大海里捞针。
首先,将抗原(比如某种疾病的蛋白质)注射到小鼠体内,让小鼠的免疫系统产生反应。
然后,从小鼠的脾脏中取出产生抗体的 B 淋巴细胞。
接下来,将这些 B 淋巴细胞与一种能够无限增殖的骨髓瘤细胞融合。
这一步非常关键,因为骨髓瘤细胞可以不停地分裂生长,而 B 淋巴细胞能够产生抗体。
融合后的细胞就兼具了两者的优点,既能产生抗体,又能无限增殖。
然后,通过特定的筛选方法,找出那些能够产生我们所需要的抗体的融合细胞。
这些细胞就是单克隆抗体的“源头”。
三、单克隆抗体技术的步骤1、免疫动物选择合适的动物(通常是小鼠),给它们注射特定的抗原,激发免疫系统产生抗体反应。
2、细胞融合将免疫后的动物脾脏细胞(包含产生抗体的 B 淋巴细胞)与骨髓瘤细胞在一定条件下进行融合。
3、筛选与克隆使用特定的培养基和检测方法,筛选出能够产生目标抗体的融合细胞。
然后对这些细胞进行克隆培养,得到大量相同的细胞。
4、抗体的提取与纯化从培养的细胞上清液或细胞内提取抗体,并通过一系列的纯化方法,去除杂质,得到高纯度的单克隆抗体。
四、单克隆抗体技术的应用1、疾病诊断单克隆抗体可以特异性地识别疾病相关的标志物,用于疾病的早期诊断。
单克隆抗体纯化工艺流程

单克隆抗体纯化工艺流程英文回答:Single clone antibody purification process is a crucial step in the production of monoclonal antibodies. Itinvolves several steps to ensure the isolation and purification of the desired antibody from the mixture of other proteins and contaminants.The first step in the purification process is toharvest the cells producing the monoclonal antibody. This can be done by centrifugation or filtration to separate the cells from the culture medium. Once the cells are separated, they are lysed to release the intracellular contents, including the antibody of interest.After cell lysis, the next step is to remove celldebris and insoluble components from the lysate. This canbe achieved through centrifugation or filtration methods. The clarified lysate is then subjected to a series ofchromatography steps to purify the antibody.One commonly used chromatography technique is protein A affinity chromatography. Protein A is a bacterial protein that has a high affinity for the Fc region of immunoglobulin G (IgG) antibodies. The lysate is passed through a column packed with protein A resin, and the antibody binds to the resin while other impurities are washed away. Elution of the antibody is then performedusing a low pH buffer or an IgG-specific elution buffer.Another purification step is ion exchange chromatography, which separates proteins based on their charge. The lysate is loaded onto an ion exchange column, and the antibody is selectively retained while otherproteins are washed away. Elution of the antibody is achieved by changing the pH or ionic strength of the buffer.Size exclusion chromatography is also employed to remove aggregates and further purify the antibody. This technique separates proteins based on their size, withlarger molecules eluting first. The antibody is collectedin the void volume while smaller impurities are separated.Finally, the purified antibody is subjected to a viral clearance step to ensure the removal of any potential viral contaminants. This can be achieved through viral filtration or other viral inactivation methods.Once the purification process is complete, the antibody is typically formulated into a suitable buffer for storage and further use. The purity and quality of the antibody are assessed using various analytical techniques, such as SDS-PAGE, HPLC, and ELISA.Overall, the single clone antibody purification process involves a series of steps, including cell harvesting, cell lysis, clarification, chromatography, viral clearance, and formulation. Each step is designed to isolate and purify the antibody of interest while removing impurities and contaminants.中文回答:单克隆抗体纯化工艺流程是单克隆抗体生产过程中的关键步骤。
一文扫尽单克隆抗体制备流程

一文扫尽单克隆抗体制备流程单克隆抗体是由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,称为单克隆抗体。
通常采用杂交瘤技术来制备,杂交瘤(hybridoma)抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏B细胞和具有无限繁殖能力的骨髓瘤细胞融合为B细胞杂交瘤。
用具备这种特性的单个杂交瘤细胞培养成细胞群,可制备针对一种抗原表位的特异性抗体即单克隆抗体。
目录1简介 2制备过程 3抗原准备 4动物免疫 5细胞融合 6杂交瘤细胞 7鉴定实验8克隆化方法 9细胞选择 10应用 11局限性 12研究进展简介1975年分子生物学家G.J.F.克勒和C.米尔斯坦在自然杂交技术的基础上,创建立杂交瘤技术,他们把可在体外培养和大量增殖的小鼠骨髓瘤细胞与经抗原免疫后的纯系小鼠B细胞融合,成为杂交细胞系,既具有瘤细胞易于在体外无限增殖的特性,又具有抗体形成细胞的合成和分泌特异性抗体的特点。
将这种杂交瘤作单个细胞培养,可形成单细胞系,即单克隆。
利用培养或小鼠腹腔接种的方法,便能得到大量的、高浓度的、非常均一的抗体,其结构、氨基酸顺序、特异性等都是一致的,而且在培养过程中,只要没有变异,不同时间所分泌的抗体都能保持同样的结构与机能。
这种单克隆抗体是用其他方法所不能得到的。
这项新技术从根本上解决了在抗体制备中长期存在的特异性和可重复性问题,可用于探讨①蛋白质的精细结构;②淋巴细胞亚群的表面新抗原;③组织相容性抗原;④激素和药物的放射免疫(或酶免疫)分析;⑤肿瘤的定位和分类;⑥纯化微生物和寄生虫抗原;⑦免疫治疗和与药物结合的免疫。
制备过程单克隆抗体制备流程1、免疫动物免疫动物是用目的抗原免疫小鼠,使小鼠产生致敏B淋巴细胞的过程。
一般选用6-8周龄雌性BALB/c小鼠,按照预先制定的免疫方案进行免疫注射。
抗原通过血液循环或淋巴循环进入外周免疫器官,刺激相应B淋巴细胞克隆,使其活化、增殖,并分化成为致敏B淋巴细胞。
单抗制备工艺

单克隆抗体制备主要步骤包括:动物免疫、细胞融合、杂交瘤细胞的筛选与单抗检测、杂交瘤细胞的克隆化、单抗的鉴定及制备等。
1 动物免疫根据抗原的特性选择合适的免疫方案,对于可溶性抗原免疫原性弱,一般要加佐剂。
常用佐剂为福氏完全佐剂和福氏不完全佐剂。
要求抗原和佐剂等体积混合在一起,研磨成油包水的乳糜状。
(1)初次免疫,Ag50ug/只,加福氏完全佐剂皮下多点注射,一般1.5ml,间隔3周。
(2)第二次免疫,剂量途径同上,加福氏不完全佐剂,间隔3周。
(3)第三次免疫,剂量同上,不加佐剂,腹腔注射,7天后采血测其效价,检测免疫效果,间隔3周。
(4)加强免疫,剂量50ug,腹腔注射。
(5)3天后,取脾融合。
2细胞融合(1)饲养细胞的制备在细胞融合后选择性培养过程中,由于大量骨髓瘤细胞和脾细胞相继死亡,此时单个或少数分散的杂交瘤细胞多半不易存活,通常必须加入其他活细胞使之繁殖,这种被加入的活细胞称为饲养细胞小鼠腹腔巨噬细胞的准备:①用6-10 周龄的BALB/c小鼠。
②拉颈处死,浸泡于75%的酒精,消毒3min,用无菌剪刀剪开皮肤,暴露腹膜。
用吸管注入6ml培养液,反复冲洗,吸出冲洗液。
③放入10ml离心管,1200rpm离心5min.④用20%小牛血清的培养液混悬,调整细胞数为1*105/ml.加入96孔板,100ul/孔。
放入37度孵箱培养。
(2)骨髓瘤细胞的准备①于融合前48-36小时,将骨髓瘤细胞扩大培养②融合当天,用弯头滴管将细胞从瓶壁轻轻吹下,收集于50ml离心管或融合管内。
③1000r/min离心5-10分钟,弃去上清。
④加入30ml不完全培养基,离心洗涤一次。
然后将细胞重悬浮于10ml不完全培养基,混匀。
⑤取骨髓瘤细胞悬液,加0.4%台酚蓝染液作活细胞计数后备用。
(3)脾细胞的准备取已经免疫的BALB/c小鼠,摘除眼球采血,并分离血清作为抗体检测时的阳性对照血清。
同时通过颈脱位致死小鼠,浸泡于75%酒精中5分钟,于培养皿上固定后掀开左侧腹部皮肤,可看到脾脏,换眼科剪镊,在超净台中用无菌手术剪开腹膜,取出脾脏置于已盛有10ml 不完全培养基的平皿中,轻轻洗涤,并细心剥去周围结缔组织。
抗体纯化手册-
单抗表达量可达 1-2g/L。 类等等。Protein A Protein A 亲和层析如 MabSelect 做快速初纯,再配合疏水层析、分子筛
亲和层析脱落集团。 等多步纯化。
利用基因工程技术表达人源 宿主杂蛋白、核酸、 若以 E.coli 包涵体形式表达,可考虑用 Sepharose 4FF 先纯化包涵体,再
2. 癌症、心血管等疾病的导向治疗:以单抗荷载同位素、 毒素蛋白、抗生素等药物制成生物导弹。
3. 应用抗体 T 细胞、抗 IL-2R 的单抗防治器官移植排斥反 应等。
的结构域可以识别和结合特异性抗原。1987 年单抗技术被成 4. 以单抗制成避孕、传染病的预防药物。
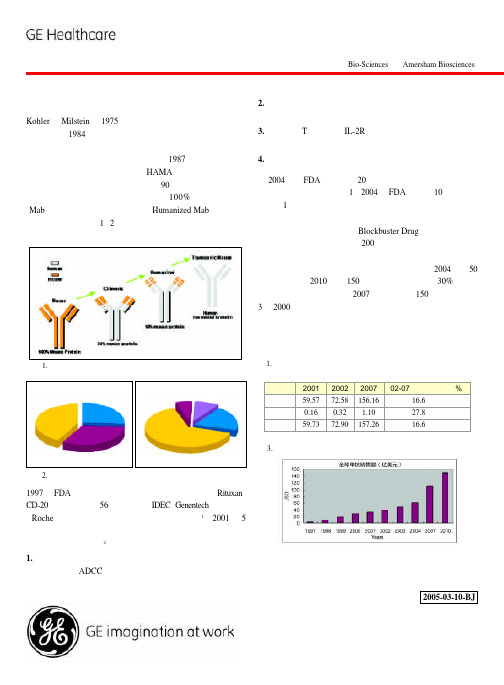
功应用到诊断试剂当中,但由于 HAMA (人抗鼠抗体) 反应, 没能有效应用在人类疾病的治疗上。90 年代,随着基因工程 技术的迅速发展,治疗性单抗从早期 100% 的鼠源性单抗 (Mab),到嵌合抗体,人源化抗体(Humanized Mab),到近年 的全人源性抗体 (图1、2),逐步消除了抗体的免疫源性问题, 在保持对抗原高亲和力的同时,改善了抗体的药动力学。
大多数 IgG 等电点高于一般血清蛋白,建议用阳离子交换层析 3 捕获浓缩抗体或分离纯化
大部分超过 pH6
除去大部分杂蛋白 (图 5)。注意:CHO 细胞表达的基因工程抗体 (Gab) 由于细胞培养过程
带来的糖基化的不均一,等电点往往较分散 (图 5),选择离子交换层析条件时须注意。
疏水性
大多数 IgG 疏水性较强
抗体纯化手册
孙文改 陈昕·通用电气(中国)医疗集团 Bio-Sciences (原 Amersham Biosciences)
一、单抗技术的发展、应用和市场前景
Kohler 和 Milstein 于 1975 年发明了被称之为“魔弹”的单抗 技术,并在1984 年获得了诺贝尔奖。单抗是B淋巴细胞和骨 髓瘤细胞杂交形成的杂交瘤细胞产生,其重链和轻链所形成
单克隆抗体纯化工艺流程

单克隆抗体纯化工艺流程英文回答:Single clone antibody purification process involves several steps to obtain a highly pure and concentrated antibody sample. Here, I will describe the general process in detail.1. Harvesting the cells: The first step in the purification process is to harvest the cells that produce the desired antibody. This can be done by culturing the cells in a suitable growth medium until they reach the desired density. Then, the cells are harvested by centrifugation or filtration.2. Cell lysis: Once the cells are harvested, they need to be lysed to release the intracellular components, including the antibody. This can be achieved by using detergents, sonication, or freeze-thaw cycles. The lysate is then clarified by centrifugation to remove cell debris.3. Affinity chromatography: The next step is to purify the antibody using affinity chromatography. This involves the use of a specific ligand that binds to the antibody with high affinity. For example, protein A or protein G can be used as ligands for purifying antibodies of different classes or species. The lysate is passed through a column containing the ligand, and the antibody binds to the ligand while other impurities are washed away. The bound antibody is then eluted using a low pH buffer or a competitive elution agent.4. Size exclusion chromatography: After affinity chromatography, the antibody sample may still contain some impurities such as aggregates or fragments. Size exclusion chromatography is used to separate these impurities based on their size. A gel filtration column is employed, and the antibody elutes in a separate peak while the impurities are excluded from the gel matrix.5. Concentration and buffer exchange: The purified antibody is typically in a low concentration and may be ina buffer that is not compatible with downstream applications. Therefore, concentration and buffer exchange steps are performed. This can be achieved by using centrifugal filter units or ultrafiltration devices. The concentrated antibody is then exchanged into a suitable buffer using dialysis or buffer exchange columns.6. Sterile filtration: To ensure the antibody is free from any microbial contamination, sterile filtration is performed. The purified antibody is passed through a sterilizing-grade filter with a pore size of 0.2 μm or smaller. This step is crucial for the final product to be used in therapeutic or diagnostic applications.7. Quality control: Finally, the purified antibody sample undergoes rigorous quality control testing to ensure its purity, potency, and stability. This includes assessing its binding affinity, specificity, and functionality. The sample is also tested for endotoxin levels and checked for any degradation or aggregation.中文回答:单克隆抗体纯化工艺流程涉及多个步骤,以获得高纯度和高浓度的抗体样品。
