电解饱和氯化钠溶液的化学方程式
江苏省镇江市五年(2018-2022)中考化学真题分题型分层汇编-03选择题(基础提升)

江苏省镇江市五年(2018-2022)中考化学真题分题型分层汇编-03选择题(基础提升)一.化学实验方案设计与评价(共1小题)1.(2018•镇江)下列实验操作中不能达到实验目的的是()选项物质目的主要实验操作A CO2和SO2鉴别分别通入稀KMnO4溶液,观察现象B CaO中含有CaCO3检验取样,加入足量稀盐酸,观察现象C MnO2和KCl的混合物分离溶解、过滤,洗涤固体并烘干,蒸发滤液D BaCl2溶液混有Ba(NO3)2杂质除杂先加入过量Na2SO4溶液,过滤、洗涤;再向所得固体中加入适量稀盐酸A.A B.B C.C D.D二.晶体和结晶的概念与现象(共1小题)2.(2019•镇江)下列说法正确的是()A.金刚石、石墨、C60都是碳单质B.铝的金属活动性比铁强,所以铁比铝更加耐腐蚀C.某气体不能使带火星木条复燃,该气体中一定不含氧气D.使饱和溶液析出晶体,溶质质量和溶质质量分数都一定减小三.氢气的制取、收集与检验(共1小题)3.(2019•镇江)如图是实验室制取并收集氢气的主要操作,其中不正确的是()A.检查气密性B.加入锌粒C.产生氢气D.收集氢气四.溶液的导电性及其原理分析(共1小题)4.(2019•镇江)电解饱和氯化钠溶液的化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑下列说法中不正确的是()A.Cl2可用于自来水生产中杀菌消毒B.农业上常用NaOH改良酸性土壤C.反应中有2种元素化合价发生改变D.NaCl可由海水蒸发结晶、精制获得五.中和反应及其应用(共1小题)5.(2018•镇江)下列说法正确的是()A.原子通过得失电子形成离子,离子一定不能形成原子B.不饱和溶液转化为饱和溶液,溶质的质量分数一定增大C.中和反应生成盐和水,有盐和水生成的反应一定是中和反应D.某溶液中滴入无色酚酞试液后变红,该溶液一定是碱性溶液六.常用盐的用途(共1小题)6.(2018•镇江)物质性质决定用途。
食盐水电解方程式

阳极反应:2Cl--2e-=Cl2↑(氧化反应)
阴极反应:2H++2e-=H2↑(还原反应)
2NaCl + 2H2O =电解= 2NaOH + H2↑ + Cl2↑
这是因为NaCl是强电解质,在溶液里完全电离,水是弱电解质,也微弱电离,因此在溶液中存在Na+、H+、Cl-、OH-四种离子.当接通直流电源后,带负电的OH-和Cl-向阳极移动,带正电的Na+和H+向阴极移动.在这样的电解条件下,Cl-比OH-更易失去电子,在阳极被氧化成氯原子,氯原子结合成氯分子放出,使湿润的碘化钾淀粉试纸变蓝.
H+比Na+容易得到电子,因而H+不断地从阴极获得电子被还原为氢原子,并结合成氢分子从阴极放出.
在上述反应中,H+是由水的电离生成的,由于H+在阴极上不断得到电子而生成H2放出,破坏了附近的水的电离平衡,水分子继续电离出H+和OH-,。
电解饱和食盐水阳极电极反应式

电解饱和食盐水阳极电极反应式
当食盐水被电解时,阳极上发生的反应式取决于阳极材料。
如果我们使用铂或其他惰性金属作为阳极,反应式可以简化为:
2Cl^(aq) → Cl2 (g) + 2e-。
这意味着氯离子在阳极上失去电子并氧化成氯气。
这是因为在电解过程中,氯离子是优先被氧化的物质。
然而,如果阳极是活泼的金属,比如铜或铁,反应式将会有所不同。
在这种情况下,水分子也可能参与反应。
以铁为例,反应式可以表示为:
4Cl^(aq) + 2H2O (l) → Cl2 (g) + 4OH(aq) + H2 (g)。
这意味着在阳极上,氯离子被氧化生成氯气,同时水也被氧化生成氢气和氢氧根离子。
因此,电解饱和食盐水时,阳极电极的反应式可能因阳极材料
的不同而有所差异。
在实际操作中,需要根据具体情况选择合适的材料以及了解可能发生的所有可能反应。
钠和化合物的化学方程式和离子方程式

钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOHCO 32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOHHCO 3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
钠及其化合物的化学方程式和离子方程式

一■、钠点耀1、钠在氧气中燃烧:2Na + O2=—=Na2O2点耀2、钠在氯气中燃烧:2Na + Cl2=2NaCl3、钠常温条件下和氧气反应:4Na + O2=2Na2OA4、钠和硫共热:2Na+S^^=Na2s5、钠和水反应:2Na +2H2O^=2NaOH + H2f2Na + 2H2O^=2Na+ + 2OH- + H2 f6、钠和稀盐酸反应:2Na + 2HCl^=2NaCl + H2f2Na + 2H+^=2Na+ + H2 f7、钠投入到硫酸铜溶液中:2Na + CuSO4+2H2O^=Na2so4+Cu(OH)2;+H2 f2Na+Cu2+ + 2H2O^=2Na+ + Cu(OH)2 ;+H2 f8、向氯化铝溶液中加入少量的钠:6Na + 2AlCl3+ 6H2O^=6NaCl + 2Al(OH)3;+3H2 f6Na +2Al3+ + 6H2O^=6Na++Al(OH)3;+3H2 f9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+ 2H2O^=NaAlO2+3NaCl +2H2f4Na+Al3+ + 2H2O^=4Na++AlO2- + 2H2 f高温10、钠在高温条件下与四氯化钛反应:4Na+TiCl4=^工4NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O + H2O=2NaOHNa2O + H2O^=2Na+ + 2OH-2、氧化钠与二氧化碳反应:Na2O + CO2^=Na2CO33、氧化钠与盐酸反应:Na2O + 2HCl^=2NaCl + H2ONa2O + 2H+^=2Na+ + H2O4、向硫酸铜溶液中加入氧化钠:Na2O + CuSO4+H2O^=Cu(OH)2J+Na2sO4Na2O + Cu2+ + H2O^=Cu(OH)2J+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O + 2AlCl3+ 3H2O^=2Al(OH)3 J+6NaCl3Na2O + 2Al3+ + 3H2O===2Al(OH)3 J+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3^=NaAlO2+3NaCl2Na2O+Al3+ ==AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O^^4NaOH + O2f2Na2O2+2H2O===4Na+ +4OH-+O2 f2、过氧化钠与二氧化碳反应:2Na2O2+2CO2^=2Na2cO3+O2f3、过氧化钠与盐酸反应:2Na2O2+4HCl^』NaCl +2H2O+O2f2Na2O2+4H+=^4Na+ + 2H2O + O2 f4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O==2Cu(OH)2;+2Na2SO4+O2 f2Na2O2+ 2Cu2+ + 2H2O^=2Cu(OH)2J+4Na++O2 f 5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+ 6H2O^^Al(OH)3J+12NaCl + 3O2 f6Na2O2+4Al3+ + 6H2O^=4Al(OH)3J+12Na++3O2 f6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+ 2H2O^=NaAlO2+3NaCl + O2f2Na2O2+Al3+ + 2H2O^=AlO2-+4Na+ + O2f7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O^=4Fe(OH)3J+4Na2sO4+O2f4Na2O2+4Fe2+ + 6H2O^=4Fe(OH)3J+8Na+ + O2f四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al + 2NaOH +2H2O^=2NaAlO2+3H2f2Al + 2OH- +2H2O^=2AlO2- + 3H2fC12+2OH-^=Cl- + ClQ- + H2OA3、氯气通入热的浓氢氧化钠溶液中:3C12+6NaOH^^=5NaC1 + NaC1O3+ 3H2OA3c12+ 6OH-^^=5C1- + C1O3-+3H2OA4、硫和氢氧化钠溶液共热:3S+6NaOH --------2Na2S+Na2sO3+3H2OA3S+6OH-^^=2s2-+SO32- + 3H2O5、硅溶于氢氧化钠溶液中:Si + 2NaOH + H2O^=Na2SiO3+ 2H2fSi + 2OH- + H2O^=SiO32- + 2H2f6、氧化铝溶于氢氧化钠溶液中:A12O3+ 2NaOH^=2NaA1O2+ H2OA12O3 + 2OH-^=2A1O2- + H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH + CO2^=Na2CO3+ H2O2OH- + CO2^=CO32- + H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH + CO2^=NaHCO3OH-+CO2^=HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2^=Na2SO3+ H2O2OH-+SO2^=SO32- + H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2^=NaHSO3OH-+SO2^=HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+ 6NaOH^=2Na3PO4+3H2OP2O5 + 6OH- ^=2PO43- + 3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH^=NaNO2+ NaNO3+ H2O2NO2 + 2OH-^=NO2- + NO3- + H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO + NO2+ 2NaOH^=2NaNO2+ H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2^=Na2SiO3+H2O2OH-+SiO2^=SiO32- + H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH^=Na2SO4+H2OSO3+ 2OH-^=SO42- + H2O16、盐酸和氢氧化钠溶液反应:HCl + NaOH^=NaCl + H2OH+ + OH-^=H2O17、醋酸和氢氧化钠溶液反应:CH3COOH + NaOH^=CH3COONa + H2OCH3COOH + OH-^=CH3COO- + H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH^=Na2S+2H2OH2s+2OH- =S2- + 2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2s+NaOH^=NaHS+H2OH2S + OH-^=HS- + H2O20、硫酸和氢氧化钠溶液反应:H2sO4+2NaOH^=Na2sO4+2H2OH+ + OH-^=H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH^=Na3PO4+3H2OH3PO4+3OH-^=PO43- + 3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH^=NaAlO2+ 2H2OAl(OH)3 +OH- =AlO2- + 2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+ NaOH^=AgOH ;+NaNO3Ag+ + OH- =AgOH ;24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH^=Na2sO4+Cu(OH)2;CU2+ + 2OH-^=Cu(OH)2 ;25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH^=Fe(OH)3;+3NaClFe3++3OH-^=Fe(OH)3 ;26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH^=Al(OH)3;+3NaClA13+ + 3OH- ==Al(OH)3 ;27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH^=NaAlO2+3NaCl +2H2OAl3++4OH- =AlO2- + 2H2OA28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4cl + NaOH^^=NaCl + NH3f+H2OANH4+ + OH;NH3f+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:ANH4HCO3+NaOH -------- N aHCO3 + NH3 f+H2OANH4++OH-二NH3T+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:ANH4HCO3+2NaOH ------- =Na2cO3+NH3f+2H2OANH4+ + HCO3- + OH-^^=CO32- + NH3f+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH^=Na2CO3+ H2OHCO3- + OH-^=CO32- + H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH^=CaCO3 ;+NaHCO3 + H2OCa2+ + HCO3-+OH-^=CaCO3;+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH^=CaCO3;+Na2CO3+ 2H2OCa2+ + 2HCO3- + 2OH-^=CaCO3 +CO32- + 2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH^=Mg(OH)2 ;+2NaHCO3Mg2+ + OH-^=Mg(OH)2 ;35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH^=Mg(OH)2 ;+Na2CO3+ 2H2OMg2+ + 2HCO32-+4OH-^=Mg(OH)2 ;+2CO32- + 2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3^AgCl ;+NaNO3Cl-+Ag+=AgCl ;A2、氯化钠固体和浓硫酸共热:NaCl + H2sO4^^=Na2so4+2HCl T电解3、电解饱和的氯化钠溶液:2NaCl +2H2O 2NaOH + H2T+Cl2T电解2Cl- +2H2O = 2OH- + H2T+Cl2T电解4、电解氯化钠的熔融液:2NaCl 2Na + Cl2T六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2cO3+ Ca(OH)2 ^=CaCO3 ;+2NaOHCO32- + Ca2+^=CaCO3;2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+ BaCl2^=BaCO3;+2NaClCO32- + Ba2+^=BaCO3 ;3、碳酸钠溶液呈碱性:Na2cO3+ H2O=NaHCO3+ NaOHCO32- + H2O^^ HCO3- + OH-4、碳酸钠溶液滴入少量的盐酸:Na2cO3+ HCl^=NaHCO3+NaClCO32- + H+^=HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2cO3+ 2HCl^=2NaCl + CO2T+H2OCO32- + 2H+^=CO2T+H2O6、碳酸钠溶液中加入醋酸:Na2cO3+ 2CH3COOH^=2CH3COONa + CO2T+H2OCO32- + 2CH3COOH^=2CH3COO- + CO2T+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+ H2O^=2NaHCO3CO32- + CO2+ H2O^=2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+H2O^=2NaHCO32Na+ + CO32- + CO2+H2O^=2NaHCO3;9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+ 2AlCl3+3H2O^=2Al(OH)3 ;+6NaCl + 3CO2 f3CO32- + 2Al3+ + 3H2O^=2Al(OH)3;+3CO2 f10、碳酸钠溶液与氯化铁溶液混合:3Na2cO3+ 2FeCl3+ 3H2O^=2Fe(OH)3;+6NaCl + 3CO2 f3CO32- + 2Fe3+ + 3H2O^=2Fe(OH)3;+3CO2 f七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+ H2O=H2cO3+ NaOHHCO3-+H2O^^ H2c O3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl^=NaCl + CO2f+H2OHCO3- + H+^=CO2f+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH^=CH3COONa + CO2f+H2OHCO3-+CH3COOH^=CH3COO-+CO2 f+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3^=Al(OH)3 ;+3NaCl+3CO2 f3HCO3-+Al3+^=Al(OH)3 ;+3CO2f5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+ FeCl3^=Fe(OH)3 ;+3NaCl + 3CO2 f3HCO3- + Fe3+^=Fe(OH)3 ;+3CO2 f6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH^=Na2CO3+H2OHCO3-+OH-^=CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3;+NaOH + H2OCa2+ + HCO3-+OH-^=CaCO3;+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3 + Ca(OH)2 =CaCO3; +Na2CO3 + 2H2OCa2+ + 2HCO3- + 2OH-^=CaCO3; +CO32- + 2H2OA9、碳酸氢钠受热分解:2NaHCO3^^Na2CO3+CO2 f +H20一、镁点燃1、镁在氧气中燃烧:2M g+O2==2M g O点燃2、镁在氯气中燃烧:Mg+CI2=^^MgCI2点物3、镁在氮气中燃烧:3Mg+N2^=Mg3N2点燃4、镁在二氧化碳中燃烧:2Mg+CO2^=2MgO + CA5、镁与硫共热:Mg+S :MgSA6、镁与水共热:Mg+2H2O^^=Mg(OH)2十% f7、镁和盐酸反应:Mg + 2HCI^=MgCI2 + H2 fMg + 2H+^=Mg2+ + H2 f8、镁和醋酸反应:Mg+2CH3COOH^=(CH3COO)2Mg+H2 fMg+2CH3COOH^=2CH3COO- + Mg2+ + H2 f9、镁和氯化镂溶液反应:Mg + 2NH4CI^MgCI2 + 2NH3 f +H2 fMg+2NH4+^=Mg2+ + 2NH3 f +H2 f 10、将少量的镁投入到氯化铁溶液中:Mg+2FeCI3^=2FeCI2 + MgCI2Mg+2Fe3+ Mg2+ + 2Fe2+ 11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCI3^=3MgCI2 + 2Fe3Mg+2Fe3+^=3Mg2+ + 2Fe 12、镁和硫酸铜溶液反应:Mg+CuSQ4^=MgSQ4+CuMg+Cu2+ Mg2+ + Cu13、镁和浓硫酸反应:Mg+2H2SQ4^=MgSQ4+SQ2f+2H2Q14、镁和浓硝酸反应:Mg+4HNQ3^=Mg(NQ3)2+2NQ2 f+2H2QMg+4H+ + 2NQ3-^=Mg2+ + 2NQ2 f+2H2Q15、镁和稀硝酸反应:3Mg+8HNQ3^=3Mg(NQ3)2+2NQ f+4H2Q3Mg+8H+ + 2NQ3-^=Mg2+ + 2NQ f+4H2Q二、氧化镁1、氧化镁与盐酸反应:MgQ + 2HCl^=MgCl2+ H2QMgQ + 2H+^=Mg2+ + H2Q2、氧化镁和醋酸反应:MgQ + 2CH3CQQH^=(CH3CQQ)2Mg+H2QMgQ + 2CH3CQQH^=Mg2+ + 2CH3CQQ- + H2Q3、氧化镁溶于氯化铵溶液中:MgQ + 2NH4Cl^=MgCl2+ 2NH3 f+H2QMgQ + 2NH4+ ^=Mg2+ + 2NH3 f+H2Q4、氧化镁投入到氯化铁溶液中:3MgQ + 2FeCl3+3H2Q^=3MgCl2+ 2Fe(QH)33MgQ + 2Fe3+ + 3H2Q^=3Mg2+ + 2Fe(QH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(QH)2+2HCl^=MgCl2+2H2QMg(QH)2+2H+^=Mg2+ + 2H2Q2、氢氧化镁和醋酸反应:Mg(QH)2+2CH3CQQH^=(CH3CQQ)2Mg+2H2QMg(QH)2+2CH3CQQH^=2CH3CQQ- + Mg2+ + 2H2Q 3、氢氧化镁溶于氯化铵溶液中:Mg(QH)2+ 2NH4Cl^=MgCl2 + 2NH3f+2H2QMg(QH)2+2NH4+^=Mg2+ + 2NH3f+2H2Q 4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+^=3Mg2+ + 2Fe(OH)3一 A5、氢氧化镁受热分解:Mg(OH)2^^MgO + H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2 + 2AgNO3^2AgCl ;+Mg(NO3)2Cl-+Ag+==AgCl ;2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+ 2NaOH=Mg(OH)2 ;+2NaClMg2+ + 2OH-^=Mg(OH)2 ;3、氯化镁溶液加入氨水:MgCl2+ 2NH3-H2O^=Mg(OH)2 ;+2NH4ClMg2+ + 2NH3-H2O^=Mg(OH)2;+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+ 2NaAlO2+4H2O^=Mg(OH)2;+2Al(OH)3 ;+2NaClMg2+ + 2AlO2-+4H2O^=Mg(OH)2 ;+2Al(OH)3 ;电解5、电解氯化镁的熔融液:MgCl2 -------- Mg+Cl2f电解6、电解氯化镁的溶液:MgCl2+ 2H2O --------------Mg(OH)2 ;+H2 f+Cl2 f电解Mg2+ + 2Cl- +2H2O ,Mg(OH)2;+H2 f+Cl2 f五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+ 2HCl===MgCl2+ CO2f+H2OMgCO3+ 2H+===Mg2+ + CO2f+H2O2、碳酸镁与醋酸溶液反应:MgCO3+ 2CH3COOH===CH3cOO)2Mg+CO2f+H2OMgCO3+ 2CH3COOH===2CH3COO- + Mg2+ + CO2f+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+ H2O===Mg(HCO3)2MgCO3+ CO2+H2O===Mg2+ + 2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+ 2FeCl3+3H2O===3MgCl2+ 2Fe(OH)31+3CO2f3MgCO3+ 2Fe3++3H2O===3Mg2+ + 2Fe(OH)3 "3CO2f5、碳酸镁加入氯化铵溶液中:MgCO3+ 2NH4Cl===MgCl2+ 2NH3f+CO2fMgCO3+ 2NH4+===Mg2+ + 2NH3f+CO2f6、碳酸镁高温煅烧:MgCO3高温MgO + CO2f六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+ 2CO2f +2H2OHCO3- + H+==£O2T+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)J+2NaHCO3Mg2+ + 2OH-===Mg(OH)2;3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2l+Na2cO3+2H2OMg2+ + 2HCO3-+4OH-===Mg(OH)2; +2CO32- + 2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+ 2Ca(OH)2===Mg(OH)2l+2CaCO31+2H2OMg2+ + 2HCO3- + 2Ca2++4OH-===Mg(OH)2l +2CaCO3 1+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2MgCO3l+CO2T+H2O一、铝点燃1、铝在氧气中燃烧:4Al + 3O==2Al2O3点燃2、铝在氯气中燃烧:2Al + 3Cl2r=^=2AlCl3A3、铝和硫共热:2Al + 3S^=A12s34、铝与稀硫酸反应:2Al + 3H2sO4^=Al2(SO4)3+3H2 f2Al+6H+^=2Al3+ + 3H2 f5、铝和氢氧化钠溶液反应:2Al + 2NaOH +2H2O^=2NaAlO2+3H2f2Al + 2OH- +2H2O^=2AlO2- + 3H2fA6、铝和浓硫酸共热:2Al + 6H2sO4^^=Al2(SO4)3+3SO2 f+6H2OA7、铝和浓硝酸共热:Al + 6HNO3=Al(NO3)3+3NO2 f+3H2OAAl + 6H+ + 3NO3- Al3+ + 3NO2f+3H2O 8、铝和稀硝酸反应:Al+4HNO3^=Al(NO3)3+NO f+2H2OAl+4H+ + NO3- =Al3+ + NO f+2H2O8、铝和硝酸银溶液反应:Al + 3AgNO3^=Al(NO3)3 +3AgAl + 3Ag+^=Al3+ + 3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4^=Al2(SO4)3+3Cu2A1 + 3CU2+^=2Al3++3Cu高温10、铝和氧化铁高温下反应:2A1 + Fe2O3一^A12O3+ 2Fe高温11、铝和四氧化三铁高温共热:8A1 + 3Fe3O4= 皿4A12O3+9Fe有温12、铝和氧化铜高温共热:2A1+3Cug^LA12O3+ 3Cu而温13、铝和二氧化镒高温共热:4A1+3MnO2= 皿2A12O3+ 3Mn二、氧化铝1、氧化铝与稀硫酸反应:A12O3+3H2SO4^=A12(SO4)3+3H2OA12O3 + 6H+^=2A13++3H2O2、氧化铝与氢氧化钠溶液反应:A12O3+ 2NaOH^=2NaA1O2+ H2OA12O3 + 2OH-^=2A1O2- + H2O3、电解氧化铝的熔融液:2ALO_及生4A1 + 3O. f2 3冰晶石2三、氢氧化铝1、氢氧化铝与稀硫酸反应:2A1(OH)3 +3H2sO4^A12(SO4)3+6H2OA1(OH)3 +3H + =A13+ + 3H2O2、氢氧化铝与氢氧化钠溶液反应:A1(OH)3 +NaOH^=NaA1O2+ 2H2OA1(OH)3 +OH-^=A1O2- + 2H2OA3、加热氢氧化铝:2A1(OH)3 A12O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:A12(SO4)3+3BaC12^=2A1C13+3BaSO4;SO42- + Ba2+ ^=BaSO4 ;2、硫酸铝的水溶液呈酸性:A12(SO4)3+ 6H2O^^2A1(OH)3+3H2SO4A13+ + 3H2O^^A1(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:A12(SO4)3+6NaOH^=3Na2sO4+2A1(OH)3;A13+ + 3OH- =A1(OH)3 ;4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH^=2NaAlO2+ 3Na2SO4+4H2OA13++4OH- =AlO2- + 2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:A12(SO4)3+3Ba(OH)2 ^=2A1(OH)3 ;+3BaSO4 ;2A13++3SO42- + 3Ba2+ + 6OH-^=2A1(OH)3 ;+3BaSO4 ;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:A12(SO4)3+4Ba(OH)2 ^=Ba(A1O2)2 +3BaSO4 ;+4H2O2A13++3SO42- + 3Ba2+ + 8OH-^=2A1O2- + 3BaSO4 ;+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2 +2KA1(SO4)2 ^=2A1(OH)3 ;+3BaSO4 ;+K2SO43Ba2+ + 6OH- + 2A13++3SO42- ==3BaSO4 ;+2A1(OH)3 ;8、向明矶溶液中加入足量的氢氧化钡溶液:KA1(SO4)2+2Ba(OH)2 ^=KA1O2 + 2BaSO4 ;+2H2OA13+ + 2SO42- + 2Ba2++4OH- =A1O2- + 2BaSO4;+2H2O9、向硫酸铝溶液中加入氨水:A12(SO4)3+6NH3.H2O^=2A1(OH)3;+3(NH4)2SO4A13+ + 3NH3-H2O^=A1(OH)3;+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:A12(SO4)3+3Na2CO3+3H2O^=2A1(OH)3;+3Na2SO4+3CO2f2A13++3CO32- + 3H2O^=2A1(OH)3;+3CO2 f11、向硫酸铝溶液中加入碳酸氢钠溶液:A12(SO4)3+6NaHCO3^=2A1(OH)3;+3Na2SO4+6CO2 fA13+ + 3HCO3- =A1(OH)3;+3CO2f12、向硫酸铝溶液中加入硫化钠溶液:A12(SO4)3+3Na2S+6H2O^=2A1(OH)3 "3Na2sO4+3H2s f2A13++3S2- + 6H2O^=2A1(OH)3;+3H2S f13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O^=2Al(OH)3 "3Na2sO4+6H2s fAl3+ + 3HS- + 3H2O^=Al(OH)3 "3H2s f14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+ 6H2O^=2Al(OH)3 ;+3Na2SO4+3H2SiO3;2Al3++3SiO32- + 6H2O^=2Al(OH)3;+3H2SiO3 ;15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+ 12H2O^=3Na2SO4+8Al(OH)3;Al3++AlO2- + 6H2O^=4Al(OH)3;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+ 2H2O=AI(OH)3+NaOHAlO2- + 2H2O^^Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+ HCl + H2O^=Al(OH)3;+NaClAlO2- + H+ + H2O^=Al(OH)3;3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl^=NaCl+AlCl3+2H2OAlO2-+4H+=Al3+ + 2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+ 3H2O^=2Al(OH)3;+Na2CO32AlO2- + CO2+3H2O^=2Al(OH)3;+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+ CO2+ 2H2O^=Al(OH)3+NaHCO3AlO2- + CO2+ 2H2O^=Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O^=3Na2SO4+8Al(OH)3;Al3++AlO2- + 6H2O^=4Al(OH)3;7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+ NH4Cl + H2O^=Al(OH)3;+NaCl + NH3 fAlO2- + NH4+ + H2O^=Al(OH)3;+NH3 f8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+ FeCl3+6H2O^=3Al(OH)3;+Fe(OH)3 ;+3NaCl3AlO2- + Fe3+ + 6H2O^=3Al(OH)3;+Fe(OH)3 ;。
制取cacl2的化学方程式

制取氯化钙(CaCl2)可以通过多种化学反应实现,以下是几种常见的制备方法及其对应的化学方程式:
1. 通过氢氧化钙与盐酸反应:
当氢氧化钙(Ca(OH)2),也就是熟石灰或消石灰,与盐酸(HCl)反应时,可以生成氯化钙和水。
化学方程式:
Ca(OH)2+ 2HCl → CaCl2 + 2H2O
2. 通过碳酸钙与盐酸反应:
碳酸钙(CaCO3),比如石灰石或者大理石,与盐酸反应也会产生氯化钙、二氧化碳气体和水。
化学方程式:
CaCO3+ 2HCl → CaCl2 + CO2↑ + H2O
3. 工业上利用电解饱和氯化钠溶液:
在特定条件下,通过电解熔融的氯化钠(NaCl),可以得到氯气(Cl2)和金属钠(Na)。
然后,将产生的
氯气通入石灰乳(悬浮的氢氧化钙微粒)中反应,可得氯化钙和次氯酸钙(Ca(ClO)2),后者可通过进一步处理转化为氯化钙。
这是一个涉及多个步骤的过程,关键步骤的化学方程式如下:
电解NaCl(l) → Na(l) + Cl2(g)
Cl2(g) + Ca(OH)2(aq) → CaCl2(aq) + H2O(l)
在实际工业生产中,根据原料来源和成本效益等因素,会选择最合适的制备途径。
高中化学方程式大全(精)
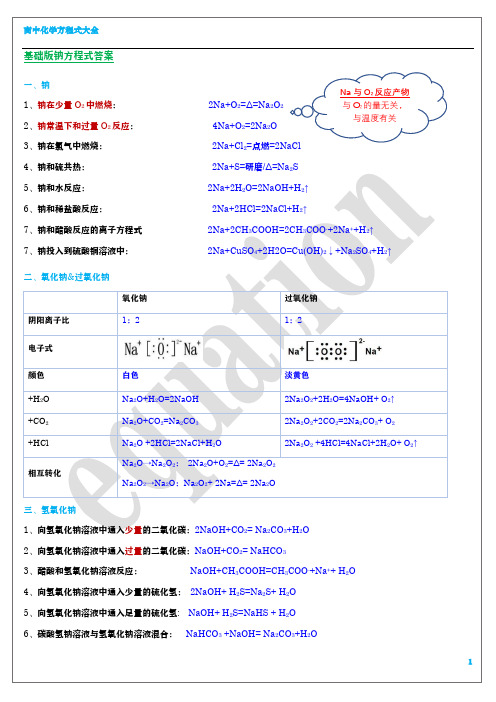
Na2O→Na2O2: 2Na2O+O2=Δ= 2Na2O2
Na2O2→Na2O:Na2O2+ 2Na=Δ= 2Na2O
三、氢氧化钠
1、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2= Na2CO3+H2O
2、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2= NaHCO3
3、醋酸和氢氧化钠溶液反应:
+CH3COOH 离子反应
CO32-+2CH3COOH(过) = 2CH3COO-+H2O + CO 2↑
Ca(OH)2
Na2CO3+ Ca(OH)2=CaCO3↓2NaOH
NaHCO3 +NaOH= Na2CO3+H2O 不反应
HCO3-+CH3COOH =CH3COO-+H2O + CO 2↑ Ca(OH)2(少) +2NaHCO3= Na2CO3+2H2O+ CaCO3↓ Ca(OH)2(过) NaHCO3= CaCO3↓+H2O +NaOH
碳酸氢铵与少量氢氧化钾溶液共热&硫酸氢铵和过量氢氧化钾溶液共热
六、绘图:将 CO2 通入 NaOH 溶液有四种可能的溶质,向溶质中滴加盐酸,纵坐标为气体/mol ;横坐标为盐酸/mol
溶质:Na2CO3
NaHCO3
Na2CO3 和 NaOH
Na2CO3 和 NaHCO3
2
高中化学方程式大全
拔高版钠方程式答案
1. 钠与盐溶液反应规律:(并不是所有的盐溶液与 Na 反应都是先水后盐:NaHSO4 等)
向饱和 Na2CO3 溶液中通入过量 CO2 气体(离子反应): 2Na++ CO32-+H2O+CO2 = 2NaHCO3↓
钠、氧化钠、过氧化钠、氢氧化钠和氯化钠及其强化练习

钠及其化合物(一)一、钠单质1、组成:Na2、结构:电子式:Na·金属键3、物理性质:银白色、柔软、熔点低、密度小4、化学性质:金属性、可燃性、还原性(1)钠露置在空气中变暗:4Na+O2===2Na2O(2)钠和硫共热:2Na+S △Na2S(3)钠在氧气中燃烧:2Na+O2点燃Na2O2(4)钠在氯气中燃烧:2Na+Cl2点燃2NaCl(5)钠和水反应:2Na+2H2O===2NaOH+H2↑(6)钠和盐酸反应:2Na+HCl===2NaCl+H2↑(7)钠和少量的氯化铝溶液反应:4Na+AlCl3+2H2O===NaAlO2+2H2↑+3NaCl (8)钠和过量的氯化铝溶液反应:6Na+2AlCl3+6H2O===2Al(OH)3↓+3H2↑+6NaCl (9)钠和硫酸铜溶液反应:2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2↓+H2↑(10)钠和熔融的四氯化钛反应:4Na+TiCl4高温Ti+4NaCl5、制法:(11)电解氯化钠的熔融液:2NaCl电解2Na+Cl2↑6、保存和用途:少量的钠保存在煤油中。
钾钠合金作原子反应堆的导热剂。
高压钠灯透雾能力强。
工业上生成钛。
7、与锂、钾的比较与水反应的剧烈程度:Cs>Rb>K>Na>Li锂与氧气反应只生成氧化锂,不生成过氧化锂。
钾除生成过氧化钾,还可生成超氧化钾。
金属性,还原性强弱:Cs>Rb>K>Na>Li最高价氧化物的水合物的碱性:CsOH>RbOH>KOH>NaOH>LiOH锂不能保存在煤油中,要保存在石蜡油中。
观察钾元素的焰色时需要透过蓝色钴玻璃。
二、氧化钠1、组成:化学式:Na2O2、结构:电子式:化学键:离子键3、物理性质:白色固体4、化学性质:碱性氧化物(1)氧化钠与水反应:Na2O+H2O===2NaOH(2)氧化钠与二氧化碳反应:Na2O+CO2===Na2CO3(3)氧化钠与盐酸反应:Na2O+2HCl===2NaCl+H2O(4)氧化钠与少量的氯化铝溶液反应:2Na2O+AlCl3===NaAlO2+3NaCl(5)氧化钠与过量的氯化铝溶液反应:3Na2O+2AlCl3+3H2O===2Al(OH)3↓+6NaCl (6)氧化钠与硫酸铜溶液反应:Na2O+CuSO4+H2O===Na2SO4+Cu(OH)2↓5、制法:(7)将过氧化钠与钠隔绝空气加热:Na2O2+2Na △2Na2O6、用途:制备氢氧化钠三、过氧化钠1、组成:化学式:Na2O22、结构:电子式:化学键:离子键、非极性键3、物理性质:淡黄色粉末4、化学性质:氧化性、漂白性(1)过氧化钠与水反应:2Na2O2+2H2O===4NaOH+O2↑(2)过氧化钠与二氧化碳反应:2Na2O2+2CO2===Na2CO3+O2↑(3)过氧化钠与盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+O2↑(4)过氧化钠与少量的氯化铝溶液反应:2Na2O2+AlCl3===NaAlO2+3NaCl+O2↑(5)过氧化钠与过量的氯化铝溶液反应:6Na2O2+4AlCl3+6H2O===4Al(OH)3↓+12NaCl+3O2↑(6)过氧化钠与硫酸铜溶液反应:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑(7)过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑(8)过氧化钠使品红褪色的原理:过氧化钠具有强的氧化性,可以氧化品红而使品红褪色。
