EO灭菌柜验证方案
EO灭菌确认方案

EO灭菌确认方案一、确认步骤1.确定验证目标:根据实际情况和要求,确定需要验证的EO灭菌过程。
2.准备样品:选择适当的产品样品作为验证对象,并保证样品完整、无损。
3.设置验证参数:根据灭菌目标和样品特性,确定EO灭菌过程的关键参数,如温度、湿度、压力、EO浓度和接触时间等。
4.设计验证试验:根据验证目标和参数要求,设计验证试验方案,并明确试验的执行步骤和流程。
5.执行验证试验:按照试验方案要求,执行验证试验,包括准备样品、装载样品、进行灭菌操作、处理验证样品等。
6.监测验证参数:在验证试验过程中,定期监测和记录关键参数的数值,确保其符合设定要求。
7.完成灭菌过程:完成验证试验后,进行EO灭菌过程的后续操作,如通气、除气、处置残留EO等。
8.数据分析和处理:对试验数据进行统计和分析,评估灭菌过程的有效性,并根据分析结果制定相应的处理措施。
9.编制验证报告:根据验证试验结果,编制验证报告,详细记录试验过程、数据分析和结论等,以供审查和审批。
二、验证测试1.生物学指标检测:通过微生物学测试方法,评估EO灭菌过程对不同微生物的杀灭效果。
2.EO浓度测试:使用气相色谱法或其他适当方法,对灭菌过程中的EO浓度进行定量分析。
3.环境监测:监测灭菌操作室的温度、湿度、压力等环境参数,确保其符合要求。
4.包装材料测试:对用于包装验证样品的材料进行物理性能、密封性能等方面的测试。
5.产品特性测试:测试验证样品的相关特性指标,如药效、物理性质等,以评估灭菌对样品的影响。
三、注意事项1.验证试验的执行必须符合相关法规和标准的要求,并进行必要的人员培训和操作指导。
2.验证试验中所使用的设备和器材必须符合相关标准,保证其可靠性和准确性。
3.验证试验过程和结果应进行严格的记录和监测,确保数据的完整性和可追溯性。
4.对验证过程中出现的异常情况,必须及时进行处理,并进行合理的分析和解释。
5.验证试验结果应进行综合评估,并及时采取相应的改进措施,确保灭菌过程的有效性和可靠性。
EO灭菌柜性能确认方案
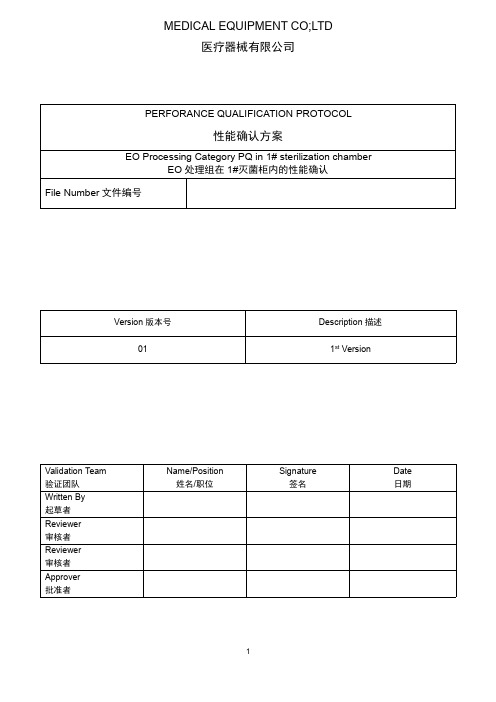
PERFORANCE QUALIFICATION PROTOCOL性能确认方案EO Processing Category PQ in1#sterilization chamberEO处理组在1#灭菌柜内的性能确认File Number文件编号Version版本号Description描述011st VersionValidation Team 验证团队Name/Position姓名/职位Signature签名Date日期Written By 起草者Reviewer 审核者Reviewer 审核者Approver 批准者目录1.验证目标Validation Objective (3)2.范围Scope (3)3.职责Responsibilities (9)4.验证策略Validation Strategy (9)5.接受标准Acceptance Criteria (11)6.偏差处理Deviations Handling (13)7.参考References (13)8.程序Procedure (14)9.附录Appendices (22)1.验证目标Validation Objective1.1.此次性能确认的目的是证实及用文件记录在现有的1#灭菌柜内采用的现有已验证的灭菌循环参数,通过实施灭菌微生物杀灭性研究(MPQ)及物理性研究(PPQ),能够实现现有EO处理组的无菌保证水平10-6。
此方案的设计持续符合ISO11135:2014-医疗产品灭菌-环氧乙烷-医疗器械灭菌过程的发展,验证及常规控制的要求。
The purpose of this Performance Qualification(PQ)is to demonstrate and document the attainment of a minimum Sterility Assurance Level of10-6for the sterilization of exiting EO Processing Category in existing1#EO Sterilization Chamber through the execution of sterilization microbiological lethality studies(MPQ)and physical performance studies(PPQ), using existing validated sterilization cycle parameters.This PQ protocol is designed to be consistent with ISO11135:2014Sterilization of health care products-Ethylene oxide-Requirements for development,validation and routine control of a sterilization process for medical devices.1.2.正常全周期循环完成后,通过EO/ECH残留的测试结果,确认达到残留放行标准的现有自然解析的时间是否足够。
臭氧灭菌柜验证方案

1. 引言臭氧灭菌柜是一种常见的消毒设备,用于对实验室器具、环境和物品进行灭菌操作。
为了保证臭氧灭菌柜的有效性和安全性,需要进行验证。
本文档将介绍臭氧灭菌柜验证方案的目的、验证方法、验证参数和验证记录。
2. 验证目的臭氧灭菌柜验证的目的是确保臭氧灭菌柜在使用过程中能够达到预期的灭菌效果,并满足相关的法规和标准要求。
验证的结果可以用来评估臭氧灭菌柜的性能,并对其进行调整和改进。
3. 验证方法3.1 初始验证初始验证是对新安装的臭氧灭菌柜进行的验证。
验证步骤如下: 1. 清洁臭氧灭菌柜,确保没有残留的污物和化学物质。
2. 将臭氧灭菌柜内放置适当数量的生物指示器(BI),并将其置于不同位置。
3. 打开臭氧灭菌柜的臭氧发生器,设置合适的臭氧浓度和作用时间。
4. 开始臭氧灭菌过程,等待灭菌完成。
5. 完成臭氧灭菌过程后,将生物指示器取出,送往实验室进行培养。
6. 根据生物指示器的培养结果,评估灭菌效果。
3.2 定期验证定期验证是对已投入使用的臭氧灭菌柜进行的验证。
验证频率根据使用情况和相关要求确定。
验证步骤如下: 1. 清洁臭氧灭菌柜,确保干净。
2. 选择适当数量的生物指示器,将其放置于臭氧灭菌柜的不同位置。
3. 打开臭氧发生器,设置合适的臭氧浓度和作用时间。
4. 启动臭氧灭菌过程,等待灭菌完成。
5. 取出生物指示器,送往实验室培养。
6. 根据生物指示器的培养结果,评估灭菌效果。
4. 验证参数在臭氧灭菌柜的验证过程中,需要注意以下参数: - 臭氧浓度:验证前需要确定臭氧灭菌柜的臭氧生成器能够产生预定的臭氧浓度。
- 作用时间:验证前需要确定臭氧灭菌柜的臭氧发生器能够提供预定的作用时间,确保灭菌效果充分。
- 温度:验证过程中需要测量臭氧灭菌柜的温度,确保温度在预定范围内,以保证臭氧发生器的正常工作。
5. 验证记录对臭氧灭菌柜的验证过程和结果需要进行详细记录,以便跟踪和审计。
验证记录包括以下内容: - 臭氧灭菌柜的标识信息和使用情况。
EO灭菌验证方案(注射器)

无菌医疗器械产品环氧乙烷灭菌工艺验证方案1 概述验证名称:无菌医疗器械产品环氧乙烷灭菌工艺验证。
容积: 6m3验证目的:通过对灭菌过程确认,确保灭菌系统和灭菌过程能持续、稳定和有效的运行,保证灭菌产品达到10-6的无菌保证水平,并且灭菌后产品和包装的性能符合预期要求。
验证时间: 2012 年 2 月至 2012 年 3 月验证项目:安装验证(IQ)、运行确认(OQ)和性能确认(PQ)。
适用产品:一次性使用吸氧管参加验证部门:研发部、质管部、生产部、设备部主要验证依据:ISO11135-1:2007 医疗保健产品灭菌环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求EN 1422:1997 环氧乙烷灭菌器(itd YY0503-2005)EN ISO 11737-1:2006 医疗器械的灭菌微生物学方法第1部分:产品上微生物总数的测定(AC:2009)EN ISO 11607-1:2009 最终灭菌医疗器械的包装第1部分:材料、无菌屏障系统和包装系统要求EN ISO 11138-2:2009 医疗保健产品灭菌生物指示物第2部分:环氧乙烷灭菌用生物指示物EN ISO 10993-7:2008 医疗器械生物学评价第7部分环氧乙烷灭菌残留量EN ISO 11737-2:2009 医疗器械的灭菌微生物学方法第2部分:确认灭菌过程的无菌试验2 验证小组的构成及人员职责根据ISO11135-1:2007标准规定,确定了从事环氧乙烷灭菌验证过程中的方案制定及实施操作、微生物检验、设备运行及计量管理工作的人员,再根据设备维护操作、计量器具检定、物理性能及微生物性能测定作了分工,见下表:3 参加验证部分人员资质确认灭菌操作人员须经专业培训合格上岗,灭菌效果验证(检验)人员应经过培训合格,建立“验证人员资质确认表”4 相关要素的确认4.1 产品定义a)适用产品名称:一次性使用吸氧管b) 主要材料: PP、PE、橡胶等。
环氧乙烷灭菌柜验证资料

第一章总则1.1 目的根据GB 18279.1-2015《医疗器械的灭菌――环氧乙烷灭菌的验证及日常控制》和ISO 11135-2014标准的要求,对环氧乙烷灭菌器进行有效性确认(验证),以保证满足一次性医疗器械无菌的要求。
1.2 范围本验证方案仅适用于规格型号:XXX、厂编号:XXX的环氧乙烷灭菌器的验证。
1.3 验证1.3.1 验证方案:验证方案由生技部制定,并经管理者代表:XXX确认后,方可实施。
1.3.2 验证实施:公司内部相关职能部门人员:XXX、XXX、XXX、XXX组成验证小组,并负责按照验证方案组织实施环氧乙烷灭菌器的验证。
1.3.3 验证结论:由验证小组对验证的过程和所取得的数据进行确认,形成验证结论并会签。
1.3.4 验证资料:所有有关验证的资料、所取得的数据、表单和验证报告由质管部妥善保管、存档。
1.4 再验证1.4.1 再验证的条件当发生以下情况时,应进行再验证:⑴.当引入新产品或产品的结构、材料发生变化时;⑵.当产品的包装型式、包装材料发生变化时;⑶.当灭菌室内负载的装载方式发生变化时;⑷.当灭菌工艺发生变化时;⑸.灭菌器大修后或连续出现灭菌质量事故(灭菌不合格)时;⑹.正常情况下,应至少每年进行一次再验证;1.4.2 再验证的组织实施1.4.2.1 再验证申请当需要进行再验证时,应由生技部提出申请,填写《再验证申请表》,报请管理者代表:XXX批准。
1.4.2.2 再验证方案的制定管理者代表批准再验证申请后,应指定相关职能部门制定再验证方案,经管理者代表确认后方可组织实施。
1.4.2.2 再验证的组织实施由质管部、生技部、灭菌车间等相关职能部门的人员:XXX、XXX、XXX、XXX组成验证小组,按照再验证方案组织实施验证。
1.4.3 再验证结论的确认验证小组负责对验证的过程和所取得的数据进行确认、形成验证结论并会签。
1.4.4 再验证资料所有有关再验证的资料、所取得的数据、表单和再验证报告应妥善保管、存档。
验证方案(EO灭菌)
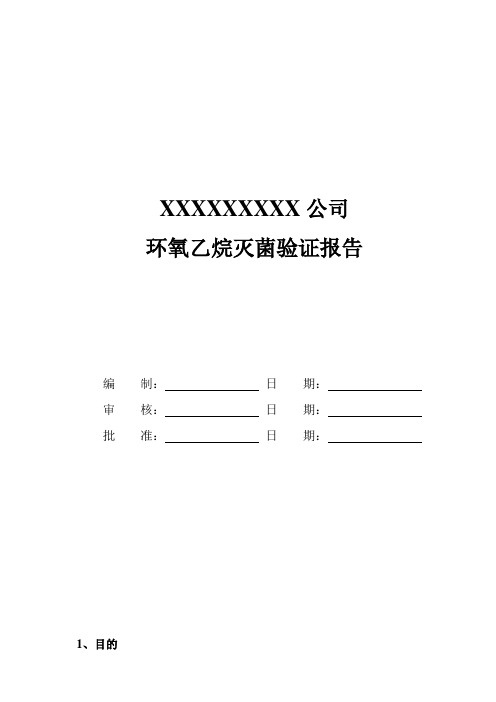
XXXXXXXXX公司环氧乙烷灭菌验证报告编制:日期:审核:日期:批准:日期:1、目的一次性使用无菌产品的灭菌是使医疗器械达到无菌使用的必须过程,灭菌过程的有效性和合理性验证和监控是确保产品无菌的可靠保障。
此验证的目的是为了证明XXXXXXXXXXXXXXX公司生产的XXXXXXXXXX的环氧乙烷灭菌过程的有效性和合理性。
2、执行标准EN550/ISO 11135:1994《医疗器械环氧乙烷灭菌确认和常规控制》3、职责3.1XXXXXXXXXX公司生产的XXXXXXXX产品由XXXXXXXX公司进行环氧乙烷灭菌验证。
3.2XXXXXXXXX提供灭菌设备、灭菌造作人员和环氧乙烷。
3.3XXXXXXXXXXX公司提供验证所需的产品和生物指示剂,并且在灭菌后测试BIs。
4、灭菌产品本次灭菌的产品是XXXXXXXXXXXXXXXXX,主要原料为XXXX,包装方式为:内袋:纸塑包装袋,生产厂家为XXXXXXX公司;中包装:使用1层瓦楞,每中包装装载10只产品;大包装:采用3层瓦楞纸,每包装装载8个中包装,即80只产品。
5、生物指示剂本次验证采用XXXXXXXXXX公司生产的环氧乙烷灭菌用生物指示剂,菌种:Bacillus atrophaeus;芽孢含量:1.9×106cfu/片。
符合标准ISO11138-1,2和EN866-1,2。
6、环氧乙烷本次验证使用的纯环氧乙烷由XXXXXXXXXX提供。
7、灭菌设备7.1本次验证的灭菌设备是北京丰台永定消毒设备厂生产的HMQ-6型灭菌器,灭菌舱容积为6M3。
7.2环氧乙烷灭菌器的确认由北京丰台永定消毒设备厂进行,详见《XXXX环氧乙烷灭菌器确认验证报告》。
8、验证小组成员9、微生物性能验证9.1产品装载灭菌产品的包装按照4中所述的规定,堆放模式见附一。
9.2温度传感器的分布依据EN550要求,温度传感器使用贴触式温度探头,数量为11个,分布模式见附二。
9.3生物指示剂的堆放依据EN550要求,本次试验每次放置22片生物指示剂菌片且分别放置在产品正常包装内封好,放置模式见附三,另外作1个阳性对照。
3产品环氧乙烷灭菌验证方案

3产品环氧乙烷灭菌验证方案一、背景介绍环氧乙烷(EO)灭菌是一种常见的灭菌方法,广泛用于医疗保健行业。
灭菌的目的是杀灭或彻底去除产品中所有存在的微生物,确保产品的安全性和无菌状态。
灭菌验证是验证灭菌过程的有效性和可靠性的过程,以确保灭菌过程符合规定的标准和要求。
本文将介绍产品环氧乙烷灭菌验证的方案。
二、实验设计1.实验目的:验证环氧乙烷灭菌过程对产品的有效灭菌作用。
2.实验流程a.准备试验样本:从生产线上抽取一定数量的产品样本进行灭菌验证实验。
b.建立灭菌参数:根据产品特性和相关标准,确定灭菌过程中的参数,如温度、压力、湿度和时间等。
c.环境监测:在灭菌过程中,对环境条件进行实时监测,确保其符合标准要求。
d.均匀分布导致菌:在试验样本中均匀分布导致菌,以确保灭菌过程可以有效杀灭这些菌。
e.灭菌过程:将试验样本放入灭菌器中,按照设定的参数进行灭菌处理。
计数试验。
g.数据分析:根据试验结果,分析灭菌过程是否达到要求的灭菌效果。
三、实验设备和材料1.环氧乙烷灭菌器:确保能够提供适当的温度、湿度和压力等参数。
2.试验样本:符合产品特性和使用标准的样本。
3.菌液:采用符合标准的菌液进行试验。
4.菌落计数平板:用于菌落计数试验。
5.环境监测设备:用于监测灭菌过程中的环境条件。
四、实验步骤1.环境监测:在灭菌过程开始前,对环境条件进行监测,确保其符合标准要求。
2.准备试验样本:从生产线上抽取一定数量的产品样本进行实验。
3.建立灭菌参数:根据产品特性和相关标准,确定灭菌过程中的参数,如温度、压力、湿度和时间等。
4.均匀分布导致菌:将菌液均匀涂抹在试验样本上,确保样本中均匀分布导致菌。
5.灭菌过程:将试验样本放入灭菌器中,按照设定的参数进行灭菌处理。
计数试验,确定菌落数量。
7.数据分析:根据试验结果,分析灭菌过程的灭菌效果是否达到要求。
8.结论和总结:根据数据分析的结果,给出针对灭菌过程的改进建议,并总结验证过程。
EO灭菌柜验证方案
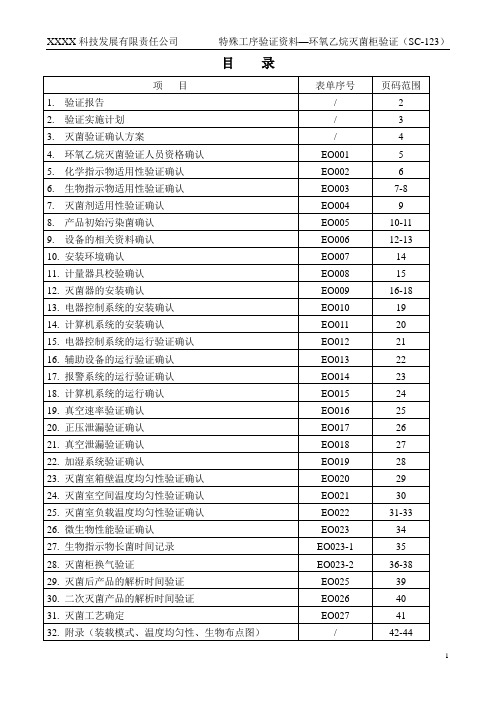
目录环氧乙烷灭菌工艺验证实施计划环氧乙烷灭菌柜确认验证实施方案一、验证目的:1、验证确认新购灭菌器安装后的运行系统是否符合GB18279-2000标准要求;2、为该灭菌柜确定有效的灭菌工艺。
二、验证时间:计划2003年1月5日—4月2日。
三、验证小组人员组成:1.组长:2.组员:四、验证依据GB18279-2000 医疗器械环氧乙烷来菌确认与常规控制GB18282-2000 医疗保健产品灭菌化学指示物GB18281.1-2000 环氧乙烷灭菌用生物指示物五、验证产品名称:1.一次性使用XXXX2..一次性使用XXXX;3.一次性使用XXXX;4.一次性使用XXXX;六、验证过程(一)验证对象新购20m3环氧乙烷灭菌器—台。
(二)人员分工1.验证前准备、灭菌工艺的确定验证:2.灭菌器运行验证:;3.灭菌验证过程的操作:4.灭菌过程验证中物理性能、生物性能、试验鉴定:;5.验证过程中的审核:6.验证报告、作业文件的批准:环氧乙烷灭菌验证人员资格确认表化学指示物使用性验证确认表生物指示物使用性验证确认表生物指示物含菌量检验记录环氧乙烷适用性验证确认表产品初始污染菌符合性验证确认表产品初始污染菌试验记录灭菌器电器控制系统的运行验证确认表灭菌器真空速率验证确认表加湿系统运行验证确认灭菌室箱壁温度均匀性验证确认灭菌室空间温度均匀性验证灭菌室负载温度均匀性试验确认表(装载模式一)微生物性能验证确认表生物指示物长菌时间记录灭菌工艺确认附图1装载模式一装载模式二附图2装载模式三温度均匀性验证布点示意图附图3 生物指示物灭菌验证布点示意图生物指示物灭菌监测布点示意图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录
环氧乙烷灭菌工艺验证实施计划
环氧乙烷灭菌柜确认验证实施方案
一、验证目的:
1、验证确认新购灭菌器安装后的运行系统是否符合GB18279-2000标准要求;
2、为该灭菌柜确定有效的灭菌工艺。
二、验证时间:计划2003年1月5日—4月2日。
三、验证小组人员组成:
1.组长:
2.组员:
四、验证依据
GB18279-2000 医疗器械环氧乙烷来菌确认与常规控制
GB18282-2000 医疗保健产品灭菌化学指示物
GB18281.1-2000 环氧乙烷灭菌用生物指示物
五、验证产品名称:
1.一次性使用XXXX
2..一次性使用XXXX;
3.一次性使用XXXX;
4.一次性使用XXXX;
六、验证过程
(一)验证对象
新购20m3环氧乙烷灭菌器—台。
(二)人员分工
1.验证前准备、灭菌工艺的确定验证:
2.灭菌器运行验证:;
3.灭菌验证过程的操作:
4.灭菌过程验证中物理性能、生物性能、试验鉴定:;
5.验证过程中的审核:
6.验证报告、作业文件的批准:
环氧乙烷灭菌验证人员资格确认表
化学指示物使用性验证确认表
生物指示物使用性验证确认表
生物指示物含菌量检验记录
环氧乙烷适用性验证确认表
产品初始污染菌符合性验证确认表
产品初始污染菌试验记录
灭菌器电器控制系统的运行验证确认表
灭菌器真空速率验证确认表
加湿系统运行验证确认
灭菌室箱壁温度均匀性验证确认
灭菌室空间温度均匀性验证
灭菌室负载温度均匀性试验确认表(装载模式一)
微生物性能验证确认表
生物指示物长菌时间记录
灭菌工艺确认
附图1装载模式一装载模式二
附图2装载模式三
温度均匀性验证布点示意图
附图3 生物指示物灭菌验证布点示意图
生物指示物灭菌监测布点示意图。
