过氧化氢分解实验报告
过氧化氢分解热的测定实验报告

过氧化氢分解热的测定实验报告实验报告:过氧化氢分解热的测定实验目的:本实验旨在探究过氧化氢分解热(ΔH)的测定方法,借此加深对热力学原理的理解。
实验步骤:1.首先,将过氧化氢的50%溶液放在实验室温度计内部的均质化反应器中。
使用温度计确认过氧化氢的初始温度,并维持恒定的温度。
2.接下来,放入2g MnO2,并快速搅拌以促进反应的进行。
3.观察反应过程中液体的颜色变化并记录下变化情况。
4.使用温度计记录反应器中混合物在反应过程中的温度变化,并将变化情况记录在实验记录表中。
5.最后,计算出过氧化氢分解热(ΔH),并分析实验结果。
实验记录:实验室内温度:25℃过氧化氢50%溶液温度:22℃加入MnO2后,溶液呈现橙黄色,并产生气泡,液面上升。
反应结束后,溶液呈淡黄色。
温度记录表:时间温度变化(℃)0秒 22℃30秒 24℃60秒 26℃90秒 28℃120秒 30℃150秒 32℃180秒 34℃实验结果:通过温度变化记录表得知,反应持续了3分钟,并在该时间内温度从22℃上升至34℃。
因此,ΔT = 12℃。
根据反应方程式2H2O2 → 2H2O + O2和反应物和生成物的生成热(反应热):H2O2→H2O+1/2O2ΔH=74.8kJ/mol可以推算出该反应的反应热。
根据热力学公式,可得反应热Q = m × C × ΔT。
其中m为过氧化氢50%溶液的质量,C为过氧化氢50%溶液的比热,ΔT为实验测得的温度变化量。
由此计算得到实验测得的ΔH为-337kJ/mol。
实验结论:通过本实验可以得出,过氧化氢分解热的测定方法是一种简单而直接的方法,可有效地测定物质的反应热,并加深对热力学原理的理解。
此外,实验结果还表明过氧化氢的反应热约为-337kJ/mol。
过氧化氢的催化分解实验报告

过氧化氢的催化分解实验报告过氧化氢的催化分解实验报告引言:过氧化氢(H2O2)是一种常见的无机化合物,具有氧化性和漂白性质。
它在许多领域中被广泛应用,如医疗、卫生、环境保护等。
本实验旨在通过催化剂的作用,观察过氧化氢的分解速度,并探究催化剂对反应速率的影响。
实验材料:1. 过氧化氢溶液(浓度为3%)2. 催化剂:铁离子溶液、锰离子溶液、铜离子溶液3. 试管4. 称量器具5. 温度计6. 计时器实验步骤:1. 准备三个试管,分别标记为A、B、C。
2. 在试管A中加入适量的过氧化氢溶液。
3. 在试管B中加入适量的过氧化氢溶液和铁离子溶液。
4. 在试管C中加入适量的过氧化氢溶液和锰离子溶液。
5. 记录每个试管中溶液的初始温度。
6. 同时开始计时器,观察溶液的反应情况。
7. 记录每个试管中溶液的反应时间,并观察反应的变化。
8. 重复实验步骤2-7,使用铜离子溶液作为催化剂。
实验结果:通过实验观察,我们得到了以下结果:1. 在试管A中,没有加入任何催化剂的过氧化氢溶液分解速度较慢,反应时间较长。
2. 在试管B中,加入铁离子溶液后,过氧化氢溶液分解速度明显加快,反应时间缩短。
3. 在试管C中,加入锰离子溶液后,过氧化氢溶液分解速度也有所增加,但相对于铁离子溶液,反应时间较长。
4. 在试管D中,加入铜离子溶液后,过氧化氢溶液分解速度最快,反应时间最短。
讨论与分析:根据实验结果,我们可以得出以下结论:1. 催化剂对过氧化氢的分解速度有显著的影响。
加入铁离子、锰离子和铜离子作为催化剂,都能够加速过氧化氢的分解反应。
2. 不同催化剂的效果不同。
铁离子和铜离子催化剂对过氧化氢的分解速度影响最大,而锰离子的效果相对较弱。
3. 催化剂可以提高反应速率的原因是它们能够提供活化能降低的反应路径,从而加速反应的进行。
4. 催化剂的选择和使用条件对反应速率有重要影响。
在本实验中,铁离子和铜离子催化剂的效果较好,可能是因为它们与过氧化氢分子之间的相互作用更强。
实验报告探究不同条件下过氧化氢的分解
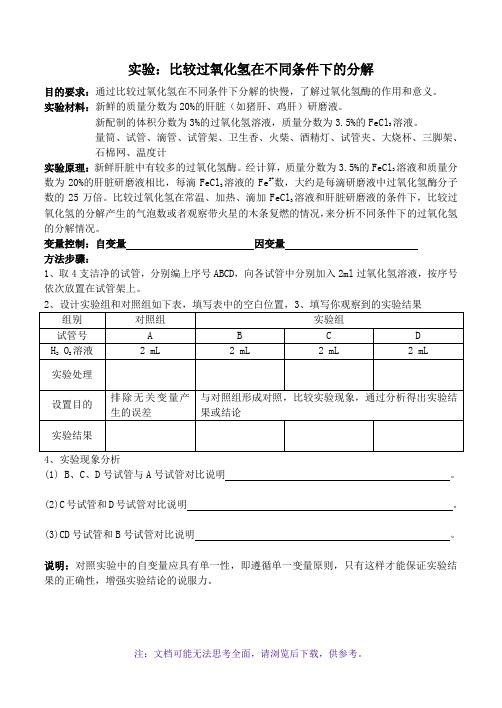
实验:比较过氧化氢在不同条件下的分解目的要求:通过比较过氧化氢在不同条件下分解的快慢,了解过氧化氢酶的作用和意义。
实验材料:新鲜的质量分数为20%的肝脏(如猪肝、鸡肝)研磨液。
新配制的体积分数为3%的过氧化氢溶液,质量分数为3.5%的FeCl3溶液。
量筒、试管、滴管、试管架、卫生香、火柴、酒精灯、试管夹、大烧杯、三脚架、石棉网、温度计实验原理:新鲜肝脏中有较多的过氧化氢酶。
经计算,质量分数为3.5%的FeCl3溶液和质量分数为20%的肝脏研磨液相比,每滴FeCl3溶液的Fe3+数,大约是每滴研磨液中过氧化氢酶分子数的25万倍。
比较过氧化氢在常温、加热、滴加FeCl3溶液和肝脏研磨液的条件下,比较过氧化氢的分解产生的气泡数或者观察带火星的木条复燃的情况,来分析不同条件下的过氧化氢的分解情况。
变量控制:自变量因变量方法步骤:1、取4支洁净的试管,分别编上序号ABCD,向各试管中分别加入2ml过氧化氢溶液,按序号依次放置在试管架上。
(1) B、C、D号试管与A号试管对比说明。
(2)C号试管和D号试管对比说明。
(3)CD号试管和B号试管对比说明。
说明:对照实验中的自变量应具有单一性,即遵循单一变量原则,只有这样才能保证实验结果的正确性,增强实验结论的说服力。
注意:①实验时要选用新鲜的肝脏作材料,否则肝细胞中的过氧化氢酶等有机物会部分分解,从而影响实验的准确性。
②肝脏要制成研磨液。
研磨后的肝脏能与试管中的过氧化氢充分接触,加速过氧化氢的分解。
实验设置原则:单一变量原则、 、 。
巩固练习:已知222222H O H O O =+↑,可以通过观察反应过程中O 2的生成速度(即气泡从溶液中释放的速度)来判断H 2O 2分解反应的速度。
请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。
要求写出实验步骤、预测实验结果、得出结论,并回答问题。
实验材料与用具:适宜浓度的H 2O 2溶液,蒸馏水,3.5%3FeCl 溶液,0.01%的过氧化氢酶溶液,恒温水浴锅,试管。
过氧化氢分解热的测定实验报告

过氧化氢分解热的测定实验报告一、实验目的1、掌握量热法测定化学反应热效应的基本原理和方法。
2、测定过氧化氢分解反应的热效应。
3、学习使用精密量热计和相关仪器设备。
二、实验原理过氧化氢(H₂O₂)在催化剂的作用下发生分解反应,生成水(H₂O)和氧气(O₂):2H₂O₂(l)→ 2H₂O(l)+ O₂(g)该反应是一个放热反应,其热效应可以通过量热法进行测定。
量热法的基本原理是在绝热条件下,使反应在量热计中进行,通过测量反应前后体系的温度变化(ΔT),结合量热计的热容(C),根据公式Q =C×ΔT 计算出反应放出的热量(Q)。
三、实验仪器和试剂1、仪器精密量热计温度计(精确到 01℃)搅拌器秒表移液管容量瓶2、试剂过氧化氢溶液(约 30%)二氧化锰(催化剂)四、实验步骤1、量热计的准备洗净并干燥量热计,确保其内部干净无杂质。
用量筒准确量取一定量的去离子水注入量热计中,记录水的体积(V)。
2、量热计热容的测定将温度计插入量热计中,搅拌均匀,待温度稳定后记录初始温度(T₁)。
用电热器对量热计中的水加热,同时搅拌,加热一段时间(t)后,关闭加热器,继续搅拌,待温度稳定后记录最终温度(T₂)。
根据公式 Q = Pt 计算出加热器提供的热量(P 为加热器功率),同时根据公式 C = Q /(T₂ T₁) 计算出量热计的热容(C)。
3、过氧化氢分解反应热的测定用移液管准确量取一定体积的过氧化氢溶液注入量热计中,加入适量的二氧化锰作为催化剂,立即盖上盖子,同时启动搅拌器和秒表,记录反应开始的时间和初始温度(T₃)。
观察反应过程中温度的变化,待温度不再升高并稳定后,记录最终温度(T₄)。
4、实验结束后,清洗仪器,整理实验台。
五、实验数据记录与处理1、量热计热容的测定|实验次数|初始温度 T₁(℃)|最终温度 T₂(℃)|加热时间 t(s)|加热器功率 P(W)||::|::|::|::|::|| 1 |____ |____ |____ |____ || 2 |____ |____ |____ |____ || 3 |____ |____ |____ |____ |取三次实验的平均值计算量热计的热容 C。
5.1 实验比较过氧化氢在不同条件下的分解、影响酶活性的条件实验报告单-2023-2024 学年高一

探究酶的特性以及酶活性的影响因素实验姓名:班级:学号:实验一:比较过氧化氢在不同条件下的分解实验目的比较H2O2在常温、常压、H2O2酶、铁离子等条件下气泡产生的多少(O2产生速率)或卫生香燃烧的剧烈程度,比较二者的催化效率的高低,了解过氧化氢酶的作用。
实验原理材料用具实验材料:新鲜的质量分数为20%的肝脏(鸡肝)研磨液、体积分数为3%的过氧化氢溶液器材:试管,量筒,小烧杯,大烧杯,滴管,试管夹,恒温水浴锅,火柴,卫生香。
实验步骤试管编号1234第一步H2O2浓度3%3%3%3%剂量第二步温度添加试剂剂量实验现象气泡产生情况卫生香复燃情况实验结论酶在细胞代谢中有作用,同时还证明与相比,酶具有的特性。
A.必须使用新鲜的肝脏研磨液。
新鲜:若肝脏不新鲜,肝细胞内的过氧化氢酶等有机物就会在腐生细菌的作用下分解,使组织中酶分子数量减少且活性降低。
研磨液:可加大肝细注意事项胞内过氧化氢酶与试管中过氧化氢的接触面积,加速过氧化氢的分解过程。
B.滴加氯化铁溶液和肝脏研磨液不能合用同一支试管。
因为酶具有高效性,少量的酶带入氯化铁溶液中也会影响实验结果的准确性。
C.过氧化氢有一定的腐蚀性,使用时不要让其接触皮肤。
实验反思(1)如何判断过氧化氢被分解的快慢?(2)与1号试管相比,2号试管产生的气泡多,这一现象说明了什么?(3)3、4号试管未经加热,也有大量气泡产生,这说明了什么?(4)3号试管Fe3+数比4号试管H2O2酶高25万倍,但4号试管反应速率更快,这说明什么?(5)2号、3号、4号试管相比,哪支试管最终产生的氧气最多,为什么?实验二:探究淀粉酶对淀实验目的探究淀粉酶是否只能催化的化学反应。
实验原理①淀粉和蔗糖都是。
它们在酶的催化作用下都能水解成。
②在淀粉溶液和蔗糖溶液中分别加入淀粉酶,再用鉴定溶液中有无还原糖。
实验材料质量分数为2%的新配制的溶液。
质量分数为3%的溶液,质量分数为3%的溶液,斐林试剂,热水。
过氧化氢分解热的测定实验报告

过氧化氢分解热的测定实验报告过氧化氢分解热的测定实验报告引言:过氧化氢是一种常见的氧化剂,其分解反应在化学实验中被广泛应用。
本实验旨在通过测定过氧化氢分解的热量,了解该反应的热力学性质,并通过实验数据验证热力学定律。
实验原理:过氧化氢(H2O2)在催化剂存在下分解为水和氧气,反应式如下:2H2O2(aq) → 2H2O(l) + O2(g)根据热力学定律,反应的热量变化(ΔH)等于反应物和生成物之间的热量差。
因此,通过测量反应过程中的温度变化,可以计算出过氧化氢分解的热量。
实验步骤:1. 将一定量的过氧化氢溶液倒入烧杯中,并用温度计测量初始温度。
2. 将催化剂(如二氧化锰)加入过氧化氢溶液中,并迅速搅拌均匀。
3. 记录反应过程中的温度变化,并在反应结束后停止记录。
4. 重复实验三次,取平均值作为最终结果。
实验结果与讨论:在实验中,我们测量了不同浓度的过氧化氢溶液的分解热。
结果显示,随着过氧化氢浓度的增加,分解热也随之增加。
这表明过氧化氢的分解反应是一个放热反应,且反应热量与反应物浓度成正比。
此外,我们还观察到反应过程中的温度变化。
在过氧化氢分解反应中,反应速率较快,产生的气体氧气会迅速逸出。
由于氧气的逸出,反应体系的温度会有所下降。
通过测量温度的变化,我们可以推断出反应的速率以及反应热量的大小。
实验误差的分析:在实验过程中,可能存在一些误差,如温度计的不准确、催化剂的量不精确等。
这些误差可能会对实验结果产生一定的影响。
为减小误差,我们进行了多次实验,并取平均值作为最终结果。
此外,实验操作时要尽量减小温度计读数的误差,确保催化剂的加入量准确。
实验应用:过氧化氢分解热的测定方法可以应用于其他化学反应的热力学研究。
通过测量反应过程中的温度变化,可以推断反应的热力学性质,如反应的放热性质、反应速率等。
这对于了解化学反应的热力学特性以及优化反应条件具有重要意义。
结论:本实验通过测定过氧化氢分解的热量,验证了热力学定律,并得出了过氧化氢分解反应是一个放热反应的结论。
过氧化氢分解实验报告

过氧化氢分解实验报告过氧化氢分解实验报告实验目的:通过观察过氧化氢在不同条件下的分解速率,探究过氧化氢分解反应的影响因素。
实验原理:过氧化氢(H2O2)是一种常见的氧化剂,它可以分解成水和氧气。
过氧化氢分解反应是一个自催化反应,即反应物中的过氧化氢分子作为催化剂参与反应。
反应的化学方程式为:2H2O2 -> 2H2O + O2。
实验材料:1. 过氧化氢溶液(浓度为3%)2. 试管3. 烧杯4. 水槽5. 温度计6. 火柴7. 实验台实验步骤:1. 将适量的过氧化氢溶液倒入试管中。
2. 将试管放入水槽中,控制水温在25摄氏度。
3. 用火柴点燃试管中的过氧化氢溶液。
4. 观察并记录气泡的产生速率。
5. 重复实验,控制水温分别为35摄氏度和45摄氏度。
6. 将实验结果整理并进行分析。
实验结果:在实验中观察到,随着水温的升高,过氧化氢分解的速率也增加。
在25摄氏度的条件下,气泡的产生速率相对较慢,而在35摄氏度和45摄氏度的条件下,气泡的产生速率明显增加。
这说明温度对过氧化氢分解反应有促进作用。
实验讨论:温度是影响过氧化氢分解速率的重要因素之一。
随着温度的升高,分子的平均动能增加,分子之间的碰撞频率也增加,从而加快了反应速率。
这可以解释为什么在高温条件下,过氧化氢的分解速率更快。
此外,过氧化氢分解反应是一个自催化反应,即反应物中的过氧化氢分子作为催化剂参与反应。
因此,过氧化氢浓度的增加也会加快反应速率。
然而,在本实验中,我们使用的过氧化氢溶液浓度为3%,因此过氧化氢浓度对实验结果的影响较小。
实验结论:通过本实验的观察和分析,我们得出以下结论:1. 温度是影响过氧化氢分解速率的重要因素,高温条件下反应速率更快。
2. 过氧化氢浓度对反应速率的影响较小。
实验意义:过氧化氢分解实验是化学教育中常见的实验之一。
通过这个实验,我们可以了解到温度对化学反应速率的影响,并且加深对催化剂作用的理解。
此外,过氧化氢分解反应还与生活中的一些现象和应用息息相关,比如火柴的燃烧和漂白剂的使用等。
过氧化氢催化分解实验报告

过氧化氢催化分解实验报告实验报告
题目:过氧化氢催化分解实验报告
实验目的:
1.了解氧化还原反应与催化反应的基本原理。
2.学习氧化剂和还原剂的特性和作用。
3.掌握实验中使用的催化剂及其催化作用。
4.探究过氧化氢催化分解的反应机理。
实验器材:
生氧化氢、催化剂、空气流量计、吸管、比色皿、坩埚、取样管等。
实验步骤:
1.将催化剂放入坩埚中,并将过氧化氢溶液加入坩埚中。
2.测量空气流量,向坩埚中加入空气。
3.用吸管分别取出实验前后的过氧化氢溶液,放入比色皿中,
测量其浓度。
实验结果:
实验前,过氧化氢的浓度为4.56mol/L;实验后,过氧化氢的
浓度为 3.45mol/L。
经过计算,反应速率为 3.18×10^(-3)mol/(L·s)。
实验原理:
过氧化氢因其能迅速剧烈分解为氧气和水,因此在制作起泡剂、消毒剂等方面有很广泛的用途。
但是,其分解热高且易于自燃,
因此必须谨慎处理。
经过实验证明,过氧化氢在催化剂的作用下
能够更容易地分解为水和氧气,所以在某些工业生产中,使用过
氧化氢的时候会加入一些催化剂,以便提高分解产物的产率。
实验结论:
通过本实验,我们了解了过氧化氢催化分解的基本原理,掌握了该反应的实验步骤,并通过实验获得了反应速率。
在实验中,我们还发现过氧化氢的浓度与反应速率成反比,催化剂的作用可以显著提高反应速率。
参考文献:
1.《无机化学实验》(第4版)
2.《化学实验技术与操作》(第3版)
3.《物理化学实验》(第2版)。
