初中化学方程式:酸的化学性质
人教版初中化学方程式大全

人教版初中化学方程式大全一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O22MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光2. 铁在氧气中燃烧:3Fe + 2O2Fe3O4现象:剧烈燃烧、火星四射、生成黑色的固体3. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O22Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O 现象:淡蓝色的火焰6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O22P2O5现象::生成白烟7. 硫粉在空气中燃烧:S + O2 SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
8. 碳在氧气中充分燃烧:C + O2CO2现象:生成能够让澄清石灰水浑浊的气体9. 碳在氧气中不充分燃烧:2C + O22CO 现象:燃烧(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 2CO211. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2↑14.加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O22MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O22CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O22CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理): Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O22H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O22MgO41.铁在氧气中燃烧:3Fe + 2O2Fe3O442. 铜在空气中受热:2Cu + O22CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸---盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)---- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属--盐+ 氢气(见上)(2)酸+ 金属氧化物--盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱--- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐----另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑1、基本反应类型:化合反应:多变一分解反应:一变多置换反应:一单换一单复分解反应:互换离子2、常见元素的化合价(正价):一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;一二铜,二三铁,二四六七锰特别。
(完整版)初中酸碱盐化学方程式(全)

1.酸及酸的通性对于酸的定义,我们说电离时生成的阳离子全部都是H+。
这里我们要特别注意的是“阳离子”、“全部”、“H+”几个关键字。
下面我们以常见的硫酸和盐酸为例来说明酸的通性。
酸的通性盐酸硫酸酸使紫色石蕊试液变红,使无色酚酞试液不变色。
盐酸使紫色石蕊试液变红,无色酚酞试液不变色硫酸使紫色石蕊试液变红,无色酚酞试液不变色。
金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;金属是指在金属活动顺序表中排在‘氢’前面的活泼金属,排在‘氢’后的金属不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
2.碱及碱的通性与酸雷同,我们可以将碱定义为:电离时生成的阴离子全部是OH-离子。
这里我们也要特别注意的是“阴离子”、“全部”、“OH -”几个关键字。
初中常见物质的化学式和化学方程式总结大全

…………………………初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)点燃1. 镁在空气中燃烧:2Mg + O ====2MgO 22. 铁在氧气中燃烧:3Fe + 2O 点燃FeO 4233. 铜在空气中受热:2Cu + O 加热2CuO 24. 铝在空气中燃烧:4Al + 3O 点燃2AlO 3 225. 氢气中空气中燃烧:2H + O 点燃2HO 2226. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O 点燃2PO 5 227. 硫粉在空气中燃烧:S + O点燃SO2 28. 碳在氧气中充分燃烧:C + O 点燃CO 2 29. 碳在氧气中不充分燃烧:2C + O 点燃2CO 2(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O 点燃2CO 2211. 甲烷在空气中燃烧:CH + 2O 点燃CO + 2HO 224212. 酒精在空气中燃烧:CHOH + 3O 点燃2CO + 3HO 25222(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O ↑214.加热高锰酸钾:2KMnO加热KMnO + MnO + O↑(实验室制氧气原理1)24 42215.过氧化氢在二氧化锰作催化剂条件下分解反应:2HO MnO2H2O+ O ↑(实验室制氧气原222 2理2)16.加热氯酸钾:2KClO 加热(MnO)2KCl + 3O↑(实验室制氧气原理) 232二、自然界中的水:17.水在直流电的作用下分解(研究水的组成实验):2HO 通电2H↑+ O↑ 2 2218.生石灰溶于水:CaO + HO == Ca(OH) 2219.二氧化碳可溶于水:HO + CO==HCO 3222三、质量守恒定律:20.镁在空气中燃烧:2Mg + O 点燃2MgO 221.铁和硫酸铜溶液反应:Fe + CuSO === FeSO + Cu 4422.氢气还原氧化铜:H + CuO 加热Cu + HO 22碳酸钠与盐酸反应:Na2CO3 + 2HCl == 2NaCl + CO ↑+ HO 22四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O点燃CO 2224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO↑225.焦炭还原氧化铁:3C+ 2FeO 高温4Fe + 3CO↑232(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O 点燃CO 2227.煤炉的中层:CO + C 高温2CO 228.煤炉的上部蓝色火焰的产生:2CO + O 点燃2CO 2 2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO + 2HCl == CaCl + HO + CO↑2223(((((((.…………………………30.碳酸不稳定而分解:HCO == HO + CO↑222331.二氧化碳可溶于水:HO + CO== HCO 322232.高温煅烧石灰石(工业制二氧化碳):CaCO 高温CaO + CO↑2333.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)+ CO=== CaCO ↓+ HO 22 2 3(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO 235.一氧化碳的可燃性:2CO + O 点燃2CO 2 2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):NaCO+ 2HCl == 2NaCl + HO + CO↑23 22五、燃料及其利用:37.甲烷在空气中燃烧:CH+ 2O点燃CO+ 2HO 24 2 238.酒精在空气中燃烧:CHOH + 3O 点燃2CO + 3HO 2225239.氢气中空气中燃烧:2H + O 点燃2HO 222六、金属43. 铝在空气中形成氧化膜:4Al + 3O= 2AlO(铝耐腐蚀的原因)生成一层致密的氧化铝薄膜22 3 (2)金属单质+ 酸--------盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + HSO4 = ZnSO4 + H↑2245. 铁和稀硫酸Fe + HSO4 = FeSO4 + H↑2246. 镁和稀硫酸Mg + HSO4 = MgSO4 + H↑2247. 铝和稀硫酸2Al +3HSO4 = Al(SO4) +3 H↑223248. 锌和稀盐酸Zn + 2HCl == ZnCl + H↑2249. 铁和稀盐酸Fe + 2HCl == FeCl + H↑2250. 镁和稀盐酸Mg+ 2HCl == MgCl + H↑2251.铝和稀盐酸2Al + 6HCl == 2AlCl + 3 H↑23(3)金属单质+ 盐(溶液)-------新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO== FeSO + Cu 4453. 锌和硫酸铜溶液反应:Zn + CuSO ==ZnSO + Cu 4454. 铜和硝酸汞溶液反应:Cu +Hg(NO3)== Cu(NO3) + Hg 22铜和硝酸银溶液反应:Cu +2AgNO== Cu(NO3) +2Ag 23(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属--------盐+ 氢气(见上)(2)酸+ 金属氧化物--------盐+ 水56. 氧化铁和稀盐酸反应:FeO+ 6HCl ==2FeCl + 3HO 23 2357. 氧化铁和稀硫酸反应:FeO+3HSO4 == Fe(SO4) + 3HO 2223 2358. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl + HO 2259. 氧化铜和稀硫酸反应:CuO + HSO4 == CuSO4 + HO 2241.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(3)酸+ 碱--------盐+ 水(中和反应)(((((((.…………………………60.盐酸和烧碱起反应:HCl + NaOH == NaCl +HO 261. 盐酸和氢氧化钙反应:2HCl + Ca(OH)== CaCl+ 2HO 22 262. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)== AlCl + 3HO 23363. 硫酸和烧碱反应:HSO + 2NaOH == NaSO + 2HO 24242(4)酸+ 盐--------另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO + 2HCl == CaCl+ HO + CO↑232265.碳酸钠与稀盐酸反应: Na2CO+ 2HCl == 2NaCl + HO + CO↑22366.碳酸氢钠与稀盐酸反应:NaHCO+ HCl== NaCl + HO + CO↑22367. 硫酸和氯化钡溶液反应:HSO + BaCl == BaSO4 ↓+ 2HCl 2242、碱的化学性质(1)碱+ 非金属氧化物--------盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO == NaCO + HO 232269.苛性钠吸收二氧化硫气体:2NaOH + SO == NaSO+ HO 23 2270.苛性钠吸收三氧化硫气体:2NaOH + SO == Na2SO + HO 23471.消石灰放在空气中变质:Ca(OH) + CO == CaCO ↓+ HO 223272. 消石灰吸收二氧化硫:Ca(OH) + SO == CaSO ↓+ HO 2232(2)碱+ 酸--------盐+ 水(中和反应,方程式见上)(3)碱+ 盐--------另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)+ NaCO == CaCO↓+ 2NaOH 32 323、盐的化学性质(1)盐(溶液)+ 金属单质-------另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO == FeSO + Cu 44(2)盐+ 酸--------另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: NaCO + 2HCl == 2NaCl + HO + CO↑2223碳酸氢钠与稀盐酸反应:NaHCO + HCl== NaCl + HO + CO↑232(3)盐+ 碱--------另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH) + NaCO == CaCO↓+ 2NaOH 3232(4)盐+ 盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO== AgCl↓+ NaNO 3 378.硫酸钠和氯化钡:NaSO + BaCl== BaSO4↓+ 2NaCl 2 24(((((((.…………………………一、物质的学名、俗名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)生石灰、氧化钙:CaO (4)干冰(固体二氧化碳):CO (5)盐2酸、氢氯酸:HCl (6)亚硫酸:HSO(7)氢硫酸:HS (8)熟石灰、消石灰:Ca(OH) (9)苛性钠、火碱、2 223烧碱:NaOH (10)纯碱、苏打:NaCO 碳酸钠晶体、纯碱晶体:NaCO.10HO (11)碳酸氢钠、酸式22332碳酸钠:NaHCO (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO.5HO (13)铜绿、孔雀石:234Cu(OH)CO(分解生成三种氧化物的物质)(14)甲醇:CHOH 有毒、失明、死亡(15)酒精、乙醇:3232CHOH (16)醋酸、乙酸(16.6℃冰醋酸)CHCOOH(CHCOO-醋酸根离子)具有酸的通性(17)氨3325气:NH (碱性气体)(18)氨水、一水合氨:NH.HO(为常见的碱,具有碱的通性,是一种不含金233属离子的碱)(19)亚硝酸钠:NaNO (工业用盐、有毒)2二、常见物质的颜色的状态1、白色固体:MgO、PO、CaO、NaOH、Ca(OH)、KClO、KCl、NaCO、NaCl、无水CuSO;铁、4225332镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO、FeO▲KMnO为紫黑色43243、红色固体:Cu、FeO 、HgO、红磷▲硫:淡黄色▲Cu(OH)CO为绿色322324、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
酸和碱的化学性质及化学方程式

酸和碱的化学性质及化学方程式金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O 碱+酸→盐+水NaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O 盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl酸性氧化物+碱→盐+水2NaOH+CO2=Na2CO3+H2OCa(OH)2+CO2=CaCO3↓+H2O酸+碱→盐+水NaOH+HCl=NaCl+H2OCa(OH)2+H2SO4=CaSO4+2H2O 盐+碱→另一种盐+另一种碱2NaOH+CuSO4=Na2SO4+Cu(OH)2↓Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 盐溶液+金属→盐ˊ+金属ˊCuSO4+Zn=ZnSO4+Cu盐+酸→盐ˊ+酸ˊBaCl2+H2SO4=BaSO4↓+2HCl盐溶液+碱溶液→盐ˊ+碱ˊ3NaOH+FeCl3=3NaCl+Fe(OH)3↓盐溶液+盐溶液→盐ˊ+盐ˊAgNO3+NaCl=AgCl↓+NaNO3AgNO3+KCl=AgCl↓+KNO3Ba(NO3)2+H2SO4=BaSO4↓+2HNO3K2CO3+2HCl=2KCl+CO2↑+H2OCO2+Ca(OH)2=CaCO3↓+H2O糟糕它不认识表格你用下面的那个吧没表格的(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn+2HCl=ZnCl2+H2↑有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑3、铁跟稀盐酸反应:Fe+2HCl=FeCl2+H2↑有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应:Fe+H2SO4=FeSO4+H2↑溶液变成浅绿色。
初中化学酸、碱、盐的化学方程式

初中必背化学方程式

初中化学方程式汇总一、氧气的性质:1单质与氧气的反应:化合反应1. 镁在空气中燃烧:2Mg + O22MgO2. 铁在氧气中燃烧:3Fe + 2O2Fe3O43. 铜在空气中受热:2Cu + O22CuO4. 铝在空气中燃烧:4Al + 3O22Al2O35. 氢气中空气中燃烧:2H2 + O22H2O6. 红磷在空气中燃烧研究空气组成的实验:4P + 5O22P2O57. 硫粉在空气中燃烧:S + O2SO28. 碳在氧气中充分燃烧:C + O2CO29. 碳在氧气中不充分燃烧:2C + O22CO2化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O22CO211. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O3氧气的来源:13.玻义耳研究空气的成分实验2HgO Hg+ O2↑14.加热高锰酸钾:2KMnO4K2MnO4 + MnO2 + O2↑实验室制氧气原理115.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O22H2O+ O2↑实验室制氧气原理2二、自然界中的水:16.水在直流电的作用下分解研究水的组成实验:2H2O2H2↑+ O2 ↑ 17.生石灰溶于水:CaO + H2O == CaOH218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O22MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO Cu + H2O22. 镁还原氧化铜:Mg + CuO Cu + MgO四、碳和碳的氧化物:1碳的化学性质23. 碳在氧气中充分燃烧:C + O2CO224.木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O34Fe + 3CO2↑2煤炉中发生的三个反应:几个化合反应26.煤炉的底层:C + O2CO227.煤炉的中层:CO2 + C2CO28.煤炉的上部蓝色火焰的产生:2CO + O22CO23二氧化碳的制法与性质:29.大理石与稀盐酸反应实验室制二氧化碳:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石工业制二氧化碳:CaCO3CaO + CO2↑ 33.石灰水与二氧化碳反应鉴别二氧化碳:CaOH2 + CO2 === CaCO3↓+ H2O4一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO Cu + CO235.一氧化碳的可燃性:2CO + O22CO2其它反应:36.碳酸钠与稀盐酸反应灭火器的原理:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O22H2O六、金属1金属与氧气反应:40.镁在空气中燃烧:2Mg + O22MgO41.铁在氧气中燃烧:3Fe + 2O2Fe3O442. 铜在空气中受热:2Cu + O22CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O32金属单质+ 酸-------- 盐+ 氢气置换反应44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2SO43 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑3金属单质+ 盐溶液------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + HgNO32 == CuNO32 + Hg3金属铁的治炼原理:55.3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质1酸+ 金属-------- 盐+ 氢气见上2酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2SO43 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O3酸+ 碱-------- 盐+ 水中和反应60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + CaOH2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + AlOH3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O4酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质1 碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:CaOH2 + CO2 == CaCO3↓+ H2O 72. 消石灰吸收二氧化硫:CaOH2 + SO2 == CaSO3↓+ H2O2碱+ 酸-------- 盐+ 水中和反应,方程式见上3碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:CaOH2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质1盐溶液+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu2盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑3盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:CaOH2 + Na2CO3 == CaCO3↓+ 2NaOH4盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
九年级化学酸的性质及化学方程式

酸的性质•定义:化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
•酸的通性:(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气例:2HCl+Fe=FeCl2+H2↑(3)跟碱性氧化物反应酸+碱性氧化物→盐+水3H2SO4+Fe2O3=Fe2(SO4)3+3H2O (4)跟某些盐反应酸+盐→新酸+新盐H2SO4+BaCl2=2HCl+BaSO4↓(5)跟可溶性碱发生中和反应酸+碱→盐+水2HCl+Ba(OH)2=BaCl2+2H2O常见酸的性质:(1)盐酸是氯化氢的水溶液,是一种混合物。
纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。
浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口立即产生白色酸雾。
这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。
纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。
稀H2SO4具有酸的通性。
浓硫酸除去具有酸的通性外,还具有三大特性:①吸水性:浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂:浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。
纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。
但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。
原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。
初中中考化学知识点常见的酸和碱
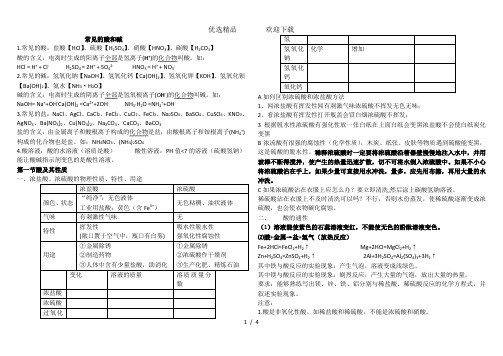
常见的酸和碱1.常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-2.常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH-NH3·H2O =NH4++OH-3.常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO44.酸溶液:酸的水溶液(溶质是酸)酸性溶液:PH值<7的溶液(硫酸氢钠)能让酸碱指示剂变色的是酸性溶液。
第一节酸及其性质一、浓盐酸、浓硫酸的物理性质、特性、用途1.4.8.A如何区别浓硫酸和浓盐酸方法1、闻浓盐酸有挥发性闻有刺激气味浓硫酸不挥发无色无味;2、看浓盐酸有挥发性打开瓶盖会冒白烟浓硫酸不挥发;3 根据脱水性浓硫酸有强化性放一张白纸在上面白纸会变黑浓盐酸不会使白纸炭化变黑B浓流酸有很强的腐蚀性(化学性质),木炭、纸张、皮肤等物质遇到硫酸能变黑,这是硫酸的脱水性。
稀释浓硫酸时一定要将浓硫酸沿着器壁慢慢地注入水中,并用玻棒不断得搅拌,使产生的热量迅速扩散,切不可将水倒入浓硫酸中。
如果不小心将浓硫酸沾在手上,如果少量可直接用水冲洗,量多,应先用布擦,再用大量的水冲洗。
