配合物的结构和研究方法 ppt课件
合集下载
配合物ppt课件

含有两种或两种以上配位体的配合物,若 配位体在空间的排列方式不同,就能形成不 同几何构型的配合物。
.
19
结构不同→性质不同
A是
。
顺式
反式
B是
。
[ Pt(NH3)2Cl2]
配合物 颜色 极性 溶解度 抗癌活性
A 棕黄色 极性 0.2577 有活性
B 淡黄色 非极性 0.0366 无活性
.
20
哪一种结构的[ Pt(NH3)2Cl2] 易溶解于H2O,为什么?
[Ag(NH3)2]+ OH-
[Fe(CN)6]4- K+
[AlF6]3-
Na+
Ag+ Fe2+ Al3+
NH3 CNF-
Ni(CO)4
Ni(CO)4
无
[Co(NH3)5Cl] Cl2
[Co(NH3)5Cl]2+
Cl-
Ni
CO
Co3+ NH3和Cl-
配位 数 2 6 6
4
6
.
12
(1)配合物整体(包括内界和外界)应显电中性;
由提供孤电子对的配位体与接受孤电子对的中心 原子(或离子)以配位键结合形成的化合物称为配位化 合物,简称配合物。
2. 形成条件
(1) 中心原子(或离子)必须存在空轨道。 (2) 配位体具有提供孤电子对的原子。
.
8
二、配合物的组成
[Cu(NH3)4] SO4
中心离子 配位体 配位数 外界离子
内界
外界
.
21
[Pt(NH3)4Cl2]
哪种结构的[ Pt(NH3)2Cl4] 在H2O中溶解度较大,试写 出其结构式。
.
19
结构不同→性质不同
A是
。
顺式
反式
B是
。
[ Pt(NH3)2Cl2]
配合物 颜色 极性 溶解度 抗癌活性
A 棕黄色 极性 0.2577 有活性
B 淡黄色 非极性 0.0366 无活性
.
20
哪一种结构的[ Pt(NH3)2Cl2] 易溶解于H2O,为什么?
[Ag(NH3)2]+ OH-
[Fe(CN)6]4- K+
[AlF6]3-
Na+
Ag+ Fe2+ Al3+
NH3 CNF-
Ni(CO)4
Ni(CO)4
无
[Co(NH3)5Cl] Cl2
[Co(NH3)5Cl]2+
Cl-
Ni
CO
Co3+ NH3和Cl-
配位 数 2 6 6
4
6
.
12
(1)配合物整体(包括内界和外界)应显电中性;
由提供孤电子对的配位体与接受孤电子对的中心 原子(或离子)以配位键结合形成的化合物称为配位化 合物,简称配合物。
2. 形成条件
(1) 中心原子(或离子)必须存在空轨道。 (2) 配位体具有提供孤电子对的原子。
.
8
二、配合物的组成
[Cu(NH3)4] SO4
中心离子 配位体 配位数 外界离子
内界
外界
.
21
[Pt(NH3)4Cl2]
哪种结构的[ Pt(NH3)2Cl4] 在H2O中溶解度较大,试写 出其结构式。
配合物结构的空间构型PPT教学课件

分析:起偏器和检偏器的偏振方向垂直时,没有 光通过;偏振方向平行时,光强度达到最大当其 中一个偏振片转动180度的过程中,两偏振片的方 向由垂直到平行再到垂直,所以通过的光先增强,
又减小到零,选项A正确.
小结:
• 光波是一种横波. • 偏振光会发生偏振现象
1、太阳、电灯等普通光源发出的光,包含着在垂直于传 播方向上沿一切方向振动的光,而且沿着各个方向振 动的光波的强度都相同.这种光叫做自然光 .
2、自然光通过第一个偏振片(叫做起偏器)之 后,只有振动方向跟偏振片的透振方向一致的 光波才能通过.也就是说,通过第一个偏振片 的光波,在垂直于传播方向的平面上,只沿着 一个特定的方向振动.这种光叫做偏振光.
sp
中心原子杂化方式
sp
配位数
2
银的化 合价
+1
形状
直线型
活动与探究
试用杂化轨道理论分析下列配合物的空 间构型 [Zn(NH3)4]2+
[Ag(CN)2]-
[HgI3][Ni(CN)4]2-
总结归纳
三、常见配合物的杂化方式、配位数及空间构型
中心原子杂化 配位数
方式
Sp
2
形状 直线型
Sp2 Sp3 *dsp2 * sp3 d *dsp3 * sp3 d2 * d2sp3
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
又减小到零,选项A正确.
小结:
• 光波是一种横波. • 偏振光会发生偏振现象
1、太阳、电灯等普通光源发出的光,包含着在垂直于传 播方向上沿一切方向振动的光,而且沿着各个方向振 动的光波的强度都相同.这种光叫做自然光 .
2、自然光通过第一个偏振片(叫做起偏器)之 后,只有振动方向跟偏振片的透振方向一致的 光波才能通过.也就是说,通过第一个偏振片 的光波,在垂直于传播方向的平面上,只沿着 一个特定的方向振动.这种光叫做偏振光.
sp
中心原子杂化方式
sp
配位数
2
银的化 合价
+1
形状
直线型
活动与探究
试用杂化轨道理论分析下列配合物的空 间构型 [Zn(NH3)4]2+
[Ag(CN)2]-
[HgI3][Ni(CN)4]2-
总结归纳
三、常见配合物的杂化方式、配位数及空间构型
中心原子杂化 配位数
方式
Sp
2
形状 直线型
Sp2 Sp3 *dsp2 * sp3 d *dsp3 * sp3 d2 * d2sp3
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
配合物结构

2 Eeg + 3Et2 g = 0 ∴ Eeg Et2 g = 10 Dg
那
Eeg = 6 Dg Et2 g = 4 Dg
3、正四面体场的作用:配体从四面体的四个顶点接近中心离子
L
L
一种 d xy , d yz , d zx
L
L L
指向四面体棱的中点,
L
受一定斥力,能量有所 上升;
L
L
d xy , d yz , d zx
2+ 4
[Fe ( H 2O )6 ] ,[Fe ( CN )6 ]
Q Fe2+ : kk 3d 6 , p = 19150cm 1 H 2O = 10400cm 1 , CN = 33000cm 1 ∴ H 2O < p ,
[Fe ( H 2O )6 ]2+ 中Fe2+的 d电子排布
eg 2 t2 g 3+1
正八面体
dsp , d sp L 杂化
一般,共价配合物多是低自旋态。如 [Fe(CN)6]3-等
晶体场理论(CFT) §6-2 晶体场理论(CFT)
M
n+与L n-的作用是L n-形成的力场对M n+的作用,使M n+
的d轨道分裂, d电子重排。
一、中心离子 轨道能级的分裂: 中心离子d轨道能级的分裂 中心离子 轨道能级的分裂: 1、球对称场的作用:5个d轨道受到的作用是相同的,轨道整 体能量上升,但不发生分裂。 Es
依光谱序列
I < Br <L< OH < F < H2O <L< py< NH3 <L< en< NO < CN,CO 2
第六章配合物和簇合物的结构与性质PPT课件
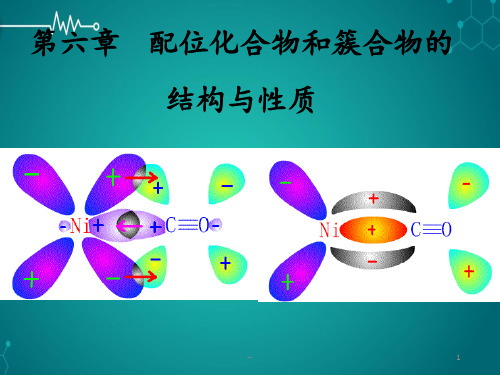
的点电荷与M的d轨道电子云产生排斥作用。
--
13
在晶体场中d 轨道能级分裂,引起电子排布及其他 一系列性质的变化,据此可解释配位化合物的各种 性质。如光谱、水合热及几何结构等特性。
--
14
六配位和四配位是过渡金属离子配合物的主要形式,
分别称为正八面体场(Oh)、正四面体场(Td)和正
方形场(D4h)。
D4h场
自由离子
Es
dx2-y2
ddxz2y dxz dyz
d轨道 球对称作用部分
x
y
四配位化合物的配位型式与d电子数的多少及配体的电
负性有关
--
21
立方体
四面体
t2g
t2
八面体 eg
平面正方形 dx2-y2
dxy
球对称
t2g
dz2
Td
Oh
eg Oh
配体对称性决定了d轨道能级的分裂
dxz, dyz
这与键的形成有关:dxy,dxz,dyz虽不能与配体L形 成键,但条件适合可形成键,从而影响的大小 ,这与配位场理论有关。
B:当配位体固定时, 随中心离子而改变:
对同一金属离子而言,电荷越高, 值越大;
如:Mn2+对H2O的值为7800cm-1,而Mn3+对H2O的
值为21000cm-1
--
26
对电子构型(d电子及价数)相同的不同金属离子,主 量子数越大(周期),则值越大; 5d 4d 3d
--
12
6.1.1 晶体场理论(CFT)
1.晶体场理论的内容: 把中心离子(M)和配体(L)的相互作用看作类似
离子晶体中正负离子的静电作用。
当L接近M时,M中的d轨道受到L负电荷的
配合物的组成和应用ppt课件

合氮酶中Fe-Mo中 心构造表示图
思索题:
要证明某溶液中不含Fe3+而能够含有Fe2+,进展如
下实验操作时,最正确顺序为
①参与足量氯水 ②参与足量酸性高锰酸钾溶液 ③参
与少量NH4SCN溶液
A.①③
B.③②
C.③①
D.①②③
答案:C
1、以下分子或离子中都存在着配位键的是( B )
A.NH3、H2O B.NH4 + 、H3O+ C.N2、HClO D.[Cu(NH3) 4]2+ PCl3
4、配合物的异构景象 问题处理:P78
顺式 极性分子
反式 非极性分子
几种配合物离子的空间构型:
[Ag(NH3)2]+ [AlF6] 3-
[Zn(NH3)4]2+
[Ni(CN)4] 2-
对“中心原子的配位数是几?配位体分布在中心原子周围 时构成的空间构型是什么?〞的判别,中学不作详细要求
【5用实、验配1 】合在物5的﹪的运硝酸银课溶本液第中7逐9页滴参活与动2与m探ol·求L-1:氨
入2~3滴的硫氰化钾(KSCN)溶液,察看实验景象。
实验景象: 溶液变成血红色。
Fe3+ +3 SCN- == Fe(SCN)3
【实验3 】在两支试管中分别参与2mL 5﹪的硫酸铜和 5﹪的硫酸铁的混合溶液,向一支试管中滴加 10﹪的氢氧 化钠溶液,向另一支试管中滴加浓氨水,察看实验景象。
Cu2+ +
专题4:分子空间构造与物质性质
请思索课本第78页<活动与探求>
【实实验验景1】象:取先5产m生l饱蓝和色硫沉酸淀铜、溶而液后于沉试淀管溶中解,向其中
逐滴滴入浓氨水,振荡,察看实验景象。
思索题:
要证明某溶液中不含Fe3+而能够含有Fe2+,进展如
下实验操作时,最正确顺序为
①参与足量氯水 ②参与足量酸性高锰酸钾溶液 ③参
与少量NH4SCN溶液
A.①③
B.③②
C.③①
D.①②③
答案:C
1、以下分子或离子中都存在着配位键的是( B )
A.NH3、H2O B.NH4 + 、H3O+ C.N2、HClO D.[Cu(NH3) 4]2+ PCl3
4、配合物的异构景象 问题处理:P78
顺式 极性分子
反式 非极性分子
几种配合物离子的空间构型:
[Ag(NH3)2]+ [AlF6] 3-
[Zn(NH3)4]2+
[Ni(CN)4] 2-
对“中心原子的配位数是几?配位体分布在中心原子周围 时构成的空间构型是什么?〞的判别,中学不作详细要求
【5用实、验配1 】合在物5的﹪的运硝酸银课溶本液第中7逐9页滴参活与动2与m探ol·求L-1:氨
入2~3滴的硫氰化钾(KSCN)溶液,察看实验景象。
实验景象: 溶液变成血红色。
Fe3+ +3 SCN- == Fe(SCN)3
【实验3 】在两支试管中分别参与2mL 5﹪的硫酸铜和 5﹪的硫酸铁的混合溶液,向一支试管中滴加 10﹪的氢氧 化钠溶液,向另一支试管中滴加浓氨水,察看实验景象。
Cu2+ +
专题4:分子空间构造与物质性质
请思索课本第78页<活动与探求>
【实实验验景1】象:取先5产m生l饱蓝和色硫沉酸淀铜、溶而液后于沉试淀管溶中解,向其中
逐滴滴入浓氨水,振荡,察看实验景象。
配合物的结构和异构现象PPT课件

1.三角双锥 2.四方锥 3.多面体之间的转化
三角双锥 (trigonal bipyramid, TBP) D3h
四方锥 (square pyramid, SP)
C4v
[Fe(CO)5] D3h
BiF5
C4v
1.三角双锥
d8、d9、d10 和 d0构型金属离子较常见。
如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 [Co(H)(N2)(PPh3)3]
S
Ag C
Ag
N
N
Ag C
S
AgSCN晶体
二、配位数3
配位数为3的配合物,其空间结构一般 为平面三角形.
原因:当三个配体配位于没有非键电子 的中心原了,只有在配体占等边三角形的三 个角即键角为120°,配体之间的斥力最小。
中心原子是以 sp2、dp2、或ds2杂化轨 道与配体的合适轨道成键。单核的平面3配 位的配合物不多。
(a), (b), D4h
沿四重轴拉长或压扁
(2).沿2个四重轴(C4)改变长度的称正交变形 (Oh→D2h).如图(c).
(3). 沿 着 一 个 三 重 轴 ( C3 ) 的 变 形 称 三 角 变 形 (Oh→D3d).如图(d).
2、三角棱柱(D3h )
1965年出现了第一个三角棱柱配合物 [Re(S2C2Ph2)3]属于这一结构。
一、平面正方形配合物的几何异构现象
1、[MA2B2] 最典型的代表是二氯·二氨合铂 (Ⅱ)[PtCl2(NH3)2],其有两种几何异构体分别为 顺式和反式。
图2.5 [PtCl2(NH3)2]的两种几何异构体
2、[MABCD] 这一类配合物应有三种几何异构体。最早得
到的这一型式的配合物是 [Pt(NH3)(NH2OH)(Py)(NO2)]+ 阳 离 子 , 它 的 三 种 异构体如下图。
三角双锥 (trigonal bipyramid, TBP) D3h
四方锥 (square pyramid, SP)
C4v
[Fe(CO)5] D3h
BiF5
C4v
1.三角双锥
d8、d9、d10 和 d0构型金属离子较常见。
如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 [Co(H)(N2)(PPh3)3]
S
Ag C
Ag
N
N
Ag C
S
AgSCN晶体
二、配位数3
配位数为3的配合物,其空间结构一般 为平面三角形.
原因:当三个配体配位于没有非键电子 的中心原了,只有在配体占等边三角形的三 个角即键角为120°,配体之间的斥力最小。
中心原子是以 sp2、dp2、或ds2杂化轨 道与配体的合适轨道成键。单核的平面3配 位的配合物不多。
(a), (b), D4h
沿四重轴拉长或压扁
(2).沿2个四重轴(C4)改变长度的称正交变形 (Oh→D2h).如图(c).
(3). 沿 着 一 个 三 重 轴 ( C3 ) 的 变 形 称 三 角 变 形 (Oh→D3d).如图(d).
2、三角棱柱(D3h )
1965年出现了第一个三角棱柱配合物 [Re(S2C2Ph2)3]属于这一结构。
一、平面正方形配合物的几何异构现象
1、[MA2B2] 最典型的代表是二氯·二氨合铂 (Ⅱ)[PtCl2(NH3)2],其有两种几何异构体分别为 顺式和反式。
图2.5 [PtCl2(NH3)2]的两种几何异构体
2、[MABCD] 这一类配合物应有三种几何异构体。最早得
到的这一型式的配合物是 [Pt(NH3)(NH2OH)(Py)(NO2)]+ 阳 离 子 , 它 的 三 种 异构体如下图。
配合物结构与性质PPT幻灯片

关于配合物的最早研究——Co(NH3)6]Cl3
CoCl2 + 6NH3
CoCl2 6NH3
蓝色(稳定)
O2
NH4Cl
玫红色(不稳定)
CoCl3 6NH3
桔黄色(稳定)
CoCl3•6H2O与浓盐酸加热至100℃也没有氨气放出; 只有在加入强碱加热的条件下,才放出氨气,但配
合物的结构也被破坏了。
H3N H3N
由离子或原子(称为中心原子)同一定数目的分子或离子(称 为配体)所组成的,无论在晶体中或溶液中都结合得比较牢 固,有一定的稳定性。通常把特征部分用方括号括起来,称 为配合物的内界,难以解离,如[Cu(H2O)4]2+。
外界:在特征部分以外的离子,如硫酸根,它同中心原子
联结得比较松弛,并使整个配合物呈中性,为配合物的 外界部分,容易解离。
配体的分类
C•o6NC3HKlOCH(O)o3HK6NCHl π-酸配体:提供孤对电子对与中心原子形成
σ-配键外,同时还有与中心原子d轨道对称性匹
加热
配的空轨道(p,d或π*),能接受中心原子提供 的非键d电子对,形成反馈π键的配体。如:
33
33
CO等
π-配体:既能提供π电子(定域或离域π键中的
电子)与中心离子或原子形成配键,又能接受中 心原子提供的非键d电子对形成反馈π键的不饱 和有机配体。烯烃、炔烃、π-烯丙基等和苯、 环戊二烯、环庚三烯、环辛四烯等。
OO
H3C
C H
CH3
联吡啶 (bipy)
N
N
配体的分类
注意
配体的齿数虽与配位原子数有关,但不能仅 凭配位原子的个数来决定它的“有效”齿数 。 配体的“有效”齿数并不是固定不变的。
第七章_配合物的结构和表征.ppt

1917 物理
巴克拉Charles Glover Barkla
元素的特征X射线
1924 物理
卡尔.西格班Karl Manne Georg Siegbahn X射线光谱学
1937 物理
戴维森Clinton Joseph Davisson 汤姆孙George Paget Thomson
电子衍射
1954 化学
物理吸附
化学吸附
吸附力
吸附热
选择性 吸附稳定
性 分子层
吸附速率
范德华力 较小,近于液化热, 一般在几百到几千焦耳每摩
尔 无选择性
不稳定,易解吸
单分子层或多分子层
较快,不受温度影响, 故一般不需要活化能
化学键力 较大,近于化学反应
热, 一般大于几万焦耳每
摩尔 有选择性
比较稳定,不易解吸
单分子层
较慢,温度升高则速 度加快,故需要活化
A
X
MOR
MOR
透射电镜
• 样品很薄:< 200 nm • 制备样品需要特殊设备:金刚石刀切片
• 分辨率很高 • 用途
• 观测结构 • 解析结构
HRTEM of JLU-20
---Hexagonal Mesopores (100)
TEM
(110)
--- High Purity
图3-13 微孔材料ETS-10的TEM成像与电子衍射[] 图3-14: 介孔材料SBA-6的[100]面TEM成像与电子衍射[]
波数(cm-1)
1050 1650 2250
Pyridine 吸附的红外光谱
阳离子振动
• 阳离子振动出现远红外区(50-200 cm-1) • 阳离子的质量增加(Na+、K+、Rb+、Cs+)而向
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
随 M 氧化态增高, L → M 所需能量减少,故 MnO 4- 吸收峰出现在波长最长的位置。
(b) 中心原子→配体 (M → L) : 电子由金属离子充满或近满的 t 2g 轨道跃迁至
配体空的π轨道。 不饱和配体和低氧化态中心原子形成配合物
时容易出现该类 CT ,尤其是反馈型配合物。
如 :[Fe(bpy) 3 ] 2+ ( 红色 )
分子在不停的振动着,不同的时刻分 子的对称性会有明显的改变,使宇称选律 部分的松动。
(3) 自旋-轨道偶合
自旋-轨道偶合可以使单重态和三重 态具有相同的总角动量,这两个状态可以 相互作用,使自旋多重度发生混合。
各种跃迁强度总结
(1) 自旋允许,宇称允许: ε≅ 10 4 ~ 10 5 L.mol -1 .cm -1
(2) 自旋选律 :不同自旋多重度之间的跃迁是禁阻 的,即 Δ S = 0 的跃迁才是允许的。
(3) 同时激发一个以上电子的跃迁是禁阻的。
3. 选律的松动
在下列情况下,禁阻的跃迁也能部分地 发生,表现出很弱的吸收。 (1) d - p 混合 (2) 电子-振动偶合 (3) 自旋-轨道偶合
(1) d - p 混合
颜色特征?解释原因。
解释 CrO 4 2 - 橙色 , MnO 4 - 紫色
(2) 电荷迁移谱带 (CT)
包括 M → L 和 L → M ,类似氧化还原过程。
如果形成配合物时,金属离子(或配体)的最高充 满轨道 (HOMO) 和配体(或金属离子)最低空轨道 (LUMO) 的能级差 比较小 ,则 M 与 L 之间发生 电子转 移 , M 被氧化, L 被还原。如果二者能级差大到能够生 成稳定配合物,则能观察到 CT ,无氧化还原产物生成。 跃迁并不意味着电子完全转移。
例: Fe(CN) 63- 配合物的红颜色就是由 CT 引起的。
(a) 配体→中心原子( L → M ): 电子由填充的配体轨道跃迁到空的金属轨道。 在可氧化的配体和高氧化态的中心原子之间
可出现。
例: CrO 42- 橙色 , MnO 4- 紫色都是由于氧上 π 轨 道的电子迁移到金属离子引起的。
例: [FeF 6 ] 3- 无色 , [FeCl 6 ] 3- 黄色 , [FeBr 6 ] 3- 褐色。电 荷迁移能逐渐降低,至 I - ,电荷迁移能更小,以 至于电子完全转移, Fe 3+ 自发的氧化 I - 。
结论:中心原子的氧化能力越高,配体的还原能 力越高,则所需要的激发能就越小。
电荷迁移光谱一般出现在紫外区。所 以过渡金属离子的颜色 大都 是 d-d 跃迁引 起的。但有时 CT 能级差较小,因而它也 可能出现在可见光谱区而掩盖了 d-d 跃迁。
(2) 自旋允许,宇称禁阻: ε ≅ 10 ~ 10 2 L.mol -1 .cm -1 (3) 自旋允许,存在 d-p 混和 : ε ≅ 5 × 10 2 L.mol -1 .cm -1 (4) 自旋禁阻,宇称禁阻: ε ≅ 10 -2 ~ 1L.mol -1 .cm -1
4. 过渡金属配合物的光谱
9.1 紫外 - 可见吸收光谱
1. 电子跃迁和光谱
电子光谱是由于分子中的 价电子 吸收了光源 能量后从低能级的分子轨道跃迁到高能级的 分子轨道而引起的
2. 跃迁选律
谱线的强度理论上与电子的跃迁几率有关
(1) 宇称选律 :对于具有对称中心的分子,允许的 跃迁是 g → u 或 u → g 。即 Δ l = ± 1 的跃迁才是允 许的。
吸收光的颜色
紫 蓝 绿蓝 蓝绿 绿 黄绿 黄 橙 红
物质的颜色
绿黄 黄 橙 红
红紫 紫 蓝
绿蓝 蓝绿
( 3 )配体内的电子跃迁带
常出现于有机配体中,吸收处于紫外区。强度 比较大,所以该类配合物的光谱和自由配体的 光谱非常类似 有机化合物中分子轨道能级的能量次序 成键 σ < 成键 π < 非键 n < 反键 π * < 反键 σ * 配体的电子吸收光谱主要由三种跃迁形式产生
(2) 自旋选律 :不同自旋多重度之间的跃迁是禁阻 的,即 Δ S = 0 的跃迁才是允许的。
Ni 2+ (d 8 ) 离子的 Orgel 图
2. 跃迁选律
谱线的强度理论上与电子的跃迁几率有关
(1) 宇称选律 :对于具有对称中心的分子,允许的 跃迁是 g → u 或 u → g 。即 Δ l = ± 1 的跃迁才是允 许的。
过渡金属配合物的光谱分为三类
( 1 ) d-d 跃迁产生的配位场光谱 ( 2 )金属与配体之间的电荷迁移光谱 ( 3 )配体内的电子跃迁光谱
(1) d-d 跃迁谱带
d - d 跃迁(宇称禁阻):电子从中心原 子的 d 轨道跃迁到较高能级的 d 轨道。
d - d 间的能级差不大,因此吸收常位于可 见区。当配合物中的水被强场配体取代时, d - d 间的能级差变大, d - d 跃迁移向短波。 例: 说明无水 CuSO 4 , Cu(H 2 O) 62+ 和 Cu(NH 3 ) 42+ 的
第九章 配合物的结构研究方法
结构研究法的一般特点:利用各种能 量的电磁波(或微粒)作为能源投照在被 研究物质样品上,利用特定的检测器测量 这种相互作用过程中某一物理量的变化, 并将所测试的结果在记录器上进行显示。
第九 配合物的结构研究方法
9.1 紫外 - 可见吸收光谱 9.2 振动光谱 9.3 光电子能谱 9.4 核磁共振波谱 9.5 X- 射线衍射
四面体配合物中不存在对称中心,在 t 2 轨道中可以同时含有 d 和 p 的成分。在 d - d 跃迁中,当电子从 e 轨道跃迁到 t 2 轨道 时,就可以包含有从 d z 2 或 d x 2 -y 2 轨道跃迁到 p x , p y , p z 轨道的成分,呈现部分 d - p 允 许跃迁。
(2) 电子-振动偶合
物质吸收的可见光波长与物质颜色的关系
吸收波长/nm
400~435 435~480 480~490 490~500 500~560 560~580 580~595 595~605 605~750
-1
波数/cm 25000~23000 23000~20800 20800~20400 20400~20000 20000~17900 17900~17200 17200~16800 16800~16500 16500~13333
(b) 中心原子→配体 (M → L) : 电子由金属离子充满或近满的 t 2g 轨道跃迁至
配体空的π轨道。 不饱和配体和低氧化态中心原子形成配合物
时容易出现该类 CT ,尤其是反馈型配合物。
如 :[Fe(bpy) 3 ] 2+ ( 红色 )
分子在不停的振动着,不同的时刻分 子的对称性会有明显的改变,使宇称选律 部分的松动。
(3) 自旋-轨道偶合
自旋-轨道偶合可以使单重态和三重 态具有相同的总角动量,这两个状态可以 相互作用,使自旋多重度发生混合。
各种跃迁强度总结
(1) 自旋允许,宇称允许: ε≅ 10 4 ~ 10 5 L.mol -1 .cm -1
(2) 自旋选律 :不同自旋多重度之间的跃迁是禁阻 的,即 Δ S = 0 的跃迁才是允许的。
(3) 同时激发一个以上电子的跃迁是禁阻的。
3. 选律的松动
在下列情况下,禁阻的跃迁也能部分地 发生,表现出很弱的吸收。 (1) d - p 混合 (2) 电子-振动偶合 (3) 自旋-轨道偶合
(1) d - p 混合
颜色特征?解释原因。
解释 CrO 4 2 - 橙色 , MnO 4 - 紫色
(2) 电荷迁移谱带 (CT)
包括 M → L 和 L → M ,类似氧化还原过程。
如果形成配合物时,金属离子(或配体)的最高充 满轨道 (HOMO) 和配体(或金属离子)最低空轨道 (LUMO) 的能级差 比较小 ,则 M 与 L 之间发生 电子转 移 , M 被氧化, L 被还原。如果二者能级差大到能够生 成稳定配合物,则能观察到 CT ,无氧化还原产物生成。 跃迁并不意味着电子完全转移。
例: Fe(CN) 63- 配合物的红颜色就是由 CT 引起的。
(a) 配体→中心原子( L → M ): 电子由填充的配体轨道跃迁到空的金属轨道。 在可氧化的配体和高氧化态的中心原子之间
可出现。
例: CrO 42- 橙色 , MnO 4- 紫色都是由于氧上 π 轨 道的电子迁移到金属离子引起的。
例: [FeF 6 ] 3- 无色 , [FeCl 6 ] 3- 黄色 , [FeBr 6 ] 3- 褐色。电 荷迁移能逐渐降低,至 I - ,电荷迁移能更小,以 至于电子完全转移, Fe 3+ 自发的氧化 I - 。
结论:中心原子的氧化能力越高,配体的还原能 力越高,则所需要的激发能就越小。
电荷迁移光谱一般出现在紫外区。所 以过渡金属离子的颜色 大都 是 d-d 跃迁引 起的。但有时 CT 能级差较小,因而它也 可能出现在可见光谱区而掩盖了 d-d 跃迁。
(2) 自旋允许,宇称禁阻: ε ≅ 10 ~ 10 2 L.mol -1 .cm -1 (3) 自旋允许,存在 d-p 混和 : ε ≅ 5 × 10 2 L.mol -1 .cm -1 (4) 自旋禁阻,宇称禁阻: ε ≅ 10 -2 ~ 1L.mol -1 .cm -1
4. 过渡金属配合物的光谱
9.1 紫外 - 可见吸收光谱
1. 电子跃迁和光谱
电子光谱是由于分子中的 价电子 吸收了光源 能量后从低能级的分子轨道跃迁到高能级的 分子轨道而引起的
2. 跃迁选律
谱线的强度理论上与电子的跃迁几率有关
(1) 宇称选律 :对于具有对称中心的分子,允许的 跃迁是 g → u 或 u → g 。即 Δ l = ± 1 的跃迁才是允 许的。
吸收光的颜色
紫 蓝 绿蓝 蓝绿 绿 黄绿 黄 橙 红
物质的颜色
绿黄 黄 橙 红
红紫 紫 蓝
绿蓝 蓝绿
( 3 )配体内的电子跃迁带
常出现于有机配体中,吸收处于紫外区。强度 比较大,所以该类配合物的光谱和自由配体的 光谱非常类似 有机化合物中分子轨道能级的能量次序 成键 σ < 成键 π < 非键 n < 反键 π * < 反键 σ * 配体的电子吸收光谱主要由三种跃迁形式产生
(2) 自旋选律 :不同自旋多重度之间的跃迁是禁阻 的,即 Δ S = 0 的跃迁才是允许的。
Ni 2+ (d 8 ) 离子的 Orgel 图
2. 跃迁选律
谱线的强度理论上与电子的跃迁几率有关
(1) 宇称选律 :对于具有对称中心的分子,允许的 跃迁是 g → u 或 u → g 。即 Δ l = ± 1 的跃迁才是允 许的。
过渡金属配合物的光谱分为三类
( 1 ) d-d 跃迁产生的配位场光谱 ( 2 )金属与配体之间的电荷迁移光谱 ( 3 )配体内的电子跃迁光谱
(1) d-d 跃迁谱带
d - d 跃迁(宇称禁阻):电子从中心原 子的 d 轨道跃迁到较高能级的 d 轨道。
d - d 间的能级差不大,因此吸收常位于可 见区。当配合物中的水被强场配体取代时, d - d 间的能级差变大, d - d 跃迁移向短波。 例: 说明无水 CuSO 4 , Cu(H 2 O) 62+ 和 Cu(NH 3 ) 42+ 的
第九章 配合物的结构研究方法
结构研究法的一般特点:利用各种能 量的电磁波(或微粒)作为能源投照在被 研究物质样品上,利用特定的检测器测量 这种相互作用过程中某一物理量的变化, 并将所测试的结果在记录器上进行显示。
第九 配合物的结构研究方法
9.1 紫外 - 可见吸收光谱 9.2 振动光谱 9.3 光电子能谱 9.4 核磁共振波谱 9.5 X- 射线衍射
四面体配合物中不存在对称中心,在 t 2 轨道中可以同时含有 d 和 p 的成分。在 d - d 跃迁中,当电子从 e 轨道跃迁到 t 2 轨道 时,就可以包含有从 d z 2 或 d x 2 -y 2 轨道跃迁到 p x , p y , p z 轨道的成分,呈现部分 d - p 允 许跃迁。
(2) 电子-振动偶合
物质吸收的可见光波长与物质颜色的关系
吸收波长/nm
400~435 435~480 480~490 490~500 500~560 560~580 580~595 595~605 605~750
-1
波数/cm 25000~23000 23000~20800 20800~20400 20400~20000 20000~17900 17900~17200 17200~16800 16800~16500 16500~13333
