苏州大学有机化学、物理化学考研大纲
硕士研究生(有机化学专业初试)入学考试大纲

硕士研究生(有机化学专业初试)入学考试大纲第一篇:硕士研究生(有机化学专业初试)入学考试大纲硕士研究生(有机化学专业初试)入学考试大纲课程名称:化学基础一、考试的总体要求1、掌握无机化学的基本概念和基本原理;掌握对一般无机化学问题进行理论分析和计算。
2、掌握分析化学中各类分析方法的特点、应用范围及局限性,正确处理分析数据与信息,并具有选择分析化学方法、正确判断和表达分析结果的能力。
3、掌握物理化学课程中重要的基本概念与基本原理并掌握其含义及适用范围。
掌握物理化学的公式应用及应用条件,概念要明确,计算题要求思路正确,步骤简明。
二、考试内容及复习范围无机、分析化学部分1.物质结构简介1)了解微观粒子运动的特殊性:能量的量子化、波粒二象性。
2)了解原子轨道、波函数、概率、概率密度、电子云的概念,了解原子轨道和电子云的角度分布特征。
重点掌握描述电子运动状态的四个量子数(n、l、m、ms)的物理意义、取值规律和合理组合。
3)根据电子排布的三个原则和能级组概念,掌握多电子原子核外电子排布规律,并根据电子排布的价电子构型,判断元素在周期表中的位置(周期、族、区)及有关性质。
4)了解电离能、电子亲和能和电负性等概念及其一般递变规律。
5)了解离子键、共价键的理论要点。
重点掌握杂化轨道理论与分子空间构型及分子极性的关系。
6)了解分子间力和氢键的性质。
7)熟悉和掌握晶体的内部结构和基本类型,以及离子键和离子晶体,金属键和金属晶体。
2.滴定分析概述1)了解有关误差的几个基本概念:系统误差、随机误差、准确度、精密度等。
2)了解误差的来源、特点、消除及减免、提高测定准确度的措施和方法,掌握各种误差的计算(绝对误差、相对误差、绝对偏差、相对偏差、平均偏差、相对平均偏差、标准偏差、变动系数)。
3)掌握有效数字及运算规则,了解置信区间与置信度的概念及计算。
4)掌握可疑值的取舍方法(Q检验法、G检验法)。
了解显著性检验方法(F检验法、t检验法)。
苏州大学化学考研大纲、参考书目及备考经验

苏州大学化学考研大纲、参考书目及备考经验考试大纲:①101 思想政治理论②201 英语一③620 综合化学一(无机化学、有机化学各50%)④806 综合化学二(分析化学、物理化学各50%)复试:1、化学实验技术(笔试)2、综合(面试)参考书目:备考建议:考研建议有机化学:1、首先,看一看真题的选择题,推断题,可以对比出选择题每年经常考什么(一般考亲电活性,亲核活性,SN2反应速率,哪些具有芳香性,哪些具有手性,酸性碱性最大的是哪个,那个结构稳定等),(推断题一般考①已知化学位移值,有几个H,几个峰,然后推断结构,也就是光谱那章②推断糖的结构)2、看李景宁的书,看完一章,就做课后习题,不会做没关系,可以对着答案做,然后做完以后再回忆一遍。
(注意:苯,醇,醛酮,羧酸,含氮化合物是比较重要的哦,要重点看,最好在把邢其毅书上的这几章也看一遍)3、看完第一遍以后,要把所有涉及到机理的知识挑出来,主要在醇,醛酮,羧酸,N那几章。
一般包括①-OH得H+变成-OH2,脱去水,就形成C+离子,这就具有了亲电性,就可以由一些亲核试剂进攻C+离子了。
②弄懂=O 接受H+,是要怎么变③ -CHn 失去H 就变成C-离子了主要把涉及到这三种的都找出来,弄懂就可以4.接下来,可以坐一坐题库,练习一下。
然后就可以可以边做真题,边再把书看一遍了。
真题大概八月份做,时间充足点。
三四天一套,要保证全部弄懂。
然后真题大概做到一看题目就知道答案,建议做真题时,不要直接写上去,写到空白纸上,方便下次再做。
做透,做熟,做烂。
5.真题边做边总结,把选择题的考点总结下来背会。
就差不多了分析化学1、分析化学上册考的计算题多,基本每章一道,下册的计算题主要是色谱那章,萃取率,还有电化学那里,重点看看。
2.自己安排一下哪天看分析,哪天看仪分,分析重点看,课后习题一定要做,很多原题的,第一阶段主要做课后题。
3.仪分的话,书上其实内容太多,可以大致过一下,可以看仪分习题库,每章的选择题都很多,可以无聊的时候多刷一刷,记一记,有个印象,对以后做题有帮助,主要看真题里的选择题,简答题,论述题,因为那是仪分的常考点。
一苏州大学 化学考研 提纲

一、原子结构与元素周期律共济网(1) 氢原子光谱33623 037(2) 核外电子运动状态的描述和四个量子数共济(3) 核外电子排布和元素周期律021-(4) 元素性质的周期性共济二、分子结构200092(1) 离子键和晶格能同济(2) 价键理论200092(3) 杂化轨道理论研(4) 价层电子对互斥理论3362 3039(5) 离域大p键理论济(6) 分子轨道理论同济(7) 分子间作用力48号三、晶体结构正门(1) 离子晶体类型和半径比规则336260 37(2) 离子极化作用48号四、酸碱平衡网络督察(1) 酸碱质子理论和酸碱电子理论(2) 水的电离和K w(3) 弱酸的电离和弱碱的电离(4) 两性物质的电离(5) 缓冲溶液五、沉淀平衡(1) 溶度积原理和溶度积常数(2) 沉淀平衡的移动六、氧化还原反应(1) 氧化数(2) 氧化还原反应的配平(3) 原电池(4) 标准电极电势及其应用(5) 能斯特方程(6) 元素电势图和φ-pH图(7) 电解七、氢和希有气体八、卤素(1) 卤素单质(2) 卤化氢和氢卤酸(3) 多卤化物、卤素互化物和拟卤素(4) 卤素含氧酸九、氧族元素(1) 氧族元素单质(2) 过氧化氢和过氧化物(3) 硫和硒及其化合物十、氮族元素(1) 氮及其化合物(2) 磷及其化合物(3) 砷、锑和铋及其化合物十一、碳族元素(1) 碳及其化合物(2) 硅及其化合物(3) 锡和铅及其化合物十二、硼族元素(1) 硼及其化合物(2) 铝及其化合物(3) 镓、铟和铊简介十三、碱金属和碱土金属(1) 碱金属化合物(2) 碱土金属化合物十四、配位化合物(1) 配位化合物概念、组成和命名(2) 配合物价键理论和晶体场理论(3) 配合物异构现象(4) 配位平衡十五、铜和锌族元素(1) 铜族元素及其化合物(2) 锌族元素及其化合物十六、过渡金属(1) 第一过渡金属及其化合物(2) 第二过和第三过渡金属简介《物理化学》部分的内容范围第一章气体理想气体状态方程,van der Waals方程,virial方程,对比状态和对比状态原理第二章热力学第一定律1 基本概念:系统与环境,系统的性质,热力学平衡态,状态函数,状态方程,过程和途径,热和功2 热力学第0定律3 热力学第一定律与内能4 准静态过程与可逆过程5 焓,等压热容,等容热容6 热力学第一定律对理想气体的应用理想气体的热力学能和焓,理想气体的Cp与Cv之差,绝热过程和过程方程,卡诺循环7 焦耳-汤姆逊效应,实际气体的△H和△U8 热化学等压热效应与等容热效应,反应进度,标准摩尔焓变,Hess定律,标准摩尔生成焓,标准摩尔离子生成焓,标准摩尔燃烧焓,反应焓变与温度的关系,绝热反应-非等温反应,热容-能量均分原理第三章热力学第二定律1 自发变化,不可逆性2 热力学第二定律3卡诺定理4 熵的定义5 克劳修斯不等式与熵增加原理6 熵变的计算7 热力学第二定律的本质和熵的统计意义,玻兹曼公式8 亥姆霍兹自由能和吉布斯自由能, 亥姆霍兹自由能和吉布斯自由能判据9 DG的计算10 热力学函数间的关系基本公式,特性函数,麦克斯韦关系式及应用,吉布斯-亥姆霍兹方程式,吉布斯自由能与温度、压力的关系112 热力学第三定律与规定熵第四章溶液1 溶液组成的表示法2 偏摩尔量,定义,加合公式,吉布斯-杜亥姆公式3 化学势定义,在相平衡中的应用,化学势与温度、压力的关系4 气体混合物中各组分的化学势, 逸度,逸度因子5 拉乌尔定律,亨利定律6 理想液态混合物,理想液态混合物中任一组分的化学势,理想液态混合物的通性,7 理想稀溶液中任一组分的化学势8 稀溶液的依数性蒸气压下降,凝固点降低,沸点升高,渗透压9 活度和活度因子10 分配定律-溶质在两互不相溶液相中的分配第五章相平衡1 多相体系平衡的一般条件2 相律, 相,组分数,自由度,相律3 单组分体系的相平衡单组分体系的两相平衡,克拉贝龙方程式,克拉贝龙-克劳修斯方程,外压与蒸气压的关系,水的相图,超临界状态4 二组分体系的相图及其应用理想的完全互溶双液系,杠杆规则,蒸馏、精馏的基本原理,非理想的完全互溶双液系,部分互溶的双液系,不互溶的双液系,简单的低共熔二元相图,形成化合物的体系,液固相都完全互溶的相图,固态部分互溶的相图第六章化学平衡1 化学反应的平衡条件与反应进度的关系2 化学反应的平衡常数和等温方程式, 气相反应的平衡常数, 溶液中反应的平衡常数3 平衡常数表示式4 复相化学平衡5 标准生成吉布斯自由能标准状态下反应的吉布斯自由能变化值,标准摩尔生成吉布斯自由能6 温度、压力及惰性气体对化学平衡的影响7 同时化学平衡8 反应的耦合第七章统计热力学基础1 统计系统的分类,统计热力学的基本假定2 玻兹曼分布,定位系统的最概然分布,非定位系统的最概然分布,3 配分函数, 配分函数与热力学函数的关系,配分函数的分离4.各配分函数求法及其对热力学函数的贡献原子核配分函数,电子配分函数,平动配分函数,单原子理想气体的热力学函数,转动配分函数,振动配分函数, 分子的全配分函数第八章电解质溶液1 法拉第定律2 离子电迁移率和迁移数3 电解质溶液的电导, 摩尔电导率,浓度对摩尔电导率的影响,离子独立移动定律,离子淌度,电导的应用4.离子强度,电解质的平均活度和平均活度系数第九章可逆电池的电动势及其应用1 可逆电池,可逆电极,电极反应,电动势的测定,电池的书写方法2 可逆电池的热力学,Nernst 方程,标准电动势求电池反应的平衡常数3 界面电势,接触电势,液体接界电势4 标准电极电势, 标准氢电极,参比电极,电池电动势的计算5 电动势测定的应用电解质的平均活度因子,难溶盐的活度积,溶液PH值的测定,电势—pH图及应用第十章电解与极化1 分解电压2 极化作用浓差极化,电化学极化,极化曲线,氢超电势,塔菲尔公式3 电解时电极上的竞争反应金属的析出与氢的超电势,金属离子的分离,电解过程的应用第十一章化学动力学基础(一)1 基本概念反应速率及其表示法,基元反应,反应级数与反应分子数,反应机理,质量作用定律,反应速率常数2 具有简单级数的反应一级反应,二级反应,三级反应,n级反应,反应级数的测定方法3 几种典型的复杂反应对峙反应,平行反应,连续反应,链反应4 温度对反应速率的影响阿累尼乌斯经验式,反应速率与温度关系的几种类型,活化能5 链反应, 稳态近似,链反应历程第十二章化学动力学基础(二)1 速率理论,基本假设,基本观点,活化能,表观活化能,概率因子2 过渡态理论基本观点,势能面,活化络合物3 光化学反应,初级过程和次级过程,光化学基本定律,量子产率,光化学反应动力学4 催化反应动力学,基本概念,基本特征,酶催化反应,自催化反应第十三章表面物理化学1 表面张力及表面Gibbs自由能,表面张力与溶液浓度的关系2 弯曲表面下的附加压力和蒸汽压,Young-Laplace公式,Kelvin公式3 溶液的表面吸附——Gibbs吸附公式4 液-液界面的铺展,单分子表面膜5 液固界面, 粘湿过程,浸湿过程,铺展过程,接触角与润湿方程6 固体的表面吸附, Langmuir吸附理论,BET吸附公式,7 气-固表面催化反应速率第十四章胶体分散体系和大分子溶液1 胶体及其基本特征2 溶胶的动力性质, 布朗运动,扩散和渗透压4 溶胶的光学性质,丁铎尔现象5 溶胶的电学性质, 电动现象,电泳、电渗6 大分子溶液,大分子化合物的平均分子量,唐南平衡《结构化学》部分的内容范围一、量子力学基础和原子结构(1)量子力学基本原理:波粒二象性、海森堡测不准原理、波函数、力学量的算符、薛定谔方程、态叠加原理等。
苏州大学物理化学考研、期末考试复习-13章表面物理化学

1 2
]
6366
2H2O2(aq) 2H20 (l)+ O2(g) 被 I-催 化 ,已 知 Ea(cat)= 56.5 kJ ·mol-1,Ea(uncat)=75.3
kJ·mol-1, 则 k(I-)/k(uncat)=_____________。(T=298 K) 6491
CH2CO 光照射分解为 C2H4 及 CO,当吸收光强 Ia=4.8×10-9 mol·s-1 ,且( C2H4)=1, ( CO)=2,则 15.2 min 内产品的物质的量 n(CO)=_________, n(C2H4)=___________ 6495
(A) 向左移动 (B) 向右移动
(C) 不移动
(D) 来回不定移动
6753
同一固体, 大块颗粒和粉状颗粒, 其熔点哪个高? ( )
(A) 大块的高
(B) 粉状的高
(C) 一样高
(D) 无法比较
6764
水平仪中有一个椭球形的液泡,长短半轴分别为 0.8 和 0.3cm,已知水的表面张力为
0.07197 N·m-1,液泡的附加压力为:( )
6782 已知 27℃及 100℃时,水的饱和蒸气压分别为 3.565 kPa 及 101.325 kPa,密度分别
6033
T=1000 K 时分子能量大于 20 kJ·mol-1 的分率为____________________。
6256
反应 Br+HCl(v) kv HBr+Cl,当 HCl 的振动量子数由 v=0 增加到 v=4 时,反应速率
k(v=4)/k(v=0)1011,由此可判断逆反应 HBr+ClBr+HCl 需要____________激发。 6258
【免费下载】苏州大学硕士研究生招生专业目录
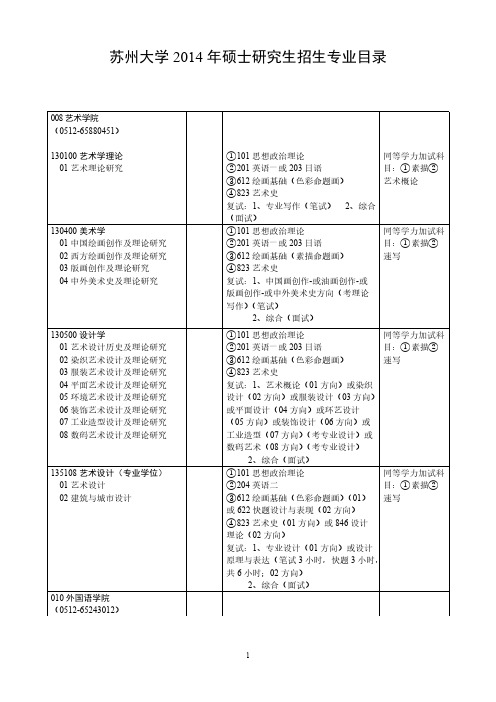
(面试)
①101 思想政治理论
②201 英语一或 203 日语
③612 绘画基础(素描命题画)
④823 艺术史
复试:1、中国画创作-或油画创作-或
版画创作-或中外美术史方向(考理论
写作)(笔试)
2、综合(面试)
①101 思想政治理论)
④823 艺术史
不招同等学力考 生。
不招同等学力考 生。
不招同等学力考
生。
不招同等学力考 生。
同等学力加试科 目:①电动力学 ②数理方法
同等学力加试科 目:①电动力学 ②数理方法
015 材料与化学化工学部 (0512-65880090) 040102 课程与教学论
01 化学教学 02 化学实验研究 03 大学化学
①101 思想政治理论 ②201 英语一 ③302 数学二 ④832 普通物理 复试:1、量子力学或电子技术基础 (笔试)2、综合(面试)
①101 思想政治理论 ②201 英语一 ③301 数学一 ④832 普通物理 复试:1、电路与信号(笔试) 2、综合(面试)
①101 思想政治理论
②201 英语一
或 622 快题设计与表现(02 方向)
④823 艺术史(01 方向)或 846 设计
理论(02 方向)
复试:1、专业设计(01 方向)或设计
原理与表达(笔试 3 小时,快题 3 小时,
共 6 小时;02 方向)
1
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,力根通保据过护生管高产线中工敷资艺设料高技试中术卷资,配料不置试仅技卷可术要以是求解指,决机对吊组电顶在气层进设配行备置继进不电行规保空范护载高与中带资负料荷试下卷高问总中题体资,配料而置试且时卷可,调保需控障要试各在验类最;管大对路限设习度备题内进到来行位确调。保整在机使管组其路高在敷中正设资常过料工程试况中卷下,安与要全过加,度强并工看且作护尽下关可都于能可管地以路缩正高小常中故工资障作料高;试中对卷资于连料继接试电管卷保口破护处坏进理范行高围整中,核资或对料者定试对值卷某,弯些审扁异核度常与固高校定中对盒资图位料纸置试,.卷保编工护写况层复进防杂行腐设自跨备动接与处地装理线置,弯高尤曲中其半资要径料避标试免高卷错等调误,试高要方中求案资技,料术编试交写5、卷底重电保。要气护管设设装线备备置敷4高、调动设中电试作技资气高,术料课中并3中试、件资且包卷管中料拒含试路调试绝线验敷试卷动槽方设技作、案技术,管以术来架及避等系免多统不项启必方动要式方高,案中为;资解对料决整试高套卷中启突语动然文过停电程机气中。课高因件中此中资,管料电壁试力薄卷高、电中接气资口设料不备试严进卷等行保问调护题试装,工置合作调理并试利且技用进术管行,线过要敷关求设运电技行力术高保。中护线资装缆料置敷试做设卷到原技准则术确:指灵在导活分。。线对对盒于于处调差,试动当过保不程护同中装电高置压中高回资中路料资交试料叉卷试时技卷,术调应问试采题技用,术金作是属为指隔调发板试电进人机行员一隔,变开需压处要器理在组;事在同前发一掌生线握内槽图部内 纸故,资障强料时电、,回设需路备要须制进同造行时厂外切家部断出电习具源题高高电中中源资资,料料线试试缆卷卷敷试切设验除完报从毕告而,与采要相用进关高行技中检术资查资料和料试检,卷测并主处且要理了保。解护现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
全国有机化学考研学校排名及所需考的专业课.

全国有机化学考研学校排名及所需考的专业课以下为全国所有招收有机化学专业研究生的学校(不包括中科院),对其考试科目进行分类,分为要考:物化和无机、物化和分析、物化和综合化学、有机和无机、有机和物化、有机和分析、有机和综合化学、综合化学Ⅰ和综合化学Ⅱ,以及其他等。
注意:1、“985”代表“985”工程大学,“211”代表“211”工程大学郑重声明:本文几乎全部信息来源于中国研究生招生信息网要考数学的学校:1、大连理工大学{985、211、考试科目:①数学二②有机(含有机实验)}2、南京理工大学{211、考试科目:①高等数学②有机或①高等数学②分析或①高等数学②无机}3、江苏工业学院{考试科目:①理学数学②有机或①综合化学②有机}4、陕西科技大学{考试科目:①数学二②有机或①有机②物化或①有机②无机与分析化学(《无机及分析化学》)}5、沈阳药科大学{考试科目:①高等数学②无机或①高等数学②物化或①生物化学②无机或①生物化学②物化或①有机②无机或①分析②无机或①分析②物化}要考物化和分析的学校:1、南京大学{985、211、考试科目:①物化②仪器分析}2、东北大学{985、211、考试科目:①物化②分析}3、南昌大学{211、考试科目:①物化②分析}4、河北大学{考试科目:①物化②分析}5、中南民族大学{考试科目:①物化②分析}6、沈阳药科大学{考试科目:①物化②分析}要考物化和无机的学校:1、厦门大学{985、211、考试科目:①物化②基础化学}2、南京大学{985、211、考试科目:①物化②大学化学}3、南京航空航天大学{211、考试科目:①物化②无机}4、南京师范大学{211、考试科目:①物化②无机}5、南昌大学{211、考试科目:①物化②无机}6、华南师范大学{211、考试科目:①物化②无机}7、中南民族大学{考试科目:①物化②无机}8、云南师范大学{考试科目:①物化②无机}注意:由于基础化学和大学化学和无机化学的内容几乎一样,故把基础化学和大学化学归为无机化学!!!要考物化和综合化学的学校:1、复旦大学{985、211、考试科目:①物化(含结构化学)②无机和分析}2、华中科技大学{985、211、考试科目:①物化②无机及分析}3、安徽大学{211、考试科目:①物化②综合化学}4、西北大学{211、考试科目:①物化②普通大学(无机和化学分析)}5、宁夏大学{211、考试科目:①物化②综合化学(有机、《无机化学与化学分析》)}6、河南大学{考试科目:①物化②无机和有机}7、浙江师范大学{考试科目:①物化②普通化学(有机、分析、仪器分析)}8、烟台大学{考试科目:①物化②化学综合(分析、无机、有机)}9、黑龙江大学{考试科目:①物化②综合化学(无机、有机、分析)}注意:《无机化学与化学分析》为参考书。
有机化学专业 考研科目

1、南京大学{985、211、考试科目:①有机②仪器分析}
2、华东理工大学{211、考试科目:①有机②分析}
3、暨南大学{211、考试科目:①有机②分析(含仪器分析)}
4、南昌大学{211、考试科目:①有机②分析}
5、贵州大学{211、考试科目:①有机②分析}
6、河南科技大学{考试科目:①有机②仪器分析}
3、兰州大学{985、211、考试科目:①无机和有机②分析和物化}
4、四川大学{985、211、考试科目:①无机及分析化学②有机及物化}
5、中山大学{985、211、考试科目:①化学(A)②化学综合(B)}
6、武汉大学{985、211、考试科目:①物化和有机②无机和分析}
7、西南大学{211、考试科目:①无机及分析(含仪器分析)②有机和物化}
5、沈阳药科大学{考试科目:①高等数学②无机或①高等数学②物化或①生物化学②无机或①生物化学②物化或①有机②无机或①分析②无机或①分析②物化}
要考物化和分析的学校:
1、南京大学{985、211、考试科目:①物化②仪器分析}
2、东北大学{985、211、考试科目:①物化②分析}
3、南昌大学{211、考试科目:①物化②分析}
要考物化和综合化学的学校:
1、复旦大学{985、211、考试科目:①物化(含结构化学)②无机和分析}
2、华中科技大学{985、211、考试科目:①物化②无机及分析}
3、安徽大学{211、考试科目:①物化②综合化学}
4、西北大学{211、考试科目:①物化②普通大学(无机和化学分析)}
5、宁夏大学{211、考试科目:①物化②综合化学(有机、《无机化学与化学分析》)}
7、河南工业大学{考试科目:①有机②分析}
《苏州大学834分析化学2007-2015年考研真题及答案解析》

苏州大学 2007 年招收攻读硕士学位研究生入学考试试卷答案解析................................ 52 苏州大学 2008 年招收攻读硕士学位研究生入学考试试卷答案解析................................ 69 苏州大学 2009 年招收攻读硕士学位研究生入学考试试卷答案解析................................ 86 苏州大学 2010 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 103 苏州大学 2011 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 118 苏州大学 2012 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 131 苏州大学 2013 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 150 苏州大学 2014 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 162
C.PhCOCH2Br
D.
《苏州大学分析化学历年考研真题及答案解析》
2/179
4.下列关于有机化合物的红外光谱的描述中,不正确的是: ( )
A.C-H 键中碳原子杂化态的 s 成分越大,C-H 键越强,振动频率也越高
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苏州大学有机化学、物理化学考研大纲.doc1.烷烃(1)烷烃的同系列、同分异构现象及命名法(2)烷烃的构型和烷烃的构象(3)烷烃的物理性质和化学性质(4)烷烃卤代反应历程2.单烯烃(1)烯烃的同分异构和命名(2)烯烃的物理性质,化学性质和制备(3)诱导效应和烯烃的亲电加成反应历程和马尔科夫尼科夫规则3.炔烃和二烯烃(1)炔烃和二烯烃的命名、物理性质和化学性质(2)共轭效应,速率控制和平衡控制4.脂环烃(1)脂环烃的命名(2)环烷烃的性质和结构(3)环己烷的构象5.对映异构(1)物质的旋光性(2)对映异构现象与分子结构的关系(3)含一个和两个手性碳原子化合物的对映异构(4)构型的R、S命名规则(5)环状化合物的立体异构(6)不含手性碳原子化合物的对映异构(7)亲电加成反应的立体化学6.芳烃(1)芳烃的异构现象和命名(2)单环芳烃的物理性质和化学性质(3)芳环的亲电取代定位效应7.现代物理实验方法在有机化学中的应用(1)紫外和可见光吸收光谱(2)红外光谱(3)核磁共振谱(4)质谱8.卤代烃(1)卤代烃的命名、同分异构现象(2)一卤代烷、一卤代烯烃、一卤代芳烃的物理性质、化学性质和制备(3)亲核取代反应历程9.醇、酚、醚(1)醇酚醚的命名、物理性质、光谱性质(2)醇酚醚的化学性质和制备(3)消除反应机理10.醛和酮(1)醛、酮的命名和同分异构现象(2)醛、酮的物理性质、光谱性质(3)醛、酮的化学性质和制备(4)亲核加成反应历程(5)不饱和羰基化合物的主要化学性质11.羧酸(1)羧酸的分类和命名(2)饱和一元羧酸的物理性质和光谱性质(3)羧酸的化学性质制备(4)羟基酸和羰基酸的化学性质(5)酸碱理论12.羧酸衍生物(1)羧酸衍生物的命名和光谱性质(2)酰卤、酸酐、羧酸酯、酰胺的化学性质及制备(3)乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用(4)羧酸衍生物的水解、氨解及醇解历程(5)有机合成路线13.含氮有机化合物(1)硝基化合物的命名、物理性质、化学性质(2)胺的命名、物理性质、化学性质(3)重氮和偶氮化合物的性质(4)分子重排机理14.含硫和含磷有机化合物(1)含硫有机化合物的命名(2)硫醇、硫酚、硫醚的化学性质和制备(3)有机硫试剂在有机合成上的应用(4)磺酸酯和磺酰胺的性质(5)含磷有机化合物命名和化学性质15.元素有机化合物(1)有机锂化合物的结构、化学性质(2)有机硼在合成中的应用16.周环反应(1)电环化反应立体选择性规则(2)环加成反应规则(3)迁移反应(4)周环反应的理论17.杂环化合物(1)杂环化合物的分类和命名(2)呋喃、噻吩和吡咯的物理性质、光谱特征、化学性质和制备(3)吲哚、吡啶和喹啉的性质(4)Skraup合成法18.糖类化合物(1)单糖的构型和反应19.蛋白质和核酸(1)氨基酸的结构、命名和性质20.萜类和甾族化合物(1)异戊二烯规律和萜的分类《仪器分析》部分一、光学分析法(一)光学分析法导论1、电磁辐射的基本特征,电磁辐射与物质结构的关系。
(二)原子光谱分析法(原子发射光谱法、原子吸收光谱法、原子荧光光谱法)1、原子光谱法的基本原理、特点及分析过程。
2、原子光谱分析仪器装置以及各部件的作用和各自特点。
3、原子光谱分析法的干扰消除和应用。
(三)紫外-可见分子吸收光谱法1、紫外-可见分子吸收光谱法基本原理。
2、分子吸收光谱法的特点,干扰效应及消除方法。
3、紫外分子吸收光谱法在有机、无机结构鉴定和定量分析中的应用。
(四)红外光谱法1、红外光谱法的基本原理。
2、基团频率和特征吸收峰。
3、红外光谱仪器结构。
4、红外光谱法的分析应用。
(五)荧光、磷光和化学发光分析法1、分子荧光和磷光分析、化学发光和生物发光法基本原理及特点。
(六)核磁共振波谱法1、核磁共振波谱法的基本原理。
2、核磁共振波谱仪结构。
3、核磁共振谱的应用。
二、电分析化学(一)电分析化学导论1、电分析化学的分类、特点。
2、电化学池、电极电位、电极分类。
(二)电位分析法1、电位分析法基本原理。
2、离子选择性电极的分类及特性。
3、离子选择性电极的应用。
4、电位滴定。
(三)电解和库仑分析1、基本原理和应用。
(四)极谱和伏安分析法1、基本原理和应用。
三、色谱分析法(一)色谱法导论1、色谱分析原理:塔板理论,速率理论。
2、色谱法分类,色谱分离效率。
(二)气相色谱法1、仪器装置。
2、固定相及其选择。
3、分离条件及分析应用。
(三)高效液相色谱法1、高效液相色谱类型及原理。
2、高效液相色谱的仪器装置。
四、质谱法1、质谱分析的离子源和质量分析器。
2、质谱仪和质谱分析过程。
3、质谱分析应用。
《无机化学》部分的内容范围一、原子结构与元素周期律(1)氢原子光谱(2)核外电子运动状态的描述和四个量子数(3)核外电子排布和元素周期律(4)元素性质的周期性二、分子结构(1)离子键和晶格能(2)价键理论(3)杂化轨道理论(4)价层电子对互斥理论(5)离域大键理论(6)分子轨道理论(7)分子间作用力三、晶体结构(1)离子晶体类型和半径比规则(2)离子极化作用四、酸碱平衡(1)酸碱质子理论和酸碱电子理论(2)水的电离和Kw(3)弱酸的电离和弱碱的电离(4)两性物质的电离(5)缓冲溶液五、沉淀平衡(1)溶度积原理和溶度积常数(2)沉淀平衡的移动六、氧化还原反应(1)氧化数(2)氧化还原反应的配平(3)原电池(4)标准电极电势及其应用(5)能斯特方程(6)元素电势图和φ-pH图(7)电解七、氢和希有气体八、卤素(1)卤素单质(2)卤化氢和氢卤酸(3)多卤化物、卤素互化物和拟卤素(4)卤素含氧酸九、氧族元素(1)氧族元素单质(2)过氧化氢和过氧化物(3)硫和硒及其化合物十、氮族元素(1)氮及其化合物(2)磷及其化合物(3)砷、锑和铋及其化合物十一、碳族元素(1)碳及其化合物(2)硅及其化合物(3)锡和铅及其化合物十二、硼族元素(1)硼及其化合物(2)铝及其化合物(3)镓、铟和铊简介十三、碱金属和碱土金属(1)碱金属化合物(2)碱土金属化合物十四、配位化合物(1)配位化合物概念、组成和命名(2)配合物价键理论和晶体场理论(3)配合物异构现象(4)配位平衡十五、铜和锌族元素(1)铜族元素及其化合物(2)锌族元素及其化合物十六、过渡金属(1)第一过渡金属及其化合物(2)第二过和第三过渡金属简介《物理化学》部分的内容范围第一章气体理想气体状态方程,vanderWaals方程,virial方程,对比状态和对比状态原理第二章热力学第一定律1基本概念:系统与环境,系统的性质,热力学平衡态,状态函数,状态方程,过程和途径,热和功2热力学第0定律3热力学第一定律与内能4准静态过程与可逆过程5焓,等压热容,等容热容6热力学第一定律对理想气体的应用理想气体的热力学能和焓,理想气体的Cp与Cv之差,绝热过程和过程方程,卡诺循环7焦耳-汤姆逊效应,实际气体的△H和△U8热化学等压热效应与等容热效应,反应进度,标准摩尔焓变,Hess定律,标准摩尔生成焓,标准摩尔离子生成焓,标准摩尔燃烧焓,反应焓变与温度的关系,绝热反应-非等温反应,热容-能量均分原理第三章热力学第二定律1自发变化,不可逆性2热力学第二定律3卡诺定理4熵的定义5克劳修斯不等式与熵增加原理6熵变的计算7热力学第二定律的本质和熵的统计意义,玻兹曼公式8亥姆霍兹自由能和吉布斯自由能,亥姆霍兹自由能和吉布斯自由能判据9G的计算10热力学函数间的关系基本公式,特性函数,麦克斯韦关系式及应用,吉布斯-亥姆霍兹方程式,吉布斯自由能与温度、压力的关系112热力学第三定律与规定熵第四章溶液1溶液组成的表示法2偏摩尔量,定义,加合公式,吉布斯-杜亥姆公式3化学势定义,在相平衡中的应用,化学势与温度、压力的关系4气体混合物中各组分的化学势,逸度,逸度因子5拉乌尔定律,亨利定律6理想液态混合物,理想液态混合物中任一组分的化学势,理想液态混合物的通性,7理想稀溶液中任一组分的化学势8稀溶液的依数性蒸气压下降,凝固点降低,沸点升高,渗透压9活度和活度因子10分配定律-溶质在两互不相溶液相中的分配第五章相平衡1多相体系平衡的一般条件2相律,相,组分数,自由度,相律3单组分体系的相平衡单组分体系的两相平衡,克拉贝龙方程式,克拉贝龙-克劳修斯方程,外压与蒸气压的关系,水的相图,超临界状态4二组分体系的相图及其应用理想的完全互溶双液系,杠杆规则,蒸馏、精馏的基本原理,非理想的完全互溶双液系,部分互溶的双液系,不互溶的双液系,简单的低共熔二元相图,形成化合物的体系,液固相都完全互溶的相图,固态部分互溶的相图第六章化学平衡1化学反应的平衡条件与反应进度的关系2化学反应的平衡常数和等温方程式,气相反应的平衡常数,溶液中反应的平衡常数3平衡常数表示式4复相化学平衡5标准生成吉布斯自由能标准状态下反应的吉布斯自由能变化值,标准摩尔生成吉布斯自由能6温度、压力及惰性气体对化学平衡的影响7同时化学平衡8反应的耦合第七章统计热力学基础1统计系统的分类,统计热力学的基本假定2玻兹曼分布,定位系统的最概然分布,非定位系统的最概然分布,3配分函数,配分函数与热力学函数的关系,配分函数的分离4.各配分函数求法及其对热力学函数的贡献原子核配分函数,电子配分函数,平动配分函数,单原子理想气体的热力学函数,转动配分函数,振动配分函数,分子的全配分函数第八章电解质溶液1法拉第定律2离子电迁移率和迁移数3电解质溶液的电导,摩尔电导率,浓度对摩尔电导率的影响,离子独立移动定律,离子淌度,电导的应用4.离子强度,电解质的平均活度和平均活度系数第九章可逆电池的电动势及其应用1可逆电池,可逆电极,电极反应,电动势的测定,电池的书写方法2可逆电池的热力学,Nernst方程,标准电动势求电池反应的平衡常数3界面电势,接触电势,液体接界电势4标准电极电势,标准氢电极,参比电极,电池电动势的计算5电动势测定的应用电解质的平均活度因子,难溶盐的活度积,溶液PH值的测定,电势-pH图及应用第十章电解与极化1分解电压2极化作用浓差极化,电化学极化,极化曲线,氢超电势,塔菲尔公式3电解时电极上的竞争反应金属的析出与氢的超电势,金属离子的分离,电解过程的应用第十一章化学动力学基础(一)1基本概念反应速率及其表示法,基元反应,反应级数与反应分子数,反应机理,质量作用定律,反应速率常数2具有简单级数的反应一级反应,二级反应,三级反应,n级反应,反应级数的测定方法3几种典型的复杂反应对峙反应,平行反应,连续反应,链反应4温度对反应速率的影响阿累尼乌斯经验式,反应速率与温度关系的几种类型,活化能5链反应,稳态近似,链反应历程第十二章化学动力学基础(二)1速率理论,基本假设,基本观点,活化能,表观活化能,概率因子2过渡态理论基本观点,势能面,活化络合物3光化学反应,初级过程和次级过程,光化学基本定律,量子产率,光化学反应动力学4催化反应动力学,基本概念,基本特征,酶催化反应,自催化反应第十三章表面物理化学1表面张力及表面Gibbs自由能,表面张力与溶液浓度的关系2弯曲表面下的附加压力和蒸汽压,Young-Laplace公式,Kelvin公式3溶液的表面吸附--Gibbs吸附公式4液-液界面的铺展,单分子表面膜5液固界面,粘湿过程,浸湿过程,铺展过程,接触角与润湿方程。
