陶瓷粉体基础--制备
自蔓延法制备陶瓷粉体

八、应用自蔓延法进行生产的企业
福建施诺瑞新 材料有限公司
氮化铝粉体
纯度
化学成分 TiC纯度: ≥99%
粒度范围为 1 30m
含氮量 >33.0wt.% 氧含量在1.0wt.%以下
粉体粒度分布 曲线
五、SHS 合成超高温陶瓷
上硅所用SHS合成超高温陶瓷ZrB2-SiC-ZrC活性粉体
超高温陶瓷(UHTCS)是在1800度以上使用,具有3000度左 右熔点及高温抗氧化性和热震性的过渡金属的硼化物、碳化物 和氮化物。
发生的化学反应
(2 x)Zr (1 x)Si B4C 2ZrB2 (1 x)SiC xZrC
表 1 PZT 陶瓷的性能参数
合成温度/度 介电损耗 相对介电常数 居里温度/度
PbZr0.52Ti0.48O3
500
0.0032
332
375
七、溶胶凝胶自燃烧合成PMN-PT
Ref. 5 Ceramics International, 35 (2009), 2899–2905 Iran
七、溶胶凝胶自燃烧合成PMN-PT
自蔓延高温法制备陶瓷粉体
自蔓延高温合成 SHS
自蔓延高温合成技术(Self-propagating High-temperature Synthesis SHS)或燃烧合成(Combustion Synthesis CS),是依靠反应自身化能放 热来合成材料的新技术。
它最大的特点是除引燃外无需外部热源,效率高。
其主要特征是反应只需局部点火引发燃烧波,并使其在原料中传播以实现 系統的合成过程。
陶瓷粉体制备ppt课件.ppt
1100-1200℃
NbC
Nb+炭黑
H2,CO, CnHm
1400-1500℃
真空
1200-1300℃
Nb2O5+炭黑
H2,CO, CnHm
1900-2000℃
真空
1600-1700℃
TaC
Ta+炭黑
H2,CO, CnHm
1400-1600℃
真空
1200-300℃
Ta2O5+炭黑
为了克服直接沉淀的缺点,改变沉淀剂的加入方式,使得溶液本身缓慢反应产生沉淀剂,常用的有尿素: (NH2)2CO+3H2O→2NH4OH+CO2 (70℃) NH4OH在溶液中形成后立即被消耗,尿素继续分解平衡,可用来制备铁、铝、锡、镓、锆等的氧化物。
铝粉和B2O3粉料在刚玉罐中球磨混合1h,经真空干燥后,压坯,置入充满氩气的反应器中,进行燃烧合成。反应器内压力可在500Pa~0.1Mpa之间调节,用钨丝通电点火。热电偶插入试样心部测温。球磨后得到粉料。
Al2O3
AlB12
自蔓延法有以下优点: 1、工艺简单 2、消耗外部能量少 3、可在真空或者控制气氛下进行,得到高纯产品 4、材料烧成与合成可同时完成
900℃5h
1300℃2h
先进陶瓷粉料的制备
固相法制备粉料
可以获得高纯的Al2O3, 粒度小于1μm
用于碳化硅生产的阿奇逊电炉 (a)炉役开始前;(b)炉役结束后
分步反应: SiO2+C → SiO(气)+CO SiO+2C → SiC+CO SiO+C → Si(气)+CO Si+C → SiC
先进陶瓷粉料的制备
A(S)+B(S)→C(S)+D(g)
固相法制备陶瓷粉体

固相反应法生产陶瓷粉体一、 固相反应法的特点固相法是通过从固相到固相的变化来制造粉体,其特征是不像气相法和液相法伴随有气相→固相、液相→固相那样的状态(相)变化。
对于气相或液相,分子(原子)有很大的易动度,所以集合状态是均匀的,对外界条件的反应很敏感。
另一方面,对于固相,分子(原子)的扩散很迟缓,集合状态是多样的。
固相法其原料本身是固体,这较之于液体和气体都有很大的差异。
固相法所得的固相粉体和最初固相原料可以使同一物质,也可以不是同一物质。
[1]二、 物质粉末化机理一类是将大块物质极细地分割,称作尺寸降低过程,其特点是物质无变化,常用的方法是机械粉碎(用普通球磨、振磨、搅拌磨、高能球磨、喷射磨等进行粉碎),化学处理(溶出法)等。
另一类是将最小单位(分子或原子)组合,称作构筑过程,其特征是物质发生了变化,常用的方法有热分解法(大多数是盐的分解),固相反应法(大多数是化合物,包括化合反应和氧化还原反应),火花放电法(常用金属铝产生氢氧化铝)等。
三、 固相反应的具体方法1、 机械粉碎法主要应用是球磨法,机械球磨法工艺的主要目的包括离子尺寸的减小、固态合金化、混合或融合以及改变离子的形状。
目前已形成各种方法,如滚转磨、振动磨和平面磨。
采用球磨方法,控制适合的条件可以得到纯元素、合金或者是复合材料的纳米粒子。
其特点是操作简单、成本低,但产品容易被污染,因此纯度低,颗粒分布不均匀[2]。
2、热分解法热分解反应不仅仅限于固相,气体和液体也可引发热分解反应,在此只讨论固相的分解反应,固相热分解生成新的固相系统,常用如下式子表示(S 代表固相、G 代表气相):1211212S S G S S G G →+→++第一个式子是最普通的,第二个式子是第一个式子的特殊情况。
热分解反应基本是第一式的情况。
3、 固相反应法由固相热分解可获得单一的金属氧化物,但氧化物以外的物质,如碳化物、硅化物、氮化物等以及含两种金属元素以上的氧化物制成的化合物,仅仅用热分解就很难制备,通常是按最终合成所需组成的原料化合,再用高温使其反应的方法,其一般工序如左图所示。
陶瓷粉体的制备及性能测定实验

陶瓷粉体的制备及性能测定实验一、实验目的1、掌握陶瓷粉体制备的原理和常用方法及设备;2、了解影响陶瓷粉体制备的各种因素;3、掌握粉料颗粒分成的表示方法和测定方法;二、实验原理粉体的制备方法分两种。
一是粉碎法;二是合成法。
粉碎法是由粗颗粒来获得细粉的方法,通常采用机械粉碎。
现在发展到采用气流粉碎技术。
一方面,在粉碎的过程中难免混入杂质;另一方面,无论哪种粉碎方式都不易制得粒径在1μm以下的微细颗粒。
合成法是由离子、原子、分子通过反应、成核和长大、收集、后处理来得到微细颗粒的方法。
这种方法的特点是可获得纯度、粒度可控均匀性好且颗粒微细的粉体。
并且可以实现颗粒在分子级水平上的复合、均化。
通常合成法包括固相法、液相法和气相法。
陶瓷干压成形所用的粉料要有一定的粒度、颗粒分布范围的要求,粒度过小,则不易排气、压实,易出现分层现象;同时还要求颗粒分布范围要窄,否则也不易压实,同时还会影响产品的强度。
粉料的颗粒分布的测定方法有很多,本实验选用筛析法,即:将一定量的陶瓷粉料用振动筛筛析,用各规格筛的筛余来表示其颗粒的分布。
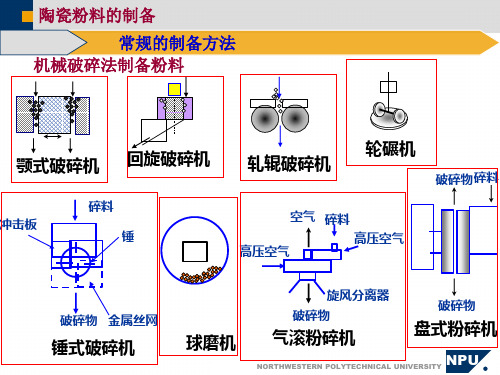
三、实验仪器设备1、陶瓷粉体制备设备:颚式破碎机、双罐快速球磨机、振动球磨机、湿法球磨机、行星球磨机、气流粉碎机。
2、陶瓷粉体性能检测仪器:振动筛、激光粒度分布测定仪。
四、粉碎设备的使用陶瓷工业广泛使用的粉碎设备有:(1) 颚式破碎机:用于大块原料的粗加工。
粒度粗、进料和出料的粉碎比较小(约为4)而且细度调节范围也不大;(2) 轮碾机:属中碎设备。
物料在固定碾盘和滚动的碾轮之间相对滑动,在碾轮的重力作用下被研磨和压碎。
粉碎比较大(约10以上)。
不适合碾磨含水量大于15%的物料;(3) 球磨机:为陶瓷工业使用最广泛的细碎设备。
湿球磨粉碎效率更高。
物料在旋转的筒内与比重较大的介质(球、棒)相互撞击和研磨而被磨细。
影响球磨效率的主要因素如下:①球磨机转速:球磨介质在离心力的作用下上升到滚筒的上部,自由落下砸在磨料上时,球磨的效率最高。
陶瓷粉末的制备

第五章高纯超细粉末的制备新工艺一、概述高技术陶瓷的制造成本粉体的重要性质:组成、粒子形状、结晶性、集合状态理想的陶瓷粉末:颗粒尺寸小、结晶形态、颗粒形态、颗粒尺寸分布、纯度、无团聚、流动性---二、超细粉末制备方法的分类机械方法(物理制备):球磨、砂磨、振动磨、星形磨、气流粉碎化学制备法:(1)固相法:氧化还原法、热分解法、元素直接反应法(2)液相法:共沉淀法、盐溶液水解法、醇盐水解法、溶胶-凝胶法、水热合成法、溶剂热法、微乳法、加热煤油(石油)法、喷雾干燥法、火焰喷雾法、冷冻干燥法---(3)气相法:气相合成法、等离子体法、激光制粉以ZrO2为例:1. ZrSiO4−H2Na2SiO3﹒nH2O−O−→−NaOH Na2ZrO3-Na2SiO3−−→过滤→Na2ZrO3−−→−HCl过滤掉SiO2gel→ZrOCl2﹒8H2O−煅烧ZrO2→结晶纯ZrOCl2﹒8H2O−−→2.ZrSiO4+4C+4Cl2→ZrCl4+SiCl4+4CO, 再氧化→ZrO23.ZrOCl2﹒8H2O, Zr(SO4)2﹒15H2O, ZrCl4 , Zr醇盐等三、超细粉的测试与表征1、粒径沉降法(重力沉降法、离心沉降法)激光光散射法显微镜法(光学、电子)XRD法比表面积法2、表面电性Zeta电位3、表面成分光电子能谱(XPS、UPS)俄歇电子能谱红外光谱4、成分化学组成:化学分析、能谱分析、光谱分析、XRF ---相结构:XRD 、高分辨电镜晶格条纹相---四、机械粉碎法超细粉碎粉体特性变化:粒子由大变小、粒度分布变化、比表面增加、容积变化、形状变化、流动性变化、分散性变化、均匀性(均匀粒子排列)、纯度变化1、球磨法2、砂磨(搅拌磨)3、振动磨4、星形磨(行星磨)5、气流粉碎导向式单轨道式机械力化学、机械合金化---五、化学制备法1、固相合成法及氧化还原法:立方ZrO2、MgAl2O4、3Al2O3·2SiO2 - - - Si + C →SiCSiO2 + 3C →SiC + 2CO3SiO2 + 6C +2N2→Si3N4 + 6CO2、热分解法Al2(NH4)2(SO4)4•24H2O各种锆盐加热时的存在相和结晶尺寸3、酒精干燥4、喷雾干燥法5、喷雾热分解法(1)火焰喷雾法(2)等离子体法6、冷冻干燥法7、加热煤油法、加热石油法加热石油干燥法制备的ZrO2的平均粒径组成煅烧温度比表面积s2/g 平均粒径um硫酸盐6MgO 800℃1h 15.9 0.064 6MgO 1200℃4h 0.89 1.18 12MgO 800℃1h 13.1 0.08 6CaO 1200℃3h 1.46 0.71 6CaO 1200℃4h 0.94 1.12 12CaO 1200℃4h 0.67 1.57醋酸盐6CaO 1200℃4h 1.71 0.58 12CaO 1200℃4h 1.58 0.658、共沉淀法 [Zr 4(OH)8(H 2O)16]8+[Zr 4(OH)8(H 2O)16]8+−−→−O H 2[Zr 4(OH)16-n (H 2O)n+8]n++(8-n)H +a.浓度b. pH 值c.表面活性剂d.洗涤e.脱水f.硬团聚g.煅烧温度 9、盐水溶液水解法ZrOCl 2 + (3+n)H 2O → Zr(OH)4•nH 2O ↓+2HCl ↑ 或 ZrOCl 2 + 3H 2O → ZrO 2•H 2O ↓+ 4HCl ↑ 10、溶胶-凝胶法(Sol – Gel )金属醇盐:M(OR)n(1) 金属与醇直接反应 M +nROH = M(OR)n +2n H 2 (2) 金属氯化物在氨的存在下与醇反应 MCl n + nROH+nHN 3 = M(OR)n + nNH 4Cla. 水解与聚合水解反应:M(OR)n +xH 2O →M(OH)x (OR)n-x +xROH 失水聚缩反应:-M-OH+HO-M-→-M-O-M-+H 2O 失醇聚缩反应:-M-OH+RO-M-→-M-O-M-+ROH形成化合物的总反应:M(OR)n +xH 2O →M(OH)x (OR)n-x +xROHM(OH)x (OR)n-x →MO n/2+2x H 2O+(n-x)ROHb. 凝胶的形成:初始粒子成核、长大、连接成键形成网络c. 凝胶的干燥d.煅烧11、醇盐水解法 12、水热法 (1)水热结晶法 (2)水热分解法ZrSiO 4 18.43 Ca(OH)2 14.9 NaOH 4.67(浓度7wt%) 液/固比 2 Ca(OH)2/ ZrSiO 4 mol 比 2温度 350℃ 蒸汽压 170×105Pa 反应时间 8h ZrSiO 4+xCa(OH)2 → ZrO 2+xCaO •SiO 2•H 2O+(x-1)H 2O (3)水热氧化法 Zr+H 2O → ZrO 2+H2 ↘ZrH x +O 2↗ 13、气相反应法足够的过饱和度 高的平衡常数 反应温度 成核剂3/106⎪⎪⎭⎫ ⎝⎛•=ρπN M C D气相反应法制备的ZrO2反应温度ZrCl4注入温度气体组成ZrCl4 O2N2流量ml/min粒径nm四方相1100 1100-1250 0.6 54.2 45.2 221 5-25 100 1100 1100-1250 0.7 52.5 46.8 229 4-8 100 1100 600 1.2 53.9 45.3 223 40-180 10 1100 600 1.2 89.8 9.0 223 120-800 7六、高熔点氮化物及碳化物微粉体的合成氮化物、碳化物微粉的制造法。
陶瓷粉体的制备及其在陶瓷制品中的应用

陶瓷粉体的制备及其在陶瓷制品中的应用第一章陶瓷粉体的制备方法陶瓷粉体是制造陶瓷制品的重要原材料。
为了获得精细、均匀、高纯度的陶瓷粉体,需要采用各种方法进行制备。
1. 干法制备干法制备是在物理或化学作用下,将陶瓷原料研磨成小颗粒,并通过筛网分级,使其达到所需的颗粒大小和分布。
干法制备可以采用磨细、粉碎和机械法等不同方法。
其中磨细法是将陶瓷原料加入磨料中进行磨细。
磨料可以是陶瓷球、圆锥桶、圆柱罐等,在不断的冲击、磨擦和摩擦作用下,使原料颗粒缩小,磨细并分散。
而粉碎法则是将陶瓷原料加入粉碎设备中进行高速旋转和撞击,达到破碎,并通过筛分制备所需粒度的陶瓷粉末。
2. 湿法制备湿法制备是将陶瓷原料和溶液混合搅拌,制成胶体状物质。
此时,可以通过超声波处理、热干燥、高速离心等方法,去除胶体中的水分和有害物质,还原成精细均匀的陶瓷粉末。
3. 气相制备气相制备是将气态陶瓷原料在保护气氛下加热至高温,使其分解,从而在炉内形成陶瓷粉末。
气相制备可以控制粉末质量、形态和制备过程中的污染,使其成为制备超细、高纯、均匀粒径的陶瓷粉末理想方法,但设备复杂,成本较高。
第二章陶瓷粉体的应用陶瓷粉体是制造各种陶瓷制品的必不可少的原料。
以下分别介绍其在建筑材料、电子元器件、汽车、生物医学等领域的应用。
1. 建筑材料陶瓷粉体可以用于建筑材料,如墙砖、地砖、水泥等。
高纯度的陶瓷粉末可以增加建筑材料的硬度、密度和韧性。
此外,陶瓷粉末对于加强建筑材料的耐热性、耐化学腐蚀性和耐磨性,也有显著的作用。
2. 电子元器件陶瓷粉体可以用于制造电子元器件,如电容器、晶体管、压敏电阻器、传感器等。
这些元器件需要高纯度的陶瓷粉体来保证其性能和稳定性。
陶瓷粉体可以增加元器件的耐压、耐高温、抗干扰能力,同时还可以缩小元器件的尺寸和重量。
3. 汽车陶瓷粉体可以用于汽车零部件。
陶瓷粉体可以制成高强度、低密度的车轮、刹车盘和发动机部件,以提高汽车的安全性和效率。
在发动机内部,使用陶瓷粉体制成的活塞、活塞环和汽缸套等部件,可以提高发动机的效率和可靠性。
(陶瓷科学与工艺学)第四章6粉体制备---水热法

六、 水热与溶剂热合成反应影响因素
大量的研究表明粉体的晶粒粒度与粉体形成时的 成核速度有关,成核速度越快,由此制得的粉体 的晶粒粒度就越小,这是因为水热法制备粉体是 在物料恒定的条件下进行的,对于溶液体系,如 果采取一定的措施,加快成核速度,即在相对较 短的时间内形成相对较多的晶核,由于在成核过 程中溶质被大量消耗,在生长过程所提供的溶质 就会相对减少,则可以使产物的晶粒粒度减少。
a. 无法观察晶体生长和材料合成的过程,不直观。
b. 设备要求高耐高温高压的钢材,耐腐蚀的内衬、技术难度大温压控 制严格、成本高。
c. 安全性差,加热时密闭反应釜中流体体积膨胀,能够产生极大的压 强,存在极大的安全隐患。
d. 不太适合批量化生产
二、水热法和溶剂热法优缺点
f.水热反应的反应机理还有待分析。目前,晶体生 长机理的理论体系在某些晶体生长实践中得到了应 用,起到了一定的指导作用。但是,迄今为止,几 乎所有的理论或模型都没有完整给出晶体结构、缺 陷、生长形态与生长条件四者之间的关系,因此与 制备晶体技术研究有较大的距离,在实际应用中存 在很大的局限性。
一、定义
溶剂热法(Solvothermal Synthesis),是在水热法 的基础上发展起来的一种新的材料制备方法,将 水热法中的水换成有机溶剂或非水溶媒(例如: 有机胺、醇、氨、四氯化碳或苯等),采用类似 于水热法的原理,以制备在水溶液中无法长成, 易氧化、易水解或对水敏感的材料,如III-V族半 导体化合物、氮化物、硫族化合物、新型磷 (砷)酸盐分子筛三维骨架结构等。
三、 水热与溶剂热合成的原理• “均匀溶液饱和析出”机制 • “溶解-结晶”机制 • “原位结晶”机制
三、 水热与溶剂热合成的原理
① “均匀溶液饱和析出”机制
陶瓷粉体制备ppt课件

解速度有利于溶胶凝胶形成。 湿度。一般<50% 温度。提高温度促进水解、缩聚反应,缩短
凝胶时间
20
醇盐分解法
采用金属醇盐M(OR)n为先驱体,以无水乙醇为溶 剂,遇水后很容易水解形成氧化物或其水合物。
控制水解条件可以获得粒径几纳米到几十纳米的超 细粉。
2. 在适当的高温下煅烧合成 3. 将合成的熟料块体粉碎研磨至所需细度
主要用于合成复合氧化物(如BaTiO3等)
BaCO3 TiO2 BaTiO3 CO2
3Al2O3 2SiO2 3Al2O3 2SiO2
3
碳热还原反应法
非氧化物的合成
碳化物
TiO2 C ArTiC CO2 SiO2 3C Ar SiC 2CO
R O
R O
Si
H2O
O R
O R
H O
OH
Si
HO
O H
21
水热法
在密闭反应釜(高压釜)内,采用水溶液为反应介质,对 反应釜加热,溶剂蒸发形成高温高压,使通常条件下难溶 或不溶的物质发生溶解析出传质,得到晶体颗粒。
优点:
晶粒发育完整、细小、均匀; 无(或少)团聚; 无煅烧及粉碎等加工过程。
这两种力的合力状态决定了颗粒的团聚 与分散(DLVO理论)。 影响分散的因素:
pH、电解质溶液中离子强度 分散剂
25
干燥过程
干燥过程中的团聚主要是由颗粒间液体 的表面张力产生的。
P 2 LV cos
R
• 乙醇的表面张力比水小,因此,通过乙 醇清洗后再干燥,可减少干燥中的团聚 程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实施例2:共沉淀法制备SOFC复合阳极 Ni/SDC(NiO-Ce0.8Sm0.2O2)
以硝酸镍和硝酸铈(钐)为原料,碳酸 氨为沉淀剂,以逆加的滴液方式,共沉 淀法制备初级粉体: Ni(OH)2/(SC)(OH)3 沉淀物经水洗、醇洗、干燥和焙烧即得 到所需的粉体。
Table Particulate properties of as-formed NiO-SDC powders
均匀沉淀法原理:
是利用某一化学反应,使溶液中的构成产物的阴离子 (或阳离子)在溶液中缓慢地、均匀地产生出来,从而 形成沉淀的方法。
生成沉淀的途径主要有: 1)沉淀剂缓慢的化学反应,导致H+(OH-)离子变化,溶 液pH值变化,使产物溶解度逐渐下降而析出沉淀 H2NCONH2 + 3H2O CO2 + NH4+ + OH- (90C) 2) 沉淀剂缓慢的化学反应,释放出沉淀离子,达到沉淀离 子的沉淀浓度而析出沉淀 NH2HSO3 + H2O SO4+ + NH4+ + H+ 3)混合作用 H2NCONH2 + H2O CO2 + NH3 (90C) NH3 + HC2O4C2O42- + NH4+
and mechanical mixing
600
5g
400
(s cm )
-1
300
200
100 500 550 600 650
o
700
750
800
Temperature( C)
缺点:溶液中沉淀生成的条件因不同金属离子而异,即在同一条
沉淀形成的条件与粉体特性之间的关系是一个比较 复杂的问题 ◆ 金属离子浓度与沉淀剂浓度 ◆ 操作温度 ◆ 两种溶液混合的顺序和均匀化速率(如搅拌) ◆ 其它杂质的存在、性质和作用 ◆ 反应副产物的去除方法 ◆ 固液分离和沉淀物的干燥 ◆ 沉淀物的灼烧(升温程序!) 沉淀条件不同,后续处理方式不同,得到不同沉淀 物,产生不同性能的粉体。
ln(T)
Electrical properties of SDC
4.8 4.4 4.0
1500 C/5h 1350 C/5h 1350 C/5h(mix)
o o o
ln(T)
3.6 3.2 2.8 2.4 0.90 0.95 1.00 1.05 1.10 1.15
1000/T
Arrhenius plot of conductivity as a function of Temperature for three Sm0.2Ce0.8O1.9 samples sintered at different temperature
Calcined Surface Particle size temperature area (nm) (m2/g) (caculated by surface area) 600 C 700 C 51.4 31.6 17.0 27.4 average average agglome crystallite size rated (nm) size (nm) NiO SDC 232 338 17.94 27.74 18.14 25.46
800 C
23.0
37.6
362
33.83
26.76
XRD pattern of the NiO/SDC powders calcined
at different temperature
# * 800 # * # # #
# SDC * NiO
* #
Intensity
700
600
10
20
30
40
50
均匀沉淀法特点
1)加入溶液的沉淀剂不立即与沉淀成分反应,而是通过 化学反应 在溶液中均匀释放构晶离子 2)构晶离子过饱和度均匀,成核、成长均匀,析出均匀, 颗粒可控、均匀,沉淀致密,易过滤 3)可避免因沉淀剂局部过浓而产生的杂质沉淀 制备Al2O3时,先制备Al(OH)3, 用此法时, 原料中有1.0 克铜, 仅有 0.1毫克铜被沉淀下来;而用普通氨法时, 原料中只有50毫克铜, 却有21毫克被沉淀下来 4) 用于粒子表面改性:均匀、可控的过饱和度,使可在 粒子表面非均相成核,通过粒子表面的其他材料复合 或外延生长而使粒子改性。 如:CoFe2O4 包覆的 r-Fe2O3
TEM photo for calcined SDC powders
(100)
(220)
(311)
Ce0.8Sm0.2O1.9
(200)
(222)
Ce0.8Gd0.2O1.9
Ce0.9Gd0.1O1.95 homogenious coprecipation GDC
standard CeO2
30
40
60
70
2
TEM photograph of NiO/SDC powder calcined at (a)600C, (b)700C, (c)800C
(a)
200nm
(b)
200nm
(c)
200nm
SEM photograph of Ni/SDC cermets anode sintered at 1350C by using the powders calcined
沉淀反应的加料方式
1、顺加(单注)法:将沉淀剂加到金属盐溶液 中 随着沉淀剂的耗尽,溶度积小的离子优先析出 2、逆加(单注)法:将金属盐加到沉淀剂中
一般,沉淀剂过量,从而该方式有利于共沉淀
3、并加(双注)法:将盐溶液和沉淀剂同时按 比例加到反应器中 ♣ 沉淀物的组成可比较均匀
影响因素 : 浓度、温度、 PH 值、滴
原子(离子)、分子水平上的混合, 混合均匀
共沉淀法中的沉淀生成情况,能够利用溶度积通过 化学平衡理论来定量讨论。 化学配比、离子浓度、溶液的pH值、温度、溶度积、 搅拌速度、沉淀剂加入方式(单注、双注)等
都会影响沉淀颗粒乃至于影响到分解后氧化物粒子
的大小、形貌、团聚状态和性能等
用沉淀法制备微粉应考虑的因素
陶瓷粉体基础
(第二讲:粉体制备)
刘杏芹
中国科学技术大学,材料科学与工程系
陶瓷工艺的一个基本特点就是以 粉体为原料经成型和烧成,形成多 晶烧结体。作为起始原料的陶瓷粉 料的质量好坏直接影响最终成品的 质量。 通过液相合成的陶瓷粉体可得粒 度相对均匀、化学成分相对准确、 分布相对均匀的超细粉体 特别近几年通过有机添加剂的加 入,陶瓷超细粉体的粒度及分布、 化学成分等均可精确控制
50
60
(400)
70
2
(331) (420)
80
SEM photo of SDC pellet sintered at 1500oC
Electrical properties of GDC and SDC
5.0 4.5 4.0 3.5
3.0 2.5 2.0 1.5 0.90 0.95 1.00 1.05 1.10 1.15
(3)均匀沉淀法
一般沉淀法是金属盐溶液与沉淀剂相混合 而生成沉淀。采用顺加、逆加或并加的加料方 式,即使在搅拌条件下也难免会造成沉淀剂的 局部浓度过高,因而是沉淀中极易夹带其他杂 质和造成组成和粒度不均匀。 为了避免这些不良后果的产生,可在溶液中 加入某种试剂,在适宜的条件下从溶液中均匀 地逐渐生成沉淀剂, 从而控制沉淀速度和形貌。
(1)制备方法分类:
1)溶液法:沉淀和共沉淀法,均匀沉淀法, 醇盐分解法,溶胶-凝胶法,苷胺酸法, 柠檬酸盐法,喷雾热解法,水热法, 燃烧法 等 2)气相法:蒸发法,化学气相淀积(CVD)法 气溶胶法, 3)固相法:热分解法,改进的固相反应法
(2)沉淀和共沉淀法
沉淀法是指在含有金属离子的溶液中加入沉淀剂, 使生成不溶性氢氧化物、碳 酸盐、硫酸盐、草酸盐等, 过滤、洗涤后,再经过热分解,得到氧化物的方法。 2Al+3 + 6OH-1 = 2Al(OH)3 = Al2O3 + 3H2O 共沉淀法是指利用同一沉淀剂,使溶液中含有两
★为了避免共沉淀法本质上存在的分别沉淀倾向, 可以采用提高沉淀剂的浓度的逆加法,激烈的 搅拌等。这些操作只能在某种程度上能防止分 别沉淀。
★注意选择尽可能使溶度积差别不大的沉淀剂和 性能相似的金属离子,否则会分步沉淀,使沉 淀物混合不均匀 ★尽量用双注法来制备沉淀,以减少沉淀剂局部 过浓带来的影响
这样在溶液内部生成沉淀剂NH4OH。若溶液中存在金 属离子将NH4OH消耗掉,不致产生局部过浓现象。当 NH4OH被消耗后, (NH2)2CO继续水解,产生NH4OH。 因为尿素的水解是由温度控制的,故只要控制好升温 速度,就能控制尿素的水解速度,这样可以均匀地产 生沉淀剂,从而使沉淀在整个溶液中均匀析出。
1000/T
Arrhenius plot of conductivity as a function of Temperature for four samples sintered at 1500C for 5h Sm0.2Ce0.8O1.90 E=51.81kJmol-1 ▲Gd0.2Ce0.8O1.9 E=44.919 kJmol-1 ■Gd0.1Ce0.9O1.95 E=63.19kJmol-1 ▼YSZ E=86.48 kJmol-1
优点:避免沉淀剂局部过浓的不均匀现象,使过饱和 度控制在适当的范围内,从而控制沉淀粒子的生长速 度,能获得粒度均匀、纯度高的超细粒子。
常用沉淀剂:尿素(NH2)2CO(碳酸二酰胺)
常温下,该溶液体系无明显变化,当加热至70C以上 时,尿素就发生如下水解反应:
(NH2)2CO+3H2O====CO2 + NH4+ + OH-)
