人教版九年级化学第七单元课题一燃烧和灭火知识点笔记
人教版九年级上册化学第七单元《燃料及其利用》知识点汇总
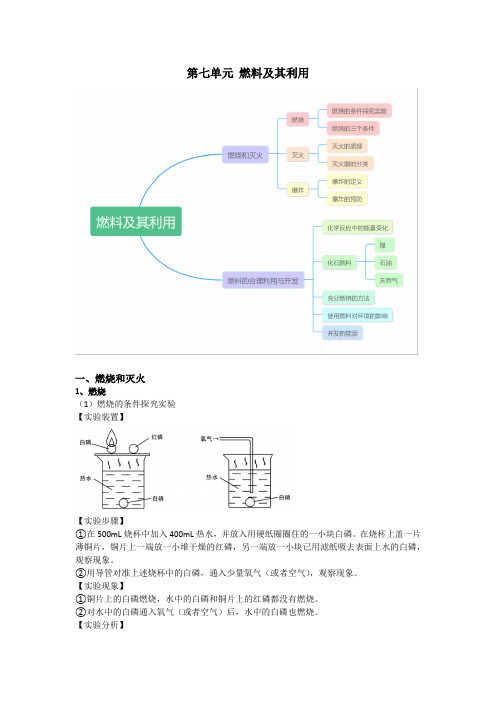
第七单元燃料及其利用一、燃烧和灭火1、燃烧(1)燃烧的条件探究实验【实验装置】【实验步骤】①在500mL烧杯中加入400mL热水,并放入用硬纸圈圈住的一小块白磷。
在烧杯上盖一片薄铜片,铜片上一端放一小堆干燥的红磷,另一端放一小块已用滤纸吸去表面上水的白磷,观察现象。
②用导管对准上述烧杯中的白磷,通入少量氧气(或者空气),观察现象。
【实验现象】①铜片上的白磷燃烧,水中的白磷和铜片上的红磷都没有燃烧。
②对水中的白磷通入氧气(或者空气)后,水中的白磷也燃烧。
【实验分析】①对比铜片上的白磷和红磷,说明燃烧需要达到一定的温度。
②对比铜片上的白磷和水中的白磷,说明燃烧需要与氧气(或者空气)接触。
③观察步骤二的现象,说明燃烧需要氧气(或者空气)。
【实验结论】燃烧需要可燃物、达到一定的温度、氧气(或者空气)。
(2)燃烧的三个条件通常情况下,可燃物与氧气发生的一种发光、发热的剧烈的氧化反应叫做燃烧。
燃烧需要三个条件:①可燃物;②氧气(或者空气);【不是所有的燃烧都需要氧气,有助燃物就行】③达到燃烧所需的最低温度(着火点)。
2、灭火(1)灭火的原理①清除或使可燃物与其他物品隔离;②隔绝氧气(或者空气);③使温度降到着火点以下。
3、爆炸(1)爆炸的定义可燃物在有限空间内急剧地燃烧,在短时间内聚积大量的热,使气体的体积迅速膨胀。
(2)爆炸的预防在油库、面粉厂、加油站等地区应该注意通风,严禁烟火。
二、燃料的合理利用与开发1、化学反应中的能量变化(1)有些化学反应会放出热量,如:(2)有些化学反应会吸收热量,如:2、化石燃料(1)煤①煤的组成煤是复杂的混合物,主要含有碳元素,此外,还含有氢元素和少量的氮、硫、氧等元素和无机矿物质。
②煤的综合利用将煤隔绝空气加强热,可以使煤分解出如焦炭、煤焦油、煤气等有用物质。
其中煤气的主要成分是氢气、甲烷、一氧化碳和其他气体。
(2)石油①石油的组成石油中主要含有碳和氢两种元素。
②石油的综合利用利用石油中各成分的沸点不同,可以分离得到不同的产品,如沥青、石蜡、润滑油、柴油、煤油、航空煤油、汽油、溶剂油等。
九年级上册化学第七单元笔记

九年级上册化学第七单元笔记第七单元燃烧及其利用一、燃烧的定义和条件燃烧是一种发光、发热的化学反应,通常伴随着火焰的产生。
燃烧的条件是可燃物、助燃物(通常是氧气)和点火源。
只有当这三个条件同时满足时,燃烧才会发生。
二、灭火的方法和原理1.清除可燃物:将可燃物与点火源分离,使其无法发生燃烧。
2.隔绝助燃物:使用灭火器等设备将氧气与可燃物隔离,使燃烧无法继续进行。
3.降低温度:使用水、泡沫等物质降低可燃物的温度,使其无法达到燃烧点。
三、燃料的选择和利用4.煤是常用的燃料之一,它含有碳、氢等元素,燃烧时会产生二氧化碳和水蒸气等产物。
煤的燃烧效率取决于其含碳量、煤粉的细度和空气的供应量。
5.石油是一种重要的能源,它主要用于生产汽油、柴油和润滑油等。
石油的开采和加工需要耗费大量的能源和资源,且会产生严重的环境污染。
6.天然气是一种清洁的能源,它主要成分是甲烷,燃烧时只产生二氧化碳和水蒸气。
天然气在燃烧时产生的热量比煤炭和石油更高,因此是一种高效的能源。
7.太阳能是一种无限的能源,它可以通过太阳能电池板转化为电能或热能。
太阳能的利用不会产生任何污染物,因此是一种非常环保的能源。
8.风能是一种清洁的能源,它可以通过风力发电机转化为电能。
风能的利用不会产生任何污染物,并且风能资源丰富,因此是一种非常有前途的能源。
四、能源的利用和环境保护9.能源的分类:能源可以分为可再生能源和不可再生能源。
可再生能源包括太阳能、风能、水能等,而不可再生能源包括煤炭、石油、天然气等。
10.能源的转化:能源可以从一种形式转化为另一种形式,例如太阳能可以转化为电能或热能,煤炭可以转化为电能或热能等。
11.能源的利用:能源的利用需要考虑到环境保护和可持续发展。
在利用能源的过程中,应该采取有效的措施减少污染物的排放,同时开发清洁、高效的能源技术,以实现能源的可持续发展。
12.环保措施:为了保护环境,可以采取一系列的措施,例如开发清洁能源、推广节能技术、加强环境监测和治理等。
初中化学7燃烧和灭火条件笔记

能源的利用和开发
1.可再生能源与不可再生能源
定义
举例
可再生能源 不随其本身的 太阳能、核能、
转化或人类的 水能、风能、
利用而减少的 氢能等
能源
不可再生能源 随本身的转化 煤、石油、天
或人类的利用 然气
二减少的能源
2.新能源 (1)氢能 ①氢气无毒;极易燃烧,化学方程式为
,产物为水(无污染),燃烧放热量多。
实验解读 探究燃烧的条件
1. 实验装置
甲
乙
2. 实验现象及分析
(1) 现象:甲图中铜片上的白磷燃烧,铜片上的红磷和水中的白磷没有燃烧。乙图中白磷在水下燃烧。
(2)分析:①与②对比,说明物质是否燃烧与可燃物的着火点有关;①与③对比,说明物质是否燃烧与
是否和氧气接触有关;③与④对比,再次说明,燃烧需要有氧气。
生产:开山采矿、定向爆炸、拆除危旧建筑等;⑤人体自身维持体温和日常活动所需要的能量等。
化石燃料的利用
1. 化石燃料(高频考点)
(1)三大化石燃料指 、
、
。它们都属于不可再生能源,都是混合物。
(2)煤:被称为“工业的粮食”,主要含有碳元素。
(3)石油:主要含有碳元素和氢元素。利用石油中各成分的 沸点 不同,经分馏(属于物理变化), 从石油分
燃烧和灭火知识梳理
燃烧的条件
1.燃烧:可燃物与氧气发生的一种 、
的剧烈的
。
2. 燃烧的条件(高频考点)
(1)
;
(2)与氧
接触;
(3)温度达到燃烧所需要的
。
注意:燃烧必须同时满足三个条件,有的燃烧不一定需要氧气,如:
2Mg + CO2
2MgO + C
最新人教版初中化学九年级下册《第7单元 燃烧及其利用》知识点汇总

第7单元知识点汇总一、燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃物(2)氧气(或空气)(3)温度达到着火点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积使燃料充分燃烧的两个条件:(1)要有足够多的空气;(2)燃料与空气有足够大的接触面积。
4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
二、燃料和能量1、三大化石燃料: 煤、石油、天然气(混合物、均为不可再生能源)(1)煤:“工业的粮食”(主要含碳元素);煤燃烧排放的污染物:SO2、NO2(引起酸雨)、CO、烟尘等(2)石油:“工业的血液”(主要含碳、氢元素);汽车尾气中污染物:CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(3)天然气是气体矿物燃料(主要成分:甲烷),是较清洁的能源。
2、两种绿色能源:沼气、乙醇(1)沼气的主要成分:甲烷甲烷的化学式: CH4 (最简单的有机物,相对分子质量最小的有机物)物理性质:无色,无味的气体,密度比空气小,极难溶于水。
化学性质: 可燃性 CH4+2O点燃CO2+2H2O (发出蓝色火焰)(2)乙醇 (俗称:酒精, 化学式:C2H5OH)化学性质: 可燃性 C2H5OH+ 3O点燃2CO2+3H2O工业酒精中常含有有毒的甲醇CH3OH,故不能用工业酒精配制酒!乙醇汽油:优点(1)节约石油资源(2)减少汽车尾气(3)促进农业发展(4)乙醇可以再生3、化学反应中的能量变化(1)放热反应:如所有的燃烧;⑵吸热反应:如一般条件为“高温”的反应4、新能源:氢能源、太阳能、核能、风能、地热能、潮汐能氢气是最理想的燃料:(1)优点:资源丰富,放热量多,无污染。
(2)需解决问题:①如何大量廉价的制取氢气?②如何安全地运输、贮存氢气?我爸爸告诉我,你现在翻的一页书都是将来要数的一张张钞票,所以不让你学习的人,就是在抢你的财富,不想要的都是傻子。
九年级化学上册第七单元《燃料及其利用》课题1《燃烧和灭火》知识点(有答案解析)

【答案】B
【解析】 在高温烘烧下,砖会裂开并咲出気气和二氧化碳,由于氮气和二氧化碳化学性质稳定,且不支持燃烧,
所以起到隔绝空气,使可燃物与氧气隔亶,不能燃烧,而熄灭.着火点不能降低,降低的是温度.
例 2.炒菜时油锅着火,盖上锅盖灭火的原理是()
A.
清除可燃物 B.降低着火点
C.隔绝空气
D.温度降到着火点以下
应沿墙根匍匐前进。
考题何现
【考題莉】
例 1.英国科技人员研制出自动灭火陶瓷砖,砖里压入了一定量的気气和二氧化碳.这种砖砌成的房屋发生火灾时, 在高
温烘烧下,砖会裂开并喷出気气和二氧化碳,从而抑制和扑灭火焰.自动灭火陶瓷砖的灭火原理是()
A.
清除可燃物 B.使燃烧物与氧气隔绝
C.降低燃烧物的着火点
D.使燃烧物的温度降低到着火点以下
气中才能燃烧,故错误.
B、 物质的着火点一般不会发生变化,故错误.
C、 空气中有氧气混有可燃性气体,谒明火达到着火点可能发生爆炸,正确.
D、 氢气燃烧只生成水,故错误. 例 2.燃烧、白燃、缓慢氧化的共同点是() A. 【答案】B
都发光 B.都放热 C.都反应剧烈 D.都有水生成
【解析】
A、 缓慢氧化不发光,故选项错误; B、 它们的共同点是:都是氧化反应,都能放出热量.故选项正确; C、 缓慢氧化进行的比较缓慢,故选项错误;
号題仰现 【考題莉】
例 1-下列有关燃烧和灭火的说法正确的是() A. 可燃物只有在空气中才能燃烧 B. 通过降低可燃物的着火点可以灭火 C. 空气中混有可燃性气体,遇明火可能发生爆炸 D. 任何燃料完全燃烧时,一定会生成二氧化碳 【答案】C 【解析】A、镁可以在二氧化碳中燃烧:发生了燃烧,没有氧气参加,说明燃烧不一定要有氧气参与,可燃物不—定在空
九年级化学上册《燃烧和灭火》知识点归纳及典例导析(含解析)(新版)新人教版

燃烧和灭火【学习目标】1.掌握燃烧的条件和灭火的原理;了解一些防火和防爆的安全知识和灭火方法。
2.通过对燃烧条件、灭火原理等的探究活动,进一步认识与体验科学探究的过程。
【要点梳理】要点一、燃烧的条件1.燃烧:可燃物与氧气发生的一种发光、放热的剧烈的氧化反应叫做燃烧。
2.燃烧条件的探究:(1)如下图所示,观察并分析热水中白磷、铜片上的白磷和红磷产生的不同现象。
思考1:为什么铜片上的白磷燃烧而红磷不燃烧?可燃物燃烧需要一定温度,即达到着火点(燃烧所需的最低温度叫着火点)。
白磷的着火点为40℃,而红磷的着火点为240℃,热水的温度大于40℃,而达不到240℃,因此白磷燃烧而红磷不燃烧。
思考2:为什么铜片上的白磷燃烧,而热水中的白磷不燃烧?可燃物燃烧需要氧气,铜片上的白磷和空气(氧气)接触,而热水中的白磷不跟空气(氧气)接触,因此铜片上的白磷燃烧而热水中的白磷不燃烧。
思考3:为什么本来在热水中不燃烧的白磷在通入空气(或氧气)后却燃烧起来?在热水中温度虽然达到白磷的着火点,但没有氧气,白磷不能燃烧;当通入空气(或氧气)后,白磷跟氧气接触就燃烧起来。
(2)完成下表中的三个小实验。
实验操作 现象 解释实验1 分别将蘸有酒精、水的小棉花球放到酒精灯上加热片刻 蘸酒精的棉花立即烧起来,而蘸水的小棉花球不会燃烧 酒精具有可燃性,而水不具有可燃性实验2 用透明的玻璃杯罩住燃烧的小蜡烛,观察小蜡烛燃烧情况 蜡烛火焰逐渐变暗,最后熄灭 烧杯中氧气含量不断变小,最后氧气被完全消耗实验3 将一根小木条和一小块煤置于同一酒精灯上加热 小木条很容易烧起来,而小煤球很难燃烧起来 使小木条发生燃烧需要的温度较低,而使小煤块燃烧需要的温度比较高①物质具有可燃性;②可燃物与空气或氧气接触;③可燃物达到它燃烧所需要的最低温度(即它的着火点)。
这三个条件缺少任何一项都不能燃烧。
【要点诠释】1.着火点是可燃物固有的性质,不随外界条件的改变而改变。
九年级化学上册第七单元课题1燃烧和灭火知识梳理新人教版
课题1 燃烧和灭火知识梳理1.燃烧(1)燃烧的定义燃烧是指___________与___________发生的一种_______、_______的剧烈的反应。
(2)燃烧的条件①___________、②___________、③___________,三个条件必须同时具备。
答案:(1)可燃物氧气发光发热氧化(2)可燃物氧气(或空气) 达到燃烧所需的最低温度(也叫着火点)2.灭火的原理和方法(1)灭火的原理①___________、②___________、③___________,三个条件只需具备一个。
(2)爆炸可燃物在________空间内发生________燃烧,称作爆炸。
(3)常用灭火器名称和适用范围(举两例)________:_______________________________________________;________:_______________________________________________;________:_______________________________________________。
(4)泡沫灭火器的反应原理(用化学方程式表示) ________________________________。
在________、________、和________易燃物和易爆物时,必须严格遵守有关规定,绝不允许违章操作。
答案:(1)清除可燃物或使可燃物与其他物品隔离隔绝氧气(或空气) 使温度降到着火点以下(2)有限急剧的(3)泡沫灭火器可用来扑灭木材、棉布等燃烧引起的失火干粉灭火器除可用来扑灭一般火灾外,还可用来扑灭油、气等燃烧引起的火灾二氧化碳灭火器可用来扑灭图书、档案、贵重设备、精密仪器等处的失火(4)Al2(SO4)3+6NaHCO3====2Al(OH)3↓+6CO2↑+3Na2SO4 生产运输使用贮存疑难突破在什么情况下会发生爆炸?剖析:可燃物在有限的空间内急速地燃烧,就会在短时间内聚集大量的热,使气体体积急速膨胀而引起爆炸。
人教版九年级化学上册第七单元课题1《燃烧和灭火》知识点
课题1 燃烧和灭火
一、燃烧的条件
1.燃烧
通常情况下,燃烧是指可燃物与氧气发生的一种发光、放热的剧烈氧化反应。
知识拓展
(1)发光、发热是燃烧的特点,但发光、发热的不一定是燃烧,如电灯通电发光、发热。
(2)广义的燃烧不一定有氧气参与,如H2在Cl2中燃烧。
2.燃烧的条件
(1)燃烧条件的探究
铜片上的白磷
燃
燃
的白磷不燃烧
(2)燃烧的条件
燃烧必须同时具备{可燃物
氧气(空气)
达到燃烧所需的最低温度(也叫着火点)
特别提醒:着火点是物质具有的固有属性,只与本身的性质有关,一般不随外界条件的改变而改变。
二、灭火的原理和方法
1.灭火的原理
(1)使可燃物与氧气(或空气)隔绝。
(2)使可燃物的温度降低到着火点以下。
(3)清除可燃物或使可燃物与其他物品隔离。
2.几种常用的灭火方法
3.常见灭火器的灭火原理及适用范围
三、易燃物和易爆物的安全知识
1.爆炸
(1)爆炸的含义:可燃物在有限的空间内急剧地燃烧,就会在短时间内聚积大量的热,使气体的体积迅速膨胀而引起爆炸。
特别提醒:并非所有的爆炸都是化学变化。
如气球爆炸、自行车轮胎爆炸等,都属于物理变化。
另外,除火药外,可燃性的气体在空气中达到一定的浓度,遇火也会发生爆炸,如H2、CO、CH4等。
(2)爆炸极限:可燃性气体等在空气中达到一定含量时,遇到火源就会发生爆炸。
这个能发生爆炸的含量范围,叫做爆炸极限。
2.一些与燃烧和爆炸有关的图标。
人教版化学 九年级上册 7.1燃烧和灭火 知识点讲义(无答案)
知识点讲义——第七单元燃烧及其利用课题1 燃烧和熄灭知识点1 燃烧的条件(重、难点)1.燃烧的利用燃烧是人类最早利用的化学反应之一,人类利用化学反应的历史,可以追溯到远古时代。
燃烧是人类的生活以及社会的发展有着密切的联系,如钻木取火、冶炼金属、烹调食物、火箭升空等都利用了燃烧反应。
2.探究燃烧的条件【实验步骤】①在500mL烧杯中加入300mL热水,并放入用硬纸圈圈住的一小块白磷。
在烧杯上盖一薄铜片,铜片上一端放一小堆干燥的红磷,另一端放一小块已用滤纸吸去表面上水的白磷,观察现象。
②用导管对准上述烧杯中的白磷,通入少量氧气(或空气),观察现象。
【实验原理】如图所示,通过热水中的白磷、铜片上的白磷和红磷产生的现象不同,逐一分析归纳得出燃烧的条件。
【实验现象】铜片上的白磷燃烧,而红磷不燃烧;铜片上的白磷燃烧,而热水中的白磷不燃烧;热水中的白磷通入氧气(或空气)后燃烧起来。
【实验分析】白磷的着火点很低,只有40℃,而红磷的着火点在200℃以上,紧靠热水加热是达不到的。
通过二者着火点的比较,说明燃烧需要达到可燃物的着火点;热水中的白磷不燃烧,通入氧气后燃烧,说明燃烧需要与氧气接触。
【实验结论】可燃物的燃烧需要达到着火点,并与氧气(或空气)接触。
【引申拓展】着火点是使物质燃烧的最低温度,不同物质的着火点是不同的。
3.燃烧的定义及燃烧的条件(1)燃烧:通常的燃烧是指可燃物跟氧气发生的一种发光、放热的剧烈的氧化反应。
(2)燃烧需要同时满足三个条件:①可燃物②与氧气(或空气)接触③达到可燃物的着火点(燃烧所需要的最低温度)着火点不是固定不变的。
对固体燃料来说,着火点的高低跟表面积的大小、颗粒的大小、导热系数的大小等都有关系。
颗粒越小,表面积越大,着火点越低。
知识点2 灭火的原理和方法(重点)1.灭火原理的实验探究【实验目的】探究灭火的原理。
【实验操作】点燃三只蜡烛,在其中一支蜡烛上倒扣一只烧杯;将另外两支蜡烛放在烧杯中,然后向其中一只烧杯中加入适量碳酸钠和稀盐酸,观察现象并分析原因。
人教版九年级化学第七单元课题一燃烧和灭火知识点笔记
第七单元燃料及其应用课题一、燃烧和灭火人类发现、利用火的意义:黑暗→光明,抵御寒冷和敌害,吃熟食利于人类进化等。
一、燃烧⏹定义:通常条件下燃烧是指可燃物跟氧气发生的一种发光、放热的剧烈的氧化反应。
⏹探究燃烧的条件【实验操作】a.如右图(I),在500mL的烧杯中注入300mL热水,并放入用硬纸圈圈住的一小块白磷。
在烧杯上盖一片薄铜片,铜片上一端放一小堆干燥的红磷,另一端放一小块已用滤纸吸去表面上水的白磷,观察现象。
b. 如右图(II),用导管对准上述烧杯中的白磷,通入少量氧气(或空气),观察现象。
【实验现象】a.铜片上的白磷燃烧产生大量白烟,黄色火焰;铜片上的红磷和水中的白磷没有燃烧。
b. 白磷在热水中燃烧。
【实验分析】如右图①与②对比,说明要达到可燃物燃烧所需要的最低温度(着火点)才能燃烧。
①与③对比,说明可燃物要与空气(氧气)接触才能燃烧。
③与图(II)对比,再次说明可燃物要与空气(氧气)接触才能燃烧。
【实验结论】燃烧的条件:可燃物、与氧气(或空气)接触、温度达到着火点。
【注意事项】①只有三个条件全部满足,燃烧才能发生。
(初中化学)②并非所有的燃烧都需要氧气,如氢气可以在氯气中燃烧生成氯化氢。
(高中化学)火一方面可以造福于人类,另一方面又会带来灾难,无情的火灾会给人民的生命财产带来重大损失。
二、灭火●讨论以下灭火的实例:1、炒菜时油锅中的油不慎着火,用锅盖盖灭或放入更多的蔬菜。
(隔绝空气氧气。
)2、堆积杂物的纸箱着火,用水浇灭。
(用水降温到纸箱的着火点以下。
)3、油罐着火用水喷湿降温。
(将温度降低到油的着火点以下。
)4、扑灭森林火灾的有效方法之一是将大火蔓延前的一片树木砍掉,形成隔离带。
(清除可燃物或使可燃物与其他物品隔离)●点燃三支蜡烛,在其中一支蜡烛上扣上一只烧杯;将另两支蜡烛分别放在两只烧杯中;然后向其中的一只烧杯中加适量碳酸钠和盐酸,比较三支蜡烛燃烧现象有什么不同?1、蜡烛慢慢熄灭。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七单元燃料及其应用
课题一、燃烧和灭火
人类发现、利用火的意义:黑暗→光明,抵御寒冷和敌害,吃熟食利于人类进化等。
一、燃烧
⏹定义:通常条件下燃烧是指可燃物跟氧气发生的一种发光、放热的剧烈的氧化反应。
⏹探究燃烧的条件
【实验操作】
a.如右图(I),在500mL的烧杯中注入300mL热水,
并放入用硬纸圈圈住的一小块白磷。
在烧杯上盖一片
薄铜片,铜片上一端放一小堆干燥的红磷,另一端放
一小块已用滤纸吸去表面上水的白磷,观察现象。
b. 如右图(II),用导管对准上述烧杯中的白磷,通入
少量氧气(或空气),观察现象。
【实验现象】
a.铜片上的白磷燃烧产生大量白烟,黄色火焰;
铜片上的红磷和水中的白磷没有燃烧。
b. 白磷在热水中燃烧。
【实验分析】如右图
①与②对比,说明要达到可燃物燃烧所需要的最低温度(着火点)才能燃烧。
①与③对比,说明可燃物要与空气(氧气)接触才能燃烧。
③与图(II)对比,再次说明可燃物要与空气(氧气)接触才能燃烧。
【实验结论】燃烧的条件:可燃物、与氧气(或空气)接触、温度达到着火点。
【注意事项】
①只有三个条件全部满足,燃烧才能发生。
(初中化学)
②并非所有的燃烧都需要氧气,如氢气可以在氯气中燃烧生成氯化氢。
(高中化学)
火一方面可以造福于人类,另一方面又会带来灾难,无情的火灾会给人民的生命财产带来重大损失。
二、灭火
●讨论以下灭火的实例:
1、炒菜时油锅中的油不慎着火,用锅盖盖灭或放入更多的蔬菜。
(隔绝空气氧气。
)
2、堆积杂物的纸箱着火,用水浇灭。
(用水降温到纸箱的着火点以下。
)
3、油罐着火用水喷湿降温。
(将温度降低到油的着火点以下。
)
4、扑灭森林火灾的有效方法之一是将大火蔓延前的一片树木砍掉,形成隔离带。
(清除可燃物或使可燃物与其他物品隔离)
●点燃三支蜡烛,在其中一支蜡烛上扣上一只烧杯;将另两支蜡烛分别放在两只烧杯中;
然后向其中的一只烧杯中加适量碳酸钠和盐酸,比较三支蜡烛燃烧现象有什么不同?
1、蜡烛慢慢熄灭。
(杯内氧气消耗完,外界空气被烧杯隔绝)2、
蜡烛持续燃烧。
(具备燃烧的三个条件)
3、迅速产生大量气泡,蜡烛随即熄灭。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
CO2密度比空气大,CO2不燃烧也不支持燃烧)
●分析泡沫灭火器的工作原理:
浓盐酸与碳酸钠溶液迅速反应,产生大量的CO2
使锥形瓶内气压增大,CO2和混合溶液(泡沫)一
起喷射到可燃物表面,起到隔绝空气和降温的作
用。
(降温到可燃物着火点以下)
Na2CO3+2HCl=2NaCl+H2O+CO2↑
●将燃着的木条分别横放、竖放、倒放,比较燃烧现象并分析原因。
⏹灭火的原理:破坏燃烧的条件,达到灭火的目的。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(空气);③降温可燃物的
着火点以下。
A、着火点是可燃物燃烧时所需的最低温度,是物质的一种性质,不随外界条件的变
化而变化。
我们只能降低可燃物的温度而不能降低可燃物的着火点。
B、在燃烧的三个条件中,破坏一个或几个条件都可达到灭火的目的。
⏹灭火器
◆水基型灭火器:产生的泡沫喷射到可燃物表面形成一层水膜,泡沫和水膜双重
作用,
快速高效灭火。
可用于扑灭非水溶性可燃性液体、如汽油柴油等,以及固体燃料,
如木材、棉布等失火。
◆干粉灭火器:2NaHCO3Na2CO3+H2O+CO2↑
(利用CO2吹出干粉,用于扑灭一般失火以及油、气的失火)
◆CO2灭火器:盛装的是液态二氧化碳,使用时不会留下任何痕迹,用于扑灭图
书、档案、贵重设备、精密仪器等物的失火。
三、易燃物、易爆物的安全知识:
⏹爆炸:可燃物在有限的空间内急剧地燃烧,在短时间内聚积大量的热,使气体的体
积迅速膨胀
而引起爆炸。
◆除了可燃性气体能发生爆炸外,可燃性粉尘如面粉、煤粉等也能发生爆炸。
◆爆炸极限:可燃性气体在空气中达到一定含量时遇火源会发生爆炸。
这个能发
生爆炸的
含量范围叫做爆炸极限。
H2 : 4.0% -74.2% CH4 5%-15% CO
12.5%-74.2%
⏹粉尘爆炸实验
【实验操作】取一空金属罐和小塑料瓶,剪去金属罐和小塑料瓶的
上部,并在金属罐和小塑料瓶的底侧各打一个比橡皮管外径略小的
小孔。
像右图那样连接好装置,在小塑料瓶中放入干燥的面粉,点
燃蜡烛,用塑料盖盖住金属罐。
从橡皮管一端快速鼓入大量的空气,使面粉充满罐,观察现象并分析原因。
【实验现象】“砰”地一声响,伴随一团火光产生;放热;塑料盖被掀起。
【实验分析】面粉与空气充分接触同时被蜡烛点燃。
在有限的空间内发生急剧燃烧并放出大量热,
产生的气浪将塑料盖掀起,说明可燃性的粉尘在有限的空间内急剧燃烧能发生爆炸。
【注意事项】①面粉应该是干燥的;②气囊的作用:使面粉与空气充分混合。
⏹油库、加油站、面粉加工厂、纺织厂、煤矿矿井内等地必须采取安全措施:通风、
严禁烟火。
因为这些地方的空气中常常混有可燃性气体或粉尘,它们遇到明火,就有发生爆炸的危险。
⏹用扇子扇煤炉火,为什么越扇越旺?而用扇子扇蜡烛火焰,为什么一扇就灭?
用扇子扇煤炉火,煤炉内着火面积大,消耗氧气多,放热多,用扇子扇风不能使温度降低到煤的
着火点以下,反而补充了氧气,所以越扇越旺;而蜡烛燃烧接触面积小,放出热量少,扇风虽然
补充了氧气,但空气的流动加快了热量的散失,主要起到了降温到可燃物着火点以下,一扇即灭。
