小鼠中脑多巴胺神经元发育的机制
gdnf分子量

gdnf分子量GDNF(Glial cell line-derived neurotrophic factor)是一种神经营养因子,其分子量约为30.6千道尔顿(kDa)。
GDNF是由神经胶质细胞分泌的一种蛋白质,对神经系统的发育和功能具有重要的调节作用。
本文将从GDNF的发现、生物学作用、研究进展和临床应用等方面进行介绍。
一、GDNF的发现GDNF最早由美国科学家Lincoln和他的团队在1993年发现。
他们从成年大鼠肾上腺髓质中分离到了一种能够促进中脑多巴胺能神经元存活和发育的物质,并将其命名为GDNF。
随后的研究表明,GDNF 不仅存在于肾上腺髓质中,还广泛分布于中枢神经系统和外周组织中。
二、GDNF的生物学作用1. 促进多巴胺能神经元的存活和发育:GDNF对中脑多巴胺能神经元具有明显的促进作用,可促进这些神经元的存活和突触形成,对于帕金森病等神经退行性疾病的治疗具有重要意义。
2. 促进神经元迁移和轴突生长:研究发现,GDNF能够诱导神经元迁移和轴突生长,对神经系统的发育和再生具有重要作用。
3. 抗凋亡作用:GDNF能够通过抑制神经细胞凋亡的发生,保护神经系统免受损伤。
三、GDNF的研究进展1. GDNF的受体及信号转导机制:GDNF的受体主要包括GFRα1、RET和NCAM等,信号转导主要通过RET受体介导的细胞内信号传递途径进行。
2. GDNF在神经系统发育中的作用:GDNF在神经系统发育过程中发挥着重要的调控作用,特别是对于多巴胺能神经元、感觉神经元和运动神经元的发育具有重要意义。
3. GDNF与神经退行性疾病的关系:研究发现,GDNF与帕金森病、亨廷顿舞蹈病等神经退行性疾病的发生和发展密切相关,GDNF的外源性给药可改善这些疾病的症状。
4. GDNF在神经再生和修复中的应用:GDNF作为一种重要的生长因子,被广泛应用于神经再生和修复的研究中,为神经系统疾病的治疗提供了新的思路。
四、GDNF的临床应用1. GDNF在帕金森病治疗中的应用:临床研究表明,GDNF的外源性给药可以显著改善帕金森病患者的运动功能,并且具有良好的安全性。
骨髓间充质干细胞向多巴胺能神经元的诱导分化

骨髓间充质干细胞向多巴胺能神经元的诱导分化刘卓;徐运;黄丹青【摘要】背景:近年来研究发现,神经营养因子在骨髓间充质干细胞的分化中发挥重要作用.目前脑组织中具有再生能力的神经干细胞在体外是否具有直接诱导骨髓间充质干细胞分化为多巴胺能神经元的作用还未见报道.目的:观察大鼠间充质干细胞在胶质细胞源性神经营养因子与神经干细胞共培养两种诱导条件下体外分化成多巴胺能神经元的能力.方法:分离培养SD大鼠骨髓间充质干细胞,取第3代细胞分2组培养,一组细胞应用胶质细胞源性神经营养因子单独诱导,另一组细胞与已培养成球的神经干细胞共培养进行诱导,共培养之前行Brdu标记.诱导3 d后以免疫组织化学法检测各组贴壁细胞神经元特异性标志物神经原纤维和多巴胺能神经元特异性标志物酪氨酸羟化酶的表达,观察间充质干细胞的分化情况.结果与结论:胶质细胞源性神经营养因子单独诱导组间充质干细胞在诱导24 h后胞体回缩呈锥形,突起延长且数量增多,有神经元样形态,且细胞间相互连接成网络状,3 d后部分细胞表达神经原纤维,其中少部分同时表达酪氨酸羟化酶.与神经干细胞共培养组神经干细胞球很快解离,迅速贴壁,共培养的贴壁细胞大量增殖且多呈神经元样,胞体细长多突起,相互间连接成网,多数贴壁细胞分别单独表达神经原纤维和酪氨酸羟化酶,少数细胞可见Brdu/神经原纤维,Brdu/胶质纤维酸性蛋白,Brdu/酪氨酸羟化酶双标阳性.提示间充质干细胞在胶质细胞源性神经营养因子、神经干细胞存在的情况下可定向转化为神经元,并有向多巴胺能神经元分化的可能.在该实验条件下胶质细胞源性神经营养因子效果好于神经干细胞.【期刊名称】《中国组织工程研究》【年(卷),期】2010(014)023【总页数】4页(P4227-4230)【关键词】骨髓间充质干细胞;神经干细胞;胶质细胞源性神经营养因子;诱导;神经元【作者】刘卓;徐运;黄丹青【作者单位】南京大学医学院附属鼓楼医院神经内科,江苏省南京市,210008;南京大学医学院附属鼓楼医院神经内科,江苏省南京市,210008;南京大学医学院附属鼓楼医院神经内科,江苏省南京市,210008【正文语种】中文【中图分类】R394.20 引言间充质干细胞(mesenchymal stem cells,MSC)是一类具有支持造血和多向分化潜能的非造血干细胞[1],在体外适当的条件下可分化为骨、软骨、脂肪、心肌、神经元等中胚层细胞。
Pitx3在中脑多巴胺能神经元发育及帕金森病中的作用研究进展

育过 程及 帕金 森 病发 病机 制 中可 能存 在 中脑 多 巴胺 能 神 经 元 的 表 达减 少 。 A酸 ( R A) A H D 2表 达于 增殖 的中 脑 在 的信号通路 及机制 。
中 的 作 用 1 . 1 P i t x 3在 中 脑 多 巴 胺 能 神 经 元 上
能 神 经元 早 期 一 多 巴胺 能 神 经元 成熟 元 的缺陷 ,而 此处 是黑 质 神经 元 的前 家族 成员 .也 是多 巴胺 能神 经元 发 育
期 。 已知 多巴胺 能神 经 元 的发育 是 一 体细胞 。 出生后 , a k小 鼠黑质 T H明显 的关键 因子 。 L m x l b在 E 7 . 5表达 . 早 于 个 有多 种转 录 因子 和生 长 因子参 与 而 减少 ,其 他 的 中脑 多 巴胺 能神 经元 标 N u r r l( E1 0 . 5 ) 和 P i t x 一 3( E 1 1 . 5 ) , 其 表 受 到严格控 制 的过 程 。 其中, P i t x 3特异 记物 也 明显改 变 ,但腹 侧 被盖 区却 被 达 不依赖 于 N u r r l 。L m x l b对 T H 的表 表达 于大脑 D A能神经 元 。 对 中脑多 巴 保 留 ,中脑多 巴胺 能神 经元 的迁移 也 达并 不 是必 需 的 . 但 P i t x 3的表 达需 要 胺 能神 经元 的分 化与 成熟 起 着关 键性 发生改 变。 最终, a k小 鼠表 现为 中脑 多 L m x l b 。 L m x l b可能处 于 P i t x 3的上游 而 作用 ,被 认 为是 中脑 多 巴胺 能神 经元 巴胺 能神经 元 进行 性 的减 少 。这可 能 调 控 其 表 达 。研 究 E 9 1 发现 , 一个 新 的 特异 性 发育 所必 需 的转 录因 子 。本文 是 P i t x 3直接导致 的发 育缺陷 [ 2 - 3 ] 。 就近年来有关 P i t x 3对 中 脑 多 巴胺 能 Wn t 1 . L m x l a自动 调节 环参与 了胚胎 干
神经干细胞向多巴胺能神经元分化机制的研究进展

pa t n f I rme t mmu oo y,I siueo i ia e cn o n lg n ttt f Clnc l diie,Chn - a a in s i s ia ,Bejn 0 0 9, h n M iaJ p n Fre d h p Ho p t l iig 1 0 2 C ia
・
31 ・ 4
中国康复理论与实践 2 1 0 0年 4月第 1 卷第 4期 ChnJRe aiThoyP at 6 i hbl e r rc,Ap.2 1 , o.1 , . r 0 0 V 经 干 细 胞 向 多 巴胺 能 神 经 元 分 化 机 制 的 研 究 进 展
a mp ra tc ls u c o h el e lcme t h r p fP r is n ie s.Thsp p rrve dt emao lc lrme h ns , ni o tn e1 o ref rtecl r pae n ea yo a kn o ' dsa e — t s i a e e iwe h j rmoeua c a im
录 因 子 。早 期 研 究 显 示 小 鼠 和 大 鼠 中 枢 神 经 系 统 内 Nu r r l的 mR NA 和 酪氨 酸 羟 化 酶 ( TH) mR 的 NA 的 表 达 区域 相 同 , 鼠 小 巾 腑 Nu r 表 达 比 T 的表 达 提 前 一 天 , 且 一 直 在 D 能 rl的 H 并 A 神 经 元 中持 续 表 达[ 。基 因敲 除 Nu r 2 ] r l的小 鼠中 脑 DA 能神 经 元 完 全 缺失 , 分 敲 除 Nu r 部 rl的 杂 合 子 小 鼠 中 脑 有 明 显 的 DA
多巴胺聚合机理

多巴胺聚合机理多巴胺是一种神经递质,能影响动物和人类的神经活动,在病理学和神经学中,它发挥着重要的作用。
在最近的研究中,科学家们发现,多巴胺不仅可以促进能量的摄取和分配,还可以发挥神经聚合的作用,因此,多巴胺聚合机理被广泛关注。
多巴胺聚合机理一般指多巴胺受体之间的联系,在此过程中,多巴胺牵引一个或多个同类的多巴胺受体,从而促进了神经元的发育与联系。
具体来说,多巴胺会结合到多巴胺受体上,使受体发生变化,影响其他神经元,从而促进神经聚合。
这一过程可分为以下几个步骤:第一,多巴胺与多巴胺受体结合,引发受体变异。
在细胞表面,多巴胺受体具有三类型,即dopamine receptor 1、dopamine receptor 2和dopamine receptor 3,当多巴胺结合到不同类型的受体上时,受体会发生变化。
第二,变异的受体会改变神经元的活动状态。
当多巴胺受体发生变化时,它会改变神经元的活动状态,影响其他神经元的活动,从而促进神经聚合。
第三,神经元之间发生联系。
神经元受到多巴胺受体发出的信号后,它们之间可以发生新的连接,从而形成新的神经联系,促进神经聚合。
此外,多巴胺聚合机理还可以影响动物的行为和学习能力,多巴胺会作用于大脑中的大量受体,从而影响动物的行为和学习能力。
例如,由于多巴胺聚合机理,动物可以适应环境,学习新的行为。
多巴胺聚合机理的研究也可以用于药物开发。
多巴胺聚合机理能够揭示大脑中多巴胺受体的变化情况,能够帮助人们了解神经元之间的互动情况,为药物开发提供重要的参考信息。
另外,多巴胺聚合机理也可能与精神疾病有关。
近年来,由于多巴胺受体的异常变化,可能与精神疾病的发生有关,因此,多巴胺聚合机理也被用于精神疾病的研究。
总之,多巴胺聚合机理是一个复杂的过程,多巴胺可以影响大脑中的多巴胺受体,从而影响神经元的活动,促进神经聚合,影响动物的行为和学习能力。
因此,多巴胺聚合机理不仅在病理学和神经学中具有重要意义,而且在药物开发和精神疾病研究中也可能发挥重要作用。
DKK3功能的研究进展及临床意义

DKK3功能的研究进展及临床意义郑健康;刘茂;苟峻琦;曾韡;朱筱;吕湛【摘要】Dickkopf(DKK)3是一种分泌性糖蛋白,是属于DKK相关蛋白家族成员之一,主要调节经典Wnt/β联蛋白信号通路.DKK3具有调控组织发育、凋亡、增殖、代谢和免疫反应等多种重要生物学功能.DKK3在心脏疾病、肿瘤、免疫调节通路、神经发生及代谢性疾病方面均有大量研究,尤其在心脏疾病及肿瘤等方面.DKK3的相关生物学功能及其与人类疾病的相关性,使其可以作为相关人类疾病诊断以及治疗的一个重要分子标志物,但其在疾病的发生、发展以及预后的具体作用机制仍不清楚,以DKK3为靶点治疗临床疾病将成为研究热点.【期刊名称】《医学综述》【年(卷),期】2018(024)018【总页数】5页(P3554-3558)【关键词】DKK3;肿瘤;心脏肥大;Wnt信号通路【作者】郑健康;刘茂;苟峻琦;曾韡;朱筱;吕湛【作者单位】川北医学院附属医院心内科,四川南充637000;川北医学院附属医院心内科,四川南充637000;川北医学院附属医院心内科,四川南充637000;川北医学院附属医院心内科,四川南充637000;川北医学院附属医院心内科,四川南充637000;川北医学院附属医院心内科,四川南充637000【正文语种】中文【中图分类】R44-6Dickkopf(DKK)3是属 DKK蛋白家族成员的一种分泌性糖蛋白,主要调节经典Wnt/β联蛋白(“Wnt”)信号通路[1]。
Wnt信号转导是一种重要的细胞通讯途径,介导胚胎发育、组织内稳态和疾病发病机制中各种细胞和分子活动[2]。
作为典型的DKK家族成员,DKK1已经被认为是Wnt信号的重要调节因子。
相反,作为Wnt信号转导的弱调节剂,DKK3的功能起始是未知的。
DKK3最初是作为肿瘤抑制剂而被人类所熟知,目前,DKK3已经被确立为许多癌细胞系中表达的潜在肿瘤生物标志物,并且是许多人类癌症中有效的肿瘤抑制剂[3]。
具有挑战性的帕金森氏法则
具有挑战性的帕金森氏法则科学家们可能已经发现,为什么只在有限的一段时间内的标准治疗帕金森氏病通常是有效的。
他们的研究可能会导致更好地理解许多脑疾病,具有挑战性的帕金森氏法则:多巴胺神经退行性疾病中的悲剧不是唯一的关键,参与调节大脑的活动。
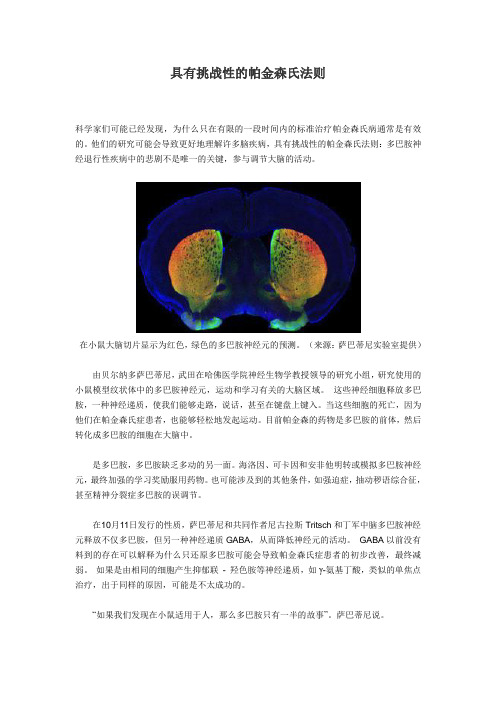
在小鼠大脑切片显示为红色,绿色的多巴胺神经元的预测。
(来源:萨巴蒂尼实验室提供)由贝尔纳多萨巴蒂尼,武田在哈佛医学院神经生物学教授领导的研究小组,研究使用的小鼠模型纹状体中的多巴胺神经元,运动和学习有关的大脑区域。
这些神经细胞释放多巴胺,一种神经递质,使我们能够走路,说话,甚至在键盘上键入。
当这些细胞的死亡,因为他们在帕金森氏症患者,也能够轻松地发起运动。
目前帕金森的药物是多巴胺的前体,然后转化成多巴胺的细胞在大脑中。
是多巴胺,多巴胺缺乏多动的另一面。
海洛因、可卡因和安非他明转或模拟多巴胺神经元,最终加强的学习奖励服用药物。
也可能涉及到的其他条件,如强迫症,抽动秽语综合征,甚至精神分裂症多巴胺的误调节。
在10月11日发行的性质,萨巴蒂尼和共同作者尼古拉斯·Tritsch和丁军中脑多巴胺神经元释放不仅多巴胺,但另一种神经递质GABA,从而降低神经元的活动。
GABA以前没有料到的存在可以解释为什么只还原多巴胺可能会导致帕金森氏症患者的初步改善,最终减弱。
如果是由相同的细胞产生抑郁联- 羟色胺等神经递质,如γ-氨基丁酸,类似的单焦点治疗,出于同样的原因,可能是不太成功的。
“如果我们发现在小鼠适用于人,那么多巴胺只有一半的故事”。
萨巴蒂尼说。
多巴胺神经元的详细视图令人惊讶的GABA的故事在萨巴蒂尼实验室开始了一系列实验,看看会发生什么,当细胞释放多巴胺。
科学家利用光遗传学,功能强大的技术,它依赖于遗传操作选择敏感细胞点燃。
在培养皿中,研究人员检测了小鼠脑组织设计,显示多巴胺神经元的活动。
通常在此类实验中,其他神经递质会被阻止,为了突出多巴胺,但在萨巴蒂尼实验室的博士后研究员,决定Tritsch,而不是在自然的状态下保持细胞。
小鼠胚胎中脑神经干细胞分离、培养及分化

小鼠胚胎中脑神经干细胞分离、培养及分化刘兵;刘洪涛;戴冀斌;彭超华;黄娟【摘要】目的:探讨小鼠胚胎中脑分离神经干细胞的体外培养方法,以获取高纯度的神经干细胞,为神经干细胞的深入研究提供试验材料。
方法:无菌条件下分离孕12~13 d小鼠胚胎中脑曲,制成单细胞悬液,碱性成纤维生长因子(bFGF)和B27存在的培养基中培养扩增,通过免疫细胞化学染色鉴定神经干细胞及子代细胞的分化方向,流式细胞术检测TH阳性神经元比例。
结果:培养的部分细胞体外分裂增殖,同时表达神经干细胞特异性抗原nestin,并向神经细胞和胶质细胞分化并经流式细胞仪检测自然分化为多巴胺能神经元的比例为3.25%。
结论:小鼠胚脑中脑存在具有多分化潜能的神经干细胞,它们能在体外稳定培养、传代和分化。
【期刊名称】《长江大学学报:医学卷》【年(卷),期】2006(000)012【总页数】4页(P)【关键词】神经干细胞;培养;分化;中脑【作者】刘兵;刘洪涛;戴冀斌;彭超华;黄娟【作者单位】长江大学医学院;武汉大学医学院;武汉大学医学院;湖北荆州;湖北荆州;湖北武汉【正文语种】中文【中图分类】Q813神经干细胞(neural stem cells, NSCs)是一类广泛存在于胚胎及成体中枢神经系统的早期未分化细胞,被认为是神经系统的“发源地”[1]。
应用神经干细胞移植的方法修复神经系统脑的损伤与治疗人类神经退行性疾病中更显示出其优越性,其中最具有代表性的就是怕金森病,然而,这种方法在患者中广泛应用的障碍就是胚脑移植的问题。
本试验对小鼠胚胎中脑神经干细胞的分离和培养进行了尝试,为神经干细胞的进一步研究奠定基础。
1 材料与方法1.1 材料1) 实验动物孕12~13 d昆明小鼠(E12~13 d,SPF级),由武汉大学医学院实验动物中心提供。
2) 试剂 DMEM/F12培养基,特优级胎牛血清(FBS),B27均购自GIBCO公司;碱性成纤维生长因子(bFGF)购自Peprotech公司;胰酶(Trypsin)、DNA酶1(DNase1)、左旋多聚赖氨酸(PLL)和DAPI购自SIGMA公司。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成绩中国农业大学课程论文(2011-2012学年秋季学期)论文题目:小鼠中脑多巴胺神经元发育起源及命运决定课程名称:发育生物学任课教师:周波班级:生化082学号:0807090106姓名:贾晓波小鼠中脑多巴胺能神经元发育起源及命运决定的分子机制贾晓波(生物学院生化082 0807090106)摘要中脑多巴胺能神经元在哺乳动物中枢神经系统中有着极其重要的生理功能,其功能包括随意运动、认知、情感及奖赏等方面,多巴胺能神经元的特异性缺失将会造成巨大的损害,其中就包括帕金森症。
一方面明确多巴胺能神经元的发育及起源的分子机制对于了解神经递质系统是一件重要的工作,另一方面,还可以为这些多巴胺能神经元缺失的疾病的治疗带来福音。
关键词胚胎发育;中脑;转录因子;命运决定1中枢神经系统中的多巴胺能神经元中枢神经系统递质表型的发育是大脑形成完整的、具有正常生理功能神经环路过程中的重要一环。
中枢神经系统包括大量形态不同、类型各异的神经元,同时它们所产生和释放的神经递质也有所不同,在一定程度上决定了神经系统功能的多样性和复杂性,最终导致了神奇的神经系统功能。
多巴胺(dopamine,DA)是儿茶酚胺类神经递质之一,它在哺乳动物中枢神经系统中有着极其重要的生理功能,包括运动的整合、神经内分泌激素释放的调节、认知、情感、奖赏、意识和记忆。
特异性分泌多巴胺神经递质的神经元成为DA神经元。
多巴胺能神经元主要源自中脑。
在小鼠的中脑,有3个DA神经元的核群:黑质(substantia nigra,SN)致密带(A9,有近10000个DA神经元)、腹侧被盖区(ventral tegmental area,VTA,A10,有近25000个DA神经元)和红核后区(retrorubral field ,RRF,A8)。
其他的DA神经元群分布于视丘下部的中间未定带(medial zona incerta)(A13,有近900个DA神经元)等。
位于黑质区的DA神经元发出的上行纤维投射至纹状体(尾核及壳核;中脑纹状体通路,mesostriatal pathway)释放DA,其退行性病变可造成纹状体内多巴胺释放量的减少,因而成为帕金森症(Parkinson’sdisease,PD)运动障碍产生的直接原因。
腹侧被盖区内DA神经元集中投射至伏隔核的边缘叶(中脑边缘叶通路,mesolimbic pathway),它的过度活跃则与精神分裂症和药物成瘾有关。
黑质和红核去DA神经元投射至大脑前额叶皮层的通路则与情绪和动机有关,而中间未定带的DA神经元则参与调节内分泌的过程。
了解中脑DA神经元的起源与发育过程,将对PD等DA神经元退行性疾病的治疗带来新的曙光。
2中脑发育:中脑和后脑组织结构形成神经元命运的决定和分化是一个级联过程,目前认为,首先是神经前体细胞产生神经元前体细胞和胶质前体细胞,前者有在不同诱导信号的作用下,分化成各种递质表型的神经元类型,不同类群的神经元在位置信号的诱导下沿着神经管的背腹轴和前后轴的精确排布并各自特化和分化。
DA神经元发源于腹侧神经管与底板的相连处,当小鼠胚龄为E8.5~E10.5时,一组DA神经前体细胞在中脑后端的区域内增殖,最后这些细胞逐渐退出细胞周期,接受和相应各种早期发育信号,并迁移至中脑前端(小鼠中E10.5~E12.5),然后逐步分化为成熟的DA神经元表型,生长出轴突与树突,并与靶区形成一系列链接,这个过程可以从E12.5一直持续到出生时。
当DA神经元表达分子标记物酪氨酸羟化酶(tyrosine hydroxylase,TH)时,表示其递质表型分化成熟。
E14以后DA神经元的投射逐步建立、成熟并形成神经环路。
2.1组织中心区的发育神经管区室化时期是中脑DA神经元发育的关键时期之一,在该时期中脑和后脑组织结构形成(mesencephalic region,MMR),在中脑和后脑交界处(mesencephalic boundary,MMB)的局部组织被成为组织中心区(isthmus organizer,Iso),该区是隔离中后脑的边界,更重要的是,它同时又是指导中后脑发育的信号集中地。
再次中心区分泌出的信号分子和神经管底板分泌出的信号分子共同作用,可使一部分神经前体细胞变成DA神经元前体细胞,走向DA神经元分化之路。
来自遗传学的证据表明,Iso的形成与一系列调控步骤密切相关。
追溯到胚胎中后脑泡的形成过程中,E8表达的同源框转录因子(homebox transcription factor)OTX2和GBX2参与限制中后脑组织结构形成,OTX2表达在中脑而GBX2表达在后脑,它们相互影响,决定了中后脑的边界并形成组织中心区(Iso),OTX2及GBX2的突变小鼠直接证明了这点,OTX2敲除的小鼠缺乏前脑及中脑,GBX2敲除的小鼠则后脑前端发育缺失且中脑后端扩展。
特别是OTX2,它可能在中脑早期命运决定中起作用,而且调节Shh(sonic hedegehog)与FGF8(fibroblast growth factor-8)在Iso附近的表达,2008年Omodei等的研究显示OTX2还能特异性的促进DA神经元的增殖。
Iso的起始形成还与形态发生原FGF8密切相关。
已有实验表明,早期分泌因子Wnt1(表达起始于E8)表达与中脑和Iso区,它是中脑和Iso形成所需要的,Wnt1基因敲除导致小鼠中脑、后脑和Iso组织结构缺失。
由此可见,Wnt1对于中脑的发育起着非常重要的作用,并且Wnt1表达的时辰与Shh和FGF8相近,但是与FGF8不同的是,Wnt1并无独立诱导出中后脑结构的能力,但是却能诱导并维持FGF8在Iso的表达,研究表明,分泌因子Wnt3a和Wnt5a在DA神经元的发育中发挥作用,Wnt3a可以促进DA神经前体细胞增殖,但不能增加TH阳性细胞数,而Wnt5a可以增加DA前体细胞分化成DA神经元表型的细胞数。
2.2多巴胺能神经元的诱导形成Iso之后,来自底板及顶板的信号将中脑与间脑分为背腹两侧,各有其不同的发育信号级联。
研究表明,两个重要的分泌信号分子对DA神经元的产生起关键作用,即表达在神经管腹侧的Shh和定位于组织中心区的FGF-8。
在胚胎早期(E7~E8.5),FGF8与Shh就已开始表达,而到E13左右终止表达,两者的联合作用可以在神经管的多个区域诱导出DA神经元,为DA神经元早期发育所必须。
在Shh存在时,异位表达FGF8可以诱导出中后脑结构,FGF8基因敲除的小鼠则缺失大部分的中后脑组织,因而无法形成DA神经元。
2009年,Joksimovic等发现Wnt和Shh信号的相互作用来决定中脑和后脑底板细胞的增殖,Shh的作用为抑制DA神经前体细胞的增殖和神经发生,而Wnt信号通路则是拮抗Shh作用促进DA神经元生成的充分必要条件。
多种转录因子在不同时空对DA神经元的发育起不同作用。
转录因子在DA 神经元发育过程中的表达有着明显的时序性。
早期出现的转录因子对中后脑细胞的存活、组织结构的维持和细胞命运的决定起关键作用,而在中后脑早期表达的转录因子(E8~E9)除OTX2和GBX2以外,还有同源框转录因子En1、En2、Lmx1b、含配对盒的转录因子Pax2、Pax5、Pax8(E7.5~E8.5)。
它们表达区域多数重叠,在中脑与后脑都有表达。
Pax2是最早表达的基因,En1和Wnt1紧接着也开始出现,随后Pax5和En2表达,Pax8最后一个出现,这是Pax2的表达区域已经被非常特异的限制在中后脑交界处。
2007年Ferri等证明了Foxa1、Foxa2参与了DA神经元发育的多个过程,Foxa1/2功能缺失证明其在DA神经前体细胞的增殖中起重要作用,还可诱导随后DA神经元命运决定的Nurr1等的表达。
这些证据表明,在发育过程中转录因子的表达有着严格的时序性和空间限制,而且随着时间推移,基因的表达区域表达量都会发生明显的变化。
3多巴胺神经元命运决定的转录因子中脑DA神经元表达分子标记TH显示其已退出了细胞周期,分出成熟的DA 神经元。
在小鼠中TH从E11.5开始表达,利用更灵敏的检测方法可见在E10左右已有少量TH开始表达,这表明DA神经元的分化成熟是一个不同步的过程,它们的出现是逐步进行的,而大量成熟DA神经元的出现约在E11.5。
已知对中脑DA神经元发育起直接调控作用的转录因子有Nurr1、Pitx3和前面所述的Lmx1b、En1/2.Nurr1为中脑DA神经元产生所必需。
Nurr1是激素类核受体家族成员之一,因与其作用的配体尚未明确故属于孤核受体,它既可以以单核形式发挥功能也可以同RXR星恒异聚体起作用。
Nurr1起始表达于E10.5,被认为表达在未成熟的有丝分裂后DA神经元前体细胞中。
Nurr1缺失并不影响中期DA神经元前体细胞的发育,因为在E15.5上能观察到DA神经元前体细胞,并且DA神经元早期发育的许多标记分子表达正常,但在这些DA神经元前体细胞发育过程中,TH 不能被诱导表达,且在出生后,小鼠中脑DA神经元则全部消失,多种与DA合成、转运和储存相关的基因也都缺失。
此外,在神经干细胞中表达Nurr1,可以增加Shh和FGF8诱导的TH阳性细胞数,但是过度表达Nurr1并不影响与DA 神经元发育相关的其他基因的表达。
已有资料也表明,Nurr1可以以单体的形式直接结合到TH上游启动子中,激活TH在DA神经元中的表达。
此外,如果将正常腹侧中脑组织与Nuur1-/-缺失的细胞共培养,则可以诱导出TH的表达,表明可能有其他不通过Nurr1的激活TH表达的机制。
Nurr1除了调节DA合成外,还在营养因子的表达调控中发挥作用。
Nurr1缺失使得DA不能合成,但仅仅这个原因似乎不足以成为DA神经元丢失的理由,推测Nurr1基因缺失可能导致那些调节DA神经元存活的信号通路功能障碍。
Pitx3从E11.5起特异性地表达于中脑DA神经元中。
Pitx3自发突变小鼠中,Pitx3阳性的DA神经元在小鼠出生后死亡,而且这些DA神经元的丢失是个渐进的过程,突变的小鼠出生后,首先黑质致密带的DA神经元缺失,到出生后一天,在黑致密带大约有90%TH阳性的DA神经元缺失,到P21,部分腹侧被盖区的DA神经元也开始消失,而到了P100,该区域大约只有一半DA神经元还存活这。
这种发育跟进行性DA神经元死亡的PD中DA神经元的退行性病变死亡有一定的相似之处。
利用遗传学操作分别敲除Lmx1b、Pitx3和Nuur1基因后的实验结果揭示了它们三者之间的关系:Lmx1b的缺失可以使Pitx3的表达大幅减少,但不影响Nurr1和TH的表达,尽管如此,这些TH阳性的神经元在胚胎发育的过程中仍旧逐渐丢失。
