DNS法测定纤维素酶活实验方法总结及优化方案
纤维素酶酶活测定

纤维素酶活测定方法一、原理纤维素酶能将纤维素降解成纤维二糖和葡萄糖,具有还原性末端的纤维二糖糖和有还原基团的单糖在沸水浴条件下可与DNS试剂发生显色反应。
反应颜色强度与酶解产生的还原糖量成正比,而还原糖量又与反应液中的纤维素酶的活力成正比。
酶活定义纤维素酶活力单位是指55℃、pH5.0的条件下,以每分钟催化羧甲基纤维素钠水解生成1μmol还原糖所需的酶量定义为一个酶活力单位U。
二、实验试剂羧甲基纤维素钠(聚合度1700-2000),内切纤维素酶(苏柯汉)50mmol NaAC-HAC、DNS试剂三、实验仪器容量瓶(1000ml ×2、500 ml×3、100 ml ×4、50ml×4 ml)、移液器、烧杯(500ml×3、50ml×3)、具塞试管、电热套、水浴锅、分光光度计、pH计、电子天平四、标准曲线的绘制五、酶活测定由于苏柯汉给定的pH范围为4.8-5.2,故选用pH 5.0的50mmol NaAC-HAC缓冲液测定纤维素酶酶活。
1、样品的制备CMC-Na溶液的制备:用pH 5.0的50mmol NaAC-HAC缓冲液配置0.5%的CMC-Na (羧甲基纤维素钠)溶液,准确称量CMC-Na 0.05g,精确至0.001g,溶于蒸馏水中,45℃水浴锅中搅拌溶解,冷却后定容至100ml。
纤维素酶液的制备:准确称取纤维素酶,精确到0.001g。
用50mmol NaAC-HAC pH5.0的缓冲液配置成适当的浓度10000倍,保证吸光度在0.2-0.6之间。
2、DNS法测酶活:取1.8ml 0.5% CMC-Na的溶液于25ml 具塞刻度试管中,55℃预热10min左右,加入0.2ml 适当稀释的酶液,于55℃水浴锅中保温30min后,然后加2ml DNS,混匀,沸水浴5min,冷却至室温,定容到25ml。
混匀测OD540nm。
空白对照用酶活的酶液作对照。
DNS法测定纤维素酶活实验方法总结及优化方案
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
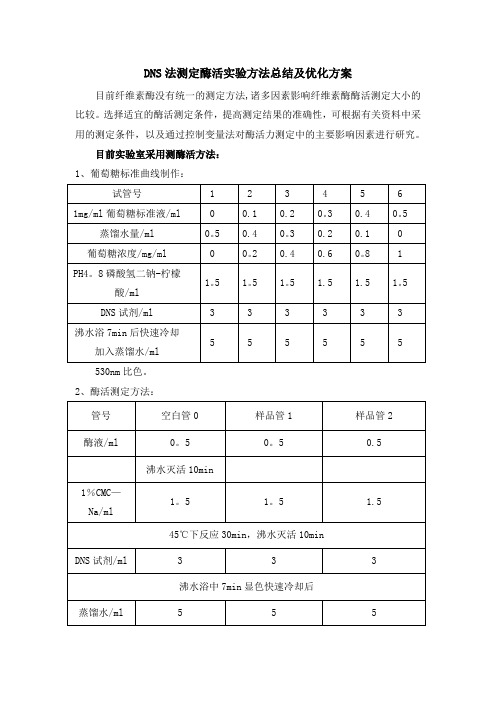
1、葡萄糖标准曲线制作:
530nm比色。
2、酶活测定方法:
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致.
单位酶活的计算:
n:稀释倍数;
K:曲线斜率;
T:反应时间,min;
1000:mg换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵
工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法.。
纤维素酶活力的测定

实验二十纤维素酶活力的测定一、目的学习和掌握3,5-二硝基水杨酸(DNS)法测定纤维素酶活力的原理和方法,了解纤维素酶的作用特性。
二、原理纤维素酶是一种多组分酶,包括C 酶、C 酶和 |?-葡萄糖苷酶三种主要组分。
其中C1 X 1酶的作用是将天然纤维素水解成无定形纤维素,C 酶的作用是将无定形纤维素继续水解成X纤维寡糖,|?-葡萄糖苷酶的作用是将纤维寡糖水解成葡萄糖。
纤维素酶水解纤维素产生的纤维二糖、葡萄糖等还原糖能将碱性条件下的3,5-二硝基水杨酸(DNS)还原,生成棕红色的氨基化合物,在540nm波长处有最大光吸收,在一定范围内还原糖的量与反应液的颜色强度呈比例关系,利用比色法测定其还原糖生成的量就可测定纤维素酶的活力。
三、实验材料、主要仪器和试剂1.实验材料(1)纤维素酶制剂 500mg(2)新华定量滤纸 50mg / 份 4(3)脱脂棉花 50mg / 份 4(4)羧甲基纤维素钠(CMC) 510mg(5)水杨酸苷 500mg2.主要仪器(1)722 型或其他型号的可见分光光度计(2)恒温水浴 2 台(3)沸水浴锅(4)电炉子(5)剪刀(6)万分之一分析天平(7)恒温干燥箱(8)冰箱(9)试管架(10)胶头滴管(11)具塞刻度试管 20mL24(12)移液管或加液器 0.5 mL3;2mL7(13)容量瓶 100 mL6;1000 mL3(14)量筒 50 mL2;100 mL1;500 mL1(15)烧杯 100 mL6;500mL3;1 000 mL13.试剂(均为分析纯)(1)浓度为 1mg/mL的葡萄糖标准液将葡萄糖在恒温干燥箱中105℃下干燥至恒重,准确称取100mg 于100mL小烧杯中,用少量蒸馏水溶解后,移入100mL容量瓶中用蒸馏水定容至 100mL,充分混匀。
4℃冰箱中保存(可用 12~15 天)。
(2)3,5-二硝基水杨酸(DNS)溶液准确称取DNS 6.3g于500mL大烧杯中,用少量蒸馏水溶解后,加入2mol/L NaOH 溶液 262mL,再加到 500mL含有 185g酒石酸钾钠(C H O KNa ! 4H O,MW=282.22)的热4 4 6 2水溶液中,再加5g结晶酚(C H OH,MW=94.11)和5g无水亚硫酸钠(Na SO ,MW=126.04),6 5 2 3搅拌溶解,冷却后移入1 000mL容量瓶中用蒸馏水定容至1 000mL,充分混匀。
两种常用纤维素酶活力测定方法滤纸酶活-CMC酶活

检测纤维素酶酶活力—滤纸酶活力(F PA)滤纸酶活力代表了纤维素酶的三种酶组分协同作用后的总酶活。
采用3,5一二硝基水杨酸法测定酶活:(简称DNS法)1、原理:纤维素经纤维素酶水解后生成还原糖,还原糖能将3,5一二硝基水杨酸中硝基还原成氨基,溶液变为橙色的氨基化合物,即:3一氨基一5二硝基水杨酸,在一定的还原糖浓度范围内,橙色的深度与还原糖的浓度成正比,据此可以推算出纤维素酶的活力。
2、采用的滤纸酶活单位定义:滤纸酶活反映了纤维素酶的3种水解酶,即内切型葡聚糖酶、外切型葡聚糖酶和β葡聚糖苷酶组成的诱导复合酶系的协同水解纤维素能力。
是该菌株整个纤维素酶系的酶活力水平的综合体现。
代表了纤维素酶的三种酶组分协同作用后的总酶活。
在此滤纸酶活单位定义为:以滤纸为底物,在一定反应条件(pH4.8,50℃,恒温lh)下,以水解反应中,1ml纤维素酶液1mi n催化纤维素生成lu g葡萄糖为1个滤纸酶活单位,以U表示。
3、滤纸酶活力(F PA)的测定:①取0.5ml适当稀释的酶液,加入PH值为4.8,0.1mol/L的乙酸-乙酸钠缓冲液l ml或柠檬酸-柠檬酸钠缓冲液lml;②再加入50±0.5mg滤纸(1cmx6c m)一条,于50℃保温酶解反应1小时,(先预热5分钟);③加入DNS显色液3ml(标准曲线用量是1.5ml),放入已沸腾的水中沸水浴l Omin,流水冷却后在540nm下测吸光度;④同时用100℃煮沸lOmi n后失活的酶液做对照,扣除本底;⑤根据吸光度从葡萄糖标准曲线中查出相应的葡萄糖含量,根据生成的葡萄糖克数计算出酶活值。
滤纸酶活按下面公式计算:X=(WxNxlO OO)/(TxM)X:为滤纸酶酶活力,单位U/mL。
DNS法测定纤维素酶活力最适条件研究

第26卷 第3期河南师范大学学报(自然科学版)V ol.26 N o.3 1998年8月J ou rnal of H enan N or m al U niversity(N atu ral S cience)A ug.1998 DN S法测定纤维素酶活力最适条件研究王 琳 刘国生 王林嵩 张志宏a 侯进怀 郭惠敏b (河南师范大学生物系,453002,新乡;a新乡市制药股份有限公司;b安阳市环保监测站;第1作者41岁,女,实验师)摘 要 鉴于纤维素酶研究和生产中,纤维素酶活力测定和酶活力单位的表示方法很不统一的现象,本文研究和分析了3,5-二硝基水杨酸法测定羧甲基纤维素酶糖化力的实验条件,如:温度、pH、酶促反应时间、DN S显色时间、波长等.实验表明:在50℃,pH4.6条件下酶促反应时间5m in,DN S显色5m in,于490nm处测定OD值比较适宜.关键词 纤维素酶活力;3,5-二硝基水杨酸(DN S);羧甲基纤维素(C M C)分类号 Q55α纤维素酶(Cellu lase)是一种多组分的复合酶,不同来源的纤维素酶其组成及各组分比例有较大差异,同时纤维素酶作用的底物也比较复杂,致使纤维素酶活力的测定方法很多,且方法复杂而不统一[1,2,3].常用的方法有:C M C糖化力法、C M C液化力法、滤纸糖化力法、滤纸崩溃法和棉花糖化力法等.国内许多单位分别采用了以上各种方法并进行了种种修改,使测定的方法更加多样化,造成不同产品,不同结果之间无法相互比较的局面.在上述测定方法中,C M C糖化力主要代表外切Β-1,4葡聚糖苷酶和内切酶的活力总和,在研究和实际生产中应用比较普遍.因此本文主要对C M C糖化力方法进行实验研究,以期引起国内同行的重视,达到在测定方法与活力表示上的统一和便于相互比较和交流的目的.1 材料的方法1.1 材料 纤维素酶由河南省生物工程中心提供.1.2 试剂 1.2.1 底物溶液:准确称取0.625g羧甲基纤维素钠盐,溶于100m l醋酸钠缓冲溶液(0.2m o l L,pH4.6),加热搅拌使之溶解.1.2.2 3,5-二硝基水杨酸显色剂(DN S显色剂):称取10g3,5-二硝基水杨酸溶于蒸馏水中,加入20g氢氧化钠、200g酒石酸钾钠和500m l水,加热溶解后再加入重蒸酚2g、无水亚硫酸钠0.5g,待全部溶解后冷却,定容至1000m l,贮于棕色瓶中,放置一周后使用,用之前过滤.1.2.3 标准葡萄糖溶液:用蒸馏水溶解27.0m g葡萄糖定容到25m l.1.2.4 酶溶液:用0.2m o l L,pH4.6醋酸钠缓冲溶液溶解酶制剂,配成一定浓的酶溶液.测α文稿收到日期:1998—02—16.定还原糖与DN S 反应产物最大吸收波长、酶促反应最适pH 、酶促反应提了适温度和酶促反应时间时所用的酶量都相同.1.3 仪器 日本日立公司330分光光度计.1.4 DN S 法测定纤维素酶活力 方法参见文献[3],[4],并有改进.1.4.1 标准曲线的绘制取5支带有20m l 刻度的试管,按下表量取试剂:试管号标准葡萄糖溶液 m l 醋酸钠缓冲溶液 0.2mo l L -1,pH 4.6试管中葡萄糖量 OD 490 Λmo l 105.0020.44.62.430.64.43.640.84.24.851.04.06.0每管各加1m l 2m o l L 氢氧化钠溶液和2m l DN S 显色液,摇匀后置于沸水浴中加热,5m in 后流水冷却,蒸馏水定容至20m l ,摇匀后以0号管为对照于490nm 处测定各管的OD 值.以葡萄糖的Λm o l 数为横坐标,OD 值为纵坐标,绘制标准曲线.1.4.2 纤维素酶活力测定:取3支带有20m l 刻度的试管,1支管作空白对照,2支管作平行样品管.每支样品管中加1m l 酶溶液,置于50℃水浴锅中预热2m in ,然后在3支试管中分别加入4m l 已预热至50℃的底物溶液,准确计时5m in 取出,每管立即分别加入1m l 2m o l L 氢氧化钠溶液和2m l DN S 显色液,摇匀后在对照管中再加入1m l 酶液.将3支试管放入沸水浴中,5m in 后立即取出,流水冷却,用蒸馏水定容至20m l ,于490nm 处测OD 值.酶活力计算:从标准曲线中查出葡萄糖Λm o l 数,酶活力(u g )=葡萄糖量(5×E w ).其中:5为保温时间(酶与底物作用时间,m in );E w 为1m l 酶液中含有的酶量(g );u 是指在特定条件下,每分钟催化纤维素水解成1Λm o l 葡萄糖的酶量.2 结果与讨论2.1 还原糖与DN S 反应产物的最大吸收波长DN S 测定的是酶对C M C 的糖化力,其水解产物如纤维二糖,葡萄糖是还原糖,能将3,5-二硝基水杨酸(DN S )还原为棕红色的氨基化合物,在一定浓渡范围内,还原糖的量与该物质溶液颜色的深浅成比例,可用分光光度计进行测定.该方法可表示纤维素酶的总活力.用DN S 法测定还原糖的方法中所采用的波长有550nm [5],540nm [6],520nm [4],490nm [3]等.波长不同则OD 值不同,据此计算出的酶活力也差别较大.这是不同论文之间无法相互比较的原因之一.我们对DN S 与还原糖反应产物的光吸收特性进行了分析,其460~620nm 光吸收曲线如图1所示.从图1曲线可知,该棕红色的氨基化合物在540~470nm 间都有较大的光吸收值,其最大吸收峰480nm 处,文献中采用550nm 、540nm 和520nm 波长与最大吸收峰偏离较大,相对灵敏度就较低,而如果直接于480nm 处测定OD 值,其数值波动较大,重复性差,且DN S 显色液在此处也有较大吸收值,故我们认为选取490nm 作为测定波长是比较合适的.76第3期 王 琳等:DN S 法测定纤维素酶活力最适条件研究图1 DN S 与还原糖反应产物的光吸收曲线图 图2 纤维素酶活大小与pH 值关系曲线2.2 酶促反应最适pH在纤维素酶系中,作用于底物的最适pH 大多在4.0~5.5[7]之间,酶促反应pH 值较为集中但又不统一,有的为pH 4.6[3],有的为pH 4.5[5],有的为pH 4.4[7].利用河南省生物工程中心提供的水霉纤维素酶样品,测定其酶活性与pH 值之间的关系,结果如图2所示该酶样品催化底物的最适pH 值4.6,考虑别多数纤维素酶的pH 在4.0~5.0之间,且多在4.5~4.6左右,为统一和便于相互比较,建议采用pH 4.6测定酶活.2.3 酶促反应最适温度用DN S 法测纤维素酶活时,发现不同的厂家和单位所采用的酶促反应温度差别很大.例如:有的采用50℃[4,6],有的采用45℃,还有的采用40℃[5]等.不同酶促反应温度所测定的酶活差异甚大,又是导致不同数据之间相互比较和交流困难的另一重要原因.纤维素酶活随温度变化如图3.图3 纤维素酶活与反应温度曲线 图4 还原糖生成量和纤维素酶活力与酶促反应时间曲线从图3中可知,在36~58℃之间相对酶活随着温度升高而升高,当温度在58~62℃之间时,相对酶活性没有明显变化,曲线近似呈水平状态,在40℃、45℃、50℃条件下,其相对酶活分别为56%,70%,80%,而当温度大于58℃以上时相对酶活不再升高.其原因可能是温度偏高造成部分酶失活.考虑到大多数情况下纤维素酶作用底物的最适温度在45~65℃之间,所以我们认为用DN S 法测定纤维素酶活时,酶促反应温度以50℃为宜,能够更真实地反映酶86河南师范大学学报(自然科学版) 1998年2.4 酶促反应时间目前,在用DN S 法测定纤维素酶活的方法中酶与底物作用时间多采用30m in[4,5],15m in [8]或10m in ,也有用5m in [3]的.时间过长或过短都不能准确反映样品的酶活力大小.在其他条件不变时.酶活力大小与酶促反应时间的关系如图4所示.图4结果表明,酶促反应1m in 后,酶作用底物产生的还原糖量随时间延长呈直线上升,5m in 后还原糖量的增加变得比较缓慢,10m in 后,曲线呈现水平状态,还原糖量不再增加.同时从相对酶活曲线可以看出,随着时间的延长相对酶活逐渐降低,在5m in 时其相对酶活降低了30%,到10m in 时相对酶活下降了50%,此后相对酶活无大变化.由此可见,在1~5m in 内,还原糖量变化曲线呈直线上升趋势,其斜率可以代表酶促反应的初速度,同时在5m in 时,相对酶活为70%,能较准确地反映酶的活力大小所以酶促反应时间以5m in 比较适宜.总之,通过对上述条件的分析,在用DN S 法测定纤维酶活力时,我们认为在50℃,pH 4.6条件下,酶促反应时间5m in ,ND S 显色5m in ,于490nm 处测OD 值比较适宜.参 考 文 献1 Gho se T K ,Pathak A N ,B isaris V S .Sympo sium on Enzym atic H ydro lysis of Cellulase (eds .Bailey ,M etal ),Sitra ,A ulanko ,F land ,1975,1112 Gok syr J ,E rik sen J .Econom ic M icrobi o logy ,vo lum e 5:M icrobial Enzym es and B i oconversi ons (e d .Ho se A .H .),L ondon ,N ew yok ,To routo ,Sydney ,San F rancisco ,1980,5:301~3063 B .施特马赫著,钱嘉渊译.酶的测定方法.北京中国轻工业出版社,1992.103~1774 北京大学生物系生化教研室编.生物化学实验指导.北京:人民教育出版社,1980.22~245 中山大学生物系生化微生物教研室.生化技术导论.北京:人民教育出版社,1979.61~636 朱 俭等.生物化学实验.上海:上海科学技术出版社,1981.1~47 张树政等.酶制剂工业.北京:科学出版社,1984.595~6238 曲音波等.曲霉的纤维素酶抗降解物阻遏突变株的选育.真菌学报,1984,3(6):238~432The Opti m a l Cond ition s for Cellula se Activ ity M ea sure m en t with D NSM ethodW ang L in L iu Guo sheng W ang L insong Zhang Zh ihong Hou J inhuai Guo H ui m in(D epartm ent of bi o logy ,H enan N o r m al U niversity ,453002,X inxiang )Abstract In the studying and p roducing of cellulase ,the m ethod of cellulase activity m easurem ent and enzym e activity exp ressi on is very diverse .So in th is paper ,the conditi ons fo r carboxy -m ethy cello se (C M C )enzym e activity m easurem ent w as studied w ith 3,5-dinitro salicylic acid (DN S )m ethod ,T he re 2sults show as fo llow s :the app rop riate enzym e reacti on conditi ons are pH 4.6,50℃and 5m iniutes ,the p roper co lo r -reacti on is 5m iniutes and the op ti m al abso rb w avelength is at 490nm .Key words cellulase activity ;3,5-dino tro salicylic acid ;carboxym ethylcellulo se 96第3期 王 琳等:DN S 法测定纤维素酶活力最适条件研究。
DNS法测定纤维素酶活实验方法总结及优化方案
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
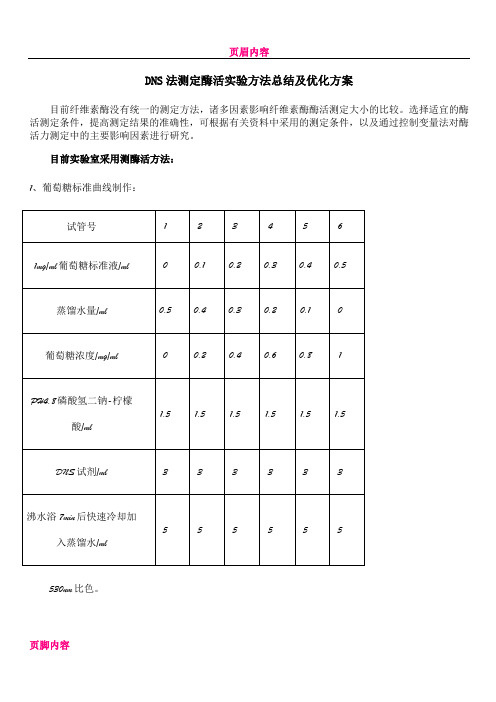
1、葡萄糖标准曲线制作:
530nm比色。
2、酶活测定方法:
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致。
单位酶活的计算:T n k OD ml U 1000
1
)/(⨯⨯⨯=酶活力 n :稀释倍数;
K:曲线斜率;
T:反应时间,min;
1000:mg换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法。
纤维素酶活力的测定实验报告
生物化学实验报告题目:纤维素酶活力的测定-----3、5—二硝基水杨酸法姓名:余振洋学号:200900140156 系年级:09级生科3班同组者:张刚刚时间:2011/4/22一、【实验目的】学习和掌握3、5—二硝基水杨酸(DNS)法测定纤维素酶活力的原理和方法,了解纤维素酶的作用特性。
二、【试验原理】纤维素酶水解纤维素,产生纤维二糖、葡萄糖等还原糖,能将3、5-二销基水杨酸中销基还原成橙黄色的氨基化合物,在550nm波长处有最大光吸收,在一定范围内还原糖的量与反应液的颜色强度呈比例关系,利用比色法测定其还原糖生成的量就可测定纤维素酶的活力。
酶活力也称为酶活性,是指酶催化一定化学反应的能力。
酶活力的大小可用在一定条件下,酶催化某一化学反应的速度来表示,酶催化反应速度愈大,酶活力愈高,反之活力愈低。
测定酶活力实际就是测定酶促反应的速度。
酶促反应速度可用单位时间内、单位体积中底物的减少量或产物的增加量来表示。
在一般的酶促反应体系中,底物往往是过量的,测定初速度时,底物减少量占总量的极少部分,不易准确检测,而产物则是从无到有,只要测定方法灵敏,就可准确测定。
因此一般以测定产物的增量来表示酶促反应速度较为合适。
实验中定义:1mg酶每分钟水解生成1微克葡萄糖的量定义为1个酶活力单位。
N×OD值对应的葡萄糖量纤维素酶活力单位=——————————————30×LN——酶液的稀释倍数30——糖化所用时间L——反应酶液毫升数三、【试验器材】比色管10支,5ml移液管,移液枪,500ml大烧杯,水浴锅,电炉,搅拌振荡器,722 型或其他型号的可见分光光度计。
四、【实验试剂】1.酶液:将0.05g酶溶解定容至50ml,从中取出1ml再定容至100ml,待测(用PH4.5乙酸—乙酸钠缓冲溶液配制)。
2.0.1mol/L PH4.5的乙酸-乙酸钠缓冲溶液。
3.3、5—二硝基水杨酸显色液:称取10克3、5-二硝基水杨酸,溶入蒸馏水中,加入20克分析纯氢氧化钠,200克酒石酸钾钠,加水500毫升,升温溶解后,加入重蒸酚2克,无水亚硫酸钠0.5克。
dns法测定纤维素酶活力原理
dns法测定纤维素酶活力原理纤维素酶,这个名字听起来就像高大上的科学词汇,其实它在咱们的日常生活中可是大有来头。
想想看,咱们的衣服、纸张,甚至一些食品里,都和它有着千丝万缕的联系。
说白了,纤维素酶就是一种能把纤维素这个“大块头”分解成小分子的“超级英雄”。
要不然,这些纤维素可真是“难啃的骨头”,光靠我们自己的牙口可没法啃下去。
所以,这种酶的活力就显得尤为重要了。
现在,咱们来聊聊用DNS法测定纤维素酶活力的原理,听起来有点复杂,其实也并不难,咱们慢慢道来。
DNS法其实就是一种颜色变化法。
嘿,你没听错,颜色变化!你想啊,咱们日常生活中,很多东西都是通过颜色来判断的,比如熟不熟、甜不甜,甚至是“这件衣服合不合适”。
所以,这个方法就是借助颜色变化,来观察纤维素酶的活力到底有多强。
这里的“DNS”指的是一种化学试剂,名字比较长,不想说了,简单点,叫它“变色剂”就行。
这个“变色剂”能跟分解后的纤维素反应,形成一种深红色的物质。
就像调色板上的颜色,越深的颜色,说明分解得越彻底,酶的活力就越强。
这个过程是怎么发生的呢?想象一下,纤维素在水中,纤维素酶像一个勤劳的小工人,正在不停地工作。
它一边“啃”着那些纤维素,一边把分解出来的小分子释放到水里。
好比咱们吃饭,吃了一口又一口,最后把盘子清理得干干净净。
然后,DNS法就是通过测量水里的颜色来评估纤维素酶的工作效率。
颜色越深,酶的活力越高,反之,颜色浅,就说明这位小工人可能今天状态不佳,干得不够。
可能有人会问,咱们为什么要关心纤维素酶的活力呢?这可是个好问题。
因为纤维素酶在许多行业里都有广泛的应用,比如说造纸、酿酒,甚至在生物燃料的生产中,都是不可或缺的“好帮手”。
如果咱们知道它的活力,就能调整工艺,优化生产,省时又省力,简直就是为生产效率加了一把火。
说说这个DNS法的操作步骤。
咱们得准备好一堆材料,包括纤维素、酶、还有那个神秘的“变色剂”。
然后,把纤维素和酶混合,放到特定的温度下,让它们好好亲密接触。
DNS法测定纤维素酶活实验方法总结及优化方案
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
1、葡萄糖标准曲线制作:
页脚内容1
530nm比色。
2、酶活测定方法:
页脚内容2
页脚内容3
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致。
单位酶活的计算:T n k OD ml U 1000
1
)/(⨯⨯⨯=酶活力 n :稀释倍数; K :曲线斜率; T :反应时间,min ; 1000:mg 换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
页脚内容4
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
页脚内容5
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法。
页脚内容6。
纤维素酶活力的测定实验报告
纤维素酶活力的测定实验报告实验名称:纤维素酶活力的测定实验目的:1.掌握测定纤维素酶活力的方法;2.了解纤维素酶的作用机制;3.探究不同条件对纤维素酶活力的影响。
实验原理:纤维素是植物细胞壁的主要组成部分之一,其主要成分是纤维素聚合物。
纤维素酶是一种能够水解纤维素的酶,通过降解纤维素将其转化为可利用的单糖。
纤维素酶活力可以通过测定其在特定条件下降解纤维素的速度来评估。
实验步骤:1.准备纤维素酶的测定液:将一定浓度的纤维素酶和适量的底物溶液混合。
2.将测定液分装到各个试管中,同时设置对照组。
3.将各个试管放置在恒温水浴中,控制温度为37℃。
4.在一定的时间间隔内,取出各个试管,加入一定量的酶停止液,停止反应。
5.将反应液和纤维素酶残余液通过离心仪离心,分离清除残余纤维素。
6. 取出上清液,加入Fehling试剂,进行加热反应。
7. 记录Fehling试剂发生颜色变化的时间,并用同样的方法测定对照组。
8.根据对照组的结果进行归一化处理,计算每个试管中的纤维素酶活力。
实验数据处理与结果分析:将实验数据整理成表格或图表,根据不同条件下的纤维素酶活力进行比较分析。
探究不同因素对纤维素酶活力的影响,如温度、pH值、底物浓度等。
分析结果可以得出,当温度和pH值处于一定范围内时,纤维素酶的活力最高。
底物浓度对纤维素酶活力也有一定影响,但超过一定浓度时,酶的反应速率将达到饱和状态。
实验结论:通过测定纤维素酶在不同条件下的活力1.温度和pH值对纤维素酶活力有显著影响,适宜的温度和pH值可以提高纤维素酶的活力。
2.底物浓度对纤维素酶活力也有一定影响,但过高浓度会使酶的反应速率达到饱和状态。
3.该实验结果可以对纤维素酶的应用提供参考,有助于优化纤维素酶的工业生产过程。
实验总结:通过本次实验,我们成功测定了纤维素酶的活力,并得出了温度、pH 值和底物浓度对其活力的影响。
实验结果对于纤维素酶的应用具有重要意义,可以为其在生物制造、生物能源等领域的应用提供参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
1、葡萄糖标准曲线制作:
530nm比色。
2、酶活测定方法:
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致。
单位酶活的计算:T n k OD ml U 1000
1
)/(⨯⨯⨯=酶活力 n :稀释倍数; K :曲线斜率; T :反应时间,min ; 1000:mg 换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法。
