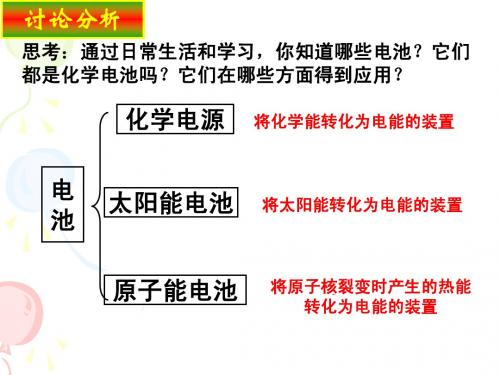
化学电源
合集下载
化学电源

铅蓄电池充电的反应则是上述反应的逆过程
①充电过程
接电源负极 阴极:PbSO4 (s) +2e- =Pb(s) + SO42- (aq) 还原反应 阳极: 接电源正极
氧化反应 充电过程总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)
PbSO4 (s)+2H2O(l) -2e- = PbO2(s) + 4H+(aq) + SO42-(aq)
银锌蓄电池
1970-1975, 开发了先进的银锌、镍镉电池技术。 1975-1983, 为美国海军生产潜水艇用银锌电池。 1979-1987,为美国国家能源部发展电动车用的镍锌电池。 1998-1992, 为美国海军发展世界上最大的镍镉电池用于核潜水艇。
正极壳填充Ag2O和石墨,负极盖填充锌汞合 金,电解质溶液KOH。反应式为: 充电 2Ag+Zn(OH)2 Zn+Ag2O+H2O 放电
燃料电池
大有发展前景的燃料电池
燃料电池是利用氢气、天然气、甲醇等燃 料与氧气或空气进行电化学反应时释放出来的 化学能直接转化成电能的一类原电池。目前燃 料电池的能量转化率可达近80%,约为火力发 电的2倍。这是因为火力发电中放出的废热太 多。燃料电池的噪声及硫氧化物、氮氧化物等 废气污染都接近零;燃料电池发明于19世纪30年代
缺点:放电量小,放电过程中易气涨或漏液
改进后碱性锌锰电池的优点: 电流稳定,放电容量、时间增大几倍,不会气涨或漏液。 Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
化 学 电 源
请考虑,废旧干电池,有无污染的问题,如何解决?
①充电过程
接电源负极 阴极:PbSO4 (s) +2e- =Pb(s) + SO42- (aq) 还原反应 阳极: 接电源正极
氧化反应 充电过程总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)
PbSO4 (s)+2H2O(l) -2e- = PbO2(s) + 4H+(aq) + SO42-(aq)
银锌蓄电池
1970-1975, 开发了先进的银锌、镍镉电池技术。 1975-1983, 为美国海军生产潜水艇用银锌电池。 1979-1987,为美国国家能源部发展电动车用的镍锌电池。 1998-1992, 为美国海军发展世界上最大的镍镉电池用于核潜水艇。
正极壳填充Ag2O和石墨,负极盖填充锌汞合 金,电解质溶液KOH。反应式为: 充电 2Ag+Zn(OH)2 Zn+Ag2O+H2O 放电
燃料电池
大有发展前景的燃料电池
燃料电池是利用氢气、天然气、甲醇等燃 料与氧气或空气进行电化学反应时释放出来的 化学能直接转化成电能的一类原电池。目前燃 料电池的能量转化率可达近80%,约为火力发 电的2倍。这是因为火力发电中放出的废热太 多。燃料电池的噪声及硫氧化物、氮氧化物等 废气污染都接近零;燃料电池发明于19世纪30年代
缺点:放电量小,放电过程中易气涨或漏液
改进后碱性锌锰电池的优点: 电流稳定,放电容量、时间增大几倍,不会气涨或漏液。 Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
化 学 电 源
请考虑,废旧干电池,有无污染的问题,如何解决?
化学电源
四、燃料电池: 燃料电池是一种连续地将燃料和氧化剂的化学能直接转 换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤 气燃料电池……) 氢氧燃料电池
负极: 2H2 - 4e- = 4H+ 酸性电解质: 正极: O2+ 4H+ + 4e- = 2H2O 总反应:2H2+ O2 = 2H2O 碱性电解质或中性介质 负极: 2H2- 4e-+ 4OH- = 4H2O 正极: O2+ 2H2O+ 4e- = 4OH总反应: 2H2+ O2 = 2H2O
知识应用
练习3:氢气是燃料电池最简单的燃料,虽然使用方便, 却受到价格和来源的限制。常用的燃料往往是某些碳氢 化合物,如:甲烷、汽油等。请写出图中甲烷燃料电池 中a极的电极反应式:
CH4+10OH- - 8e-=CO32- +7H2O
此时电池内总的反应式:
, a
b
CH4+2O2+2KOH=K2CO3+3H2O 。
B 电池正极电极反应式为:
2MnO2s+H2Ol+2e=Mn2O3s+2OHaq
C 电池工作时,电子由正极通过外电路流向负极 D 外电路中每通过02 mol电子,锌的质量理论上减 小65 g
知识梳理 3、银锌钮扣电池
负极:Zn +2OH--2e- = ZnO+H2O 正极:Ag2O + H2O+ 2e- = 2Ag+2OH-
接电源负极 阴极:PbSO4 +2e- =Pb + SO42-
还原反应
接电源正极 阳极: PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42- 氧化反应
化学电源基本概念

比能量的应用:选择电池的重要依据
例:某一起使用电源体积限定:130mm×60mm×8mm 平均工作电压:13V 最大工作电流:250mA 工作时间:4h
电池能量=I×t×U=0.25A×4h×13V=13Wh 电池组体积=130mm×60mm×8mm=0.0624dm3 13Wh 体积比能量= =208Wh/dm3 0.0624 dm 3 查表:ZnHg 或ZnAg 电池
一、化学电源的概述
1 定义
电化学电池是一种直接把化学能转变为电能的装置。
2 优点
1、 能释放能源,又能储存能源; 2、 能量转换效率高,工作时没有噪音,无污染; 3、 工作范围广泛,对环境适应性强(耐冲击、震动、 在失重情况下能正常工作; 4、 工作重要参数(电压、电流、容量及电池的形状) 可在较大范围内变动; 5、 携带方便,特别适用于移动式通讯交通工具上。
四、电池的主要性能 1、电池的开路电压
指外电路电流无穷小(电路断开)时两极间的电势差。 与正负极材料本性、电解质和温度有关
与电池的几何结构、尺寸大小无关
电池的额定电压(公称电压)
指某电池开路电压的最低值。 ZnMn干电池额定电压为1.5V,开路电压不小于1.5V
2、电池的容量 电池的容量:是指在一定的放电条件下,即一定的温度和
充电也类似: 锂电池是1320毫安。
充电器输出DC:
USB:
350mA-±50mA
800mA
1320mAh 用充电器充电:充电时 间 3.8h 350mA 1320mAh 用USB充电:充电时间 1.65h 800mA 在实际中,充电时间比理论时间长,因为充电时有能量耗损,同 时电流有可能不稳定。
• 3 化学电源工作原理 电池要实现化学能转变为电能必须满足以下条件:
化学电源

化学电源的主要性能
电池容量是评价电池性能的重要指标,可通过 放电曲线测定。 电池容量和放电条件相关,放电条件一般指: 放电电流、放电深度、放电形式、放电期间电 池的温度等。
化学电源的主要性能
对给定的电池,由于欧姆内阻和极化内阻的存 在,电池容量、放电电压和电池的使用寿命随放电 电流增加而减小,只有当电池以很小电流放电时才 能接近理论电压和理论容量。
化学电源的主要性能
电池的工作电压(V): 电池有电流流过时正、负电极的端电压。 它随输出电流的大小、放电深度和温度等变化
而变化。电流流过电池时,会产生电化学极化、
浓差极化和欧姆极化等,使电池的工作电压总低 于开路电势。
化学电源的主要性能
表征电池放电时电压特性的术语: 额定电压:电池工作时公认的标准电压。 如:锌锰电池:1.50V;镉镍电池:1.20V 中点电压:电池放电期间的平均电压。 截止电压:电池放电终止时的电压值,是放电倍率的
化学电源的主要性能
自放电:指电池由于一些自发过程的进行引起的电
池容量的损失。
过充电:对二次电池,若充电时间过长,电池可能
出现过充电,此时会出现新的电极反应,如水的电
解等,会影响电池的寿命。
一般,只要不经常过充电,对电池的性能影响不大。
化学电源的主要性能
电池在贮存和使用过程都会出现自放电,主要原因: 1)不期望的副反应的发生,如铅酸电池的正极发生 2)电池内部变化导致的接触问题; 3)活性物质的再结晶; 4)电池的负极大多数使用活泼金属,可能发生阳极 溶解; 5)无外接负载时电池在电解质桥上的放电。
根据放电倍率的大小分类:
低倍率:<0.5C;
高倍率:3.5-7C;
中倍率:0.5-3.5C;
高中化学——化学电源

配电荷的等号另一边配水
配
对
CH4
O2
根据溶液环境定离子 配 电
等
4水 CH4-8e-+10OH-=CO32-+7H2
得失电子看不见 定 荷
KOH溶液
全靠化合价来体现 得 失
3 CH4-8e-+10OH-=CO32-
写总方程式,找反应物和 电
产物
写
1 负极:CH4-8e-+10OH-=CO32-+7H2O总 反 应
3 .
优点
供燃料和氧化剂。
清洁、安全、高效(燃料利用率超过80%), 环境友好。
四步走暴击电极反应式
03 燃料电池的一般套路(甲烷酸性燃料电池)
配电荷的等号另一边配水
配
对
CH4
O2
根据溶液环境定离子 配 电
等
4水 CH4-8e-+2H2O=CO2+8H+
得失电子看不见 定 荷
HCl溶液
全靠化合价来体现 得 失
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
03
镁铝原电池——稀硫酸or氢氧化钠
稀硫酸or 氢氧化钠
配电荷的等号另一边配水
配
对
根据溶液环境定离子 配 电
等
水4
得失电子看不见 定 荷
全靠化合价来体现 得 失
3
写总方程式,找反应物和 电
产物
写 总
优点:不会破裂漏液,效能高
溶液变红色 二次电池(铅酸蓄电池) 放电 SO +H O ⇌H SO 总反2应:Pb + PbO22+2H2SO4 2PbS2O4 +2H2O 3 充电(难溶于水)
02化学电源

电池的实际容量总是小于 电池的理论容量,其比称 为活性物质利用率η
idt 电池实际容量 0 100 %= 电池理论容量 mzF M
电池容量是评价电池性能最重要的指标之一,实际生产中常用比容 量来反映电池的容量性能。
t
比容量是指单位质量或单位体积电池所输出的电量,分别以A· h· kg-1和 A· h· L-1表示。 质量比容量间接地反映了活性物质的利用率; 体积比容量则反映了电池结构的特征。
• 外电路上电子流过的速率等于每个电极/电解质界面上的电荷迁移
速率,电化学过程的速率可以由连接在外电路中的安培表直接读出。
3.电流和电流效率
• 电流越大,由于内阻的存在,使电池的放电电压下降,电极上活性 物质来不及反应.导致了电池容量的下降。
• 对于电池反应,能承受的充、放电电流的大小反映了反应的可逆性。 • 为降低电极反应的极化、提高电池所能承受的电流,电极一般做成
• 只有可逆电池的开路电压才等于电池电动势,—般电池的开路电压 总小于电池的电动势。 • 工作电压 (V):指电池有电流流过时的端电压,它随输出电流的大 小、放电深度和温度的变化而变化。
• 当有电流流过电池时,会产生电化学极化、浓差极化和欧姆极化等,
使得电池的工作电压总低于开路电势。
• 表征电池放电时电压特性的术语还有额定电压、中点电压和截止电压。 • 额定电压:指电池工作时公认的标准电压。 • 中点电压:指电池放电期间的平均电压。 • 截止电压:指电池放电终止时的电压值,是放电倍率的函数,截止电 压一般是电池制造商规定的。 • 当电池外加一负载时,外线路中有电流通过,电池对外做电功,电池 的工作电压为:
糊式电池:
(-) Zn | NH4Cl + ZnCl2 | MnO2, C (+)
常见化学电源
常见化学电源1、干电池(1)电极负极:Zn 正极:碳棒(2)电解质溶液:NH4Cl(淀粉糊)(3)电极反应负极:Zn-2e-=Zn2+正极:2MnO2+2NH4++2e-=Mn2O3+NH3+H2O 2、铅蓄电池(1)电极材料负极:Pb 正极:PbO2(2)电解质溶液:H2SO4(3)电极反应式负极:Pb -2e-+ SO42-= PbSO4正极: PbO2 + SO42- + 4H+ + 2e- = PbSO4 + 2H2O 3、银锌电池(钮扣电池)(1)电极材料负极:Zn 正极:Ag2O(2)电解质溶液:KOH溶液(3)电极反应式负极:Zn -2e-+2OH-= ZnO+H2O正极: Ag2 O+ 2e- + H2O =2Ag + 2OH-3、氢氧燃料电池(1)碱性电解质溶液①电极材料负极:Pt 正极:Pt②电解质溶液:KOH溶液③电极反应式负极:2H2 -4e-+4OH-= 4H2O正极: O2+ 4e- +2H2O =4OH-(2)酸性电解质溶液①电极材料负极:Pt 正极:Pt②电解质溶液: H2SO4溶液③电极反应式负极:2H2 -4e--= 4H+正极: O2+ 4e- +4H+=2H2O5、海水电池(1)电极材料负极:Al 正极:石墨(2)电解质溶液:海水(3)电极反应式负极:Al -3e-=Al3+正极: O2+ 4e- + 2H2O =4OH-6、甲烷燃料电池(1)电极材料负极:Pt 正极:Pt(2)电解质溶液:KOH溶液(3)电极反应式负极:CH4 -8e-+10OH-= CO32-+7H2O 正极: O2+ 4e- + 2H2O =4OH-。
应用电化学---第三章 化学电源
3.电流和反应速率 反应速率等于电流强度,可以直接从电流表 读出。电流的大小,就是充电或者放电速率 的大小。 由于电池存在内阻,当有电流流过时,电池 的放电电压下降,电极上的活性物质来不及 反应,使电池容量的下降。对于电池反应, 能承受的充、放电电流的大小反映了电池反 应的可逆性。为降低电极反映的极化、提高 电池所能承受的电流,电极一般做成多孔扩 散电极。
放电深度:电池放电量占其额定容量的百分 数。 理想的电池在整个放电过程中应该保持一个 恒定的工作电压,但大多数电池只有在较低 的放电深度时才保持平稳的工作电压。 放电深度大时电池能放出较多的容量,但考 虑到电池的工作性能,一般情况下电池放电 深度只为额定容量的20%一40%。
电池放电一段时间后搁臵时,开路电压会 上升。图3.2为电池连续放电和间隙放电时 的放电曲线。依图可见,间隙放电时的容 量要较连续放电时为大。特别当以大电流 放电时,间隙放电会使电池容量有较大的 提高。
给电池外加一负载并接通外电路时,外线 路中有电流通过,电池对外做电功,其工 作电压为:
Rp,RΩ分别是极化内阻和欧姆内阻,E,V 分别使电池电动势和电池工作电压
电池内阻R =Rp + RΩ ,
极化内阻是由于电化学极化和浓差极化而 引起的,所以极化内阻的大小与电极材料 的本质、电池的结构、制造工艺和工作电 流的大小等有关。为降低极化内阻,电极 一般做成多孔电极以提高电极的表面积, 并选择具有高交换电流密度的活性物质。
电池的负极一般选用较活泼的金属,而正 极一般选用金属氧化物,电极材料的选择 和评价原则前面已经介绍,后面还要针对 电池来具体讲授。表3.1列出了电池常用的 一些负极材料的性能。
添加剂:包括能提高电极导电性能的导电剂 (如金属粉和碳粉)、增加活性物质粘结力的 粘结剂(如聚四氟乙烯和聚乙烯)、延缓金属 电极腐蚀的缓蚀剂等。 集电器:由于活性物质通常是构成一种糊状 电极,需要用集电器来作为支持体,集电器 通常是一个金属栅板或导电的非金属棒(如碳 棒),以提供电子传导的路线,集电器重量应 轻,化学稳定性应好。
应用电化学课件第三章化学电源
要点二
详细描述
质子交换膜燃料电池以质子交换膜为媒介,通过电化学反 应产生电能。在电池中,氢气在阳极被氧化成氢离子和电 子,氢离子通过质子交换膜传递到阴极,与氧气和电子反 应生成水。电子通过外电路传递形成电流,为外部负载提 供电力。质子交换膜燃料电池具有较高的能量密度和效率 ,且工作温度较低,因此被广泛应用于汽车、便携式电源 等领域。
甲醇燃料电池
总结词
甲醇燃料电池是一种以甲醇为燃料,通 过电化学反应产生电能的装置。
VS
详细描述
甲醇燃料电池以甲醇为燃料,通过电化学 反应产生电能。甲醇在阳极被氧化生成甲 醛和电子,电子通过外电路传递形成电流 ,为外部负载提供电力。同时,在阴极上 ,氧气与电子和水反应生成水。
磷酸燃料电池
总结词
磷酸燃料电池是一种以磷酸为电解质,通过 电化学反应产生电能的装置。
应用电化学课件第三章化学 电源
目录
• 化学电源概述 • 一次电池 • 二次电池 • 燃料电池 • 化学电源的应用
01
化学电源概述
定义与分类
定义
化学电源是一种将化学能直接转 化为电能的装置,也称为电池。
分类
根据工作原理和特点,化学电源 可分为一次电池、二次电池、燃 料电池等类型。
工作原理与特点
和充电效率较低,且存在一定的环境污染问题。
镍镉电池
总结词
镍镉电池是一种可充电的二次电池,具有较高的能量密度和自放电率较低的优点,但存在记忆效应和重金属污染 问题。
详细描述
镍镉电池由正极、负极、电解液和隔膜组成,正极为氢氧化镍,负极为镉。在充电过程中,正极上的氢氧化镍发 生还原反应,负极上的镉发生氧化反应。镍镉电池的优点包括较高的能量密度、自放电率较低、可快速充电以及 较好的耐过充过放能力。然而,其存在记忆效应和重金属污染问题,且镉资源有限。
化学电源
铅蓄电池
• Pb——PbO2——H2SO4溶液
负极(Pb):Pb+SO42-—2e 正极(PbO2): PbO2+SO42- + 4H++2e
-=PbSO4
-=PbSO4+2H2O
总反应: Pb+PbO2+2H2SO4=2PbSO4 + 2H2O
碱性锌锰电池
• Zn——MnO2——KOH溶液
负极(Zn):Zn+2OH —2e = Zn(OH)2
化学电源
化学电源的分类
1.一次电池(如干电池):用过后不能复原 • 例如:干电池—— Zn- Mn普通干电池
2.二次电池(如蓄电池):充电后能继续使用 • 例如:银锌纽扣电池 铅蓄电池 3.燃料电池:常见的燃料电池有氢氧燃料电 池、甲烷燃料电池、铝-空气燃料电池、熔 融盐燃料电池等。
氢氧燃料电池
总反应:CH4+2O2+2KOH=K2CO3+3H2O
甲醇—空气燃料电池
两极分别通入CH3OH、O2 ;电解质:KOH溶液
负极:2CH3OH+16OH --12e =2CO32-+12H2O 正极:3O2+ 6H2O+12e =12OH
总反应:
2CH3OH+3O2+4OH =2CO32-+6H2O
正极(MnO2):
2MnO2+2H2O+2e =2MnO(OH)+2OH
总反应: Zn+2MnO2+2H2O= 2MnO(OH)+ Zn(OH)2
甲烷燃料电池
• 两极分别通入CH4、O2 ; 电解质:KOH溶液
负极:CH4+10OH —8e =CO32-+7H2O 正极:2O2+4பைடு நூலகம்2O+8e =8OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总反应:2H2 + O2 = 2H2O
2018/7/3 10
二、发展中的化学电源
改变燃料 CH4 +2O2 == CO2 + 2H2O
H2 负极:CH4 + 10OH- – 8e- == CO32+ 7H2O
正极:2O2 + 4H2O +
8e-
==
8OH-
O2
CH4
总反应:
CH4 +2O2 + 2OH- == CO32- + 2H2O
2018/7/3 11
二、发展中的化学电源
燃料电池不是把还原剂、氧化剂物质全 部贮藏在电池内,而是在工作时,不断从外 界输入,同时将电极反应产物不断排出电池
2018/7/3 12
二、发展中的化学电源
使用燃料电池的汽车
2018/7/3 13
二、发展中的化学电源
其他电池
空气电池
2018/7/3
14
Байду номын сангаас
优点:可反复使用
2018/7/3
8
二、发展中的化学电源
3、燃料电池:
⑴ 氢氧燃料电池
4e-
2H2 + O2 == 2H2O
H2
O2
负极:2H2 – 4e- == 4H+ 正极:O2 + 2H2O + 4e- == 4OH-
总反应:2H2 + O2 == 2H2O
2018/7/3 9
二、发展中的化学电源
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜; D. 银圈向下倾斜;
2018/7/3
19
二、发展中的化学电源
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对 环境造成严重的污染。
上世纪50年代,震惊世界的日本“水俣病” 就是因汞中毒引起的。
2018/7/3 15
二、发展中的化学电源
减少污染
2018/7/3
节约资源
16
二、发展中的化学电源
1、随着人们生活质量的不断提高,废电池必须进 行集中处理的问题被提到议事日程,其首要原因 是( B ) A.利用电池外壳的金属材料 B.防止电池中汞、镉和铅等重金属离子对土 壤和水源的污染
碱性电池
2018/7/3
5
二、发展中的化学电源
2、充电电池
负极:Pb + SO42- - 2e- == PbSO4 正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O
总反应:
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O
已知:PbSO4难溶于水
新课标人教版高中化学课件系列
化学 必修2 第二章 化学反应与能量 第二节 化学能与电能
第2课时
2018/7/3
1
二、发展中的化学电源
干电池
碱性电池
锂离子电池
燃料电池 蓄电池
2018/7/3 2
二、发展中的化学电源
一次性电池:如干电池
化学电池
二次电池(可充电电池):铅蓄 电池等
燃料电池:氢氧燃料电池
C .正极为Fe 、负极为Zn,电解质溶液为Fe2(SO4) 3溶液
D .正极为Ag 、负极为Fe,电解质溶液为CuSO4溶液
2018/7/3
18
二、发展中的化学电源
3、 如图所示,在铁圈和银圈的焊接处,用 一根棉线将其悬在盛水的烧杯中,使之 平衡;小心的向烧杯中央滴入CuSO4溶 液,片刻后可观察到的现象是(D )
电解质溶液的酸碱性对电极反应的影响 酸性条件下 负极:2H2 – 4e- == 4H+ 正极:O2 + 4H+ + 4e- == 2H2O
总反应:2H2 + O2 = 2H2O
碱性条件下 — 有效地防止电解质溶液对外壳的腐蚀 负极:2H2 + 4OH- – 4e- == 4H2O 正极:O2 + 2H2O + 4e- == 4OH-
2018/7/3
铅蓄电池构造示意图
6
二、发展中的化学电源
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可 充电的绿色电池,现已成为 笔记本电脑、移动电话、摄 像机等低功耗电器的主流。
2018/7/3 7
二、发展中的化学电源
思考与交流:充电电池与一次电池相比有何优 点?如何科学合理地使用充电电池?请与同学 们讨论、交流。
2018/7/3
3
二、发展中的化学电源
1、干电池(锌锰电池) 负极:Zn – 2e- == Zn2+ 正极: 2NH4+ +2MnO2 + 2e== 2NH3 + Mn2O3 + H2O
干电池
锌筒 (负极) 石墨棒 (正极) NH4Cl、ZnCl2 和 H2O等 MnO2和C
总反应:
普通锌-锰干电池的结构
Zn+2NH4+ +2MnO2 =Zn2++2NH3 +Mn2O3 + H2O
2018/7/3 4
二、发展中的化学电源
思考与交流:锌锰干电池即使不用,放置过久, 也会失效(作为电解质的糊状NH4Cl显酸性), 为了充分而有效地利用锌锰干电池,在购买、 保存和使用方面你有何经验与建议?请与同学 交流分享。
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
2018/7/3 17
二、发展中的化学电源
2、某原电池总反应的离子方程式为2Fe3++Fe==3Fe2+,不
能实现该反应的原电池是(CD ) A .正极为Cu 、负极为Fe,电解质溶液为FeCl3溶液
B .正极为C 、负极为Fe,电解质溶液为Fe(NO3)3溶液
