精排半对数坐标纸(一页4用)
《土力学》试验指导与报告书

《土力学》试验指导与报告书试验目录试验一颗粒分析试验试验二含水率试验试验三界限含水率试验试验四固结试验试验五直剪试验试验六击实试验试验一土的颗粒分析试验(筛分法)颗粒分析试验方法可分为筛分析法和静水沉降分析法,静水沉降分析法又有比重计法、移液管法。
工程上对地基土检测时,对于粒径大于0.075mm小于60mm的土,采用筛分析法;对于粒径小于0.075mm的土,采用静水沉降分析法(密度计法);对于混合类土,则联合使用筛分析法与密度计法。
一.试验原理筛分析法是测定土的粒度成分的最简单的一种方法。
其原理是将土样通过逐级减小孔径的一组标准筛子,对于通过某一筛孔的土粒,可以认为其粒径恒小于该筛的孔径,反之,遗留在筛上的颗粒,可以认为其粒径恒大于该筛的孔径。
这样即可把土样的大小颗粒按筛孔大小加以分组,并分别计算出各级粒组占总质量的百分数,再根据所占百分数进行归并和分类。
二.适用范围本试验适用于粒径大于0.075mm小于60mm的土。
三.仪器设备1.标准筛:粗筛(圆孔):孔径为60mm、40mm、20mm、10mm,5mm、2mm;细筛:孔径为2.0mm、1.0mm、0.5mm、0.25mm、0.075mm。
2.天平:称量5000g,感量5g;称量1000g ,感量1g;称量200g,感量0.2g。
3.摇筛机(带震动、拍打功能)。
4.其他:烘箱、筛刷、烧杯、木碾、研钵等。
四.试样将土样风干,使其土中水分蒸发。
从风干、松散的土样中,用四分法按照下列规定取出具有代表性的试样:1.小于2mm 颗粒的土100~300g;2.最大粒径小于10mm 的土300~900g;3.最大粒径小于20mm 的土1000~2000g;4.最大粒径小于40mm 的土2000~4000g;5.最大粒径大于40mm 的土4000g 以上。
五.试验步骤(一)对于无凝聚性的土1.按规定称取试样,将试样分批过2mm 筛。
2.将大于2mm 的试样按从大到小的次序,通过大于2mm 的各级粗筛,并将留在筛上的土分别称量。
大学物理实验坐标纸(一)2024

大学物理实验坐标纸(一)引言概述:大学物理实验中,坐标纸是一种常用的工具,用于记录和分析实验数据。
坐标纸上标有坐标轴和网格线,可以帮助实验者更准确地绘制图表和进行数据分析。
本文将介绍大学物理实验中常用的坐标纸,包括其种类、用途和使用方法。
正文内容:1. 坐标纸的种类- 直角坐标纸:直角坐标纸上有两条垂直相交的坐标轴,用于表示二维平面上的点的坐标。
- 极坐标纸:极坐标纸采用极坐标系,其中原点表示坐标轴的起点,极角表示与坐标轴正向的夹角,极径表示点到原点的距离。
- 对数坐标纸:对数坐标纸上的坐标轴采用对数尺度,适用于表示变化范围较大的物理量。
2. 坐标纸的用途- 绘制图表:坐标纸可以用于绘制物理实验中得到的数据图表,如位置-时间图、速度-时间图等,方便进行数据可视化分析。
- 数据分析:通过在坐标纸上绘制实验数据,可以更直观地观察数据的变化趋势,进一步进行数据分析和模型拟合。
- 精确测量:坐标纸上的网格线可以作为参考标志,帮助实验者更准确地测量数据点的坐标值。
3. 坐标纸的使用方法- 坐标标定:在使用坐标纸前,需先确定坐标轴的起点和方向,并标定刻度。
通常选择适当的比例尺,使数据点在坐标纸上分布均匀且容易观察。
- 数据绘制:根据实验数据,将各组数据点绘制在坐标纸上,并根据需要连接数据点,形成曲线或直线图。
在绘制过程中,要注意保持数据的准确性和图形的清晰可读。
- 数据分析:通过观察数据在坐标纸上的分布和趋势,可以得出实验结果,并进一步分析数据之间的关系及其物理意义。
4. 坐标纸的注意事项- 刻度选择:合理选择坐标轴上的刻度,使数据点不要过于集中或稀疏,保证图表的完整性和可读性。
- 数据精度:在绘制数据时,要注意数据的精确度和测量误差,避免误差累积和数据失真。
- 图表清晰:绘制图表时,要使用清晰的图形符号和线条,以及适当的标注和图例,方便他人理解和分析。
5. 坐标纸的扩展应用- 实验模拟:借助坐标纸,可以进行物理实验的模拟计算和预测,帮助实验前进行方案设计和参数选择。
物理实验数据处理方法
物理实验数据处理⽅法数据处理⽅法数据处理是指从获得的数据得出结果的加⼯过程,包括记录,整理,计算,分析等处理⽅法。
⽤简明⽽严格的⽅法把实验数据所代表的事物内在的规律提炼出来,就是数据处理。
正确处理实验数据是实验能⼒的基本训练之⼀。
根据不同的实验内容,不同的要求,可采⽤不同的数据处理⽅法。
本章介绍物理实验中较常⽤的数据处理⽅法。
1 列表法获得数据后的第⼀项⼯作就是记录,欲使测量结果⼀⽬了然,避免混乱,避免丢失数据,便于查对和⽐较,列表法是最好的⽅法。
制作⼀份适当的表格,把被测量和测量的数据⼀⼀对应地排列在表中,就是列表法。
⼀、列表法的优点1.能够简单地反映出相关物理量之间的对应关系,清楚明了地显⽰出测量数值的变化情况。
2.较容易地从排列的数据中发现个别有错误的数据。
3.为进⼀步⽤其他⽅法处理数据创造了有利条件。
⼆、列表规则1.⽤直尺划线打表,⼒求⼯整。
2.对应关系清楚简洁,⾏列整齐,⼀⽬了然。
3.表中所列为物理量的数值(纯数),因此表的栏头也应是⼀纯数,即物理量的符号除以单位的符号,例如:α /ms ̄2、I /10 ̄3A等,其中物理量的符号⽤斜体字,单位的符号⽤正体字。
为避免⼿写正、斜体混乱,本课程规定⼿写时物理量⽤汉字表⽰,例如:加速度/m?s ̄2、电流强度/10 ̄3A。
4.提供必要的说明和参数,包括表格名称、主要测量仪器的规格(型号、量程、准确度级别或最⼤允许误差等)、有关的环境参数(如温度、湿度等)、引⽤的常量和物理量等。
三、应⽤举例例1 ⽤列表法报告测得值。
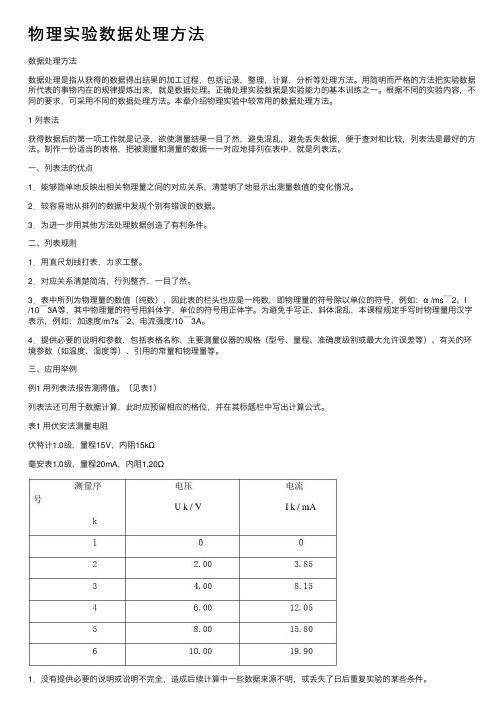
(见表1)列表法还可⽤于数据计算,此时应预留相应的格位,并在其标题栏中写出计算公式。
表1 ⽤伏安法测量电阻伏特计1.0级,量程15V,内阻15kΩ毫安表1.0级,量程20mA,内阻1.20Ω2.横排数据,不便于前后⽐较(纵排不仅数据趋势⼀⽬了然,⽽且可以在⾸⾏之后仅记变化的尾数)。
3.栏头概念含糊或错误,例如将U k / V写成U k (V)或U k,V等。
氟化物 固定污染源实验作业指导书

氟化物的测定1、方法依据大气固定污染源氟化物的测定离子选择电极法HJ/T 67-20012、适用范围本标准适用于大气固定污染源有组织排放中氟化物的测定。
不能测定碳氟化物,如氟利昂。
3、测定范围当采样体积为150L时,检出限为6×10-2mg/m³;测定范围为1~1000mg/m³。
4、测定原理使用滤筒、氢氧化钠溶液为吸收液采集尘氟和气态氟,滤筒捕集尘氟和部分气态氟,用盐酸溶液浸溶后制备成试样,用氟离子选择电极测定;当溶液的总离子强度为定值而且足够大时,其电极电位与溶液中的氟离子活度的对数成线性关系。
5、试剂本标准所用试剂除另有说明外均为分析纯试剂,所用水为去离子水。
5.1盐酸(HCL):ρ=1.18g/ml。
5.1.1盐酸溶液0.25mol/L:取21.0ml盐酸(5.1)用水稀释到1000ml。
5.1.2盐酸溶液1.0mol/L:取84.0ml盐酸(5.1)用水稀释到1000ml。
5.2氢氧化钠(NaOH)5.2.1氢氧化钠溶液0.3mol/L:将氢氧化钠(5.2)12g溶于水并稀释至1000ml 做为吸收液。
5.2.2氢氧化钠溶液1.0mol/L:将氢氧化钠(5.2)40g溶于水并稀释至1000ml。
5.3氟化钠标准贮备液1.000mg/ml:称取0.2210g氟化钠(优级纯,于110℃烘干2小时放在干燥器中冷却至室温)溶解于水,移入100ml容量瓶中,用水定容至标线,贮存于聚乙烯瓶中。
在冰箱内保存,临用时放至室温再用。
5.4氟化钠标准溶液:将氟化钠标准贮备液(5.3)用水稀释成2.5μg/ml、5.0μg/ml、10.0μg/ml、25.0μg/ml、50.0μg/ml、100.0μg/ml的标准溶液,临用现配。
上述溶液均贮存于聚乙烯瓶中。
5.5溴甲酚绿指示剂0.1g/100ml:称取100mg溴甲酚绿于研钵中,加少量1+4(V/V)乙醇研细,移入100ml容量瓶中,用1+4(V/V)乙醇定容至标线。
自控理论 4-3对数坐标图

(2) 将各环节的L(w),j(w)曲线画于对数坐标纸上 1) L1(w) = 20lg4 ≈12(dB)是幅值为12dB的水平线。 2) L2(w)是过ω=1, L(w)0dB,斜率为 -20dB/dec的直线。 3) L3(w)是转角频率为ω=0.5的惯性环节对数幅频曲线。 4) L4(w)是转角频率为ω=2的微分环节对数幅频曲线。 5) L5(w)是转角频率为ω=8的振荡环节对数幅频曲线。
惯性环节L(w) 1 ① G(s)= 0.5s+1
L(w)dB 40 26dB 20
100 ② G(s)= s+5
[-20]
0dB 0o -20 - 30o - 45o o -40 - 60 - 90o 0.1 0.2
ω
1
2
10 20
[-20]
100
5. 一阶微分环节 (Ts 1) L(w ) 20lg 1 (wT) 2 j (w ) tg -1wT 1 Ts 1与 两环节的 Bode 图关于 Ts 1 横轴成镜像对称 关系。
斜率 40 20 20
40
30
-20
20
17.5
10
-60 -80
0
-10
-60
-20
-30
-40 -1 10
10
0
10
1
图4-19 例4-6的幅频特性
1 7.5( s 1) 3 G( s) 1 s 2 1 s( s 1)[( ) s 1] 2 2 2
图4-19 例4-6的相频特性
j
290o w r w n 1 2
2
wn
0dB
L(w r ) 20 lg 2
用Excel绘制标准曲线(画半对数坐标)

算术坐标系统:就是普通的笛卡儿坐标,横纵的刻度都是是等距的。
(举例来说:如果每1cm的长度都代表2,则刻度按照顺序0,2,4,6,8,10,12,14……)对数坐标:坐标轴是按照相等的指数变化来增加的,(举例来说:如果每1cm代表10的1次方增加,则坐标轴刻度依次为1,10,100,1000,10000……)半对数坐标系统:只有一个坐标轴是对数坐标,另一个是普通算术坐标,如下图所示:首先,将数据整理好输入Excel,并选取完成的数据区,并点击图表向导,如下图所示。
点击图表向导后会运行图表向导如下图,先在图表类型中选“XY 散点图”,并选了图表类型的“散点图”(第一个没有连线的)。
点击“下一步”,出现如下图界面。
如是输入是如本例横向列表的就不用更改,如果是纵向列表就改选“列”。
如果发现图不理想,就要仔细察看是否数据区选择有问题,如果有误,可以点击“系列”来更改,如下图如果是X值错了就点击它文本框右边的小图标,结果如下图:出现上图后,如图在表上选取正确的数据区域。
然后点击“下一步”出现图表选项界面,如下图,上应调整选项,以满足自己想要的效果。
点击“下一步”,现在一张带标准值的完整散点图就已经完成,如下图。
完成了散点图,现在需要根据数据进行回归分析,计算回归方程,绘制出标准曲线。
其实这很简单,先点击图上的标准值点,然后按右键,点击“添加趋势线”。
如下图。
由于本例是线性关系,在类型中选“线性”如下图点击“确定”,标准曲线就回归并画好了。
标准曲线是画好了,可是我们怎么知道回归后的方程是什么样呢?这了简单,点击趋势线(也就是我们说的标准曲线)然后按右键,选趋势线格式,如下图:在显示公式和显示R平方值(直线相关系数)前点一下,勾上。
再点确定。
好了,现在公式和相关系数都出来了。
如图:呵R的平方达0.996,线性相当好。
可是有时候有的项目是成指数增加的,散点图如下图,从上图看并不值关,除了最大的一个点外其余的几乎都成了直线。
药代动力学的数学基础(中文)

药物动力学的数学基础:介绍因为药物动力学和生物药剂学有很强的数学基础,在代数、微积分、指数、对数和单位分析这些数学原理上有一个坚实的基础对学生学习这两门学科至关重要。
本章中自检方法提供对一个人基本数学技能中弱点的自我评估。
在自我检测中问题处理困难表明回顾数学本质是必要地。
在这里总结数学原理以仅达到回顾的目的。
为了一个更加完整的基本原理的讨论,应该参考一本合适的数学教科书。
数学自检方法1.浓度的单位是什么?2.一药物溶液浓度为50mg/ml,在20.5ml溶液中需药物量为多少?在0.4升?若30mg药物需溶剂量多少?3.将上述溶液转换单位:从mg/ml到g/L和μg/μl,如果药物分子质量为325Da,换算为浓度单位为多少?4.如果将20mg药物加入装水容器使浓度为0.55mg/L,容器中水的体积是多少?5.下列方程:y=0.5x+2a.画出方程的曲线b.描述该方程各部分的相关性c.如果x=0.6,y=?d.如果y=4.1,x=?6.求下列方程的解a.logx=0.95b.e x=0.44c.lnx=1.227.连接两点直线斜率是多少?y=0.5x+28.根据下图,若x=2,x=12,C=?评估与计算器和计算机的使用药物动力学需要的大多数学计算和这本书中其他计算可能通过铅笔,方格纸和逻辑思维过程完成。
拥有对数和指数运算功能的科学计算器使计算不再繁琐。
特殊的计算机软件(见附录B)可用于临床药物动力学疾病状态计算。
每当计算影响药物剂量时,应该在给定的信息条件下评估结果是否正确。
比如,对于给定的问题,考虑结果数据是否有正确的范围和单位,如果正确的结果应该在100mg到200mg之间,像结果12.5mg和1250mg就是错误的。
一个问题的答案的单位应该仔细检查,比如,如果期望值是浓度单位,那mg/L或μg/ml是可以的,像L或mg/hr一定是错误的。
错误的单位可能由错误的替换或选择了错误的公式引起。
在药物动力学计算中,只要数据和单位都正确,结果也会正确。
生化实验七 SDS一聚丙烯酰胺凝胶电泳法测定蛋白质的分子量

实验七 SDS —聚丙烯酰胺凝胶电泳法测定蛋白质的分子量一、 实验原理了解SDS-聚丙烯酰胺凝胶电泳的原理,学会用这种方法测定蛋白质的相对分子量 二、实验原理带电的颗粒(蛋白质)在电场的作用下,移动的速度是根据此公式,在同一电场强度(v /d)和电极缓冲液(η)条件下,带电的各种蛋白质成分,移动的速度决定于各蛋白质的带电量(q)和自身分子的大小(6πr)。
若使各蛋白质成分的带电量(q)相近似时,则各蛋白质成分移动的速度就只决定于各蛋白质成分自身分子的大小(6πr)。
1967年Shapiro 等人发现,在聚丙烯酰胺凝胶中加入阴离子去污剂十二烷基硫酸钠(sodium dodecylsulfate ,SDS),不影响凝胶的形成,而蛋白质的电泳迁移率则主要取决于它的自身分子量的大小。
加入SDS 之所以能获得如此的效应,是因为SDS 能打开蛋白质分子间的氢键和疏水键,使蛋白质变性成为松散的线状。
同时大多数蛋白质的每个氨基酸都能与固定量的SDS 相结合[溶液中的SDS 总量,至少要比蛋白质的量高3倍以上,大多数蛋白质与SDS 按1:1.4(W /W)的比例结合],形成SDS 一蛋白质复合物。
其结果: (1)由于SDS 解离后带有很强的负电荷,致使SDS 一蛋白质复合物都带上了相同密度的负电荷,其电量大大超过了蛋白质分子原有的电荷量,基本掩盖了不同种类蛋白质间原有的电荷差异。
(2)SDS 与蛋白质结合后,改变了蛋白质原有构象,使所有蛋白质水溶液中的形状都近似椭圆柱形。
不同SDS 一蛋白质复合物的短轴直径都一样,约为18nm ,而长轴则与蛋白质分子的大小成正比。
这样SDS 一蛋白质复合物在凝胶电泳中的迁移率,就不再受蛋白质原有电荷及其形状的影响了,而只取决于椭圆柱长度,即蛋白质分子的大小。
需要注意的是:为使SDS 与蛋白质能充分的按比例结合,必须将蛋白质间的二硫键完全打开。
因此,在用SDS 处理蛋白质样品时,必须同时用巯基乙醇处理。
