第八章血浆蛋白质的测定(精)
血浆蛋白质检查

血浆蛋白质检查血浆蛋白质检查一、主要血浆蛋白质的理化性质、功能和临床意义(一)血浆蛋白质的组成包括前白蛋白、白蛋白、α1-抗胰蛋白酶、α1-酸性糖蛋白、结合珠蛋白、α2-巨球蛋白、铜蓝蛋白、转铁蛋白、β2-微球蛋白、C-反应蛋白。
(二)功能和临床意义1.前清蛋白(PA):又称前白蛋白。
由肝细胞合成,其半寿期很短,仅约12h。
(1)功能1)参和组织修补。
2)运载蛋白:运输激素和维生素,如运输甲状腺激素和维生素A。
(2)临床意义1)营养不良指标。
2)肝功不全指标:在肝炎发病早期血清前白蛋白浓度下降往往早于其他血清蛋白成分的改变。
3)急性炎症、恶性肿瘤、肾炎时其血清浓度降低。
2.清蛋白(Alb)由肝实质细胞合成,是血浆中含量最多的蛋白质,占血浆总蛋白的57%~68%。
(1)功能①内源性氨基酸营养源;②维持血液正常pH;③血浆中主要的非特异性载体,可运输许多水溶性差的物质如胆红素、胆汁酸盐、前列腺素、类固醇激素、金属离子、多种药物等;④维持血液胶体渗透压。
(2)临床意义1)个体营养状态的评价指标:医学认定水平:Alb>35g/L时正常;28~34g/L轻度缺乏;21~27g/L中度缺乏;<21g/L严重缺乏。
当清蛋白浓度低于28g/L时,会出现水肿。
2)在血浆蛋白质浓度明显下降的情况下,可以影响许多配体在血循环中的存在形式,包括内源性的代谢物、激素和外源性的药物。
3)浓度升高:严重脱水、休克、饮水不足时。
4)浓度降低摄入不足(营养不良)合成障碍(慢性肝病)消耗增大(恶性肿瘤、甲亢、重症结核等)丢失增多(肾病综合征、严重烧伤、急性失血、组织炎症等)白蛋白分布异常(门静脉高压腹水)先天性白蛋白缺乏症(罕见)3.α1-酸性糖蛋白(AAG):又称血清类黏蛋白,包括等分子的己糖、己糖胺和唾液酸。
临床意义:主要作为急性时相反应的指标。
增高:风湿病、恶性肿瘤及心肌梗死患者常增高。
降低:在营养不良、严重肝损害等情况下。
血液生化元素的分析测定方法

血液生化元素的分析测定方法血液是构成人体的一个非常重要的组成部分,它包含了多种生化元素,如蛋白质、脂肪、糖分、细胞等,这些元素可以反映出身体的健康状态。
因此,血液生化元素的分析测定方法非常重要,可以帮助医生及时发现疾病,对健康的评估和预防也有很大的意义。
一、血液生化元素的分类血液生化元素包括蛋白质、脂肪、糖分、胆红素、酶等,这些元素可以通过化学分析、生物学检测等方法进行分析和测定。
其中,蛋白质是人体中最重要的生化元素之一,它包括多种种类,如白蛋白、球蛋白、免疫球蛋白等。
脂肪是体内储存能量的最主要的物质之一,包括胆固醇、甘油三酯、磷脂等。
糖分是人体能量的主要来源,主要指葡萄糖和果糖等。
胆红素是红细胞的主要代谢产物之一,酶则是人体各种生化反应的催化剂。
二、(一)血浆蛋白质的分析测定血浆蛋白质的分析测定是血液生化分析的基础。
目前,血浆蛋白质的测定方法主要有凝胶电泳、免疫扩散和免疫电泳等三种。
凝胶电泳是测定血浆蛋白质最常用的方法之一,它可以将血浆中的蛋白质分离出来,并根据分离出的蛋白条带比较血浆蛋白的分布情况,从而判断蛋白质异常的类型和数量。
免疫扩散法是一种基于免疫学原理的测定方法,它通过在琼脂凝胶中作用抗原和抗体,使它们互相结合沉淀。
通过比较形成的沉淀带的形态和大小,可以判断血浆蛋白质的种类和数量。
免疫电泳是凝胶电泳和免疫扩散法的结合,它将两种方法相结合,既可以准确分离出不同种类的蛋白质,又可以用染料染色,从而得到更清晰的检测结果。
(二)血液脂质的分析测定血液脂质的分析测定是血液生化分析中的又一重要部分,主要包括胆固醇、甘油三酯等测定。
目前,血浆脂质的测定方法主要有化学测定法和光度法两种。
化学测定法是一种比较常见的测定方法,它利用化学药剂作用于血浆样品中的脂质,转化为可测定的物质,然后通过比色、比重等方法测定样品中的脂质含量。
光度法是一种应用比色法或荧光法测定血脂含量的方法,它可以直接测定比色或荧光度数与标准浓度之间的关系,从而得到血液中脂质的含量。
临床医学检验临床化学技术-血浆蛋白质检查(精选试题)

临床医学检验临床化学技术-血浆蛋白质检查1、关于前白蛋白叙述错误的是()A.营养不良敏感指标B.运载蛋白C.组织修补材料D.肝炎发病早期,浓度下降晚于其他血清蛋白E.运载维生素A2、下列情况可导致α1-酸性糖蛋白降低的是()A.风湿病B.恶性肿瘤C.心肌梗死D.严重肝损伤E.糖尿病3、血浆中分子量最大的蛋白质是()A.AACB.HpC.AMGD.CERE.CRP4、下列何种情况干扰血清总蛋白的双缩脲法测定()A.高血糖B.高血钾C.高血钠D.高血钙E.血清呈乳糜状5、下列血浆蛋白中可作为机体营养不良指标的是()A.转铁蛋白B.前清蛋白C.铜蓝蛋白D.C反应蛋白E.结合珠蛋白6、与Wilson病相关的血清蛋白是()A.AAGB.TRFC.BMCD.CERE.CRP7、下列对血清蛋白质正常范围叙述错误的是()A.白蛋白正确范围为35~50g/LB.球蛋白正确范围为大于60g/LC.总蛋白正确范围为60~80g/LD.白蛋白/球蛋白比值为1.5~2.5:1E.α抗胰蛋白酶范围为小于500g/L8、关于β2-微球蛋白叙述错误的是()A.存在于所有有核细胞表面尿液B.患炎症及肿瘤时血浆中浓度可降低C.β2-微球蛋白主要用于监测肾小管功能D.急性白血病有神经浸润时,脑脊液中β2-微球蛋白可增高E.肾移植后如排斥反应影响肾小管功能时,尿液β2-微球蛋白可出现增高9、醋酸纤维薄膜电泳可把血清蛋白分成五条带,由负极数起,依次是()A.α1、α2、β、γ、AlBB.AlB、β、α1、α2、γC.AlB、α1、α2、β、γD.γ、α1、α2、β、AlBE.γ、β、α2、α1、AlB10、人体内含铁总量最多的蛋白质是()A.转铁蛋白B.铁蛋白C.肌红蛋白D.血红蛋白E.细胞色素类11、下列哪种蛋白不是由肝细胞合成的()A.白蛋白B.凝血酶原C.免疫球蛋白D.纤维蛋白原E.前白蛋白12、下列不属于运输载体类的血浆蛋白质是()A.清蛋白B.铜蓝蛋白C.转铁蛋白D.前清蛋白E.免疫球蛋白13、C反应蛋白在哪种情况下不升高()A.病毒感染B.细菌感染C.高血压D.急性心肌梗塞E.大面积烧伤14、特别适用于分子量相同而电荷不同的蛋白质分离的电泳技术为()A.醋酸纤维薄膜电泳B.琼脂糖凝胶电泳C.等点聚焦电泳D.转移电泳E.SDS-PAGE15、从血清蛋白电泳中区别出脂蛋白的方法是()A.特殊缓冲剂B.不同等电点C.不同支持介质D.特殊染色方法E.蛋白区带位置16、下列哪项可导致血清总蛋白增高()A.消耗增加B.营养不良C.丢失过多D.脱水E.肝功能障碍17、下列关于电泳的支持介质,叙述错误的是()A.电渗作用越小越好B.支持物应有一定的坚韧度并适于保存C.对支持介质的基本要求是有化学惰性D.电渗方向与电泳方向相反时,则电泳速度加快E.电渗方向与电泳方向一致时,则电泳速度加快18、不属于急性时相反应蛋白的是()A.AlbB.AAGC.HpD.LDLE.C319、关于蛋白电泳的下列叙述,何种是错误的()A.电压为电流与电阻的乘积B.缓冲液浓度越高,分离色带越清楚C.缓冲液的离子强度越高,温度越高D.血清和血浆的电泳染色结果完全相同E.不同电泳介质分离效果不同20、患者主诉骨痛,血浆蛋白质电泳图谱的变化为ALB减少,β-γ区带出现典型M蛋白,此患者最可能是()A.急性肝炎B.肾病综合征C.慢性乙型肝炎D.多发性骨髓瘤E.急性时相反应症21、肾病综合征患者的特征性血清蛋白电泳图谱为()A.清蛋白↓↓,α1↑,α2↑↑,不定β-γ↑B.清蛋白↓↓,α1N↓,α2N↓,β-γ↑C.清蛋白↓,α1↑,α2↑,β,γND.在β~γ区带间出现M蛋白区带E.清蛋白↓↓,α1↑↓,α2,β,γ↑22、肝硬化患者的特征性血清蛋白电泳图谱为()A.清蛋白↓↓,α1↑,α2↑↑,不定β-γ↑B.清蛋白↓↓,α1N↓,α2N↓,β-γ↑C.清蛋白↓,α1↑,α2↑,β,γND.在β~γ区带间出现M蛋白区带E.清蛋白↓↓,α1↑↓,α2,β,γ↑23、多发性骨髓瘤患者的特征性血清蛋白电泳图谱为()A.清蛋白↓↓,α1↑,α2↑↑,不定β-γ↑B.清蛋白↓↓,α1N↓,α2N↓,β-γ↑C.清蛋白↓,α1↑,α2↑,β,γND.在β~γ区带间出现M蛋白区带E.清蛋白↓↓,α1↑↓,α2,β,γ↑24、下列哪一组属于急性时相反应蛋白()A.α1-酸性糖蛋白,结合珠蛋白,铜蓝蛋白,C反应蛋白B.转铁蛋白,血红素结合蛋白,甲胎蛋白,结合珠蛋白C.甲胎蛋白,C反应蛋白,血红素蛋白,铜蓝蛋白D.铜蓝蛋白,血红素蛋白,结合珠蛋白,转铁蛋白E.免疫球蛋白,白蛋白,α-酸性糖蛋白,C反应蛋白25、某研究单位为了观察静脉营养对胃大部切除的狗的治疗效果,其采集了动物血浆准备探讨双组的血浆中蛋白质总量的差异。
医学检验--血浆蛋白质检查
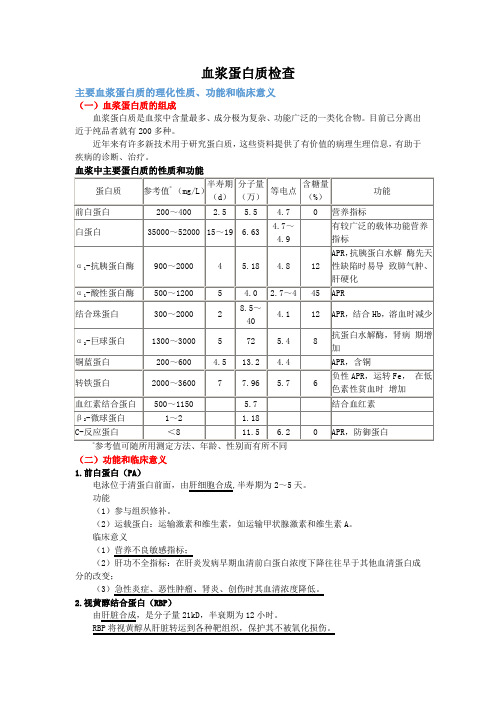
血浆蛋白质检查主要血浆蛋白质的理化性质、功能和临床意义(一)血浆蛋白质的组成血浆蛋白质是血浆中含量最多、成分极为复杂、功能广泛的一类化合物。
目前已分离出近于纯品者就有200多种。
近年来有许多新技术用于研究蛋白质,这些资料提供了有价值的病理生理信息,有助于疾病的诊断、治疗。
参考值可随所用测定方法、年龄、性别而有所不同(二)功能和临床意义1.前白蛋白(PA)电泳位于清蛋白前面,由肝细胞合成,半寿期为2~5天。
功能(1)参与组织修补。
(2)运载蛋白:运输激素和维生素,如运输甲状腺激素和维生素A。
临床意义(1)营养不良敏感指标;(2)肝功不全指标:在肝炎发病早期血清前白蛋白浓度下降往往早于其他血清蛋白成分的改变;(3)急性炎症、恶性肿瘤、肾炎、创伤时其血清浓度降低。
2.视黄醇结合蛋白(RBP)由肝脏合成,是分子量21kD,半衰期为12小时。
RBP将视黄醇从肝脏转运到各种靶组织,保护其不被氧化损伤。
在血浆中RBP与TTR(甲状腺素转运蛋白)以1:1结合,可避免小分子RBP从肾小球滤过。
在靶细胞内,随TTR-RBP复合物的降解,视黄醇被摄入细胞。
3.白蛋白(Alb)Alb由肝细胞合成。
白蛋白是血浆中含量最多的蛋白质,占总蛋白的57%~68%。
功能(1)内源性氨基酸营养源;(2)维持血浆的胶体渗透压;(3)具有酸碱缓冲能力,维持血浆的正常pH;(4)运输和储存作用:是血浆中主要的非特异性载体。
可运输许多水溶性差的物质如胆红素、胆汁酸盐、前列腺素、类固醇激素、金属离子、多种药物等。
因分子量较小,它在血管外体液中的浓度可作为各种膜屏障完整性的良好指标。
临床意义(1)个体营养状态的评价指标。
(2)血浆蛋白质浓度明显下降时,可以影响一些内源性的代谢物、激素和外源性的药物在血液循环中的存在形式。
(3)血浆的清蛋白增高较少见,血液浓缩如严重脱水、休克、饮水不足等。
(4)浓度降低见于①白蛋白合成降低,如急、慢性肝病;②营养或吸收不良;③组织损伤或炎症引起的白蛋白分解代谢增加如大面积组织损伤;④消耗性疾病(恶性肿瘤,严重感染等);⑤白蛋白异常丢失,如肾病综合征、慢性肾炎等;⑥白蛋白分布异常,如有门静脉高压腹水时;⑦遗传性疾病等。
实验九 血浆蛋白测定

• 清蛋白 试剂 1.琥珀酸缓冲液75mmol/L 2.溴甲酚绿 3.Brij35(30%)ቤተ መጻሕፍቲ ባይዱ.15mmol/L 主要性能指标 1.试剂空白吸光度A ≤0.25
2.准确性:相对偏差不超过±4% 3.重复性:变异系数≤5% 4.批间差: ≤3%
5.线性误差:10-60不超过±10% 6.校准液溯源性:校准液的溯源于ROCHE公司的 Calibrator for automated systems中清蛋白校 正血清 注意事项 1.如果样品中蛋白浓度超过60g/L用生理盐水稀释 样品,重新测定,结果乘以稀释倍数。 2.本产品在2-8度条件下储存
实验九 血浆蛋白测定
一、血清总蛋白测定
(一)凯氏定氮法(Kjeldahl method) (二)双缩脲法 (三)酚试剂法(phenol ragent method) (四)紫外分光光度法 (五)染料结合法 (六)比浊法
二、血清清蛋白测定
溴甲酚绿(bromcresol green,BCG)和 溴甲酚紫(bromcresol purple,BCP)
实验操作:
TP : 蒸馏水 标准液 血清 试剂 空白 100μl 标准 100μl 5ml 5ml 测定
100μl 5ml
37℃,10min 540nm比色
ALB: 蒸馏水 标准液 血清 试剂 空白 20μl 标准 20μl 4ml 4ml 测定
20μl 4ml
混匀 5min 630nm比色
• 总蛋白
试剂
氢氧化钠 0.6mmol/L 酒石酸钾钠32mmol/L 碘化钾20mmol/L 硫酸铜12mmol/L
主要性能指标
1.试剂空白吸光度在546处≤0.20 2.准确性相对偏差不超过±4% 3.重复性:变异系数≤5% 4.批间差: ≤3%
2020检验学考试资料:血浆蛋白质检查要点

血浆蛋白质检查要点一提到蛋白质大家可能最先想到是鸡蛋、牛奶、豆浆和瘦肉等各类食物,蛋白质作为主要的一类营养物质与人们的日常生活息息相关。
人体血浆中的蛋白质除营养作用外还具备多种生理功能,对其进行定性、定量的检测对机体生理功能的评估具有重要作用。
血浆蛋白质检查主要考察功能、实验室检测及主要血浆蛋白质这三大方面。
一、血浆蛋白质具有九大功能:1.营养作用。
2.维持血浆胶体渗透压。
3.充当运输载体。
4.缓冲血液PH。
5.起到催化作用的酶。
6.抑制组织蛋白酶的作用。
7.参与机体的代谢调控。
8.参与凝血,纤溶过程。
9.参与体液免疫(免疫球蛋白)。
蛋白质功能在考试中常爱出现,要求重点掌握,这里整理一条口诀帮助大家来记忆:运输营养渗透压,酶促抑制代调控,凝溶免疫PH。
二、血浆蛋白质测定:1.血清蛋白电泳分析蛋白质主要分为清蛋白和球蛋白两大类,正常情况下通过电泳可以得到五个区带分别对应清蛋白、α1球蛋白、α2球蛋白、β球蛋白、γ球蛋白。
在疾病状态时电泳图谱会发生相应改变。
肾病综合症时清蛋白下降;肝硬化出现融合区带β-γ桥。
M蛋白血症的M蛋白常在γ或β带出现。
2.血浆蛋白质定量检测利用双缩脲比色法测定总蛋白,溴甲酚绿法测定清蛋白,球蛋白由总蛋白、清蛋白差值计算得出。
清/球蛋白比(A/G)正常值1~2/1。
比值下降提示实质性的肝损伤。
三、主要血浆蛋白质主要的血浆蛋白质包括:前清蛋白(PA)、清蛋白(ALb)、α1-抗胰蛋白酶(AAT)、α1-酸性糖蛋白(AAG)、触珠蛋白(Hp)、α2-巨球蛋白(AMG)、铜蓝蛋白(CP/CER)、转铁蛋白(TF/TRF)/C-反应蛋白(CRP)、血清淀粉样蛋白A(SAA)、β2-微球蛋白(β2-MG)名称和缩写要能够与之对应。
种类很多同样可以通过口诀帮助记忆:前清蛋白清蛋白,抗胰酸性α1白,触珠铜蓝是α2,转铁微球β带,还有C反淀粉样,别忘巨球非时相。
总结下具有代表性的特点:具有运输作用有PA、ALb、CER、TRF;ALb血浆中含量最多,是重要的营养蛋白;血浆中最大蛋白的AMG;肝病时PA变化较ALb早;溶血时Hp的含量是下降的。
血浆蛋白质的测定(精)

第八章血浆蛋白质的测定第一节概述一、血浆蛋白质的组成及功能血浆蛋白质是血浆固体成份中含量最多、组成复杂、功能广泛的一类化合物。
占血浆固体成份90%左右,目前已经研究的血浆蛋白质有300多种,分离出的纯品约100来种,除免疫球蛋白外,主要由肝细胞合成,主要功能。
1. 维持血浆胶体渗透压;清蛋白。
2. 作为某些物质的载体,起运输作用;如清蛋白能与多种物质结合(FA、胆红素),某些球蛋白具特异地运输某些物质的功能,运铁蛋白、运皮质醇蛋白。
3. 维持体液pH恒定;血浆蛋白pI一般都小于7.4是弱酸,一部分以弱酸盐形式存在,构成缓冲对。
4. 免疫功能;血浆中许多具有免疫功能的球蛋白,主要由浆细胞合成,电泳时位于γ区带,如IgG、IgA、IgM、IgD、IgE,此外,还有具有免疫作用的非特异球蛋白,如补体。
5. 凝血与纤溶作用;凝血与纤溶是一对矛盾的统一、凝血因子与纤溶因子绝大部分是血浆蛋白质,它们促进血液凝固,防止血液流失和溶解血栓,防止重要脏器的动脉栓塞。
6. 营养作用;血浆蛋白质可分解成AA,用于合成组织蛋白或氧化供能。
7. 催化作用;血浆中有许多酶类,其中部分在血浆中发挥作用,称血浆功能性酶,如凝血酶原、纤溶酶原、铜蓝蛋白、LPL、LCAT、肾素等。
二、个别血浆蛋白质(一)前白蛋白(prealbumin,PA)分子量5.4万,由肝细胞合成,电泳时移动速度较白蛋白快,位于其前方面得名,半寿期短12h,PA是一类运载蛋白,一种能与甲状腺素结合,称为甲状腺结合蛋白,一种能与VitA结合,称为VitA 结合蛋白,常用测定方法是免疫学方法,正常参与范围0.2~0.4g /L,急性炎症,恶性肿瘤,肝硬化或肾炎时下降。
(二)白蛋白(albumin,Alb)分子量66458,由肝实质细胞合成,半寿期15~19天,是血浆中含量最多的蛋白质,占40%~60%,主要功能,维持血浆胶体渗透性,缓冲作用,运输作用,营养作用,调节某些激素或药物活性。
血浆蛋白质的测定(精)

第八章血浆蛋白质的测定第一节概述一、血浆蛋白质的组成及功能血浆蛋白质是血浆固体成份中含量最多、组成复杂、功能广泛的一类化合物。
占血浆固体成份90%左右,目前已经研究的血浆蛋白质有300多种,分离出的纯品约100来种,除免疫球蛋白外,主要由肝细胞合成,主要功能。
1. 维持血浆胶体渗透压;清蛋白。
2. 作为某些物质的载体,起运输作用;如清蛋白能与多种物质结合(FA、胆红素),某些球蛋白具特异地运输某些物质的功能,运铁蛋白、运皮质醇蛋白。
3. 维持体液pH恒定;血浆蛋白pI一般都小于7.4是弱酸,一部分以弱酸盐形式存在,构成缓冲对。
4. 免疫功能;血浆中许多具有免疫功能的球蛋白,主要由浆细胞合成,电泳时位于γ区带,如IgG、IgA、IgM、IgD、IgE,此外,还有具有免疫作用的非特异球蛋白,如补体。
5. 凝血与纤溶作用;凝血与纤溶是一对矛盾的统一、凝血因子与纤溶因子绝大部分是血浆蛋白质,它们促进血液凝固,防止血液流失和溶解血栓,防止重要脏器的动脉栓塞。
6. 营养作用;血浆蛋白质可分解成AA,用于合成组织蛋白或氧化供能。
7. 催化作用;血浆中有许多酶类,其中部分在血浆中发挥作用,称血浆功能性酶,如凝血酶原、纤溶酶原、铜蓝蛋白、LPL、LCAT、肾素等。
二、个别血浆蛋白质(一)前白蛋白(prealbumin,PA)分子量5.4万,由肝细胞合成,电泳时移动速度较白蛋白快,位于其前方面得名,半寿期短12h,PA是一类运载蛋白,一种能与甲状腺素结合,称为甲状腺结合蛋白,一种能与VitA结合,称为VitA 结合蛋白,常用测定方法是免疫学方法,正常参与范围0.2~0.4g /L,急性炎症,恶性肿瘤,肝硬化或肾炎时下降。
(二)白蛋白(albumin,Alb)分子量66458,由肝实质细胞合成,半寿期15~19天,是血浆中含量最多的蛋白质,占40%~60%,主要功能,维持血浆胶体渗透性,缓冲作用,运输作用,营养作用,调节某些激素或药物活性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章血浆蛋白质的测定教学目的:掌握:急性时相反应蛋白的概念;个别血浆蛋白质特别是血浆中的白蛋白、前白蛋白的临床意义。
熟悉:血浆蛋白质的理化性质、功能与临床意义。
了解:血浆蛋白质测定的临床意义:疾病时血浆蛋白质的变化(肝疾病)等重点:急性时相反应蛋白的概念;个别血浆蛋白质特别是血浆中的白蛋白、前白蛋白的临床意义。
难点:急性时相反应蛋白的概念和种类教学方法和手段:课堂讲授为主,多媒体教学为辅,课堂提问突出重点。
授课时数:6学时教学内容及组织:第一节概述一、血浆蛋白质的组成及功能血浆蛋白质是血浆固体成份中含量最多、组成复杂、功能广泛的一类化合物。
占血浆固体成份90%左右,目前已经研究的血浆蛋白质有300多种,分离出的纯品约100来种,除免疫球蛋白外,主要由肝细胞合成,主要功能。
1. 维持血浆胶体渗透压;清蛋白。
2. 作为某些物质的载体,起运输作用;如清蛋白能与多种物质结合(FA、胆红素),某些球蛋白具特异地运输某些物质的功能,运铁蛋白、运皮质醇蛋白。
3. 维持体液pH恒定;血浆蛋白pI一般都小于7.4是弱酸,一部分以弱酸盐形式存在,构成缓冲对。
4. 免疫功能;血浆中许多具有免疫功能的球蛋白,主要由浆细胞合成,电泳时位于γ区带,如IgG、IgA、IgM、IgD、IgE,此外,还有具有免疫作用的非特异球蛋白,如补体。
5. 凝血与纤溶作用;凝血与纤溶是一对矛盾的统一、凝血因子与纤溶因子绝大部分是血浆蛋白质,它们促进血液凝固,防止血液流失和溶解血栓,防止重要脏器的动脉栓塞。
6. 营养作用;血浆蛋白质可分解成AA,用于合成组织蛋白或氧化供能。
7. 催化作用;血浆中有许多酶类,其中部分在血浆中发挥作用,称血浆功能性酶,如凝血酶原、纤溶酶原、铜蓝蛋白、LPL、LCAT、肾素等。
二、个别血浆蛋白质(一)前白蛋白(prealbumin,PA)分子量5.4万,由肝细胞合成,电泳时移动速度较白蛋白快,位于其前方面得名,半寿期短12h,PA是一类运载蛋白,一种能与甲状腺素结合,称为甲状腺结合蛋白,一种能与VitA结合,称为VitA 结合蛋白,常用测定方法是免疫学方法,正常参与范围0.2~0.4g /L,急性炎症,恶性肿瘤,肝硬化或肾炎时下降。
(二)白蛋白(albumin,Alb)分子量66458,由肝实质细胞合成,半寿期15~19天,是血浆中含量最多的蛋白质,占40%~60%,主要功能,维持血浆胶体渗透性,缓冲作用,运输作用,营养作用,调节某些激素或药物活性。
白蛋白可微量地通过肾小球,约0.04%,但大部分被血小管重吸收。
白蛋白的测定方法目前主要是溴甲酚绿(BCG)法,正常参考范围35~55g/L,血浆白蛋白增高临床少见,主要见于严重失水引起血液浓缩,血浆白蛋白降低临床常见。
①合成障碍急;慢性肝炎。
②丢失过多;肾病综合症、慢性肾小球、肾炎、糖尿病、系统性斑狼疮等。
③分解过多;营养不良,慢性胃肠道疾病。
(三)α1-酸性糖蛋白(α1-acid glycoprotein,AAG)、分子量约4万,含糖约45%,pI2.7~3.5,主要由肝细胞合成,某些肿瘤组织也可合成。
AAG是主要的急性时相反应蛋白,急性炎症时上升,与免疫防御功能有关。
AAG测定方法,使用AAG抗体,进行免疫扩散法或免疫比浊法检测,正常参考范围0.5~1.5g/L,主要作为急性时相反应的指标,风湿病、恶性肿瘤、心肌梗塞患者上升,营养不良、严重肝病下降。
(四)α1-抗胰蛋白酶(α1-antitrypsin,α1AT或AAT),分子量5.5万,pI4.8,含糖10%~12%,电泳时位于α1区带,占90%左右,由肝细胞合成,能抑制多种酶活性,尤其是蛋白酶,占血清中抑制蛋白酶活力的90%左右,抑制作用有明显的pH依赖性,在中性和弱碱性中活力最大。
AAT也是一种急性时相反应蛋白,主要功能是对抗多形核白细胞吞噬作用时释放的溶酶体蛋白水解酶。
AAT测定方法,目前主要采用免疫化学法,正常参考范围,新生儿血清1.45~2.7g/L,成人0.78~2.0g/L,AAT下降见于胎儿呼吸窘迫症,AAT缺陷所致的肺气肿、肝硬化等,AAT上升见于急性炎症、外科手术后,长期服用可的松药物,妊娠及服用避孕药物。
(五)甲胎蛋白(α1-fetoprotein,AFP)分子量6.5~7万,pI4.75含糖量4%,主要由胎儿肝合成,妊娠13~15周血清AFP含量最高,以后逐渐下降,出生时仅为高峰期的1%~0.1%,周岁时接近成人水平,仅10~30μg /L,功能不详。
AFP作为肿瘤标志物,对原发性肝Ca的诊断很有价值,80%以上原发性肝Ca患者血清AFP上升,但无特异性,肺Ca、胰腺Ca,肝硬化患者血清AFP亦升高,此外,羊水AFP含量测定可用于胎儿产前监测,AFP↑提示胎儿畸形(神经管缺损、脊柱裂、无脑儿),死胎。
AFP测定方法,火箭电泳放射自显影,放射免疫分析法,灵敏度特异性很高,有放射污染。
反向间接血凝法(RPHA),操作简便,定量不够精细,适合于普查、筛选。
酶联免疫法(ELISA),灵敏度接近放免,且操作简便,无放射污染,便于推广。
(六)结合珠蛋白(haptoglobin,Hp)又名触珠蛋白,是一种糖蛋白,主要由肝合成,电泳时位于α2区带,是一种急性时相反应蛋白,为两对肽链组成的四聚体(α2β2),α链有α1和α2两种,其中α1有两种遗传变异体。
Hp的主要功能与血浆中游离血红蛋白结合,(不可逆结合),并送至肝细胞内降解,因此Hp在溶血后含量急剧下降。
血浆Hp测定方法,①测定Hp-Hb复合物中过氧化物酶活性。
②在血浆中加入过量Hb,生成Hp-Hb复合物,凝胶层折法收复合物分离,测定结合的Hb。
③电泳法。
④免疫分析法,正常参考范围0.3~2.15g/L,个体间变异较大。
急性时相反应中血浆Hp上升,烧伤、肾病综合征引起Alb丢失时Hp上升,血管内溶血Hp下降。
(七)α2-巨球蛋白(α2-macroglobulin,α2MG或AMG)是血浆中分子量最大的蛋白质,分子量为62.5~80万,含糖量8%。
AMG最突出的特性能与多种分子和离子结合,特别是它能与不少蛋白水解酶结合而影响这些酶的活性,有选择地保护某些蛋白酶活性的作用。
AMG由肝细胞与单核吞噬细胞系统合成,半寿期5天。
AMG测定方法,免疫化学法,正常参考范围1.25~4.10g /L,在低Alb血症,AMG上升,妊娠、服用避孕药时AMG上升。
(八)铜蓝蛋白(ceruloplasmin,CER)含铜的糖蛋白,分子量约12~16万,含糖量约10%,因含铜而呈蓝色,故名铜蓝蛋白。
CER具有氧化酶活性,使血液中Fe2+氧化成Fe3+,故又称亚铁氧化酶。
CER 还起着抗氧化剂的作用。
防止组织中脂质过氧化物和自由基的生成,CER属于急性时相反应蛋白,血浆CER在感染、创伤、肿瘤上升,Wilson病(肝点状核变性)CER下降。
CER测定方法,根据其氧化酶活性或免疫化学法,成人正常参考范围0.2~0.5g/L。
(九)转铁蛋白(transferrin,TRF)血浆中主要含铁蛋白质,分子量7.7万,含糖约6%,由肝及网状皮系统合成,半寿期7天。
主要运载由消化道吸收的铁和RBC降解释放的铁,此外还可逆地结合多价金属离子,如Ca、Zn、Cu等。
TRF测定方法,扩散法、放免法、散射比浊法,成人正常参考范围2.2~4.0g/L。
TRF在急性时反应中下降,如炎症、恶性病变时、TRF、Alb、PA同时下降,慢性肝病,营养不良亦下降,妊娠、口服避孕药,注射雌激素TRF上升。
(十)β2-微球蛋白(β2-microglobulin,BMG)分子量11800,存在于所有有核细胞的表面,特别是淋巴细胞和肿瘤细胞并由此释放入血,半寿期107mim。
作为人类淋巴细胞抗原β链交部分。
BMG测定方法,由于含量很低,常采用放免法,正常参考范围1.0~2.5mg/L。
主要用于监测肾小管功能,特别是肾移植后,如有排斥反应,BMG在尿中排出量上升,肾功能衰竭,炎症、肿瘤血浆BMG上升。
(十一)C-反应蛋白(C-reactive protein,CRP),是一种能结合肺炎双球菌细胞壁C-多糖的蛋白质,分子量11.5~14万,五条肽链组成,肝细胞合成。
CRP能激活补体,促进粒细胞巨噬细胞的运动和吞噬,具有调理素样作用。
CRP测定方法,免疫扩散法,火箭免疫电泳法,ELISA法,放免法,正常参考范围:成人0.42~5.2mg/L。
作为急性时相反应的一个极灵敏指标,急性心肌梗死,创伤、感染、炎症、外科手术、肿瘤浸润迅速上升。
血浆蛋白质的组成与含量组成分子量功能正常参考值临床意义前白蛋白(PA)5.4万运载T3、T4、VitA0.2-0.4g/L营养不良、肿瘤、急性炎症、肝病↓白蛋白(Alb)6.6万维持胶渗、缓冲作用、运输作用35-55g/L慢性肝炎、肝硬化、肾炎↓α1-酸性糖蛋白(AAG)4万与免疫功能有关0.5-1.5g/L风湿病、恶性肿瘤、心肌梗塞↑α1-抗胰蛋白酶(AAT)5.5万对抗溶酶体蛋白水解酶0.78-2g/L胎儿呼吸窘迫症、肺气肿、急性炎症、妊娠↑甲胎蛋白(AFP) 6.5-7万10-30μg/L 原发性肝癌↑羊水AFP胎儿产前监测结合珠蛋白8-40万与血浆中游离Hb结合0.3-2.05g/L Alb丢失时↑、溶血时↓α1-巨球蛋白(AMG)62.5-80万与蛋白水解酶结合影响其活性1.25-401g/L低Alb、妊娠、口服避孕药↑铜蓝蛋白(CER)12-16万使Fe2+→Fe3+,抗氧化剂0.2-0.5g/L感染、创伤、肿瘤↑、Wilson病↓转铁蛋白(TRF)7.7万运载Fe3+ 2.2-4.0g/L炎症、恶性病变、慢性肝病↓妊娠、口服避孕药↑β2-微球蛋白(BMG)1.18万淋巴细胞抗原一部分1-2.6mg/L肾小管功能监测,肾衰、炎症、肿瘤↑C-反应蛋白(CRP)10.5-14万激活补体、促进粒C、巨噬C的运动和吞噬0.42-5.2mg/L急性心肌梗塞、创伤、感染、炎症、手术后、妊娠↑↑上述蛋白质除PA、Alb、BMG外都属于糖蛋白,含糖量最高的是AAG、45%,除BMG外都主要由肝细胞合成。
三、疾病时的血浆蛋白质(一)炎症、创伤在炎症、创伤、感染、心肌梗塞、肿瘤等情况下其血浆浓度会发生明显改变的蛋白质称为急性时相反应蛋白(acute phcse reactante,APR),主要包括AAG、AAT、Hp、CER、C3、C4、纤维蛋白原、CRP↑;PA、Alb、TRF↓。
(二)肝脏疾病血浆蛋白质大多数是由肝细胞合成,因此肝脏疾病会导致多种血浆蛋白质发生变化。
如乙肝活动期AAT、IgM↑;而Hp、PA、Alb↓。
肝硬化时AAT、IgA、AMG↑↑;IgG↑;CER、CRP轻度↑;而AAG、Hp、C3↓;PA、Alb、TRF↓↓。
