化学计量的相关计算
化学计量与化学反应的计算

化学计量与化学反应的计算化学计量是研究化学反应中各种物质之间的数量关系的分支学科。
化学反应的计算是根据反应的化学方程式,通过计算出反应物与生成物的数量关系,从而确定反应物与生成物的摩尔比例和化学计量关系。
本文将介绍一些常见的化学计量和化学反应的计算方法。
一、化学计量问题化学计量问题主要涉及到反应物的物质量、物质的摩尔数和物质的体积等方面的计算。
常见的化学计量问题包括:1. 摩尔质量计算:根据元素的原子质量和分子式,计算出物质的摩尔质量。
摩尔质量的计算公式为:摩尔质量 = 原子质量1 ×原子个数1 + 原子质量2 ×原子个数2 + ... + 原子质量n ×原子个数n。
2. 摩尔比例计算:根据化学方程式,计算反应物与生成物之间的摩尔比例。
摩尔比例可以通过化学方程式中的系数来确定,系数表示了反应物与生成物之间的物质的摩尔比例关系。
3. 反应物的量与物质量关系计算:根据已知的反应物的物质量,通过化学方程式和摩尔质量的计算,可以确定反应物的摩尔数。
摩尔数可以与化学方程式中的系数进行比较,从而得到反应物的摩尔比例关系。
4. 体积与摩尔数关系计算:根据气体的理想气体状态方程和摩尔体积的概念,可以将气体的体积与其摩尔数之间建立数学关系。
根据气体体积和摩尔体积之间的关系,可以计算气体的摩尔数和摩尔比例。
二、化学反应计算方法在化学反应中,反应物的量与生成物的量之间存在一定的摩尔比例关系。
根据这个关系,可以通过已知物质量和化学方程式中的摩尔比例关系,计算出生成物的摩尔数。
化学反应的计算方法包括:1. 已知反应物的物质量,求生成物的物质量:根据已知反应物的物质量和反应物与生成物的摩尔比例关系,可以计算出生成物的物质量。
计算公式为:生成物的物质量 = 已知反应物的物质量 ×生成物的摩尔数 / 反应物的摩尔数。
2. 已知反应物的物质量,求生成物的摩尔数:根据已知反应物的摩尔质量和反应物与生成物的摩尔比例关系,可以计算出生成物的摩尔数。
化学计量知识点

化学计量知识点化学计量是化学中一个非常重要的概念,它帮助我们从定量的角度理解化学反应以及物质的组成和变化。
接下来,让我们逐步深入了解化学计量的相关知识。
首先,我们来谈谈物质的量。
物质的量是表示含有一定数目粒子的集合体的物理量,单位是摩尔(mol)。
1 摩尔任何粒子所含的粒子数都约为 602×10²³个,这个常数被称为阿伏伽德罗常数。
比如说,我们要计算一定质量的某种物质所含粒子的数目,就需要用到物质的量。
假设我们有 18 克水,水的摩尔质量是 18 克/摩尔,那么水的物质的量就是 1 摩尔。
因为 1 摩尔水中含有阿伏伽德罗常数个水分子,所以 18 克水中水分子的数目就约为 602×10²³个。
再来说说摩尔质量。
摩尔质量是指单位物质的量的物质所具有的质量,单位是克/摩尔。
对于一种物质,其摩尔质量在数值上等于该物质的相对原子质量或相对分子质量。
例如,氧气(O₂)的相对分子质量约为 32,那么氧气的摩尔质量就是 32 克/摩尔。
气体摩尔体积也是化学计量中的一个重要概念。
在标准状况下(0℃、101kPa),1 摩尔任何气体所占的体积都约为 224 升,这个体积叫做气体摩尔体积。
但需要注意的是,气体摩尔体积的数值会随着温度和压强的变化而改变。
例如,在相同条件下,1 摩尔氢气(H₂)和 1 摩尔氧气(O₂)的体积都约为224 升。
但如果温度升高或压强降低,气体体积就会增大;反之,如果温度降低或压强增大,气体体积就会减小。
物质的量浓度在化学实验和计算中经常用到。
它是以单位体积溶液里所含溶质 B 的物质的量来表示溶液组成的物理量,单位是摩尔/升。
比如,我们配制 1 升浓度为 2 摩尔/升的氯化钠(NaCl)溶液,就需要称取 117 克氯化钠溶解在适量水中,然后再加水稀释至 1 升。
在化学反应中,化学计量数有着重要的意义。
化学方程式中的化学计量数不仅表示了反应物和生成物之间的粒子个数比,还表示了它们之间的物质的量之比。
2020届高三化学题型强化训练——化学计量的相关计算

2020届高三化学题型强化训练——化学计量的相关计算1 / 252020届届届届届届届届届届届——届届届届届届届届届一、单选题(本大题共20小题,共40分)1. 标准状况下,将VLA 气体(摩尔质量为M g/mol)溶于0.1L 水中,所得溶液密度为ρg/mL ,则此溶液物质的量浓度为( )A. VρMV+2240 mol/LB. 1000VρMV+2240 mol/LC. 100VρMV+2240 mol/LD. 1000+VρMMV+2240 mol/L2. 在200mL 含Mg 2+、Al 3+、NH 4+、H +、Cl −等离子的溶液中,逐滴加入4mol/L 的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述正确的是( )A. 原溶液中n(Mg 2+):n(Al 3+)=10:1B. 原溶液中的c(H +)=0.8mol/LC. x 与y 的差值为0.01molD. 原溶液中c(Cl −)=0.66mol/L3. 往含0.2mol NaOH 和0.1mol Ba(OH)2的溶液中持续稳定地通入CO 2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO 2气体的体积关系正确的图象是(气体的溶解忽略不计)( )A. B.C. D.4. 1.52g铜镁合金完全溶解于50mL密度为1.40g⋅mL−1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0mol⋅L−1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是()A. 该合金中铜与镁的物质的量之比是1:2B. 该浓硝酸中HNO3的物质的量浓度是14.0mol⋅L−1C. NO2和N2O4的混合气体中,NO2的体积分数是80%D. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL5.将一定量Mg、Al合金溶于1mol⋅L−1的HCl溶液中,进而向所得溶液中滴加1mol⋅L−1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液体积(mL)的图示如下。
化学计量在方程式中的计算
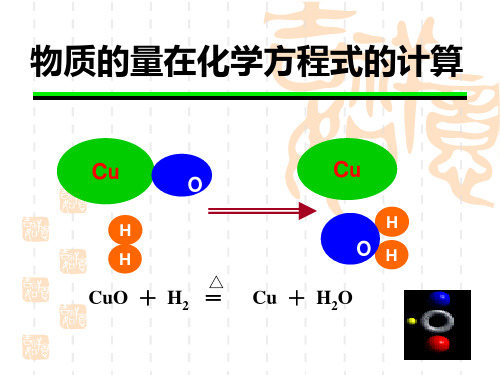
物质的量在化学方程式的计算
Cu
O
H
H △
CuO + H2 =
Cu
H
OH Cu + H2O
回忆以物质的量为核心的计算公式 V(气体)
÷Vm ×Vm
N ÷NA n ×M
×NA
÷M
m
÷V(溶液) ×V(溶液)
C
方程式中化学计量数与物质的量的关系
MnO2+4HCl==MnCl2+ Cl2 化学计量数 1 : 4 : 1 : 1 : 2 +2H2O
一题多变
1、完全中和0.1 mol NaOH,所需H2SO4 的质量是多少?
2、将8.1g铝与足量的氢氧化钠反应, 计算生成氢气 ___ L,需要氢氧化钠 __ mol。
已知:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑
综合计算
某盐酸的 =1.18g/cm3,HCl的质量分
数为36.5%。求①该盐酸物质的量浓度是 多少?②200mL该盐酸与过量铁屑充分反 应,生成 H2的体积(标况状况下)是多少? 若反应后溶液体积变化忽略不计则FeCl2 物质的量浓度是多少?有多少克FeCl2?
能生成氢气___L(标准状况)。盐酸的物 质的量浓度为___。
Zn + 2HCl = ZnCl2 + H2↑
1
2
1
n(Zn)
n(HCl)
n(H2)
化学方程式计算的步骤
设 设所求物质的物质的量n 写 写出相关的化学方程式
在化学式下面标出化学计量数及所 标 求物质的物质的量 列 列出比例式 解 根据比例式求n,再求V、C、m 答 简明地写出答案
粒子数N之比 1 : 4 : 1 : 1 : 2 扩大NA倍 1NA : 4NA : 1NA : 1NA : 2NA
化学计量的相关计算

化学计量的相关计算物质的量摩尔质量一、物质的量(一)物质的量(n)1.定义:表示含有一定数目微观粒子的集合体的一个物理量2.单位: 摩尔(简称“摩”),符号:mol▲把含有6.02×1023个粒子的任何粒子集体计量定为1摩尔▲物质的量与微观粒子数之间成正比:n1/n2=N1/N23.使用物质的量应注意事项:①物质的量这四个字是一个整体,是专用名词,不得简化或增添任何字。
②物质的量只能描述分子、原子、离子、中子、质子等微观粒子,不能描述宏观物质,用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。
如:1 mol H、1 mol H+、1 mol H2 ,不能用“1 mol 氢”这样含糊无意义的表示。
③物质的量计量的是粒子的集合体,不是单个粒子,物质的量的数值可以是整数,也可以是小数。
(二)阿伏加德罗常数(N A)事实证明,1mol粒子集体所含的粒子数与0.012g 12C所含的碳原子数相同,约为6.02 ×1023。
国际上把1mol任何粒子集体所含的粒子数叫做阿伏伽德罗常数。
(12C是指原子核内有6个质子和6个中子的碳原子。
)1.阿伏加德罗常数(1)含义:科学上规定把0.012kg12C中所含有的碳原子数叫做阿伏加德罗常数。
(2)符号:N A(3)单位:mol-1(4)近似值:6.02×1023mol-1(5)物质的量(n),阿伏加德罗常数(N A)与粒子数(N)三者之间关系:n=N/NA。
(三)物质的量、阿伏加德罗常数与粒子数间的关系粒子数(N)、物质的量(n)和质量(m)之间的关系:【例题】在0.5 mol O2中含有的氧原子数目是多少?随堂练习:1.1 mol C中约含有个碳原子2.0.3 mol H2SO4含有个硫酸分子3.1.204 ×1024个H2O2分子的物质的量为。
4.1 mol Na2CO3中约含有__ _molNa+、_ __molCO32-离子,共含有离子的个数为__________个。
化学计量的相关计算

化学计量的相关计算化学计量是研究化学反应中物质的质量关系的学科。
它涉及到对化学方程式的解读和化学反应的质量关系进行计算。
化学计量的相关计算包括化学方程式的平衡计算、反应物的摩尔关系计算以及反应的产物计算等。
一、化学方程式的平衡计算化学方程式是化学反应的表达式,它描述了反应物和产物之间的定量关系。
化学方程式的平衡计算是指根据化学方程式所给出的反应物和产物的化学计量关系,推算出化学反应中各物质的质量关系。
平衡计算的关键在于利用化学方程式中的化学计量关系来推导出化学反应中反应物和产物的摩尔比例关系。
化学方程式平衡计算的具体步骤如下:1.根据化学方程式列出各物质的摩尔数。
2.根据反应物和产物的摩尔数,计算出物质的质量。
3.判断反应物和产物中哪些物质的量较少,以确定限量反应物。
4.根据限量反应物的摩尔数,计算出非限量反应物和产物的摩尔数。
5.根据非限量反应物和产物的摩尔数,计算出非限量反应物和产物的质量。
二、反应物的摩尔关系计算反应物的摩尔关系计算是指根据给定的反应物的质量,计算出其他反应物和产物的摩尔量。
反应物的摩尔关系计算主要包括以下几种类型的问题。
1.已知反应物的质量,求其他反应物的摩尔数。
例如:已知铁和硫的质量,求生成亚硫酸亚铁的摩尔数。
解题步骤:1.计算铁和硫的摩尔数。
2.根据化学方程式中所示的化学计量关系,计算出亚硫酸亚铁的摩尔数。
2.已知反应物的梅尔数,求其他反应物的质量。
例如:已知氢气和氧气的摩尔数,求生成水的质量。
解题步骤:1.根据化学方程式中所示的化学计量关系,计算出水的摩尔数。
2.根据水的摩尔数和相应的摩尔质量,计算出水的质量。
三、反应的产物计算反应的产物计算是指根据给定的反应物的质量,计算出反应生成物的质量。
反应的产物计算同样需要根据化学方程式中所示的化学计量关系来计算。
反应的产物计算包括以下几种类型的问题。
1.已知反应物的质量,求其中一产物的摩尔数。
例如:已知氯化铵的质量,求生成氨气的摩尔数。
化学计量问题的解题公式和计算

单击添加标题
计算公式: Kc=([C]^m×[D]^n)/([A] ^p×[B]^q),其中C、D、 A、B分别代表不同物质的浓 度,m、n、p、q分别代表
它们的化学计量数。
单击添加标题
注意事项:化学平衡常数只 受温度影响,与反应物和生 成物的浓度无关。在计算时 需要注意单位的统一和平衡
06 化 学 计 量 问 题 的 发 展趋势和展望
Part One
单击添加章节标题
Part Two
化学计量问题的基 本概念
化学计量数的定义
化学计量数:表示反应物和生成物之间物 质的量比例的系数
化学计量数与化学方程式的关联:化学计 量数是化学方程式中各物质的化学式前的 数字
化学计量数的意义:表示反应中各物质之 间的定量关系,是计算反应物和生成物的 物质的量、质量、气体体积等的基础
物料守恒的应用
定义:物料守恒是指化学反应前后,物质的质量和物质的量保持不变。
应用场景:在化学计量问题中,物料守恒可以用于解决各种问题,如化学反应平衡、 化学反应速率等。
解题公式:利用物料守恒,可以推导出许多有用的解题公式,如质量守恒、物质的量 守恒等。
计算方法:通过物料守恒,可以简化计算过程,快速得到答案。
化学计量问题的解 题公式
质量守恒定律的应用
质量守恒定律的定义:化学反应前后,物质的质量总和保持不变。
应用场景:计算化学反应中各物质的质量关系,确定反应物和生成物的质 量比。
计算公式:利用质量守恒定律,可以推导出各种化学计量问题的计算公式, 如化学方程式的配平、反应物和生成物的质量计算等。
注意事项:在应用质量守恒定律时,需要注意物质的质量单位和化学计量 数的一致性,以及反应前后物质的质量变化情况。
化学计量学中的质量计算与化学式关系

化学计量学中的质量计算与化学式关系化学计量学是研究化学反应中物质的质量关系的分支学科,质量计算是化学计量学中的基本内容之一。
在化学反应中,质量是一个重要的参数,它与化学式之间存在着紧密的关系。
本文将介绍质量计算在化学计量学中的应用以及质量与化学式之间的关系。
一、质量计算在化学计量学中的应用质量计算是通过给定物质的质量或者化学式,来计算其他相关物质的质量的过程。
在化学实验、物质合成以及药品配制等领域,质量计算是不可或缺的工具。
下面将介绍质量计算在化学计量学中的几个常见应用。
1. 摩尔质量计算摩尔质量是指某个物质的单位摩尔的质量,它是计算化学反应中物质质量关系的重要参数。
对于分子式已知的物质,可以通过从化学元素的周期表中找到各个元素的相对原子质量,然后将它们累加得到该物质的摩尔质量。
摩尔质量的计算可以通过下式来进行:摩尔质量 = 各元素的相对原子质量之和。
2. 反应物质量计算在化学反应中,给定某个物质的质量,可以利用化学方程式中的化学计量关系来计算其他反应物或生成物的质量。
例如,通过化学方程式可以知道反应物A和B的摩尔比例是1:2,如果给定A的质量,利用质量与摩尔数的关系可以计算出B的质量。
3. 反应产率计算反应产率是指化学反应中实际生成物的质量与理论生成物质量之间的比值,它反映了反应的效果。
通过质量计算可以计算出反应产率。
例如,如果已知某个反应物A与B按照化学方程式反应生成物C,可以根据实验数据计算出C的实际生成质量,与理论生成质量的比值即为反应产率。
二、质量与化学式之间的关系化学式是用化学元素的符号和次数表示化合物的符号组合。
质量与化学式之间存在着紧密的关系,下面将介绍几种常见的关系。
1. 摩尔质量和化学式的关系摩尔质量是化合物的质量与化学式之间的关系。
对于分子式已知的化合物,可以通过查找化学元素的摩尔质量或者原子质量表来计算摩尔质量。
摩尔质量的计算方法为:将各个元素的摩尔质量相加得到化合物的摩尔质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学计量的相关计算物质的量摩尔质量一、物质的量(一)物质的量(n)1.定义:表示含有一定数目微观粒子的集合体的一个物理量2.单位: 摩尔(简称“摩”),符号:mol▲把含有6.02×1023个粒子的任何粒子集体计量定为1摩尔▲物质的量与微观粒子数之间成正比:n1/n2=N1/N23.使用物质的量应注意事项:①物质的量这四个字是一个整体,是专用名词,不得简化或增添任何字。
②物质的量只能描述分子、原子、离子、中子、质子等微观粒子,不能描述宏观物质,用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。
如:1 mol H、1 mol H+、 1 mol H2,不能用“1 mol 氢”这样含糊无意义的表示。
③物质的量计量的是粒子的集合体,不是单个粒子,物质的量的数值可以是整数,也可以是小数。
(二)阿伏加德罗常数(NA)事实证明,1mol粒子集体所含的粒子数与 12C所含的碳原子数相同,约为×1023。
国际上把1mol任何粒子集体所含的粒子数叫做阿伏伽德罗常数。
(12C是指原子核内有6个质子和6个中子的碳原子。
)1.阿伏加德罗常数(1)含义:科学上规定把中所含有的碳原子数叫做阿伏加德罗常数。
(2)符号:N A (3)单位:mol-1(4)近似值:×1023mol -1(5)物质的量(n ),阿伏加德罗常数(N A )与粒子数(N )三者之间关系:n=N/NA。
(三)物质的量、阿伏加德罗常数与粒子数间的关系 粒子数(N)、物质的量(n)和质量(m)之间的关系: 【例题】在 mol O2中含有的氧原子数目是多少 随堂练习:1.1 mol C 中约含有 个碳原子2. mol H 2SO 4含有 个硫酸分子 3. × 1024个H2O2分子的物质的量为 。
4.1 mol Na2CO3中约含有__ _molNa+、_ __molCO32-离子,共含有离子的个数为__________个。
二、摩尔质量1.定义:单位物质的量的物质所具有的质量 2.符号:符号:M 单位:g /mol 或 g·mol -13.含义:某物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量。
4.公式: m (g) = n (mol) · M(g/mol) n = m /M自我检测1.下列说法中正确的是( )A .摩尔是表示原子、分子、离子的个数的单位B .摩尔既表示物质中所含的离子数,又表示物质质量的单位C .摩尔是物质的量的单位,用“mol ”表示D .摩尔质量的单位是克/摩,用“g/mol ”表示 2.下列物质中所含氢原子数最多的是( )3.下列说法中正确的是( )A .2molCH 4的质量和氧气的摩尔质量都是32g 任何气体中都含有相同的原子数C .1molNaCl 含有×1023个微粒 的摩尔质量是mol4.O 2、SO 2、SO 3三者的质量之比为2:4:5,它们的物质的量之比为( ) :4:5 :2:3 :1:1 :2:35.N A 表示阿伏加德罗常数,下列说法正确的是( ) A. N A 个氢气分子与N A 个氧气分子的质量比为1:1 B. N A 个水分子的质量与水的摩尔质量在数值上相等 氧气中含有的氧气分子数为N A 与28gCO 所含有的分子数均为N A 6.下列说法中不正确的是( )A .Na 的摩尔质量为23g B. Na 的摩尔质量为23C .Na 的摩尔质量为23g·mol —1 D. Na 的摩尔质量为×10—2 kg·mol —1 7.含有不同氧原子数的两种物质是( )A.质量比为2:1的SO 2和O 2 水和22gCO 2 和 D.物质的量相同的H 2SO 4和H 3PO 48. 49gH 2SO 4的物质的量是 。
的质量是 ,其中含有 molH ,含有 gO 。
9.0.8molCO 2和中含有碳原子的物质的量之比为 ,含有氧元素的质量之比为 ,两物质中含有电子的物质的量之比为 。
10. 1.5 mol H 2SO 4的质量是 。
其中含有 mol O, mol H,其质量分别为 和 。
11. 0.01 mol 某物质的质量为 g ,此物质的摩尔质量为 。
12.下列说法正确的是( )g 氯相当于2 mol 氯 B.每摩尔物质中含有×1023个原子C.阿伏加德罗常数为12 g 12C 所含的碳原子数 mol KClO 3中含有3 mol 氧元素13.如果1 g 水中含有m 个氢原子,则阿伏加德罗常数是( ) A.m9114.下列说法正确的是( )A.氮原子的质量就是氮的相对原子质量B.氢氧化钠的摩尔质量是40 g mol H 2SO 4中含有1 mol H 2 D.氩气的摩尔质量在数值上等于它的相对原子质量.8g 某物质含有*1022个分子,该物质的式量约为( )16.与22gCO 2所含分子数相等的水的质量为( ) B. 22g%的KOH 溶液中,平均多少个水分子溶有一个OH - ( ) B. 818.能电离出的Cl -数目与2molNaCl 电离出的Cl -数目相同的是( )219.有98g 纯H 2SO 4和纯H 3PO 4的混酸,其中含氧64g ,则混酸中H 2SO 4和H 3PO 4的物质的量之比为( ):1 :3 :2 D.任意比20.由FeO 、Fe 2O 3、Fe 3O 4组成的混合物,测得铁与氧元素的质量比为21:8,则这种混合物中FeO 、Fe 2O 3、Fe 3O 4的物质的量之比可能是( )A. 1:2:1B. 2:1:1 :1:1 :2:3 21.2.16gX 2O 5中含有氧原子,则X 的相对原子质量为( ) A.21.6和V 2O 5按不同物质的量之比混合可按化学计量系数完全反应,今欲制备V 8O 17,则V 2O 3和V 2O 5的物质的量之比为( ):2 :1 C. 3:5 :323.如果mg 氨气由a 个原子构成,则2m g 硫化氢中含有的分子数为 (用含a 的代数式表示)。
g 氯化钙中所含氯离子数相同,所含氧原子数与 g 水中所含氧原子数相同。
2SO 4的物质的量为 ,其中含 molS ,含 gH ,含个O 。
当它溶于水完全电离时,可产生____ molH +和 molSO 42-。
2完全反应,生成的AB 3,则单质Ax 的化学式是 。
27.71gNa2SO4中含有的Na +和SO 42-的物质的量多少 28.的物质的量是多少的质量是多少29.等质量的下列物质中,所含分子数最少的是()30.1g H2O中含有a个氢原子,则阿伏加德罗常数为()A.(a/9)mol-1B. 9a mol-1 mol-1 mol-1 31.用NA表示阿伏加德罗常数的值。
下列说法中正确的是( )。
A.1molO2比1molN2的质子数多NAB.2g氢气中含有的原子数为NAC.×1023个氮分子中含有的原子数为NA D.17g氨气中含有的电子数为10NA32.用NA表示阿伏加德罗常数的值。
下列说法中错误的是( )-含10NA 个电子水中所含的电子数为8NA分子的质量与NA 个H2O分子的质量相等分子约含有×1024个H原子33. H2SO4中氧元素的质量_________________34. 含有*1022个分子,其质量为,求分子质量35. 多少克H2SO4所含的分子数与克10%盐酸所含溶质的分子数相等36. mol KClO3中所含的Cl原子数与多少克CaCl2中所含的C l-离子数相等气体摩尔体积一、气体摩尔体积(一)1.单位物质的量的气体所占的体积,就叫作气体摩尔体积。
符号:Vm单位:L/mol2.在标准状况下,任何气体的摩尔体积都约为 L/mol在0℃、101KP时,1mol任何气体的体积都约为。
我们将0℃、101KP称为标准状况。
在标准状况下,1mol任何气体所占的体积都约为。
3. Vm= V/n (单位:L/mol)【注意】(1)气体摩尔体积仅仅是针对气体而言(2)气体在不同状况下的气体摩尔体积是不同的,在标准状况下的气体摩尔体积约为 L/mol(3)同温同压下,气体的体积只与气体的分子数目,而与气体分子的种类无关。
二、阿伏伽德罗定律及其推论1.阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
即同温同压下:2.相关推论:(1)在同温同压下,相同体积的气体质量比等于摩尔质量比,(相对分子质量),即:(2)在同温同压下,两种不同的气体的密度比等于摩尔质量(相对分子质量)比: (“D”为气体1 对气体2 的相对密度)(3)在同温同压下,等质量的两种气体的体积比与摩尔质量成反比:(4)在同温同体积下,两种不同气体的压强比等于物质的量之比:专题:混合气体平均相对分子质量的几种求法【例题1】在标准状况下,由10gCO和CO2组成的混合气体的体积为,则此混合气体中CO和CO2的分子个数之比为多少【例题2】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。
则该混合气体中CO2、H2和CO的体积比为()A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57随堂练习一:1.已知空气的平均摩尔质量为29g/mol,在同温同压下,某气体R对空气的相对密度为2,该气体的相对分子质量为:____________2.由CO 2 、H 2和CO 组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO 2 、H 2的体积比为多少自我检测1.下列关于物质的量表示正确的是( )A 、1mol 氢B 、2mol 分子C 、3mol 氧原子D 、4mol H 2 2.下列说法正确的是( )A 、氮原子的质量在数值上等于它的摩尔质量B 、NaOH 的摩尔质量是40gC 、氩气的摩尔质量在数值上等于它的相对原子质量D 、CaCO 3的摩尔质量是100Kg/mol3.中含有的O 3 数目是______________,含有的O 原子数目是______________,含有的质子数目是______________。
4.等质量的下列物质中所含有原子数目最少的是( ) A 、Cl 2 B 、HCl C 、NH 3 D 、H 2SO 4 5.下列说法中正确的是( )A 、1mol O 2 和1mol N 2所占的体积都约为B 、H 2的气体摩尔体积约为C 、在标准状况下,1mol H 2和1mol H 2O 所占的体积都约为D 、在标准状况下,由N 2、N 2O 组成的混合气体中所含有的氮原子的物质的量约为2mol6.相同状况下,下列气体所占体积最大的是…………………………………………( )A .3g H 2B .16g O 2C .32g H 2SD .80g SO 3 7.下列各物质所含原子数目,按由大到小顺序排列的是……………………………( )① NH3②标准状况下 He ③4℃ 9mL 水④ H3PO4A.①④③② B.④③②① C.②③④① D.①④③②8.用NA表示阿伏加德罗常数的值,下列叙述正确的是………………………………()A.含有NA个氦原子的氦气在标准状况下的体积约为B.25℃,×105Pa,64gSO2中含有的原子数为3NAC.在常温常压下, Cl2含有的分子数为D.标准状况下,含有的分子数为9.等物质的量的氢气和氦气一定具有相等的………………………………()A.原子数 B.体积 C.质子数 D.质量10.下列说法正确的是……………………………………………………………………()A.标准状况下气体摩尔体积为B.非标准状况下,1mol任何气体的体积不可能为C.标准状况下任何物质都含有约×1023个分子D.1mol H2和O2的混合气体在标准状况下的体积约为11.在相同状况下,两种物质的量相同的气体必然具有………………………………()A.体积均为 B.相同的体积 C.相同的原子数目 D.相同的质量12.用NA表示阿伏加德罗常数的值,下列叙述正确的是………………………………()A.标准状况下,1L水所含分子数为1/ NAB.在常温常压下,升氯气含有的分子数为C.在标准状况下,个氯气分子所占体积是D.在25℃,压强为×105Pa时,升氮气所含的原子数目为NA13.用NA表示阿伏加德罗常数的值,下列叙述正确的是………………………………()A.在常温常压下,升氧气所含的原子数目为NAB.常温常压下,甲烷所占有的体积大于C.常温常压下,1 mol氦气含有的核外电子数为2NAD.同温同压时,相同体积的任何气体单质所含的原子数目相同14.在标准状况下① CH4②×1023个HCl分子③ H2S ④ NH3, 下列对这四种气体的关系从大到小表达正确的是…………………………………………()a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④d.氢原子个数①>③>④>②A.abc B.bcd C.cba D.abcd15.在标准状况下,10克CO和CO2组成的混合气体,其体积为,则混合气体中,CO和CO2的物质的量之比为……………………………………………………………()A.2∶1 B.1∶2 C.2∶3 D.3∶216、N2、CO2、SO2三种气体的质量比为7:11:16时,它们的分子个数比为___________;物质的量之比为___________;同温同压下体积比为___________。
