fda发布咀嚼片关键质量属性指导原则(1)
FDA药-械组合产品桥接指导原则介绍

【审评规范】FDA药-械组合产品桥接指导原则介绍萧惠来国家药品监督管理局药品审评中心,北京100022摘要:美国食品药品管理局(F D A)的“供企业用药-械和生物制品-器械组合产品的桥接指导原则(草案)”详细描述 了药-械组合产品注册申请人,利用另外的开发方案产生的信息,作为拟开发产品的注册资料(即桥接),替代试验研究资 料的方法,支持拟申报产品的批准;推荐渐进式5步骤法,确定桥接策略和信息需求并列举了3个示例予以解读。
详细介绍 该指导原则的内容,期望为中国药-械组合产品研发和监管开辟新思路,建议在合适的条件下可考虑利用“桥接”方法减少 试验研究,加速研宄进程,缩短研宄周期,节省研宄经费,促进药-械组合产品的开发。
关键词:美国食品药品管理局:药-械组合产品:桥接:指导原则中图分类号:R951 文献标志码: A 文章编号:1674-6376 (2021) 03-0461-07DOI :10.7501/j.issn. 1674-6376.2021.03.001Introduction to FDA's bridging for drug-device combination products guidanceXIAO HuilaiCenter for Drug Evaluation, National Medical Products Administration, Beijing 100022, ChinaAbstract: The FDA's Bridging for Drug-Device and Biologic-Device Combination Products Guidance for Industry (Draft) described in detail that the applicant for registration of drug-device combination products can use the information developed by another development program as the registration information of the product to be developed (i. e. bridging) and replace the experimental research data to support the approval of the product to be applied for. That is to say, the stepwise five step approach is recommended to determine the bridging strategy and information requirements are determined, and three examples are given to interpret. This paper introduces the guidance in detail, hoping to open up new ideas for the research and development as well as supervision of drug-device combination products in China. In suitable conditions, it can be considered to use "bridging" method to reduce experimental research, speed up the research process, shorten the research cycle, save research funds, and promote the development of drug-device combination products.Key words: FDA; drug-device combination product; bridging; guidance美国食品药品管理局(FDA)于2019年12月发 布了“供企业用药-械和生物制品-器械组合产品的 桥接指导原则(草案)”[1]。
FDA数据完整性法规解读与初步认知

》第9节:良好文件规范中说明:只要能够达到GMP的要求,纸质的追踪记录也 13 可以被接受。(任何删改都经过申请、审核、批准)(切记与报警系统一致) 13
指南解读
问题
FDA 回答 及要 求
Q7:审计追踪应多长时间审查一次?
FDA建议,采集关键数据变更的审计追踪应在每次记录和最终批准记录前审查。需要定 期审查的审计追踪应包括但不限于以下内容:最终产品检验结果的更改历史、样品运行序 列的更改、样品标识的更改、关键工艺参数的更改。
解读与 讨论
1)按文件要求,复核检验记录的复核人应需要对电子记录和审计追踪进 行进行核实。(做不到怎么办?) 2)部门负责人、QA专人定期审核,审核期限根据参数影响评估。
15
15
指南解读
问题
Q1:术语定义——“静态记录”和“动态记录”定义
静态用于表示固定数据文件,例如纸质记录或电子图像;
FDA 回答 及要 求
7
7
数据完整性基础定义
原始性(original)
原始数据应当被审核; 应当留存原始数据和/或认证的真实、准确副本,副本 保存了原始数据的内容及含义; 在记录留存期内,原始记录应当完整、持久而且容易 获得、易读;
原始记录应当被审核; 数据审核应当被记录(纸质记录前面)
电子数据的源记录应当被审核
解读 与讨 论
14
14
指南解读
问题
Q8.应由谁来审查审计追踪?
审计追踪被认为是相关记录的一部分。根据CGMP负责记录审查的人员, 应审查采集与记录相关的对关键数据更改的审计追踪,如他们审查其它记
FDA回 答及要 求
录一样(例如,§§ 211.22(a),211.101(c),211.194(a)(8) 例如,所有 生产和控制记录,包括审计追踪,必须由质量部门审核和批准(§ 211.192)。这与FDA对企业在审核数据时在纸上划痕标注的预期是一样 的。
美国食品药品监督管理局(FDA)发布3D打印医疗产品技术指导意见

3D打印医疗产品迅速发展,个性化的医疗器械和能够显著改善健康状况的创新药物使患者从中受益。
美国食品药品监督管理局(FDA)已经审查了目前市面上100多个由3D打印技术生产的医疗产品。
为跟上技术革新,FDA正努力提供更全面的监管途径,帮助促进基于增材制造技术的安全有效地创新。
一、增材制造背景及视角FDA所制定的技术指导意见代表其对增材制造技术应用于医疗产品生产领域的初步意见。
(一)增材制造相关定义增材制造设备:“增材制造流水线的一部分,包括硬件、机器控制软件、数据处理软件和完成零件生产所必需的外围附件”。
制造周期:“一个或多个组件在增材制造系统内分层堆积的单次过程循环。
”制造准备软件:“用于将制造产品三维模型数据转换为可用于增材制造装备加工格式的处理软件。
”设计处理软件:“允许针对特定情况(例如患者匹配)修改医疗产品设计的计算机程序。
”(二)增材制造医疗产品介绍医疗产品制造行业最常用的相关技术有:粉体熔化成型:依靠激光或电子束选择性地熔化或烧结金属或聚合物粉末,逐渐成型。
立体光固化成型:通过特定波长与强度的激光选择性聚焦到光固化材料表面使之凝固。
熔融挤出成型:通过熔化位于热熔喷头的固体长丝,按照零件预定轨迹以固定的速率进行熔体凝固。
液态挤出成型:通过喷射液体使之固化(方法包括曝光、溶剂蒸发或其他化学过程)。
(三)增材制造技术指导意见概述本指导意见主要涉及设计和制造注意事项和产品测试注意事项两部分内容。
“设计和制造注意事项”涉及的环节应遵循产品质量体系(Quality System,QS)的要求。
此类要求依照产品的法定类别及适用于产品的相关法规决定。
“产品测试注意事项”描述了产品上市前应向FDA递交的上市前审批(Premarket Approval,PMA)申请、人道主义产品豁免(Humanitarian Device Exemption HDE)申请、新创请求和增材制造研究性产品豁免(Investigational Device Exemption,IDE)申请等信息。
FDA发布行业指南草案《ANDA提交质量管理规范》

FDA发布行业指南草案《ANDA提交质量管理规范》2018年伊始,FDA 即一并发布了两份文件,旨在简化和改善仿制药申请(ANDA)的提交和审评。
第一份文件是行业指南草案《ANDA 提交质量管理规范》(Good ANDA Submission Practices),强调了我们在仿制药申请中看到的可能导致审批延迟的常见缺陷。
第二份文件是《ANDA 评估质量管理规范》(Good ANDA Assessment Practices),其中概述了FDA 工作人员的ANDA 评估实践。
其中,行业指南草案《ANDA 提交质量管理规范》(Good ANDA Submission Practices)中,从专利和排他性缺陷、标签缺陷、产品质量缺陷和生物等效性缺陷四个角度对ANDA提交中的常见缺陷进行了系统的整理,用于指导制药公司及其代理人的ANDA提交工作,其中大体内容如下:Ⅰ专利和排他性缺陷A. 法律诉讼的文件和通知B. 解决或提起法律诉讼C. P IV证明通知D. 橙皮书中新增或修订的信息E. 对未经批准的ANDA进行的修改F. 商业营销通知Ⅱ标签缺陷A. 容器标签和纸盒标签样稿B. 容器标签和纸盒标签的颜色差别C. 标签格式D. 注射剂1. 包装类型2. 产品规格3. 套圈和瓶盖顶封Ⅲ产品质量缺陷A. 原料药1. 活性药物成分起始原料2. API 生产工艺3. 杂质a API表征信息b 实际和潜在杂质的致突变能力的安全性评估4. 可分离中间体的质量标准5. 特定关键质量属性的检测B. 制剂1. 建立关键质量属性2. 杂质的鉴别、控制和质量a 鉴别和控制杂质b 原料药或制剂中杂质超过相关限度阈值的安全限定3. 非活性成分a 引用非活性成分数据库进行说明b 仿制药制剂中非活性成分超出IID最大值的安全性说明4. 分析方法的验证C. 体外溶出度(生物药剂学)1. 当溶出测试不能标准化时,开发和验证内部溶出度测试方法2. 溶出度接受标准D. 设施1. 生产设备的标识2. 核查的准备3. 合同生产设备和CGMP的选择E. 商业生产工艺F. 微生物学考虑1. 过程中的生物负载测试和验收标准2. 细菌内毒素测试方法的描述和验证3. 支持延长存储时间的微生物数据Ⅳ生物等效性缺陷A. 生物分析研究数据B. 临床概要C. 特定产品指导原则的偏离D. 有关BE的信息和体内BE研究的安全性E. 配方和非活性成分的差异F. 依据21 CFR 314.99(b)的豁免要求本文转自:制剂汇网,转发仅为学习交流,如有侵权,请联系小编删除。
咀嚼片(化学药品)质量属性研究技术指导原则(征求意见)
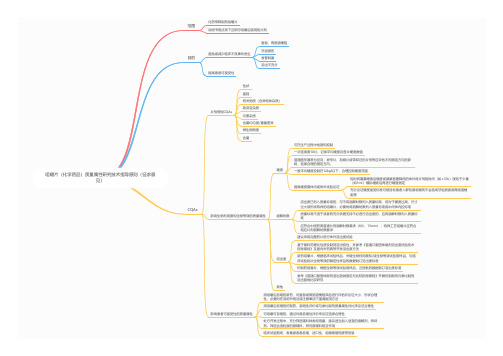
咀嚼片(化学药品)质量属性研究技术指导原则(征求意见)范围化药常释制剂咀嚼片说明书用法项下注明可咀嚼后服用的片剂目的避免或减少临床不良事件发生窒息、胃肠道梗阻牙齿损伤食管刺激溶出不充分CQAs提高患者可接受性片剂常规CQAs性状鉴别有关物质(含异构体杂质)致突变杂质元素杂质含量均匀度/重量差异微生物限度含量影响生物利用度和生物等效的质量属性硬度崩解时限溶出度其他影响患者可接受性的质量属性须咀嚼后吞咽的新药,对窒息或胃肠道梗阻风险进行评估并论证大小、形状合理性,必要时在说明书用法或注意事项下强调服用方法须咀嚼后吞咽的仿制药,吞咽性评价或与参比制剂质量属性对比来论证合理性可咀嚼可吞咽的,通过对易吞咽性评价来论证选择合理性处方开发过程中,充分筛选辅料种类和用量,建议适当加入适宜的崩解剂,矫味剂,筛选合适粒度的原辅料,研究原辅料相互作用临床试验期间,收集患者易吞咽、适口性、咀嚼难易程度等信息可在生产过程中检测和控制一次连续测10片,记录平均硬度及各片硬度数值普通圆形通常为径向;异形片、刻痕片或带印记的片剂等应评估不同测定方向的影响,选择合理的测定方向。
一般平均硬度控制在12kgf以下,合理控制硬度范围提高硬度需体内或体外试验论证短时间暴露唾液后硬度或崩解显著降低的体外将片剂短时间(如≤30s)浸泡于少量(如1ml)模拟唾液后再进行硬度测定充分论证硬度接受标准可被目标患者人群轻易咀嚼而不会造成牙齿损害或胃肠道梗阻等溶出度已列入质量标准的,可不将崩解时限列入质量标准,但对于硬度过高、尺寸过大或形状特异的咀嚼片,必要时将崩解时限列入质量标准或中间体内控标准质量标准不适于或者有充分依据支持不必进行溶出度的,应将崩解时限列入质量标准应符合中国药典普通片剂崩解时限要求(6片,15min);特殊工艺咀嚼片应符合相应片剂崩解时限要求建议采用完整药片进行体外溶出度试验基于原料药理化性质及制剂溶出特性,并参考《普通口服固体制剂溶出度试验技术指导原则》及国内外药典等开发溶出度方法新药咀嚼片,根据临床试验样品、关键生物利用度和/或生物等效试验用样品、与临床试验批次生物等效的稳定性样品的数据制订溶出度标准仿制药咀嚼片,根据生物等效试验用样品、注册批的数据制订溶出度标准参考《普通口服固体制剂溶出曲线测定与比较指导原则》开展仿制制剂与参比制剂溶出曲线比较研究。
美国FDA指导原则CPGSEC555500所有食品卫生检查分类英文原版

美国FDA指导原则CPGSEC555500所有食品卫生检查分类英文原版The U.S. Food and Drug Administration (FDA) provides guidance for food establishments on how to maintain food safety. One such important guidance document is the Code of Federal Regulations (CFR) Title 21, Part 110, which outlines the Current Good Manufacturing Practice (CGMP) regulations for food processors.Under the CGMP regulations, food establishments are required to follow specific guidelines to ensure that the food producedis safe for consumption. These guidelines cover a wide range of areas, including personnel training, sanitation practices, equipment maintenance, and recordkeeping.Here is a breakdown of the different food safety inspection categories outlined in the FDA's guidance document, CPG Sec. 555.500:1. Personnel: This section focuses on the training and health requirements for individuals who handle food. It includes guidelines on cleanliness, handwashing, and the use ofprotective clothing.2. Plant and grounds: This section covers the maintenance and cleanliness of the food processing facility, including building construction, water supply, plumbing, lighting, and ventilation.3. Sanitary operations: This section outlines the practices necessary to prevent contamination during food processing. It includes guidelines on cleaning and sanitizing equipment and utensils, preventing cross-contamination, and controlling pests.4. Sanitary facilities and controls: This section addresses the design and maintenance of facilities like restrooms, handwashing stations, and employee break areas. It also includes guidance on controlling physical hazards, such as glass or metal fragments.5. Equipment and utensils: This section provides guidelines for the design, construction, and maintenance of equipment used in food processing. It also covers the proper cleaning and storage of utensils.6. Processes and controls: This section focuses on the control measures necessary to ensure the safety of specific food products. It includes guidelines for pasteurization, heat treatment, and other processing methods to eliminate or reduce pathogens.7. Warehousing and distribution: This section covers the storage and transport of food products. It includes guidelines on temperature control, pest control, and preventing contamination during distribution.8. Defect action levels: This section provides guidance on acceptable levels of quality defects in certain food products.It helps to ensure that products with significant defects are not sold to consumers.9. Food additives: This section outlines the requirements for the safe use of food additives, including labeling and documentation.10. Color additives: This section provides guidelines for the use of color additives, including permitted colors and labeling requirements.。
实施“质量源于设计”的五个关键因素

实施“质量源于设计”的五个关键因素在药品⽣产⾏业,对药品质量的控制经历了从“检验决定质量”模式到“⽣产决定质量”模式并逐渐向“质量源于设计”模式的发展。
质量源于设计的相关理念始源于20世纪70年代Toyota为提⾼汽车质量⽽提出的创造性的概念,并经过在通信、航空等领域的发展逐渐形成。
美国⾷品药品监督管理局(FDA)已逐渐将“质量源于设计”的理念使⽤贯穿于药品诞⽣周期的全过程的各个阶段,其⽬的在于更好地控制药品质量及维护患者⽤药的安全性。
1、 “质量源于设计”简介质量源于设计(Quality by Design,QbD)这⼀理念⾸先出现在⼈⽤药品注册技术规定国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)发布的Q8中,其定义为“在可靠的科学和质量风险管理基础之上的,预先定义好⽬标并强调对产品与⼯艺的理解及⼯艺控制的⼀个系统的研发⽅法”。
ICH Q8指出,质量不是通过检验注⼊到产品中,⽽是通过设计赋予的。
要获得良好的设计,必须增加对产品的认知和对⽣产的全过程控制。
实施QbD是将过程分析技术与风险管理综合应⽤于药品⼯艺开发的过程,它的⽬的不是消灭⽣产过程中的偏差,⽽是建⽴⼀种可以在⼀定范围内调节偏差来保证产品质量稳定性的⽣产⼯艺。
通过QbD可以找出这个范围,并建⽴设计空间(Design Space)。
ICH Q8对设计空间的定义为“已被证明有质量保障作⽤的物料变量和⼯艺参数的多维组合和相互作⽤”,就是各种影响产品质量的关键因素和参数的组合。
设计空间允许企业在研究的基础上确定⼀个可以保证产品质量的操作空间。
⼀旦确定产品⽣产的设计空间,则在此设计空间中的各种⼯艺等⽅⾯的变化,⽆需进⾏进⼀步的注册审批,减少上市后的变更申报。
咀嚼片化学药品质量属性研究技术指导原则试行溶瘤病毒产品药学研究与评价技术指导原则试行(一)

咀嚼片化学药品质量属性研究技术指导原则试行溶瘤病毒产品药学研究与评价技术指导原则试行(一)咀嚼片化学药品质量属性研究技术指导原则试行咀嚼片是一种常见的口服制剂形式,其可以直接在口腔中咀嚼,释放药物成分,更容易被机体吸收,因此得到广泛应用。
然而,咀嚼片化学药品的质量属性研究一直是制药研发和质量控制的关键问题之一。
为了保证制剂的有效性和安全性,需要对咀嚼片药品的质量属性进行全面、精细的研究,制定科学的技术指导原则。
一、咀嚼片的性质及其对药品质量属性的影响咀嚼片是一种特殊的制剂形式,它比普通口服制剂在药物释放、药物转运和药效表现等方面具有独特的优势。
因此,在咀嚼片的研发和质量控制中,需要考虑以下因素:1.咀嚼片的组成和结构2.咀嚼片的口感和咀嚼性3.咀嚼片的溶解度和离子强度4.咀嚼片的药物释放速度和药效持续时间以上因素都会对咀嚼片的药物质量属性产生影响。
因此,在研究和评价咀嚼片化学药品的质量属性时,需要全面考虑这些影响因素。
二、咀嚼片化学药品质量属性研究技术指导原则试行为了提高咀嚼片化学药品的质量和有效性,需要制定科学合理的研究技术指导原则。
以下是一些可能的技术指导原则:1.药品质量属性研究应注重口感和咀嚼性口感和咀嚼性是咀嚼片区别于其他制剂的重要特点。
因此,在研究药品质量属性时,需要注重这些特点的评价。
例如,可以采用口感评估仪、颗粒度分析仪等工具,对咀嚼片的口感和咀嚼性进行精细化评估。
2.药品质量属性研究应注重药物释放速度和药效持续时间咀嚼片的药物释放速度和药效持续时间是咀嚼片制剂性能的重要指标。
在研究药品质量属性时,需要注重这些指标的评价。
可采用离体、原位等不同方法,对药物释放速度和药效持续时间进行研究和评价。
3.药品质量属性研究应注重溶解度和离子强度咀嚼片的溶解度和离子强度是药物在体内吸收和转运的重要影响因素。
因此,在研究药品质量属性时,需要注重这些指标的评价。
应注意选取合适的试验条件和测定方法,提高测试的准确性和可重复性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FDA发布咀嚼片关键质量属性指导原则(中英文对照)I. INTRODUCTIONI.引言This guidance provides manufacturers of chewable tablets for human use with the Center for Drug Evaluation and Research’s (CDER) current thinking on the critical quality attributes that should be assessed during the development of these drug This guidance also provides recommendations about submitting developmental, manufacturing, and labeling information for chewable tablets that must be approved by CDER before they can be distributed. The recommendations in this guidance apply mainly to new drug applications(NDAs), abbreviated new drug applications (ANDAs),3 and certain chemistry, manufacturing, and controls(CMC) supplements to these some of there commendations about the submission of developmental information may also apply to investigational new drug applications (INDs). The recommendations about assessing critical quality attributes apply to all chewable tablets for human use, including non-application products.本指南向生产者提供了药品审评研究中心(CDER)对人用咀嚼片在研发过程中应评估的关键质量属性的当前想法2。
该指南也提供了必须向CDER提交并被其批准的咀嚼片的研发、生产及说明书信息的建议。
该指南的这些建议主要针对新药申请(NDAs)、仿制药申请(ANDAs)3和一些化学、生产和质控(CMC)补充申请4。
某些建议同样适合于研究性新药申请(即新药临床申请,INDs)。
关于评估关键质量属性的建议适用于所有人用咀嚼片,包括非申请产品。
Ingeneral, FDA’s guidance documents do not establish legally enforceableresponsibi lities. Instead, guidances describe the Agency’s current thinking ona topic and should be viewed only as recommendations, unless specificregulatory or statutory requirements are cited. The use of the word should inAgency guidances means that something is suggested or recommended, but notrequired.通常,FDA的指导文件不具有法律强制性,指南中描述的主题仅代表FDA机构目前的看法,只作为建议,除非是引用具体的法规或条例要求。
建议或推荐使用该指导原则,但不是必须的。
II. BACKGROUNDII.背景Chewabletablets are an immediate release (IR) oral dosage form intended to be chewedand then swallowed by the patient rather than swallowed whole. They should be designed to have a pleasanttaste and be easily chewed and swallowed. Chewable tablets should be safe and easyto use in a diverse patientpopulation, pediatric, adult, or elderly patients, who are unable or unwillingto swallow intact tablets due to the size of the tablet or difficulty withswallowing. The availability of safe, easy-to-use dosage forms is important inclinical practice. Chewable tablets are available for many over-the-counter(OTC) and prescription drug products.咀嚼片是患者经咀嚼后立即释放的口服剂型,而不是整个吞咽。
其应被设计为可口的味道且易于咀嚼和吞咽。
咀嚼片应是安全的,易于那些因片子大小或吞咽困难导致不能或不愿吞服的特殊人群、儿童、成年、或老年患者服用。
能获得安全的、易于服用的剂型在临床实践中非常重要。
在许多OTC和处方药中均有咀嚼片。
TheUnited States Pharmacopeia (USP) recognizes and differentiates between twotypes of chewable tablets: (1) thosethat may be chewed for ease of administration, and (2) those that must bechewed or crushed before swallowing to avoid choking and/or to ensure therelease of theactive The concepts in this guidance are applicable to both types of chewabletablets.USP药典中识别和区分两种类型的咀嚼片:(1)可以咀嚼以方便服用的咀嚼片;(2)必须咀嚼或压碎以避免吞咽窒息和/或确保活性成分充分释放的咀嚼片5。
本指南中的概念适用于这两种类型的咀嚼片。
Adverseevents for chewable tablets can include gastrointestinal (GI) obstructionresulting from patients swallowing whole or incompletely chewed tablets, as wellas tooth damage and denture breakage resulting from excessive tablet A related potential adverse event thatsponsors should also consider is esophageal irritation from chewabletablets. A review of numerous approveddrug product applications for chewable tablets revealed that in certain casescritical quality attributes such as hardness, disintegration, and dissolutionwere not given as much consideration as may have been warranted. This was evidenced by instances of incompletemonitoring of all relevant critical quality attributes or the use of widelyranging values that were not justified as acceptance criteria. In addition, a wide variation in analyticalprocedures has been ,8,9咀嚼片的不良反应包括患者整片吞咽或不完全咀嚼导致的胃肠道(GI)阻塞,以及片剂过硬导致牙齿损伤和假牙破损6。
也应考虑咀嚼片引起的食道刺激这一潜在不良事件。
从过去批准的很多咀嚼片来看,许多产品对硬度、崩解时限、溶出度等关键质量属性的考察仍不充分,例如,对所有相关的关键质量属性监管不完全,或质量指标范围很宽泛但未证明其在可接受的标准之内。
此外,据报道,分析方法也存在很大差异7,8,9。
Thisguidance describes the critical quality attributes that should be consideredwhen developing chewable tablets and recommends that the selected acceptancecriteria be appropriate and meaningful indicators of product performancethroughout the shelf life of the product.本指南建议了开发咀嚼片时应考虑的关键质量属性、可选择的合适的可接受标准、产品有效期内的有意义的产品性能指标。
III.讨论Avariety of physical characteristics should be considered in the manufacturingprocess for chewable tablets. An idealchewable tablet should be:•Easy to chew•Palatable (taste masked or of acceptable taste)•Of appropriate size and shape10•Able to disintegrate readily to minimize aspiration and facilitate dissolution.在咀嚼片剂生产工艺中,应考虑各种物理特性。
