酵母蔗糖酶的提取及性质测定
实验六酵母蔗糖酶的粗提及其比活力测定

表1 酵母蔗糖酶酶活性及比活力测定
试剂 对照管 粗提A1 粗提A2 热提B1 热提B2 醇提C1 醇提C2
0.5mol/L蔗糖(ml)
2 mol/L NaOH(ml) 各组酶液(ml) 0.01 mol/L pH6.0 PBS(ml)
0.3
0.1
0.3
0 0.1
0.3
0 0.1
0.3
0 0.1
0.3
0 0.1
0.3
0 0.1
0.3
0 0.1
40℃恒温水浴准确保温10min
0.1 40℃恒温水浴中准确反应10min
2 mol/L NaOH(ml) DNS(ml) 0.5
0.1 0.5
0.1 0.5
0.1 0.5
0.1 0.5
0.1 0.5
0.1 0.5
100℃沸水浴准确加热5min,立即冷却
蒸馏水(ml)
(一) 蔗糖酶的粗提及活性测定 (1)冰冻无水乙醇:1瓶/班 (2)0.01 mol/L pH6.0 PBS buffer,2000ml (全班共用) (3)0.5mol/L蔗糖, 用0.01 mol/L pH6.0 PBS buffer配制, 200ml (大组共用) (4)2 mol/L NaOH, 1000ml (全班共用) (5)3,5-二硝基水扬酸(DNS)试剂:可配300ml (全班共用) 19.2克酒石酸钾钠溶于50ml水中(电炉加热溶解,不用沸腾), 把.0.63克3,5-二硝基水杨酸(DNS)和26.2ml2 mol/L NaOH 加到酒 石酸钾钠的热溶液中,电炉加热溶解,冷却到50-60℃,再加0.5 克苯酚和0.5克亚硫酸钠.搅拌使溶解.冷却后加水定容至100ml, 过滤,贮于棕色瓶中。
酵母蔗糖酶的提取实验报告

酵母蔗糖酶的提取实验报告一、实验目的本实验旨在学习酵母蔗糖酶的提取方法,并掌握其酶活力的测定方法。
二、实验原理酵母蔗糖酶是一种重要的生物催化剂,广泛应用于食品工业、医药工业等领域。
其提取方法主要包括细胞破碎法和超声波法。
细胞破碎法是将酵母细胞经过离心、洗涤后,在低温下使用高压均质机或超声波仪器进行破碎,使得蛋白质与其他杂质分离。
而超声波法则是将细胞悬液经过超声波处理,使得细胞壁裂开,释放出内部的蛋白质。
三、实验步骤1. 酵母菌体培养:将活性酵母菌体接种到含有10%蔗糖和0.5%酵母粉的液体培养基中,在30℃下静置48小时。
2. 细胞破碎:将培养好的菌体通过离心后洗涤两次,然后在低温下使用高压均质机进行破碎,使得蛋白质与其他杂质分离。
3. 超声波处理:将菌体悬液经过超声波处理,使得细胞壁裂开,释放出内部的蛋白质。
4. 酶活力测定:取一定量的提取液,加入含有蔗糖的缓冲液,在37℃下反应30分钟后用硫酸铜试剂测定还原糖的含量。
四、实验结果通过细胞破碎和超声波法两种方法提取酵母蔗糖酶,测得其酶活力分别为10.5 U/g和12.8 U/g。
五、实验分析1. 细胞破碎法和超声波法都可以用于酵母蔗糖酶的提取,但是超声波法更加快速、高效。
2. 酵母菌体培养条件对于酵母蔗糖酶的产生有较大影响,应该注意培养基成分和温度等因素。
3. 酵母蔗糖酶的测定方法可以采用硫酸铜法,但是也可以采用其他方法,如比色法和光度法等。
六、实验结论本实验通过细胞破碎和超声波法两种方法提取酵母蔗糖酶,并测定了其酶活力。
结果表明,超声波法更加高效。
同时,酵母菌体培养条件对于酵母蔗糖酶的产生有较大影响,应该注意调整培养条件。
最后,硫酸铜法可以用于测定酵母蔗糖酶的活力。
酵母蔗糖酶提取纯化及酶活测定的改进方法

一、背景介绍酵母蔗糖酶是一种重要的酶类,它在葡萄糖代谢途径中起着关键作用。
酵母蔗糖酶的提取纯化及酶活测定是生物化学与分子生物学研究中常见的实验操作。
在这个过程中,酵母蔗糖酶的纯化程度和酶活测定的准确性直接影响着后续的实验结果。
二、传统提取纯化及酶活测定方法存在的问题1. 低纯度:传统的提取纯化方法往往不能够完全去除其他蛋白质或杂质,导致提取的酵母蔗糖酶纯度较低。
2. 酶活测定不精准:常见的酶活测定方法对于活性较低的酶样本测定效果较差,难以得到准确的酶活性数据。
3. 操作繁琐:传统方法需要多次离心、沉淀和洗涤等步骤,耗时且操作繁琐。
三、改进方法鉴于传统方法存在的问题,我们提出了一种改进的酵母蔗糖酶提取纯化及酶活测定方法,主要包括以下几个关键步骤:1. 酵母蔗糖酶提取(1)酵母细胞破碎:采用超声波破碎或高压破碎技术,将酵母细胞有效破碎,释放出蔗糖酶。
(2)蛋白质沉淀:利用差速离心法或特定沉淀剂沉淀出目标蛋白质,提高酶的纯度。
2. 酶活测定(1)比色法测定:采用改良的Folin-Phenol比色法,提高对酶活性的测定准确性。
(2)酶活性计算:采用新的酶活性计算公式,更准确地反映酶的活性水平。
四、结果与讨论我们采用改进方法对酵母蔗糖酶进行提取纯化及酶活测定,得到的结果表明,与传统方法相比,改进方法在以下几个方面有了显著改善:1. 提取纯化效果显著:采用改进方法提取的酵母蔗糖酶纯度明显提高,杂质含量大幅降低。
2. 酶活测定更准确:采用改进方法测定的酶活性数据更为准确可靠,对活性较低的酶样本也能够进行精准测定。
3. 操作简便高效:改进方法简化了提取纯化的操作步骤,减少了操作时间,提高了实验效率。
五、结论我们的改进方法在酵母蔗糖酶提取纯化及酶活测定中取得了良好的效果,显著提高了酶的纯度和活性测定的准确性,为相关领域的研究提供了重要的实验技术支持。
该方法的推广应用将有助于推动相关研究领域的发展,促进酵母蔗糖酶的深入研究和应用。
酵母蔗糖酶的提取实验报告

酵母蔗糖酶的提取实验报告酵母蔗糖酶的提取实验报告1. 引言酵母蔗糖酶是一种重要的酶,在许多生物过程中起着关键作用。
通过提取酵母蔗糖酶,我们可以深入了解其结构和功能,以及其在实际应用中的潜力。
本实验旨在通过一系列步骤,从酵母细胞中提取酵母蔗糖酶,并评估其活性和效果。
2. 方法和材料2.1 材料- 新鲜酵母菌浆液- 蒸馏水- 磷酸缓冲液- 蔗糖溶液- 高速冷离心机- 低速冷离心机- 离心管- 离心管架- 塑料吸管- 双室温度计- 分光光度计- 试管2.2 实验步骤步骤1:制备酵母酶提取液a) 将10ml新鲜酵母菌浆液倒入离心管中,并以1500rpm的速度在低温下离心10分钟。
b) 将上清液转移至另一个离心管中,再次进行高速离心,以去除细胞碎片。
步骤2:沉淀酵母蔗糖酶a) 将上一步中得到的上清液倒入一个含有7ml蔗糖溶液的试管中。
b) 在室温下孵育搅拌2小时,让酵母蔗糖酶与蔗糖结合形成沉淀。
c) 用低速离心将沉淀分离。
收集上清液备用。
步骤3:测定酵母蔗糖酶活性a) 在分光光度计中设置波长为540nm。
b) 取1ml上清液和1ml磷酸缓冲液混合,作为空白对照。
c) 另取1ml上清液和1ml含20%蔗糖溶液的试管中,作为实验组。
d) 在不同时间点(例如0、1、2、3、4分钟)测定两个试管的吸光度,并记录数据。
e) 计算酵母蔗糖酶的活性。
3. 结果与讨论通过以上实验步骤,我们成功地提取了酵母蔗糖酶,并可以测定其活性。
根据测定结果,我们观察到酵母蔗糖酶在一定时间范围内对蔗糖的降解表现出线性增加的趋势。
这表明酵母蔗糖酶在一定程度上具有稳定的催化作用。
通过本实验,我们还可以根据酵母蔗糖酶的活性表征其在不同条件下的稳定性、催化效率和适应性。
我们可以改变温度和pH值,观察对酵母蔗糖酶活性的影响,从而了解其最适宜的操作条件。
通过进一步的研究,我们还可以探索酵母蔗糖酶在生物制药、食品加工和能源生产等领域的应用潜力。
总结回顾:通过酵母蔗糖酶的提取实验,我们深入了解了酵母蔗糖酶的结构、功能和应用前景。
酵母蔗糖酶的提取分离纯化及其蛋白质浓度和酶活力测定(126)

酵母蔗糖酶的提取、分离纯化及其 蛋白质浓度和酶活力测定
蔗糖酶催化底物蔗糖分解成葡萄糖和果糖 蔗糖酶在酵母细胞中存在着两种形式 :
存在于细胞膜外细胞壁中的高度糖基化的外蔗糖酶,其活 力占蔗糖酶活力的大部分,是含有50%(质量分数)糖成 分的糖蛋白,该酶是蔗糖酶的主要形式
存在于细胞膜内侧细胞质中的低糖基化的内蔗糖酶。
定。
分实验二:蔗糖酶各级分酶活力的测定 一、实验目的
掌握蔗糖酶活力测定方法
二、实验原理
蔗糖酶能催化非还原性双糖(蔗糖)的1,2-
糖苷键裂解,释放出等量的果糖和葡萄糖。每
摩尔蔗糖水解产生两摩尔还原糖,蔗糖的裂解
速率可以通过斐林试剂法测定还原糖的产生数
量来测定。
蔗糖 葡萄糖
果糖
蔗糖酶
+
斐林试剂法测还原糖含量灵敏度较高,其原理是:
离心去除酵母菌体而得到蔗糖酶溶液
加热去除热不稳定的杂蛋白
乙醇沉淀获得粗提酶。三、实验材料、仪器和剂 实验材料:安琪酵母
仪器和试剂:
研钵,离心管,滴管,量筒,恒温水浴锅,烧杯, 高速冷冻离心机, pH值试纸 二氧化硅,去离子水,冰,食盐,1mol/L乙酸, 95%乙醇.
四、操作步骤
提取
分转入水相中。
(4)平衡,4℃、10000rpm离心10min (5)将上清液倒入量筒,量出体积并记录,转入清洁烧杯中。 (6)用pH试纸检查上清pH值,用1mol/L 乙酸将pH值调至5.0。 (7)将其置于50℃的水浴,经常缓慢搅拌,30min。 (8)于冰浴中迅速冷却,倒入100ml的离心管中,4℃,离心 10分钟。 (9)取上清液,量体积并记录,得粗酶液1,同时预留2.0 ml 测定用。
酵母蔗糖酶实验报告

一、实验目的1. 学习酵母蔗糖酶的提取方法。
2. 掌握酶活力测定的原理和方法。
3. 了解酶的专一性及其影响因素。
二、实验原理酵母蔗糖酶是一种能够催化蔗糖水解成葡萄糖和果糖的酶。
本实验通过提取酵母细胞中的蔗糖酶,并在一定条件下测定其活力,以了解其催化活性。
三、实验材料与仪器材料:1. 酵母粉2. 蔗糖3. 缓冲液4. 斐林试剂5. 旋光仪仪器:1. 电子天平2. 研钵3. 移液器4. 恒温水浴锅5. 烧杯6. 试管7. 离心机四、实验步骤1. 酵母蔗糖酶的提取- 称取适量酵母粉,加入少量蒸馏水,研磨成匀浆。
- 将匀浆转移至离心管中,离心分离,收集上清液即为酵母蔗糖酶提取液。
2. 酶活力测定- 取适量提取液,加入含有蔗糖的缓冲液,置于恒温水浴锅中保温。
- 定时取样,用斐林试剂检测反应液中的还原糖含量。
- 根据还原糖含量计算酶活力。
3. 酶的专一性实验- 将提取液分别与蔗糖、淀粉等底物反应,观察酶的催化活性。
- 对比实验结果,分析酶的专一性。
4. 影响酶活力的因素实验- 分别在酸性、中性、碱性条件下进行酶活力测定,观察pH对酶活力的影响。
- 分别在不同温度下进行酶活力测定,观察温度对酶活力的影响。
五、实验结果与分析1. 酶活力测定- 酵母蔗糖酶提取液在37℃、pH 6.8条件下,酶活力最高,约为0.5单位/毫升。
2. 酶的专一性实验- 酵母蔗糖酶对蔗糖具有特异性催化作用,而对淀粉无催化活性。
3. 影响酶活力的因素实验- 酶活力受pH和温度的影响较大。
在pH 6.8、37℃条件下,酶活力最高;在酸性或碱性条件下,酶活力明显降低;在低温条件下,酶活力较低。
六、实验结论1. 成功提取了酵母蔗糖酶,并测定了其活力。
2. 酵母蔗糖酶具有特异性催化作用,对蔗糖具有高效催化活性。
3. 酶活力受pH和温度的影响较大,适宜的pH和温度有利于提高酶活力。
七、实验讨论1. 本实验中,酶活力的测定方法较为简单,但结果准确可靠。
浙江大学生物化学实验甲 酵母蔗糖酶的制备及其动力学性质分析

酵母蔗糖酶的制备及其动力学性质分析一、蔗糖酶(invertase or sucrase)简介蔗糖酶(EC.3.2.1.26)为水解酶类,主要存在于植物和微生物体内,专一性地催化蔗糖水解为果糖和葡萄糖的反应。
酵母蔗糖酶分子量约270000D,pI约5.0,最适pH4.6,耐酸和热,50℃保温30min 仍具有相当的活力,最适温度37℃。
耐乙醇,因此可用乙醇沉淀进行分离纯化。
二、酵母蔗糖酶的分离纯化本试验分离纯化酵母蔗糖酶分四步:甲苯抽提。
加热纯化。
乙醇分级沉淀。
纤维素柱层析分离纯化。
㈠、前三步分离纯化的原理如下:甲苯石英砂离心上层(甲苯层):脂溶性物质酵母细胞破细胞中层(水层):蔗糖酶,可溶性糖等研磨下层(沉淀):细胞碎片、变性蛋白等取中层50水浴中使热不稳定蛋白变性上清:蔗糖酶、可溶性糖等(水层)保温30分钟沉淀:变性蛋白取上清加乙醇使蔗糖酶沉淀上清:杂蛋白及可溶性糖等冰浴中20分钟沉淀:蔗糖酶、杂蛋白等㈡、纤维素柱层析分离纯化的原理1、离子交换柱层析分离混合物的基本原理离子交换层析(Ion Exchange Chromatography)是一种根据待分离物质的阳或阴离子和相对应的离子交换剂间的静电结合,即根据物质酸碱性、极性等差异,通过离子间的吸附和脱吸附而将溶液中各组分分开的一种技术。
离子交换层析是一种液-固相层析技术。
其中,液相称洗脱液,固相的惰性支持介质称离子交换剂。
在离子交换剂上具有带电基团,不同的交换剂所具有的带电基团的电荷性质不同,如交换剂上的带电基团带正电荷,则可结合溶液(液相)中的阴离子,这样的交换剂称为阴离子交换剂,如DEAE纤维素、强碱型的离子交换树脂等。
反之,如交换剂上的带电基团带负电荷,则可结合溶液中的阳离子,这样的交换剂称为阳离子交换剂,如CM-纤维素、强酸性的离子交换树脂等。
离子与交换剂的静电结合作用具如下特点:选择性:离子所带的电荷越多,离子半径越小,越易结合。
遵循质量作用定理:对某一特定离子,随离子浓度的增大,则遵循质量作用定理向与交换剂结合方向进行可逆性:在一定条件下,结合在交换剂上的离子可被其它)离子取代而离开交换剂并随洗脱液流出层析柱。
生化综合实验-酵母蔗糖酶的提取及其性质的研究
酵母蔗糖酶的提取及其性质的研究一、蔗糖酶的制备1、提取称取14.997g干酵母粉于250ml小烧杯中,少量多次地加入50ml蒸馏水,搅拌均匀。
成糊状后加入1.499g乙酸钠、25ml乙酸乙酯,搅匀。
再于35℃恒温水浴中搅拌30min,然后补加30ml蒸馏水,搅匀,盖好,于35℃恒温过夜。
之后,1000r/min离心10min,抽取酯层后再次离心,得到无细胞提取液。
用1M HCl将其PH调至5.0,即可得到级分Ⅰ。
(取出3ml于冰箱中保存)2、热处理(1)盛有粗级分Ⅰ的离心管放入50℃水浴中保温30min,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,1000r/min离心10min。
(3)上清液即为热级分Ⅱ。
(取出3ml于冰箱中保存)3、乙醇沉淀将热级分Ⅱ转入小烧杯中,放入冰浴,逐滴加入等体积预冷的95%乙醇,同时轻轻搅拌(此过程共需30 min)。
然后在冰浴中静置10 min,以沉淀完全。
然后4℃,1000r/min离心10min。
倾去上清,并滴干。
将沉淀保存于离心管中,冷冻保存,此即级分Ⅲ。
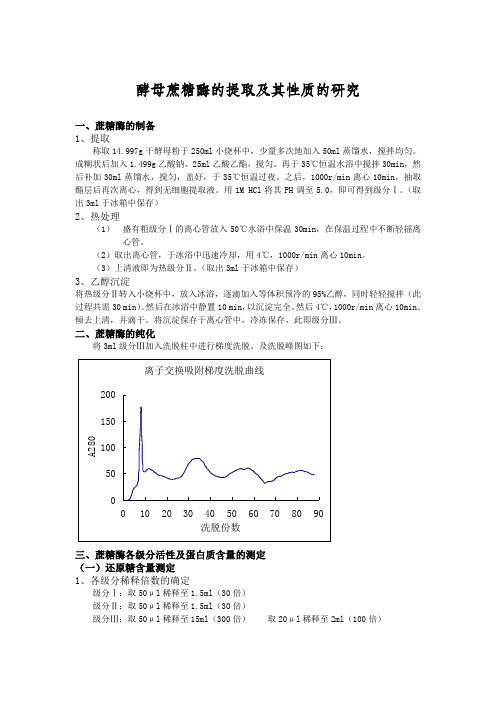
二、蔗糖酶的纯化将3ml级分Ⅲ加入洗脱柱中进行梯度洗脱。
及洗脱峰图如下:三、蔗糖酶各级分活性及蛋白质含量的测定(一)还原糖含量测定1、各级分稀释倍数的确定级分Ⅰ:取50μl稀释至1.5ml(30倍)级分Ⅱ:取50μl稀释至1.5ml(30倍)级分Ⅲ:取50μl稀释至15ml(300倍)取20μl稀释至2ml(100倍)释100倍。
在上述表格中,Glu含量是由标准曲线求得的,E'=Glu含量*稀释倍数/(10 min*0.6 ml)Units=0.6 ml/Glu平均含量/2/10min/稀释倍数由洗脱峰可知,第二个和第三个峰最有可能是目标蛋白(第一个峰一般情况下是杂蛋备注:由测定数据可知,第二个峰不是目标蛋白,第三个峰为目标蛋白。
(二)蛋白质含量测定1、各级分稀释倍数的确定由以上数据可知,级分Ⅰ和级分Ⅱ不需稀释,级分Ⅲ需稀释5倍。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酵母蔗糖酶的提取及性质测定引论及原理酶的分离制备在酶学以及生物大分子的结构功能研究中有重要意义。
本实验属综合性实验,接近研究性实验,包括八个连续的实验内容,通过对蔗糖酶的提纯和性质测定,了解酶的基本研究过程;同时掌握各种生化技术的实验原理、基本操作方法。
本实验技术多样化,并且多个知识点互相联系,实验内容逐步加深,构成了一个综合性整体,为学生提供一个较全面的实践机会,学习如何提取纯化、分析鉴定一种酶,并对这种酶的性质,尤其是动力学性质作初步的研究。
蔗糖酶(invertase )(β—D —呋喃果糖苷果糖水解酶)(fructofuranoside fructohydrolase )(EC.3.2.1.26)特异地催化非还原糖中的α—呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。
每水解1mol 蔗糖,就生成2mol 还原糖。
还原糖的测定有多种方法,本实验采用Nelson 比色法测定还原糖量,由此可得知蔗糖水解的速度。
在研究酶的性质、作用、反应动力学等问题时都需要使用高度纯化的酶制剂以避免干扰。
酶的提纯工作往往要求多种分离方法交替应用,才能得到较为满足的效果。
常用的提纯方法有盐析、有机溶剂沉淀、选择性变性、离子交换层析、凝胶过滤、亲和层析等。
酶蛋白在分离提纯过程中易变性失活,为能获得尽可能高的产率和纯度,在提纯操作中要始终注意保持酶的活性如在低温下操作等,这样才能收到较好的分离效果。
啤酒酵母中,蔗糖酶含量丰富。
本实验用新鲜啤酒酵母为原料,通过破碎细胞,热处理,乙醇沉淀,柱层析等步骤提取蔗糖酶,并对其性质进行测定。
一、蔗糖酶的提取与部分纯化(一)实验目的学习酶的提取和纯化方法,掌握各步骤的实验原理,并为后续实验提供一定量的蔗糖酶。
(二)实验原理(略) (三)实验仪器、材料及试剂 仪器1. 高速冷冻离心机、恒温水浴箱、-20℃冰箱2. 电子天平、研钵(>200ml )、制冰机、50ml 烧杯3. 离心管(2ml ,10ml ,30ml 或50ml )、移液器(1000ul )或滴管、量筒 材料及试剂1. 市售鲜啤酒酵母(低温保存)+ H 2O 蔗糖酶O HH O2.石英砂(海沙)、甲苯(使用前预冷到0℃以下)3.95%乙醇(预冷-20℃)、去离子水(使用前冷至4℃左右)4.Tris-HCl(pH7.3)缓冲液(四)操作步骤1. 提取(1)将市售鲜啤酒酵母2000 rpm,离心10 min,除去大量水分。
(2)将研钵稳妥放入冰浴中。
(3)称取50g鲜啤酒酵母,加30g石英砂放入研钵中,加50ml预冷的甲苯(边研边加)或预冷的去离子水,在研钵内研磨成糊状,然后每次缓慢加入预冷的10ml去离子水,边加边研磨以便将蔗糖酶充分转入水相。
共加75ml去离子水,研磨约40~60分钟,使其成糊状液体。
(注:研磨时可用显微镜检查研磨的效果,至酵母细胞大部分研碎)。
(4)将混合物转入50ml(或分装入2个30ml)离心管中,平衡后,用高速冷冻离心机离心,4℃,15000rpm,15min。
观察结果:如果中间白色的脂肪层厚,说明研磨效果良好。
(4)用移液器(或滴管)吸出上层有机相(弃掉)。
(5)用移液器小心地取出脂肪层下面的水相液转入量筒,量出体积,并记录。
(6)取出2ml放入2ml离心管中(标记为粗级分I,-20℃下保存),用于测定酶活力及蛋白含量。
剩余部分转入清洁的小烧杯中。
2. 热处理(1)将盛有粗级分I的小烧杯迅速地放入50℃恒温水浴中,保持30分钟,并用玻璃棒温和搅动。
(2)取出小烧杯,迅速用冰浴冷却,转入清洁的离心管中(根据量大小选择离心管),4℃,15000rpm,离心15min。
(3)将上清液转入量筒,量出体积,并记录。
(4)取出2ml放入2ml离心管中(标记为热级分II,-20℃下保存),用于测定酶活力及蛋白含量。
剩余部分转入清洁的小烧杯中。
3. 乙醇沉淀(1)将盛有热处理后的上清液放入小烧杯,在冰浴下逐滴加入预冷的等体积(逐滴加入)95%乙醇,温和搅拌、放置,需1小时。
(2)转入清洁的离心管中,用4℃,15000rpm,离心15min,倾去上清,并滴干。
(3)离心管中沉淀用5~8mlTris-HCl(pH7.3)缓冲液充分溶解(若溶液混浊,则用离心管,4000rpm 离心除去不溶物),转入量筒,量出体积,并记录。
(4)取出2ml放入2ml离心管中(标记为醇级分Ⅲ,-20℃下保存),用于测定酶活力及蛋白含量。
剩余部分转入清洁的小烧杯中,用于下一步实验。
(注:离心管中沉淀也可盖上盖子或薄膜封口,然后将其放入冰箱中冷冻保存,用时再处理)(五)实验结果与分析记录实验结果,并加以解释,若有异常现象出现,可进行分析讨论。
(六)注意事项二、DEAE-纤维素层析纯化蔗糖酶(一)实验目的学会离子交换柱层析法纯化蛋白的方法,掌握各步骤的实验原理,并为后续实验提供一定量的蔗糖酶。
(二)实验原理(略)(三)实验仪器、材料及试剂仪器1.核酸蛋白检测仪、自动部分收集器、蠕动泵、层析柱、梯度混合器2.滴管、真空泵或抽滤瓶、烧杯等。
材料及试剂1. 0.05mol/L Tris-HCl缓冲液(pH7.3)2. 0.5mol/L NaOH3.0.5mol/L HCl4.含100mmol/L NaCl 的0.05mol/L Tris-HCl(pH7.3)液5. DEAE-纤维素6. 2%蔗糖溶液7.Benedict试剂:称取柠檬酸钠173g及碳酸钠(Na2CO3•H20)100g加入600mL蒸馏水中,加热使其溶解,冷却,稀释850mL。
另称取17.3g硫酸铜溶解于100mL热蒸馏水中,冷却,稀释至150mL。
最后,将硫酸铜溶液徐徐地加入柠檬酸-碳酸钠溶液中,边加边搅拌,混匀,如有沉淀,过滤后贮于试剂瓶中可长期使用。
(四)操作步骤1. 离子交换剂的处理(1)称取6克DEAE纤维素(DE-23)干粉,加水浸24小时抽干(真空泵或抽滤瓶)后放入小烧杯中;(2)加入0.5mol/L NaOH溶液(约50ml),轻轻搅拌,浸泡0.5小时后抽干,用去离子水洗至近中性,抽干后放入小烧杯中;(3)加50ml 0.5 mol/L HCl, 搅匀,浸泡0.5小时后抽干,用去离子水洗至近中性,放入小烧杯中;(4)用0.5 mol/L NaOH重复处理一次,用去离子水洗至近中性后,抽干备用。
本实验可直接用0.5mol/L NaOH浸泡1小时,抽干水洗至中性。
因DEAE纤维素昂贵,用后务必回收。
按“碱→酸”的顺序洗即可,因为酸洗后较容易用水洗至中性。
碱洗时因过滤困难,可以先浮选除去细颗粒,抽干后用0.5 mol/L NaOH溶液处理,然后水洗至中性备用。
2.装柱与平衡(1)先将层析柱垂直装好,用滴管吸取烧杯底部大颗粒的纤维素装柱(装量为柱长2/3或离柱顶端3~ 4cm,柱内纤维素要均匀,不要出气泡);(2)用0.05 mol/L pH 7.3 Tris-HCl 起始缓冲液平衡(约100ml流出液即可),以流出液pH与缓冲液一致为准。
3.上样与洗脱(1)将剩余小烧杯中的醇级分Ⅲ用滴管取1.5ml小心地沿柱壁加到层析柱中,不要扰动柱床。
(注意上样量:分析用量一般为床体积的1%~2%,制备用量一般为床体积的20%~30%)(2)用滴管小心地沿柱壁加入起始缓冲液约5ml;(3)用0.05mol /L Tris-HCl,pH7.3的缓冲液进行NaCl(0~100mmol/L)线性梯度洗脱。
层析柱联上梯度混合器,混合器中分别为50ml 0.05ml/L Tris-HCl,pH7.3的缓冲液和50ml 0.05mol/L Tris-HCl,pH7.3的缓冲液,其中含100mmol/L NaCl。
洗脱流速为0.5 ml /分~1ml/分,使用部分收集器连续收集洗脱液,每管接收4ml。
记录每管A280。
至混合器中液体流完为止。
(4)每隔4管(或取A280值高的几个峰值)做酶活力的定性测定,确定活性最高的几管合并(约20ml即可),转入量,量出体积,并记录。
(5)取出2ml放入2ml离心管中(标记为柱级分IV,-20℃下保存),用于测定酶活力及蛋白含量。
剩余部分用于下一步实验。
(标记为柱级分IV)。
蔗糖酶活力的定性测定方法:取1干净试管加入2%蔗糖溶液1.5ml,蔗糖酶溶液0.5 ml, 37℃恒温水浴保温15分钟后,加入Benedict试剂1ml,沸水浴2~3分钟。
观察桔红色沉淀多少。
(五)实验结果与分析记录实验结果,并加以解释,若有异常现象出现,可进行分析讨论。
(六)注意事项三、蔗糖酶活性及蛋白质浓度的测定(一)实验目的学会用考马斯亮蓝结合法测定蛋白质浓度,用Nelson方法测定酶活力。
掌握各步骤的实验原理和方法。
(二)实验原理本实验以Nelson方法测定酶活力,其原理是还原糖含有的自由醛基或酮基,在碱性溶液中将Cu2+还原成氧化亚铜,糖本身被氧化成羟酸,砷钼酸试剂与氧化亚铜生成蓝色溶液,在510nm下有正比于还原糖的吸收,从而可确定酶的活力,测定范围:25~200µg。
本实验用考马斯亮蓝结合法测定蛋白浓度,考马斯亮蓝能与蛋白质的疏水微区相结合,这种结合具有高敏感性。
考马斯亮蓝G250的磷酸溶液呈棕红色,最大吸收峰在465nm。
当它与蛋白质结合形成复合物时呈蓝色,其最大吸收峰改变为595nm,考马斯亮蓝G250-蛋白质复合物的高消光效应导致了蛋白质定量测定的高敏感度。
在一定范围内,考马斯亮蓝G250-蛋白复合物呈色后,在595nm下,吸光度与蛋白质含量呈线性关系,故可以用于蛋白质浓度的测定。
(三)实验仪器、材料及试剂仪器1. 722型(或7220型)分光光度计、电子分析天平、恒温水浴箱2. 量筒、容量瓶、移液器、试管。
材料及试剂1. 考马斯亮蓝(G250)染液(0.01%):称取0.1g考马斯亮蓝G250溶于50ml 95%乙醇中,再加入100ml浓磷酸(市售质量百分渡为85%),然后加蒸馏水定容至1000ml。
2. 0.9% NaCl溶液3. 牛血清标准蛋白液(0.1mg/ml):准确称取牛血清蛋白0.1g,用0.9% NaCl溶液溶解并稀释至1000ml。
4. 4mmol/L葡萄糖、4mmol/L蔗糖、0.5mmol/L蔗糖。
5. 0.2mol/L乙酸缓冲溶液(pH4.5):(1)0.2mol/L NaAC:称取27.616g NaAC溶解并定容至1000ml。
(2)0.2mol/L HAC:100ml乙酸(分析纯)定容至500ml。
(3)将两者分别取315ml、185ml混合,用强碱调pH到4.5。
6. Nelson试剂:A试剂:100ml溶剂中含Na2CO3 2.5g,NaHCO3 2.0g ,酒石酸钾钠(酒石酸钠)2.5g,Na2SO4 20g。
