直接碘量法名词解释
2_分析化学名词解释

1.分析化学是化学的一个分支科学,是关于测定物质的质和量的科学,是化学测量和表征的科学2.定性分析:确定物质是由哪些组分--元素,离子,基团或化合物所组成3.定量分析:测定物质中有关组分的含量4.化学分析:以物质的化学反应为基础的分析方法5.仪器分析:以物质的物理化学性质为基础的仪器分析方法6.仲裁分析:不同单位对同一产品的分析结果有争议时,要求某单位(如一定级别的药检所,法定检验单位等)用法定方法进行准确的分析,以判断原分析结果是否准确7.系统误差:是由测定过程中某些确定的因素造成的8.偶然误差:是由某些不确定的原因或某些难以控制得原因造成的9.方法误差:不适当的实验设计或分析方法本身所造成的误差10.操作误差:操作人员的主观原因或习惯在实验过程中所引起的误差11.误差:测量值与真实值之间的差值12.相对误差:绝对误差在真实值中所占的百分率13.标准参考物质:必须要有公认的权威机构鉴定,并给与证书,具有良好的均匀性和稳定性,其含量测定的准确度至少高于实际测量的3倍14.偏差:是指某一尺寸减其基本尺寸所得的代数差15.相对偏差:单次测量值的绝对偏差在平均值中所占的百分率16.平均偏差:各测量值的绝对偏差的绝对值的算数平均值17.相对平均偏差:平均偏差在平均值中所占的百分率18.准确度:测量值与真实值的符合程度19.精密度:在相同条件下,同一试样的重复测定值之间的符合程度20.有效数字:是指在分析工作中实际测量到的数字,除最后一位是可疑的外,其余的数字都是准确的21.有效数字的修约:计算前舍去多余数字的过程22.平均值的置信区间:表示在一定置信水平下,以单位测定值x为中心,包括总体平均值在内的可信范围23.空白实验:在不加试样的情况下,按照与试样测定相同的条件和步骤进行的实验24.对照实验:用已知含量的标准试样或纯溶液,在与试样相同的测定条件下进行分析测定,所得分析结果与已知含量比较,便可得出分析的误差,有时可对测定误差加以校正25.回收试验:用所建方法测定出试样中被测组分的含量后,在几份相同的试样(n>5)中加入一定量的被测组分的纯品,在相同的条件下用相同的方法测定,计算回收率26.滴定分析法(容量分析法):是将一种已知浓度的溶液--标准溶液滴加到被测物质的溶液中,使其与被测物质按化学计量关系定量反应,然后根据所加入标准溶液的浓度与体积,计算出被测物质的含量的方法27.标准溶液:是已知准确浓度的溶液,称为滴定剂28.化学计量点:当加入的标准溶液的量与被测物质的量按照化学反应式的化学计量关系完全作用时,反应达到了化学计量点29.滴定终点:由于指示剂颜色发生变化或电位电导电流等发生突变而停止滴定之点30.终点误差(滴定误差):化学计量点与滴定终点不符产生的误差31.非水滴定法:在以水以外溶剂中的滴定反应为基础的滴定分析方法32.基准物质:能用于直接配制标准溶液或标定标准溶液的物质33.物质的量浓度:表示单位体积的溶液中所含溶质的物质的量34.滴定度:①以每毫升标准溶液中所含溶质的质量表示,以T B表示②每毫升标准溶液T能与被测组分B完全作用时消耗B的克数,以T T/B表示35.酸碱滴定法:是以质子转移为基础的滴定分析方法36.质子酸:能给出质子的物质37.质子碱:能接受质子的物质38.酸碱半反应:酸失去一个质子或碱得到一个质子转变成相互对应的碱或酸的反应39.共轭酸碱对:酸碱半反应中的酸与碱以质子联系而成共轭关系,相互依存又相互转换40.溶剂的质子自递反应:只发生在溶剂分子之间的质子转移反应,称为溶剂的质子自递反应41.分析浓度:溶液中溶质的总浓度42.平衡浓度:平衡状态时溶质或溶质各型体的浓度43.酸度:溶液中氢离子的平衡浓度称为酸度44.质量平衡(MBE):平衡状态时,溶质的各型平衡浓度之和与溶质分析浓度为等衡关系45.电荷平衡(CBE):处于平衡状态的水溶液是电中性的,既溶液中荷正电质点电荷之和必等于荷负电荷点电荷之和46.质子平衡(PBE):酸碱反应达到平衡时,酸与碱之间得失质子的平衡关系称为质子平衡47.质子条件式:质子平衡的数学表达式48.滴定突跃:在化学计量点附近溶液pH的突变称为滴定突跃49.滴定突跃范围:突跃所在的pH范围称为滴定突跃范围50.分布系数:溶液中某酸碱组分的平衡浓度占其总浓度的分数51.质子溶剂:能接受质子或给出质子的溶剂52.耦合亲质子溶剂:分子中无可转移质子,但却有较弱的接受质子能力和形成氢键的能力53.惰性溶剂:几乎没有接受质子和形成氢键的能力的溶剂54.均化效应:这种将不同强度的酸均化到溶质和质子水平的效应55.区分效应:能区分酸碱强弱的效应称为区分效应1.质子溶剂:能接受质子或给出质子的溶剂2.两性溶剂:既易给出质子又易接受质子的溶剂或称为中性溶剂3.酸性溶剂:给出质子能力较强的溶剂4.碱性溶剂:接受质子能力较强的溶剂5.耦合亲质子溶剂:分子中无可转移质子,但却有较弱的接受质子能力和形成氢键能力6.惰性溶剂:几乎没有接受质子和形成氢键的能力的溶剂7.混合溶剂:为使样品易于溶解,增大滴定突跃,并使终点指示剂变色敏锐,还可以将质子性溶剂与惰性溶剂混合使用8.非质子溶剂:没有给出质子的能力的溶剂称为无质子性溶剂9.均化效应和均化性溶剂:均化效应是指当不同的酸或碱在同一溶剂中显示相同的酸碱强度水平。
分析名词解释

分析名词解释分析名词解释1.分析化学:是关于研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的一门科学。
2.准确度:指测量值与真值(真实值)接近的程度3.误差:衡量测量准确度高低的尺度,分为绝对误差和相对误差4.精密度:测量的各测量值间的相互接近程度。
5.偏差:衡量精密度高低的尺度6.滴定:将滴定剂通过滴定管滴入待测溶液中的过程。
7.滴定剂:浓度准确已知的试样溶液。
8.指示剂:滴定分析中能发生颜色改变而指示终点的试剂。
9.滴定终点:滴定分析中指示剂发生颜色改变的那一点(ep)10.化学计量点:滴定剂与待测溶液按化学计量关系反应完全的那一点(sp)11.滴定终点误差:滴定终点与化学计量点不一致造成的误差(TE),简称终点误差,又称滴定误差12.滴定曲线(Titration curve): 以作图的方式描述滴定过程中组分浓度的变化。
以加入的滴定剂体积(或滴定百分数)为横坐标,溶液的组分浓度或与浓度相关的某种参数(pH, pM等)为纵坐标绘制的曲线13.滴定突跃范围;在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱滴定中的pH)的突然改变就是滴定突跃,突跃所在的范围称为突跃范围。
14.指示剂的变色范围;指示剂由一种型体颜色变为另一型体颜色的范围称为指示剂的变色范围。
15.指示剂的理论变色点;当两者浓度相等时,即[In]=[XIn],溶液呈现指示剂的中间过渡颜色,这一点称为指示剂的理论变色点16.基准物质:能用于直接配制或标定标准溶液的物质.17.滴定度;T T/B指每毫升滴定剂溶液相当于待测物的质量18.均化效应(拉平效应):能将不同强度的酸或碱均化到溶剂化质子(或溶剂阴离子)水平的效应19.区分效应:能区分酸碱强弱的效应20.酸效应:由于H+存在,在H+与Y之间发生副反应,使Y参加主反应能力降低的现象.21.共存离子效应:溶液中存在其他金属离子N时,Y与N形成配合物,而使Y参与主反应能力降低的现象22.配位效应:由于其他配位剂L与M发生副反应,使金属离子M与配位剂Y参加主反应能力降低的现象.23.金属离子指示剂:配位滴定中,能与金属离子生成有色配合物从而指示滴定过程中金属离子浓度变化的显色剂(多为有机染料、弱酸).24.指示剂的封闭现象:化学计量点时不见指示剂变色25.指示剂的僵化现象:化学计量点时指示剂变色缓慢.26.条件电位:一定介质条件下,氧化态和还原态的分析浓度均为1mol/L或它们的比值为1时的电对电极电位27.盐效应:溶液中电解质浓度对条件电位的影响作用称为盐效应28.自身指示剂:有些滴定剂或被测物有颜色,滴定产物无色或颜色很浅,则滴定时无须再滴加指示剂,本身的颜色变化起着指示剂的作用,称自身指示剂29.特殊指示剂:有些物质本身不具有氧化还原性,但可以同氧化还原电对形成有色配合物,因而可以指示终点。
分析化学8碘量法

和测定样品完全相同条件下进行的 平行测定)。
反应式
Na2S2O5+2I2+3H2O = Na2SO4+H2SO4+4HI I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Na2S2O5 ~ 2I2 ~ 4Na2S2O3
Na2S2O3%=
1 4
CNa2S2O3
[V (空白) Na2S2O3
VNa2S2O(3 测量)]M
Na2S2O5×100
1000S
%
漂白粉中有效氯的测定
Cl
Ca OCl +2H+ = Ca2+ + Cl2 + H2O Cl2+2I- =I2 + 2ClI2 + 2S2O32- = 2I -+ S4O62-
碘量法
教学目标
1.简述直接碘量法和间接碘量 法的测定原理和滴定条件。
2.会进行碘滴定液、硫代硫 酸钠滴定液的配制和标定。
3.说出几个常用的碘量法应用 实例。
碘量法(iodimetry)
利用I2的氧化性或I-的 还原性来进行的氧化还原滴 定的方法。
直接碘量法
电位比I2/I- 低的强还原性 物质,可用碘液直接滴定,这种 滴定方式称为直接碘量法或碘滴 定法。
mol/L
0.1mol/L硫代硫酸钠滴定液的标定
取在120ºC干燥至恒重的基准重铬
酸钾0.15g,精密称定,置碘瓶中,加 蒸馏水50ml使溶解,加碘化钾2.0g, 轻轻振摇使溶解,加稀硫酸40ml, 摇匀,密塞;在暗处放置10min, 加 蒸馏水250ml稀释, 用待标定的 Na2S2O3溶液滴定至近终点,加淀粉指 示剂 3ml,继续滴定至蓝色消失而
第六章氧化还原滴定法碘量法

SO2 S H2O
4I 4H O2
2I2 2H2O
若在碱性溶液中,则发生:
3I2 6OH
5I IO3 3H2O
4I2
S O2 23
10OH
2SO
2 4
8I
5H2O
间接碘量法的误差主要来源于两
方面:一是I2的挥发,二是I-在酸性 溶液中被空气中的O2氧化。
防止I2挥发的方法:1)加入过量的 KI;2)在室温中进行;3)使用碘瓶, 快滴慢摇。
将过滤后的溶液贮存于棕色试剂 瓶中,放于暗处,以待标定。
2.标定KMnO4溶液的基准物质
H2C2O4 2H2O、Na2C2O4、Fe(NH4 )2 (SO4 )2 6H2O
As2O3、纯铁丝
2MnO4-+5C2O42-+16H+
2Mn2++10CO2+8H2O
为使这个反应能定量地较快进行,注意条件:
2MnO4-+5C2O42-+16H+ 2Mn2++10CO2+8H2O
二、标准溶液的配制
1.配制高锰酸钾标液采用
标定法
一般高锰酸钾试剂中常含有 少量MnO2和其他杂质,而且…
为配制较稳定的KMnO4溶液,常需:
称取稍多于理论量的KMnO4溶解。 将配好的溶液加热至沸,并保持 微沸1hr,密闭放置7~10天。 用微孔玻璃漏斗过滤。
配制过程中加入少量Na2CO3作稳定剂, 可基本保持三个月内浓度基本不变。
对氨基苯磺酸
H2N
SO3H +NaNO2+2HCl
基准物 [N N
SO3H]Cl +NaCl+2H2O
分析化学---名词解释

名词解释第二章误差和分析数据处理:准确度:分析结果与真实值接近的程度,其大小可用误差表示。
精密度:平行测量的各测量值之间互相接近的程度,其大小可用偏差表示。
系统误差:是由某种确定的原因所引起的误差,一般有固定的方向(正负)和大小,重复测定时重复出现。
包括方法误差、仪器或试剂误差及操作误差三种。
偶然误差:是由某些偶然因素所引起的误差,其大小和正负均不固定。
空白试验:在不加入试样的情况下,按与测定试样相同的条件和步骤进行的分析试验,称为空白试验。
有效数字:是指在分析工作中实际上能测量到的数字。
通常包括全部准确值和最末一位欠准值(有±1个单位的误差)。
t分布:指少量测量数据平均值的概率误差分布。
可采用t分布对有限测量数据进行统计处理。
置信水平与显著性水平:指在某一t值时,测定值x落在μ±tS范围内的概率,称为置信水平(也称置信度或置信概率),用P表示;测定值x落在μ±tS范围之外的概率(1-P),称为显著性水平,用α表示。
置信区间与置信限:系指在一定的置信水平时,以测定结果x为中心,包括总体平均值μ在内的可信范围,即μ=x±uσ,式中uσ为置信限。
分为双侧置信区间与单侧置信区间。
显著性检验:用于判断某一分析方法或操作过程中是否存在较大的系统误差和偶然误差的检验。
包括t检验和F检验。
第三章滴定分析法概论:滴定度:是每毫升标准溶液相当于被测物质的质量(g或mg),以符号T T/B表示,其下标中T、B分别表示标准溶液中的溶质、被测物质的化学式。
T T/B=m B /V T,单位为g/ml或mg/ml分布系数:是溶液中某型体的平衡浓度在溶质总浓度中所占的分数,又称为分布分数以δi表示。
化学计量点:滴定剂的量与被测物质的量正好符合化学反应式所表示的计量关系的一点。
滴定终点:滴定终止(指示剂改变颜色)的一点。
滴定误差:滴定终点与化学计量点不完全一致所造成的相对误差。
可用林邦误差公式计算。
碘量法

二、实例: (一)铜矿中铜的测定: 铜合金 分解 溶液(Cu 2 )
HNO 3
NH 4 HF2控制pH 3.2 ~ 4.0 PH 3.2 ~ 4.0 I 2 KI Na2 S 2O3 近终点加入NH 4 SCN 终点
由于I2 氧化能力不强,所以滴定仅限于较强的还原剂, 因此可用于直接滴定的物质不多,有S2- 、SO32- 、 Sn2+、S2O32-、AsO33-等。
直接碘量法应在酸性、中性或弱碱性溶液中进行。
PH>9时,则有如下副反应 3I2 + 6OH- = IO3- + 5I- + 3H2O
2. 间接碘法:利用I-的还原性
2Cu
2
4 I 2CuI I 2
析出的I 2用欲标定的Na2 S 2O3溶液滴定
2 2 I 2 2 S 2O3 2 I S 4O6 2 2 1Cr2O7 3I 2 6 S 2O3
用Na2S2O3 与I2 定量作用,求出Na2S2O3
的准确浓度.
3. 实验条件 (1) 酸度:0.2~0.4mol/L为宜;过高,I-易被氧化;过低反应 速度慢。
(2) 反应速度:K2Cr2O7与KI的反应速度较慢。应将碘瓶中封
后,暗处反应10min。 (3) 稀释:降低Cr3+的浓度,有利于终点观察;降低酸度,减 慢I-被空气氧化速度,降低Na2S2O3分解。 (4) 终点:滴定溶液呈稻黄色时,再加入淀粉指示剂。 (二) I2标准溶液 间接法,用标准Na2S2O3溶液标定。
解:有关反应式为: Pb3O4 8 HCl Cl2 3PbCl2 4 H 2O Cl2 2 KI I 2 2 KCl
碘量法

3.碘量法应用示例 (1) S2-或H2S的测定。酸性溶液中,用淀粉做指示剂 2- :H S+I =S+2I-+2H+ I2氧化S 2 2 (2)铜合金中铜的测定。试样可用HNO3分解,也可用H2O2 和HCl分解试样:Cu+2HCl+H2O2=CuCl2+2H2O煮沸除尽过 量的,加入过量KI使I析出:2Cu2++4I-=2CuI↓+I2 (3)漂白粉中有效的氯的测定。 试样在稀H2SO4介质中,加过量KI反应生成的I2,用 Na2S2O3标准溶液滴定:ClO-+2H++2I =I2+Cl-+H2O 试样中的ClO2-及ClO3-亦参加反应 (4)某些有机物的测定。凡能被碘直接氧化的物质,只 要反应速度足够快,就可用直接碘量法进行测定。例如 巯基乙酸、四乙基铅[Pb(C2H5)4]、抗坏血酸(维生素C) 及安乃近(药物名)等。
碘量法的分类
2 . 标准溶液的配制与标定
碘量法中常用Na2S2O3和I2标准溶液,两种溶液的配制与标定 方法如下:
(1)Na2S2O3标准溶液的配制与标定。
固体Na2S2O3·5H2O容易风化,并且含有S、S2-、SO32-、 CO32-、CI-等杂质,因此不能用来直接配制标准溶液。 Na2S2O3溶液不稳定,其易分解的原因: ①细菌的作用 Na2S2O3 →Na2SO3+S
①.直接碘量法。电极电位比 φθ (I2/I-)小的还原性物质,I2 标准溶液直接滴定的方法。基本反应是: I2+2e ⇌ 2I可用用以滴定S2-、SO32-、Sn2+、AsO33-等 注意:直接碘量法的应用受溶液H+浓度的影响很大,反 应一般在中性或弱酸性中进行。PH过高,I2会发生歧化反应: 3I2+6OH-=IO3-+5I-+3H2O,给测定带来误差。 ②.间接碘量法。在一定条件下,用过量的还原剂KI与电极电 位比 φθ(I2/I-)电对高的氧化剂反应,再用硫代硫酸钠 (Na2S2O3)标准溶液滴定析出的I2的方法。基本反应是: 22-=I 2I -2e 2 I2+2S2O3 =S4O6 +2I ③.间接碘量法的反应条件: <1>.酸度,必须在中性或弱酸性中进行。 <2>.终点常用淀粉指示剂来确定。有少量I-存在时,形成蓝 色化合物。
维生素C的含量测定(直接碘量法)
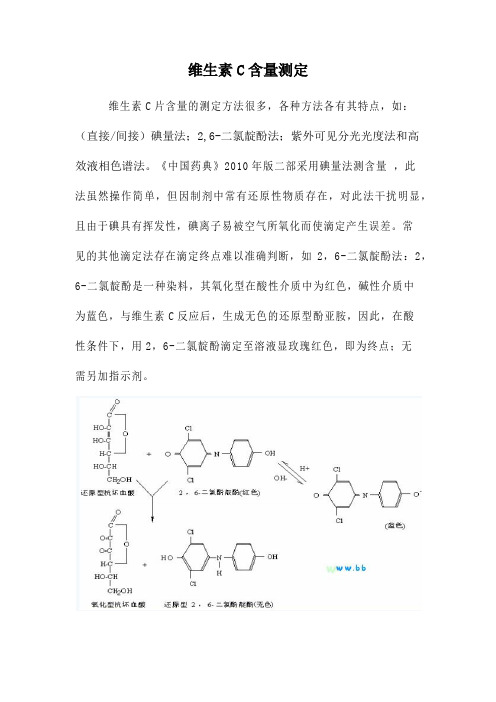
维生素C含量测定维生素C片含量的测定方法很多,各种方法各有其特点,如:(直接/间接)碘量法;2,6-二氯靛酚法;紫外可见分光光度法和高效液相色谱法。
《中国药典》2010年版二部采用碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法干扰明显,且由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-二氯靛酚法:2,6-二氯靛酚是一种染料,其氧化型在酸性介质中为红色,碱性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至溶液显玫瑰红色,即为终点;无需另加指示剂。
分光光度法运用维生素C的旋光性能进行含量测定,但操作费时,而高效液相色谱法是目前发展较为迅速的一种方法,灵敏度高,选择性好,是一个准确高效的测定维生素C含量的方法。
我们主要介绍的是直接碘量法。
直接碘量法一.实验原理维生素C是人体重要的维生素之一,它影响胶元蛋白的形成,参与人体多种氧化-还原反应,并且有解毒作用。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C,通常还需储藏能维持一个月左右的维生素C。
缺乏时会产生坏血病,故又称抗坏血酸。
维生素C属水溶性维生素,分子式C6H8O6。
分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,因而可用I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、饮料、蔬菜、水果中维生素C的含量。
由于维生素C的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I - 在强酸性中也易被氧化,故一般选在pH为3~4的弱酸性溶液中进行滴定。
由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差;又由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定比较麻烦。
