直接碘量法测定维生素C含量
直接碘量法测定药片中维生素C的含量

直接碘量法测定药片中维生素C的含量11化学曾凯平11218022一实验目的1.掌握碘标准溶液的配制注意事项。
2. 通过维生素C的测定了解直接碘量法的过程。
二实验原理维生素C又叫抗坏血酸,分子式C6H4O6。
由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,其反应式为:碱性条件下可使反应向右进行完全,但因维生素C还原性很强,在碱性溶液中尤其易被空气氧化,在酸性介质中较为稳定,故反应应在稀酸(如稀乙酸、稀硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直接称取,需采用间接配制法;通常用基准As2O3对I2溶液进行标定。
As2O3不溶于水,溶于NaOH:As2O3+6NaOH═2Na3AsO3+3H2O由于滴定不能在强碱性溶液中进行,需加H2SO4中和过量的NaOH,并加入NaHCO3使溶液的pH=8。
I2与亚砷酸之间的反应为:AsO32-+I2+H2O═AsO43-+2I-+2H+三器皿和试剂酸式滴定管;NaHCO3、KI、I2(以上为AR),As2O3(于105 C 干燥至恒重),6mol·L-1NaOH,0.5mol·L-1H2SO4,10%HAc,1%淀粉溶液,维生素C片剂。
四实验步骤1. 0.1mol·L-1I2标准溶液的配制称取10.8gKI,溶于10mL蒸馏水中,再用表面皿称取I2约6.5g,溶于上述KI溶液,加1滴浓盐酸,加水稀释至300mL,摇匀,用玻璃漏斗过滤,贮存于棕色试剂瓶中并置于暗处。
2.0.1mol·L-1I2标准溶液的标定准确称取基准As2O30.15g,加6mol·L-1NaOH溶液10mL,微热使溶解,加水20mL,加甲基橙指示剂1滴,加0.5mol·L-1H2SO4试液至溶液由黄色变为粉红,再加NaHCO32g、水30mL、淀粉指示剂2mL,用碘标准溶液滴定至蓝色,半分钟内不褪色,计算I2的浓度。
维生素C含量的测定

浓度 1 2
体积 3
2、维生素c含量的测定记录
实验编号
2溶液浓度/mol
1
2
3
/m3
维生素c的质量/g
滴定前读数/ml 滴定后读数/ml 滴定用I2溶液体积 /cm3
维生素c的含量%
维生素c的平均含 量%
维生素C含量的测定 ——直接碘量法
维生素C 定义:显示抗坏血酸生物活性的 化合物的通称,是一种水溶性维 生素,水果和蔬菜中含量丰富。 在氧化还原代谢反应中起调节作 用,缺乏它可引起坏血病。
键线式
实验目的 (1)了解测定维生素C的实验方法与原理 (2)掌握碘标准溶液的配制与标定的方法。 (3)掌握直接碘量法测定维生素C的原理、方
I2是中等强度的氧化剂,可以氧化许多具有还 原性的物质。维生素C分子中含有还原性的二烯醇 基,能被I2定量氧化成二酮基:
而且反应速率较快,所以可用I2标准溶液直接滴定 的方法,测定出样品中维生素C的含量。直接碘 量法适用于药片、注射液、蔬菜、水果中维生素 C的含量测定。维生素C易被空气氧化,特别是在 碱性溶液中更易被氧化,所以,在测定中须 加入稀 HAc,使溶液保持足够的酸度,以减少副反应的发 生。
法及其操作。
Ⅱ.实验用品
仪器:酸式滴定管,锥形瓶 试剂:2 mol/L HAc,0.1mol/L Na2S203标准溶液, 0.5%淀粉指示剂 材料:维生素C(s),I2 (s),KI(s)
Ⅲ.实验原理
维生素C(简写为Vc)又称抗坏血酸,是人体重要的 维生素之一,分子式为C6H8O6,在医 mo/L I2标准溶液的配制与标定
配制(由实验室预先做):将3.3 g I2与5 gKI置 于研钵中,在通风柜中加入少量水(切不可多加!) 研磨,待I2全部溶解后,将溶液转入棕色瓶中,加水 稀释至250 mL,摇匀。
碘量法测维生素C含量

I2 溶液的标定用Na2S2O3标准溶液: 基本反应式:2S2O32-+I2=S4O62-+2I-
I2溶液(0.05mol/L): Na2S2O3标准溶液(0.01mol/L) 淀粉溶液(2g/L) HAc(1+1) 固体Vc样品(维生素片剂) 重铬酸钾(A.R) KI溶液(约200g/L)
维生素C含量的测定:
Na2S2O3标准溶液浓度:
实验序号 记录项目 M药片质量/g V消耗I2体积/ml ω维C含量/% ω维C平均含量/% 1 2
I2标准溶液的浓度:
3
1. 配制I2标准溶液时,为什么要加过量KI?可否 将称得的I2和KI一起加水至一定体积? 2 .溶解样品时,为什么要用新煮沸并冷却的蒸馏 水? 3.加醋酸的目的是什么?
碱性条件下可使反应向右进行完全,但因维生素 C还原性很强,在碱性溶液中尤其易被空气氧化, 在酸性介质中较为稳定,但是在强酸性溶液中I也易被氧化。 故反应应在稀酸(pH为3—4)(如稀乙酸、稀 硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸 后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直 接称取,需采用间接配制法;用Na2S2O3标准溶 液标定I2 溶液。 标定Na2S2O3溶液: 6I-+Cr2O72-+14H+=2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I- n(K2C2O7): 6n(Na2S2O3)=1:6
I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶 解得很慢,所以配制I2溶液时不能过早加水稀释,应 先将I2和KI混合,用少量水充分研磨,溶解完全后 再加水稀释。 I与KI间存在如下平衡:I2+I- =I3- 游离I2容易挥发损失,这是影响碘溶液稳定性的原因 之一。因此溶液中应维持适当过量的I-离子 ,以减 少I2的挥发。空气能氧化I-离子,引起I2浓度增加: 4 I-+O2+4H+ =2I2+2H2O 此氧化作用缓慢,但能为光,热,及酸的作用而加 速,因此I2溶液应处于棕色瓶中置冷暗处保存。I2能 缓慢腐蚀橡胶和其他有机物,所以I应避免与这类物 质接触。
直接碘量法测定维生素c含量[整理版]
![直接碘量法测定维生素c含量[整理版]](https://img.taocdn.com/s3/m/448c533b5022aaea988f0f26.png)
直接碘量法测定维生素c含量[整理版] 一(实验目的1(掌握碘标准溶液的配制和标定方法;2(了解直接碘量法测定维生素C的原理和方法。
二(实验原理,1维生素C(Vc)又称抗坏血酸,分子式,分子量。
Vc具有还原性,可CHO176.1232/g•mol686被定量氧化,因而可用标准溶液直接滴定。
其滴定反应式为:。
II22由于Vc的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定,宜在酸性介质中进行,以减少副反应的发生。
考虑到在强酸性溶液中也易被氧化,故一般选在pH=3~4I的弱酸性溶液中进行滴定。
三(主要试剂,1KI0.05mol•L 1(溶液(约):称取3.3g和5g,置于研钵中,加少量水,在通风橱中研磨。
待 III222全部溶解后,将溶液转入棕色试剂瓶中,加水稀释至250mL,充分摇匀,放阴暗处保存。
,10.1127mol•LNaSO 2(标准溶液() 223,12mol•L 3(HAc()4(淀粉溶液5(维生素C片剂6(KI溶液四(实验步骤I 1(溶液的标定 2NaSO 用移液管移取20.00mL标准溶液于250mL锥形瓶中,加40mL蒸馏水,4mL淀粉溶液,223,1然后用溶液滴定至溶液呈浅蓝色,30s内不褪色即为终点。
平行标定3份,计算。
Ic(I)/mol•L222(维生素C片剂中Vc含量的测定准确称取2片维生素C药片,置于250mL锥形瓶中,加入100mL新煮沸过并冷却的蒸馏水,10mLHAc溶液和5mL淀粉溶液,立即用标准溶液滴定至出现稳定的浅蓝色,且在30s内不褪色即为终点,记下I2消耗的。
平行滴定3份,计算试样中的Vc的质量分数。
V(I)/mL2五(数据记录与处理1(溶液的标定 I21 2 3 项目序号,1 c(NaSO)/mol•L0.1127 223V(NaSO)/mL20.00 223V(I)/mL23.39 23.35 23.33 2,1 0.04818 0.04827 0.04831 c(I)/mol•L2,1平均0.04825 c(I)/mol•L2dr/% 0.15 0.04 0.120.10 dr/%2(维生素C片剂中Vc含量的测定1 2 3 项目序号,1 0.04825 c(I)/mol•L2m(药片)/g0.2408 0.2395 0.2377V(I)/mL23.92 23.82 23.67 2,(Vc)/%84.41 84.52 84.62平均 ,(Vc)/%84.52dr/% 0.13 0 0.120.08 dr/%六(实验总结,1,(Vc),84.52%标定得,测得。
直接碘量法测定绿茶中维生素C含量

直接碘量法测定绿茶中维生素C含量黄素梅(广西师范大学化学化工学院,桂林541004)摘要本文采用直接碘量法测定绿茶中维生素C的含量。
绿茶经草酸提取后,用I标准溶液直接滴定。
实2验结果表明:绿茶中维生素C的含量为25.20mg/10g。
采用直接碘量法测定绿茶中的维生素C含量,操作简便,快速。
关键词直接碘量法;绿茶;维生素C绿茶中含有丰富的维生素,其中以维生素C的含量最高,维生素C可作为衡量绿茶品质的一个重要生化指标。
一般绿茶中维生素C含量可达(100mg~250mg)/100g,高级龙井【】1茶(绿茶中的绝品)中的维生素C含量可达360mg/100g。
关于茶叶维生素的研究文献很少,仅20余篇,涉及茶叶维生素分析方法的文献只有10【】1余篇,其中涉及高效液相色谱法,分光光度法,荧光法,但据我了解,未涉及直接碘量法。
本文采用直接碘量法测定绿茶中维生素C的含量,操作简便,快速。
1 原理维生素C(Vc)属于水溶性维生素,它的分子式为CHO,由于分子中的烯二醇基具686有还原性,能被I定量地氧化成二酮基: 21mol维生素C与1mol I定量反应,维生素C的摩尔质量为176.12g/mol。
当溶液中有2淀粉存在,过量的碘遇淀粉变蓝色,指示滴定终点。
由于维生素C的还原性很强,在空气中极易被氧化,尤其是在碱性介质中,测定时采用草酸溶液提取绿茶中的维生素C,使样液呈弱酸性,减少维生素C的副反应。
2 仪器与试剂2.1 仪器碱式滴定管;25mL移液管2.2 试剂 0.05mol/L草酸溶液;0.01mol/LI标准溶液;1%淀粉溶液;绿茶:市售立顿绿2茶3 实验部分3.1 维生素C 提取液的制备准确称取10g绿茶,加入适量0.05mol/L草酸溶液,充分振荡4-5分钟。
过滤,洗涤,滤液转入250mL容量瓶中,用0.05mol/L草酸溶液定容至250mL。
3.2 用直接碘量法滴定绿茶中的维生素C用25mL移液管移取上述提取液于250mL锥形瓶中,加入1 mL淀粉溶液后,立即用0.01mol/LI标准溶液滴定至溶液变色,且30s内不退色,即为滴定终点。
实验五 水果维生素c含量的测定 ---直接碘量法

(二)试剂
0.02 mol/L碘溶液、氯化氢的质量分数为2%的盐酸、可溶 性淀粉的质量分数为0.5%的溶液、蒸馏水、维生素C、碘 酸钾、碘化钾;
(三)器械
解剖刀、小烧杯、试管、广口瓶、量筒、玻璃棒、纱布、
研钵、pH试纸、标签纸、试管刷、100ml容量瓶、0.5、2、
2020/75/2m7 l移液管、滴定管、漏斗、分析天平。
2020/7/27
6
(二)样品试液的制备
将果蔬样品洗净,用纱布拭干其外部所附着的水分, 若样品清洁可不必洗涤。样品若为大型果蔬,先纵切 为4~8等分,取其20~30g为一份,除去不能食用部分, 切碎。若为大型叶菜,沿中脉切分为二分,取其一分 切碎,称取20g作分析用;
将称取的样品放研钵中,加2%的盐酸5~10ml,研磨 至呈浆状。小心无损地移研钵中样品于100ml容量瓶 中,研钵用2%盐酸液冲洗后,亦倒入量瓶中,并加 2%盐酸至100ml,充分混合。用清洁干燥二层纱布过 滤入干燥的烧杯中,滤液作测定用。
2020/7/27
7
(三)样品液的测定
在50ml的烧杯中,用移液管注入1%的KI0.5ml, 0.5%淀粉液2ml,以及上述制得的试液5ml;再加 蒸馏水至总体积10ml(加2.5毫升);
用0.001N KIO3液滴定,要一滴一滴加入,并时时 摇动烧杯,至微蓝色不褪为终点(一分钟不褪为 止);
5
四、操作方法
(一)试剂制备
1. 0.5%淀粉液:称取可溶性淀粉0.5g,用蒸馏水 调成浆状,注入100ml蒸馏水,煮沸至透明状, 冷后用棉花过滤;
2.0.001N KIO3液:精确称取KIO3 0.3568g(KIO3 预先在102℃烘2小时,在干燥器中冷却备用), 准确配成1000ml,得到0.01N KIO3液。再稀释10 倍即为0.001N。
维生素C的含量测定(直接碘量法)
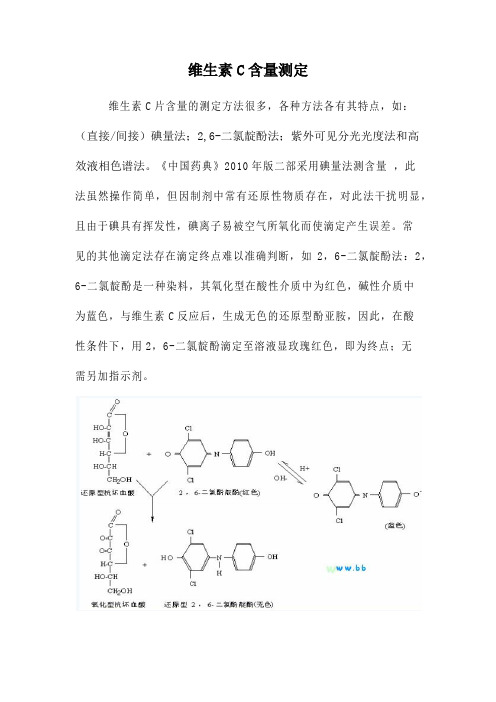
维生素C含量测定维生素C片含量的测定方法很多,各种方法各有其特点,如:(直接/间接)碘量法;2,6-二氯靛酚法;紫外可见分光光度法和高效液相色谱法。
《中国药典》2010年版二部采用碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法干扰明显,且由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-二氯靛酚法:2,6-二氯靛酚是一种染料,其氧化型在酸性介质中为红色,碱性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至溶液显玫瑰红色,即为终点;无需另加指示剂。
分光光度法运用维生素C的旋光性能进行含量测定,但操作费时,而高效液相色谱法是目前发展较为迅速的一种方法,灵敏度高,选择性好,是一个准确高效的测定维生素C含量的方法。
我们主要介绍的是直接碘量法。
直接碘量法一.实验原理维生素C是人体重要的维生素之一,它影响胶元蛋白的形成,参与人体多种氧化-还原反应,并且有解毒作用。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C,通常还需储藏能维持一个月左右的维生素C。
缺乏时会产生坏血病,故又称抗坏血酸。
维生素C属水溶性维生素,分子式C6H8O6。
分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,因而可用I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、饮料、蔬菜、水果中维生素C的含量。
由于维生素C的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I - 在强酸性中也易被氧化,故一般选在pH为3~4的弱酸性溶液中进行滴定。
由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差;又由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定比较麻烦。
直接碘量法测定维生素c含量

直接碘量法测定维生素c含量
维生素C,也被称为抗坏血酸,是一种水溶性维生素。
它在许多生物体内起着重要的生理作用,并且对人体有益。
维生素C含量测定是基于一种叫做碘量法的化学方法。
该方法利用碘酸钾溶液与维生素C反应的化学性质,通过了解反应后剩余的碘酸钾的含量来测定维生素C含量。
碘量法测定维生素C的过程如下:
准备样品:将要测定的样品加入到3%的浓磷酸中,并将其加热到约80℃,然后再冷却。
制备碘酸钾溶液:将20克的碘酸钾加入到1000毫升的蒸馏水中,并充分搅拌,以制备出0.1N的碘酸钾溶液。
测定过程:将取出的样品加入到定容瓶中,加入足够的蒸馏水,直至瓶子充满为止。
然后取出1毫升的样品溶液,并将其加入到滴定瓶中。
加入几滴淀粉溶液。
此时,溶液会变成淡蓝色。
准备滴定剂:将制备好的碘酸钾溶液滴加到另一个滴定瓶中,并加入适量的酒精。
通过滴加,将滴定剂加入到样品溶液中,直至溶液变成深蓝色。
读取数据:记录滴定剂滴入样品溶液的次数,并且根据已知的滴定剂浓度计算出维生素C的含量。
利用碘量法可以准确地测定含有维生素C的食物以及药品的维生素C含量。
然而,由于该测量方法需要使用化学试剂和复杂的实验过程,所以在实践中不太实用。
为了更加方便测量维生素C的含量,也出现了其他测量方法,例如高效液相色谱法和光谱法。
无论使用哪种方法测量维生素C的含量,都可以帮助人们了解他们摄入的营养成分,以及制定更加健康的膳食计划。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一.实验目的
1.掌握碘标准溶液的配制和标定方法;
2.了解直接碘量法测定维生素C 的原理和方法。
二.实验原理
维生素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1
mol •176.1232/g -。
Vc 具有还原性,可
被2I 定量氧化,因而可用2I 标准溶液直接滴定。
其滴定反应式为:。
由于Vc 的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到-
I 在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
三.主要试剂
1.2I 溶液(约1
L •0.05mol -):称取3.3g 2I 和5g KI ,置于研钵中,加少量水,在通风橱中研磨。
待2I
全部溶解后,将溶液转入棕色试剂瓶中,加水稀释至250mL ,充分摇匀,放阴暗处保存。
2.322O S Na 标准溶液(1
L •0.1127mol -) 3.HAc (1
L •2mol -) 4.淀粉溶液 5.维生素C 片剂 6.KI 溶液
四.实验步骤
1.2I 溶液的标定
用移液管移取20.00mL 322O S Na 标准溶液于250mL 锥形瓶中,加40mL 蒸馏水,4mL 淀粉溶液,
然后用2I 溶液滴定至溶液呈浅蓝色,30s 内不褪色即为终点。
平行标定3份,计算1
2L •)/m ol (I -c 。
2.维生素C 片剂中Vc 含量的测定
准确称取2片维生素C 药片,置于250mL 锥形瓶中,加入100mL 新煮沸过并冷却的蒸馏水,10mLHAc 溶液和5mL 淀粉溶液,立即用2I 标准溶液滴定至出现稳定的浅蓝色,且在30s 内不褪色即为终点,记下消耗的)/m L (I 2V 。
平行滴定3份,计算试样中的Vc 的质量分数。
五.数据记录与处理
1.2I 溶液的标定
2.维生素C 片剂中Vc 含量的测定
六.实验总结
标定得)L •04825(mol .0)(I 1
2-=c ,测得%52.84)Vc (=ω。
七.分析讨论
1.KI I 2-溶液呈深棕色,在滴定管中较难分辨凹液面,但液面最高点较清楚,所以常读取液面最高点,读时应调节眼睛的位置,使之与液面最高点前后在同一水平位置上。
2.使用碘量法时,应该用碘量瓶,防止2I 、322O S Na 、Vc 被氧化,影响实验结果的准确性。
3.由于实验中不能避免地摇动锥形瓶,因此空气中的氧会将Vc 氧化,使结果偏低。
八.思考题
1.溶解2I 时,加入过量KI 的作用是什么?
答:查得,碘在水中的溶解度为O)00gH g/(02.021。
因此,溶解度很低。
加入过量的KI ,可增加2I 在
水中的溶解度,反应式如下:
2.维生素C 固体试样溶解时为何要加入新煮沸并冷却的蒸馏水?
答:Vc 有强还原性,为防止水中溶解的氧氧化Vc ,因此要将蒸馏水煮沸,以除去水中溶解的氧;为
防止Vc 的结构被破坏,因此要将煮沸的蒸馏水冷却。
3.碘量法的误差来源有哪些?应采取哪些措施减少误差?
答:(1)读数误差,由于碘标准溶液颜色较深,溶液凹液面难以分辨;但液面最高点较清楚,所以常
读数液面最高点,读时应调节眼睛的位置,使之与液面最高点前后在同一水平位置上。
(2)反应物容易被空气中的氧氧化;滴定过程中用碘量瓶,而不用锥形瓶,避免剧烈地摇动。
