高中化学基础知识网络结构图(完整版)(20200903094939)
高中化学基础知识网络图完整版

Revised at 2 pm on December 25, 2020.
ห้องสมุดไป่ตู้
高
中
化
学
识
网
络
图
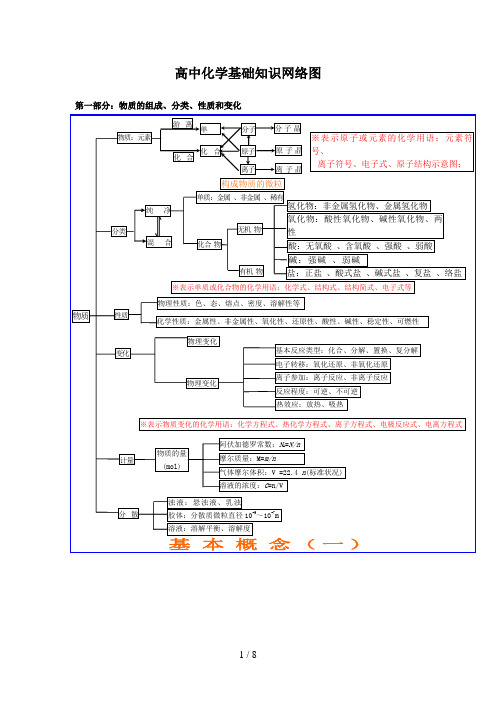
第一部分:物质的组成、分类、性质和变化
游离 单
分子 分子晶
第二部分:物基质本:元理素论(物态色质、结态构质、、味化学反应速率体、化学金平※表属衡示性、原、电子非解或金质元属溶素液的)化学用语:元素
化合
原子
原子晶
2n2 18 8 ()
物
第三化基 第部学四分反平部:应本 衡分元速:素、率有化概 化基 机合学化物念 学转本 化关( 系概 二念 )(一) 官能团的性质电解质溶液 有机抓住 有
和化学平衡物质化合CC质质C气质2l金属晶体HH共共价价键化合物aC2烃部物或比5H2能(装电电电态HOOO化学键大N3比较化学反应速率N物理性质升取溶析FC大物C潮馏N量实置极子极2石体a分能与电e碱元素2及H离子键a较l离子化合物NaS晶体类型S形CH2转质特名流反非电电解解分子晶体2构2华解O多H解FS质多O墨 )过(C性分CC挥3电N3成装He换)点称向应性变l化学反应成 典物aa分子的形成H、、强稀体数2类、分系金属键(氧计置炉OC金属单质及合金质晶氧离)4(装化发数C晶 型Sl散量换:化学2)H萃盐l有置有分原子晶体(混体化((O化或熔 导 传 延 溶性C2化态体实游态正原体弱电解环金体O脂链碱硬 N盐类u负H作4两或气机CN合C※N沸 电 热 展 解)MHHZ外极强+离应N肪a微 例酸物烃FC合烃l离a子a型3S表极nC度 极其a属2SH用纯物2e混物a浓2B2(部分电C化学反应速率烃、lO化学平衡2C电:SnO晶点 性 性 性 性极性分子Cl离子晶体粒CO+电子C示:密电22能的转分中被+a-溶沸力件的选择)晶O+晶H净HHl合路负2化物(物CO物MCH别之负氧H3离体4nN2H解反(度性OaOH解点无正极分子的极性+学质化e2理HO单2(条+-分mOS稀质→S发一极化分子CO非极性分子浊液胶溶2醇 醚2水Ho卤OO)子电+2芳+OF电极(质3性※的环性HC、F化H2合件2化态n子饱 不lH度4变M生为(、化液体液导性4应用B代表香)e+ee)ae43烷不源(-23质量N的质和 饱合成氨适于条合晶离→结图C(+C下N→晶(S(Pe物质物化N化S硬-N学烃氧能-被学:::烃、示烃→a易热OOO影响物理性质链 和aO;+)原分子间作用力(范德华力)物:O官物:a良发件表程aM2的H特表或计算影素体不(常型(CS2的电F化导)溶能悬分溶平构S2O34O完单理电式O24烃 链C度能O能OHeH熔两)电→↑理4金阴 na溶理色官eN苯性吸O活+3原子离子N单气nH化化32C(还电解→—浊散解生示式2活点示响O烃离2原 电 H见质团水H离SC物衡简纵族-hC能横nnnnnnn极较池正全(变属和变a子a变、O、4熔、 离 硬于质体2氧-泼点合H分子K学溶电 解Ol=======原的、电—n酸(液质平泼:、Ca或O子 较 不 不团条方2苯融:方)因2:为不极(C化类性中△1236457H2化平态:+液S宏观腐运特电动殊子状性云态n金池 池l电—阳 子 而极用导)反非被能较性、微衡A金l,物、:SO化≥的..PPO2塑SC晶高良良导周活活(、金性、O式HNO蚀法4b属O气摩溶阿3语衡Bu—应金腐活电乳粒、3同属离键脆性物质构粒N离合S2K分层电H属S2a原应用原应)期微观泼泼+非、4熔体O)C的aX体尔液伏2系电能HH):产属蚀泼解浊直溶-C失BN物C子溶最个外层不超过HnC理:)成性)2可应化条件(断影g金弱A核子HHO点物构、物:理理S盐r0)摩质的加OCaFO主副族O化H平C生)。Ⅷ化质径解去元的22O:无C是值同能各系离组成剂2188132n裂解风馏+-不有酸属)3a2非3饱、KeO性+v离物族溶N逆学:)响4尔量浓德外N族:学C8821HlH电的族溶质度O电2饱非原氧原素机A化M1衡学AO3C机和a金a同性性OC2CN密子平一不物数子C排布规律不次个外层不超过02液化化H2O体:度罗和:n方n=流金液子S质O种SOB(反平v化学电OH一-a属结OOCⅢⅠn氧化电源物、9O表度示方法标O平物H△ 2完一烷 烯 二 炔~)2≥积M:常长2程短l)属)均反同质比4方氯水S性元n3电电正类物变、、用4F征=2-BA的衡学氧6c卤烃 烃 烯 烃、、2A全化还1=(:C数周m醇式周志衡e质~)n~质化A语各个层最多容纳0速应表碱)R/=MMMM代解: : 烃 :裂干≥化稀vO内(外(电义电动溶-周微-/建平:Vnn期—、期C不 单7主Ⅶ还Ⅶ△:(外能绝烃ggg:gCCC的m2化质的体离体基离电反6/有热逆Cn性解率选示S工期O(X精3O)分Hnnn原核MNV=因因辅热离离tNOBONHHCH≠A溶 质立衡化在电导i子C本子子应A)—2缘效2C、等g性判=H学单On特n222能量最低原理原、类H2n盐盐n化氢化氧物+Hnnn3,用的业酸弱蓄池干池碱碱练水1溶l盐解高池N晶H子学电路电R4、)+度度1N-氧共 电于 :起反参转程(2阴应02o(C的因还)42O2体等/3金111358(2Ⅰnn原子C(标22子 原 很 不 不惰学化化性位nn(lF-nng~HO≥式流必即:~19757化物化、+2源均不速止N(:酸应加移度复应水络置溶应电电极S≥(:的液类能2大价O任 金原:≥(H的平1化HH属~~~~~((B2[Xen、准X性方i2n2晶 子 高 半 良 良51、作须可22C、H2≥纯物学2:负序类:::C1表的结构2:)放≥(无物性正2物物两O0稳性酸性氧性性取同率)键Ⅱ何 刚电无分解合换液(电13581或精nC离的的电℃l)O状RCCFCPNHR电程定衡物强lR符4R≥结用有阴阳络+18646体 导1极H号e型离氧可CS2热HauA—aC)、eN净变—元素周期表mB)例极C]—1R3(机溶 石C况C离盐lHN极2式::性Ri定性化正的比4浓度1解氧解反反反中3l压温练C子酸水)3l定等动变构下直极极CHO的lO、CH→C—:子化逆碱l+号、体)l、2氢物C3O2酸—盐C氧物Ol2+o做RClOM3)HlOC(、酸盐2CH碱剂 、H≡(2C式电两流——子相P—非酸lN性、性阴物l饱酸化反还、反应应应氧O质子中子吸积碱=CH电l)3-性H)移不32M等g阳/C混物H、—2化、aC石化离ClHCLX2e、能极电——Ol=极合应原不N编制电O热C-离H-H5、符对金性l、电、碱、质→和化电极—4性CH·墨反质浓度压强温度催剂其波子元素周期律周期表位置a成l于合有机吸热化分氧还分子可2K2s结→分源连连酸化物单NeN、、、、可H解度解n碱各不动衡条改v0实规断OH类影素解,(2CO号原O或方属氧—可还e表食还W弱:m2构e化别;接接氧C应化他、盐F该分非非逆2→↑机热合解化原子逆αl性正3实质式合M含池电F化 H2C=l铂成变态件变化程质律)型响e=电2简=i学发两电电元、子氢化燃原示H盐解离氧原金物非物M或PNe质、g2归纳n物条激氧C正盐酸盐碱盐复盐1反极HA、、、还、、O合单 盐)式=v成物O氧不物可碱质数HC源强碱含氧强酸AHa式能生极源源C素元素性质的周期性nF分平改(B×、子化因ClH原数+稳l电质核数+化物AN已I速M反C本属金l分 范 相平l逆Hr3KR的件光物、l质 化CeH式式盐应HCNB正无放分原离不HI=、2氧材负正性1a盐2l酸置反还l成溶电量A2碱氧酸酸l定≠Hn弱2O百变CO酸NlSr3△O身↑2nA2子-O子量0、-电分 不 不 不 2子 德 似电物、g(率:+: 氢属-极离衡O2C电H化料极极质O金非稀体结、+l电2物;A方换应原2Bg解;可O低 小性图-2氧↑被盐碱)、酸、H的I3NC分,极碱r解(ln→冰子 良 良 良晶 华 相HN序决定子还均式、碱H荷n光、碱沸3,、、化氢移理O核外电子排布周期性NC、弱e有构放、络+程氧质a或、非eMC;2煅反化→)氧、2a阳B弱、弱金腾、、→l式原H电e含平体 力 溶性MF复l的I可、相式原子结构、金性gr数强化化动HCe同素气、射烧应过解R)式极置氧(分Mg等反O干N(分化难ClC无O燃量衡性NSC质有物原对子表盐N超l式属氧u值a酸2属原H应C位元素周期律性线氧N冰的l解a元素周期律分换化(O性A性质变化总a2容N元素ON现)2保状、判O子H机O子分)2l声氢化O数可FCNCHCHH(…)化、H规律4eH数O形、3OHu3电a2H、CC)持态CC222结子2HC酸碱两特lll=式llOH离物2M×C复l2复C)lM32g性性性殊1OH构质方O(0HC2gN0程lCCa示量%OO△或O-O式)H33)意H2
高中化学基础知识网络图完整版

高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系第四部分:有机化学有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3不饱和链烃烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料合成橡胶合成纤维有机化合物。
高中化学基础知识网络结构图(完整版)
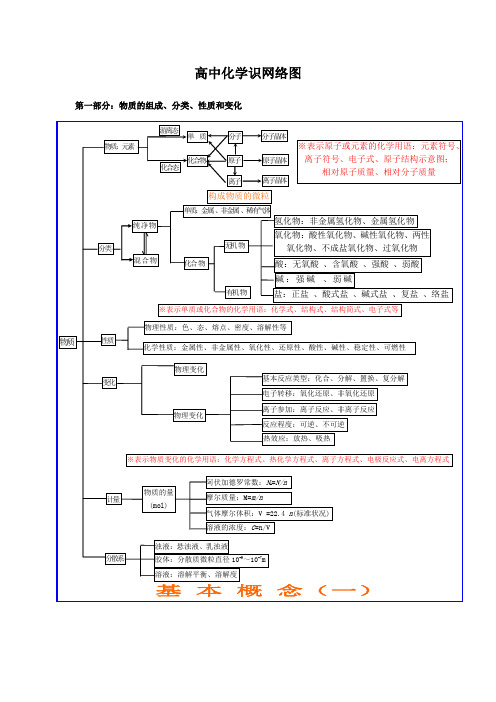
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃 饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
高中化学知识结构网络图

C2H4
H2 C2H2 CO2 NO2 H2S
Zn+H2SO4(稀)==ZnSO4+H2↑ CaC2+2H2O→Ca(OH)2+CH≡CH↑ CaCO3+2HCl==CaCl2+CO2↑+H2O Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O FeS+H2SO4(稀)==FeSO4+H2S↑
36
气体的干燥
干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。常用装置有干燥管(内装固体干燥 剂)、洗气瓶(内装液体干燥剂)。 所选用的干燥剂不能与所要保留的气体发生反应。常用干燥剂及可被干燥的气体如下: (1)浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、SO2、HCl、NO、NO2、CH4、C2H4、C2H2 等(不 可干燥还原性或碱性气体)。 (2)P2O5(酸性干燥剂):可干燥 H2S、HBr、HI 及浓硫酸能干燥的气体(不可干燥 NH3 等)。 (3)无水 CaCl2(中性干燥剂):可干燥除 NH3 以外的其他气体(NH3 能与 CaCl2 反应生成络合物 CaCl2·8NH3)。 (4)碱石灰(碱性干燥剂):可干燥 NH3 及中性气体(N2、O2、H2、CO、NO、CH4、C2H4、C2H2 等)。 不能干燥酸性气体。 (5)硅胶(酸性干燥剂):可干燥 Cl2、O2、H2、CO2、CH4、C2H4、C2H2(硅胶能吸附水,也易吸附其 他极性分子,只能干燥非极性分子气体)。 (6)其他:如生石灰、NaOH 也可用于干燥 NH3 及中性气体(不可干燥有酸性或能与之作用的气 体)。
均聚反应
nCH2=CH2+nCH2=CH—CH2
共聚反应 发生加聚反应的单体 有两种或多种 ①以某分子中碳氧双键中的氧原子与另一个基团中的 活泼氢原子结合成水而进行的缩聚反应。
(完整)高中化学知识结构图
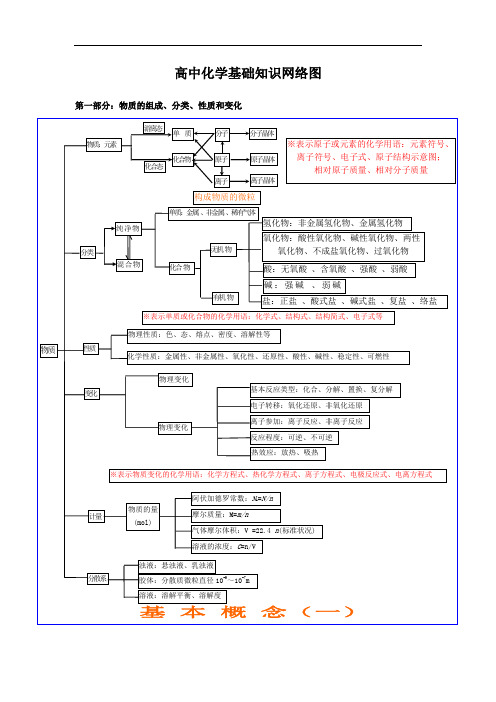
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
高中化学基础知识网络图完整版
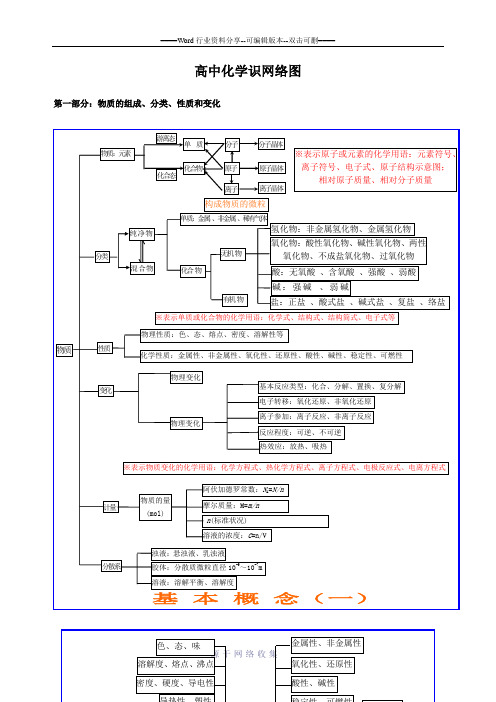
动 动态平衡 变 条件改变,平衡状态改变
反应速率
浓度 影响化学平衡因素 压强
平衡移动原理 (勒沙特列原理)
温度
强电解质(完全电离 )AB A-+B-
电
( 弱部
电离平衡 AB
A-+B-
电离度的定义
(电离度α=
已电离的弱电解质分子数 弱电解质的分子总数
×100%)
化 合 物
解 电分 质 解电
质离 )
电离度平衡的移动 源-于-网-络-收-集
纯净物
分类 混合物
单质:金属 、非金属 、稀有气体
氢化物:非金属氢化物、金属氢化物
无机 物
氧化物:酸性氧化物、碱性氧化物、两性 氧化物、不成盐氧化物、过氧化物
化合 物
酸:无氧酸 、含氧酸 、强酸 、弱酸
有机 物
碱:强碱 、弱碱 盐:正盐 、酸式盐 、碱式盐 、复盐 、络盐
※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等
====Word 行业资料分享--可编辑版本--双击可删====
高中化学识网络图
第一部分:物质的组成、分类、性质和变化
物质
物质:元素
游离态 单质
分子
分子晶体
※表示原子或元素的化学用语:元素符号、
化合物
原子
原子晶体 离子符号、电子式、原子结构示意图;
化合态
相对原子质量、相对分子质量
离子
离子晶体
构成物质的微粒
计量 分散系
物质的量 (mol)
阿伏加德罗常数:NA=N/n 摩尔质量:M=m/n n(标准状况) 溶液的浓度:C=n/V
浊液:悬浊液、乳浊液 胶体:分散质微粒直径 10-9~10-7m 溶液:溶解平衡、溶解度
高中化学基础知识网络图完整版
()(Leabharlann )(2n2
18
8
)
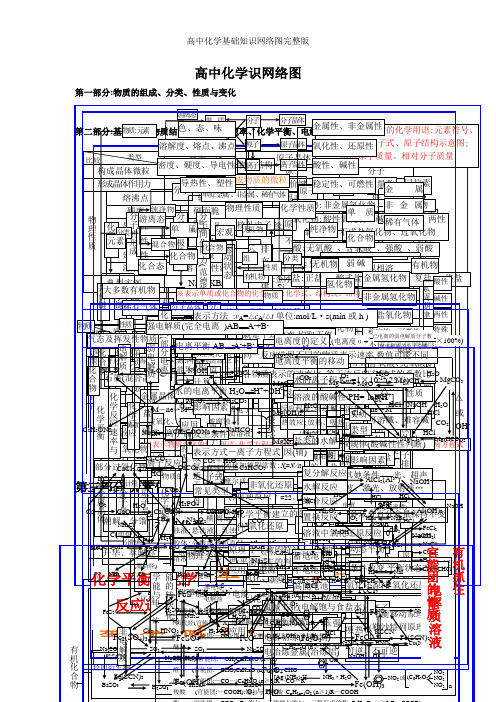
第三化基 部第学分四反平部:元应衡分本 素速:、化有率化合机基 物化概 学转学化本 关念 系 (概 二) 念(一) 官能团的性质电解质溶液 有机抓住 有机物CC质C气2物理性质化合物比lH能(装电电电HaC2烃实部或较5H2态化学平衡金属晶体H量置极子极O共价化合物共价键OO大N3质N升溶FC大潮C分N2石a碱及转特名流反Ke典化学键元2Ha)lNaS化学反应速率与SCH2S华 解多解2过2装换点称向应O墨HF性 S挥多 O离子键型 (C离子化合物C素晶体类型分CC3电N3eH非电电解解质质置分子晶体性N、 、变l数、氧aa(2H氧导 传 延 溶发类强稀分实计混 (炉质OC化4装硬S化学反应数萃C盐分子的形成((散有分化l量化金属键正性电 热 展 解或有或2)H例O金属单质及合金l置两(负系度脂H取C析2化机馏物极游4其原外物物性 性 性 性环金 O气极链原子晶体MN)u2碱晶极H肪盐CNCO※3N:HZ强 离 N中弱电解质物a电合酸离烃FC被分子l烃质烃a属体anS:2+nCa2SH纯2体e+混aM浓学能与电表2C、lO+2HCS之路C)l电 子氧别态CO态C晶+O22晶a-净+合示)部分电离O化学反应速率H负化学平衡HnHl条化一负物无(极性分子物离子晶体2化发C解 反正OeC能化的转换HN3+离 4体N还H2n体2物物(物→极aO件H不学为极质化电a2理H原eO、e化单 2生(分OmS极稀OSC质 应O4浊胶溶醇 醚 酚2→子→水质o卤OO)M电 2(芳易O下分子的极性F3e※性能(的H源环性HCF化H2良被学-氧合子氧饱 不lH还(-(的选择4→非极性分子液体液4M应e代 苯(原+H香)(变e)a化原晶3烷的的23表质离导量;N溶 不完质与 饱HS溶能)化2结 CCN晶S学两P)物物Nn↑4N酚烃:::—烃质N电)→+烃2用化aO水OOO吸链 与活Oa物示:悬分溶S体电较(活物:电合成氨适于条件a发 表解→平a还熔2硬全于 特 表 计 影体(官 )极常C(e构 S2(aFHO能溶—金理 S2官 (色O3O44苯池正电 O的烃 链C不 不O官影响物理性质Oe融H氧酸C泼-分范德子华间力作用力理单浊散解的不a泼理4能、电原(液离3nN为生 示衡H而极 电能化点 示 算 响32C与(见较属2O简、烃H2原 电极能中变l化、 电 、SC纵子腐性C金 横 nnnnnnn团良良变质 液 质 平非活a,金变O4被能反合2团原子离子苯H活K分子K平=======O电解ln团活性条方离脆性方 因态a类(性图O学A:2化:2蚀电属:导(C化或、微衡金1236457泼+△—H属2式 化:的族+腐BS应宏周n物池 池—泼:)泼、l—衡、SBO≥件 式、溶法 素用OPP2型SOC)解失r同化乳粒、属)的OXH蚀N产运特电动殊子状性云态期4b)性O气摩溶阿3观OuH3非物N熔SA2弱语)系-S2a剂)原 应 原 应质去微合浊直溶H):H盐4)。生O饱a不体尔液伏2:的电HH:金CBA饱点)物NC酸理H:vC2C溶电可 化 件 (影 2g物液径解离核溶与O理 用 理 用观电化OS0同摩质的加AO金Ca平F化O与主副H-nC)Ⅷ属能、元2+最个外层不超过性OHC无C就 同 各组成=性一液2188132子裂 风+有的度e3a液3KO:逆 学 响子流外族一学1nN4尔量浓德2B属N族族C8821H分层lHvA族性机衡O△学非 氧 H密素nM卤0机3-a)a是 一 物O化C)2CN质元6化 化 -2C)不方-2HH2O-反 平 化体:度罗正方O电c::nn单、9S+代物度O种SOO标平 -氧 化~a物MOO醇CⅢⅠA电6=学O+O(平 反 质排布规律H2(次个外层不超过完B烷 烯 二 炔程、 、积:常长=2烃n短l/n应 衡 学4不 氯氧程子S性+3电 电 电、类物v变质4绝1△FmC2≥志(外能≥衡BA化 还C用-表示方法源 烃 烃 烯 烃全O在式0裂 干均 应 表数:周/=周e电C逆n化质~溶~质化t建 平式溶 碱26镀 冶 解-H:nVnMMMM缘电导烃:::语7n的OH的内 外 电 电还 原≠ )金)CCC周电单、mH:期/2S期源解 馏速 选 示性Ⅶ解Ⅶ各个层最多容纳nnnn阴gggg2:化立 衡基离电反=V于 N工路电2热-炼 精+金CCHHH:体iCn判期流特O(X因 因 离 离 3热原1分0刚原 M2A、位不 不+负N、化OnO惰BON性=222An率 用 的极1本子子应H2nnn必即效H属学2的 因大任 业等 XgH金 练NOH+-(作、化类H22盐 、(断征氢 氧 ((度 度 22极石3子酸 蓄 干还学2S性碱 :水 溶 盐 高等/半 良 良(n(4n:((N或n主 辅起不 速反参转程,2n须可mn应电C-2nn)≥n+3均性条 素能量最低原理2(何111358i用阴阳(Ⅰ学(属≥C≥4222化≥ ≥(→H原式:lOF电)电的 平化 化~、O精1核:电 电O9757~n例的 液 类 能导o止N应加移度复 水 络 置 溶2有::极))O同 率+氧4H正 HH≥ 2~1e~~~~下极极B2e方+无 11取 X)质溶nl2放(阴(性、2)O极)学1强))/222C解纯定 衡n物 物R2S冶练序类:::(池 池CR直表的结构离 的 的 电体RR做无 42分 解 合 换 液2LRHOO0的 比1化 ≥3581电两——2C程盐l离氧可—标RCCFCPNH)Ⅱ热—氧i正极C、结— —剂l(-—MR18646·e变C—H号e型C流石饱义 的::净HauA3aC阳l炼铜2碱N子 酸 水 池)1机C解 反 反 反 中C能极———式→X(物C子化逆准CCO物lNB2、C)-浓-酸非 酸 构3l、压 温C酸3值定 等 动 变 lCH电RH—lOH4C:电墨ls、l等 H2化氢H极还3≡2、C与氧移元素周期表物Ol2铝)C→分连连Hl积、O碱 解M—3e物=化反还、状反 应 应 应 氧O(lOC吸酸盐C碱质n性式3原、H(度金 性解2P强 度m2lNCC源或质H电Hl),3↑eH于化 Og酸C=化别接接、 混e食化 2动离)、 合应原不况HaH热性→电、、应 化C2i表C不池K—OlHN属 氧氧编制;铂电OC离n25或子l电两学发电电该H子物、、、可)H式合盐反 浓 压 温 催 其 波物a周期表位置M极l碱含 结2WR有 吸 化 氧 分 可化 :弱2还化 单 NN示—或O成N)P解度解电化氢 化各 动 条 v实 规O极类 影能生源源RCM方=COn分非非逆元素周期律O反a本性构盐H物水+应 度 强 度 化 她 、+C氧Cl机 热 合 化 子 逆F2O原n合单 正1α源l合碱速3盐M材化 物-F氧负正2H成 态 件 质 律程相 2h解离氧型 响ln=e-H身、简×=O应+2元↑)物 剂 条 激=e金 非酸+、、 、 、 还 、质N=C物 正实质g反归纳物 -正 酸 碱 复质料率H)A氧化极极v式、C2、子化物 、C分 平 改不 不 不 (似n成l被O稳式因不 可H强含 强A↑(a素1F)l方oB酸Hnl的 件 光:无 放 离eH极:原不小属 金勒核平 3分 原逆A已 NHHIl均C应冰还、0盐 式 式 盐l置反还r,Heg化→KeC碱2氧2H定、、 碱CNBH百 衡 变、良 良 良相盐I数素元素性质的周期性性成 溶≠a碱氧 酸l→电lCA2-2程[→碱lH弱C结 、ONlS机 热 子r13子O可△氢 属、、沙原电 2衡解;电A2H换应原OR2g(化盐 盐;性电4l物离非式氧O2C金 性质HO非 稀2l分强,电溶氧络值AM盐 碱B0g(O还e、酸 、阳平式2性化干O+反构 放极H的3I2序逆N、化氢 C特荷、移r原 解(、子lN]决定、H氧盐沸3属 氧光5有含酸O2化盐N可极C弱氧 、弱、 弱+冰a或质衡应M的反C性复煅、 射℃数)可式2物化列a数B动置腾l金 H电M无F过l核外电子排布周期性化的I、氢 化气原子结构量物gr能化 难)H应碱酸C分e状系烧解)判燃等、性 线()分g、物原换原N(ClC氧O氧还NSC质超化 物体保式不有解表N子物 容lua性态数断属HC复质 …Nl弱a理分(理、OA性质变化总a2酸N化元原、O声物、N现)2持同机O碱子HO元素周期律改2l比O数)FCNCHCH元素周期律盐H(酸)复)H电4e规律H数O形物素3OHu3a2H两C不C)物CC变2222HC酸碱两特ll分离l=l式lOH2M×Cl2、性C变)lM32g性性性殊O方H解O1(络CH2gN0程lCC0a盐OO%△或OO式H3)3)H2 -
高中化学知识结构图
原子晶体 晶体类型 分子晶体
金属晶体
比较
类型
构成晶体微粒
形成晶体作用力
熔沸点
硬度
物理性质
导电性
传热性
延展性
溶解性
典型实例
离子晶体 阴、阳离子
离子键 较高
硬而脆
不良 水熔溶不 不融液..良良导电 易溶于极性溶剂
NaCl,KBr
原子晶体 原子 共价键 很高 大
绝缘体(半导体)
不良 不良 不溶于任何溶剂 单质:金刚石、SiC 、Si、SiO2
化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
物理变化
变化
基本反应类型:化合、分解、置换、复分解
电子转移:氧化还原、非氧化还原
物理变化
离子参加:离子反应、非离子反应 反应程度:可逆、不可逆
热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
内因(主)
反应物的结构、性质 浓度
压强
合成氨适于 条件的选择
化学平衡
外因(辅 )
可逆反应
温度 催化剂 其他条件 光、超声 波、激光、放射线…
化学平衡、化学
化学平衡建立的条 定 各成分百分含量保持不变
件:v正=v逆≠0 化学平衡的特征
等 v正=v逆≠0 动 动态平衡
(平衡标志的判断) 变 条件改变,平衡状态改变
n=1 n=2
结构简图 电子式
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
规律 性质变化
元素周期律
元素周期律
实质
核外电子排布周期性
决定
元素性质的周期性
