《药物合成反应》人名反应
(完整word版)《药物合成反应》人名反应
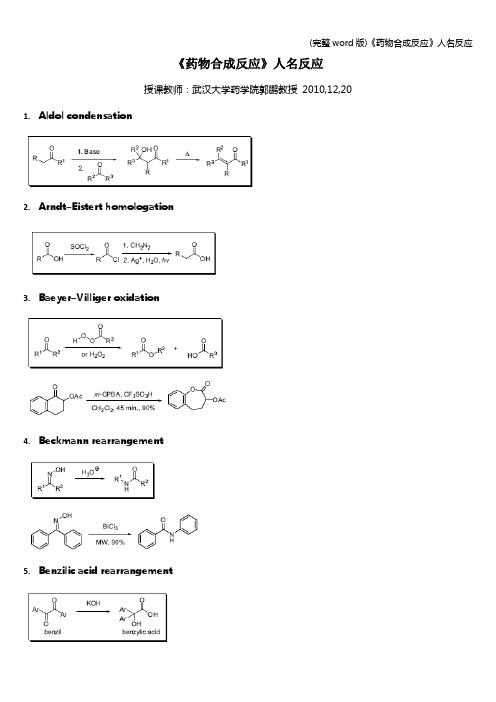
《药物合成反应》人名反应授课教师:武汉大学药学院郭鹏教授2010,12,20 1.Aldol condensation2.Arndt–Eistert homologation3.Baeyer–Villiger oxidation4.Beckmann rearrangement5.Benzilic acid rearrangement6.Benzoin condensation7.Birch reduction8.Buchwald–Hartwig amination9.Cannizzaro reaction10.Claisen condensation11.Claisen rearrangement12.para-Claisen rearrangement13.Clemmensen reduction14.Cope rearrangement15.Criegee mechanism of ozonolysis16.Curtius rearrangement17.Darzens condensation18.Delépine amine synthesi s19.Demjanov rearrangement20.Tiffeneau–Demjanov rearrangement21.Dieckmann condensation22.Favorskii rearrangement23.Fries rearrangement24.Gabriel synthesis25.Gattermann–Koch reaction26.Hofmann rearrangement27.Houben−Hoesch reaction28.Jones oxidation29.Knoevenagel condensation30.Leuckart–Wallach reaction31.Mannich reaction32.Meerwein–Ponndorf–Verley reduction33.Michael addition34.Moffatt oxidation35.Nef reaction36.Oppenauer oxidation37.Paal–Knorr furan synthesis38.Paal–Knorr pyrrole synthesis39.Perkin reaction40.Pinacol rearrangement基团迁移顺序:富电子基团迁移最快烷基:3o > 环己基> 2 o > 苄基> 苯基> 1 o> 甲基> H取代芳基:给电子取代的迁移能力大于无取代的芳基,无取代大于吸电子基团取代的芳基41.Prévost trans-dihydroxylation42.Prins reaction43.Reformatsky reaction44.Reimer–Tiemann reaction45.Robinson annulations46.Robinson−Schöpf reaction47.Rosenmund reduction48.Sandmeyer reaction49.Schmidt rearrangement50.Sommelet reaction51.Sommelet–Hauser rearrangement52.Stobbe condensation53.Strecker amino acid synthesis54.Swern oxidation55.Vilsmeier−Haack reaction56.[1,2]-Wittig rearrangement57.[2,3]-Wittig rearrangement58.Wolff rearrangement59.Wolff–Kishner reduction60.Woodward cis-dihydroxylation 有关Cr的氧化剂极性反转。
人名反应 药物合成反应中主要地人名反应
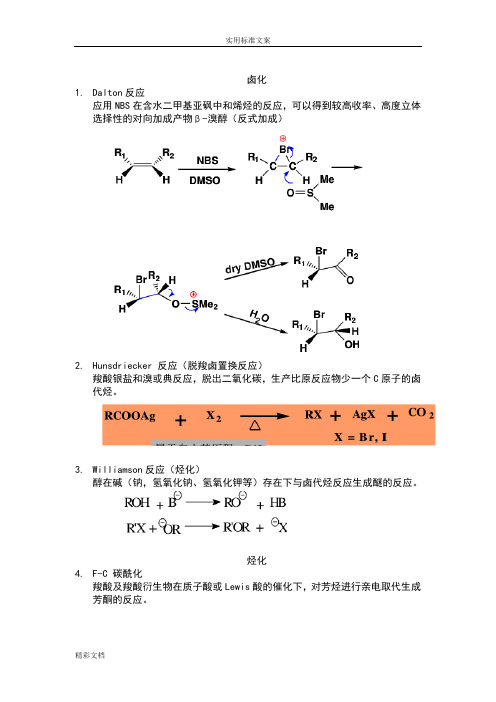
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原实用标准文案精彩文档22. 黄明龙反应23. 氨基保护剂还有Boc。
药物合成反应-人名反应
20
Delépine amine synthesis.
Delepine胺合成
用卤代烃和环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
P057
21
Dieckmann condensation
若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应。
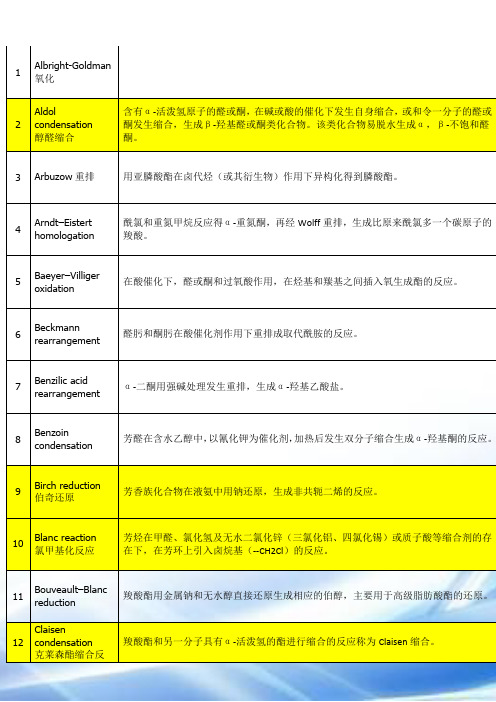
1
Albright-Goldman氧化
P222
2
Aldol condensation
醇醛缩合
含有α-活泼氢原子的醛或酮,在碱或酸的催化下发生自身缩合,或和令一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物。该类化合物易脱水生成α,β-不饱和醛酮。
P130
3
Arbuzow重排
用亚膦酸酯在卤代烃(或其衍生物)作用下异构化得到膦酸酯。
P202
17
Curtius rearrangement
酰基叠氮化合物加热分解生成异腈酸酯的反应。
P188
18
Dakin oxidation
在芳香醛中,当醛基的邻、对位有羟基等供电子基团时,和有机过氧酸反应,醛基经甲酸酯阶段,最后转换成羟基。
P226
19
Darzens condensation
醛或酮和α-卤代酸酯在碱催化下缩合生成α,β-环氧羧酸酯的反应。
用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
P271
37
Lossen rearrangement
异羟肟酸的O-酰基衍生物用碱处理,有时只需加热,先生成异氰酸酯,然后水解得到伯胺的反应。
P187
38
Mannich reaction
具有活性氢的化合物和甲醛(或其他醛)、胺进行缩合,生成胺甲基衍生物的反应。
药物合成反应

课后思考题
• • • • • • 3. 下列什么条件下能进行Birch还原么? A. 冷的氨水中; B. 无水条件下; C. 冷液氨,钠和醇溶液中; D. 水溶液中; E. 室温条件下。
课后思考题
• 4. 在苯环上含有吸电子取代基的情况下进 行Birch 还原反应,吸电子取代基可以在新 产物的那部分结构中找到? • A. 非还原的结构部分找到; • B. 未参与反应的原料中找到; • C. 参与反应的原料中找到; • D. 被还原的结构部分找到; • E. 副产物的结构中找到。
在有机合成中的应用
• 2. 取代环己酮衍生物的制备: • 环己酮衍生物的合成可以用Birch还原反应制备, 可能的原料为:取代苯环衍生物,如苯甲醚和苯 胺类。
在有机合成中的应用
在有机合成中的应用
• 紫杉醇全合成
延伸阅读 Enzymatic Birch Reduction
• The Birch reduction is a widely used synthetic tool in organic chemistry that achieves 1,4-dihydro additions to benzenoid and other aromatic compounds. The reaction proceeds by alternate electron transfer and protonation steps to the aromatic ring and requires solvated electrons, which are usually generated by dissolving an alkali metal in liquid ammonia. • Considering these nonphysiological conditions it is remarkable that a similar reaction exists in biology: the dearomatizing benzoyl-coenzyme A reductase (BCR) plays a key role in the anaerobic degradation of aromatic compounds.
人名反应药物合成反应中主要的人名反应
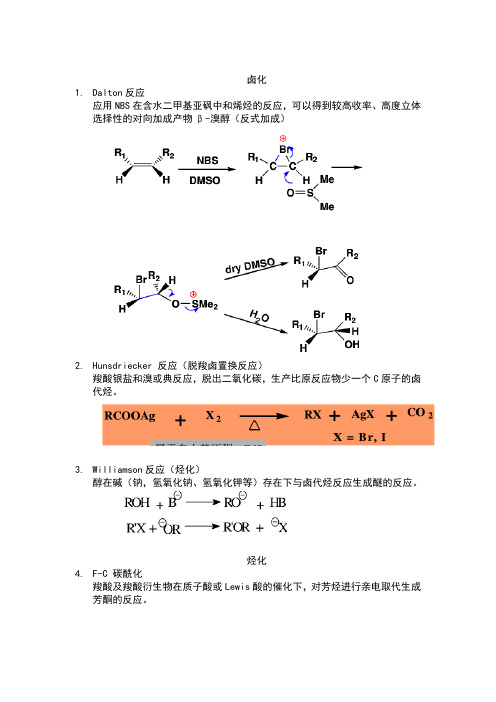
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原22.黄明龙反应23.氨基保护剂还有Boc。
人名反应药物合成反应中主要的人名反应

卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原22.黄明龙反应23.氨基保护剂还有Boc。
【2017年整理】药物合成的人名反应

1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
药物合成人名反应整理

1.Baeyer-Villiger:酮与过氧酸,重排成酯;如环酮,转化成内酯或羟基酸2.Birch:芳香族化合物在液氮中用钠还原,生成非共轭二烯3.Claisen重排:烯丙基芳基醚加热重排为邻烯丙基酚类4.Claisen反应和Dieckmann:C为羧酸酯与另一分子具有α-活泼氢的酯缩合得到β-酮酸酯;D 发生在同一分子内5.Clemmensen:酸性条件,用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基6.Friedel-Crafts:羧酸及衍生物在质子酸或Lewis酸催化下对芳烃亲电取代生成芳酮7.Gattermann:羟基或烷氧基取代的芳烃在ZnCl2、AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应生成亚胺盐酸盐,再水解生成芳醛8.Grignard:有机卤素与金属镁在无水醚存在下生成格氏试剂,后者再与羟基反应得醇类9.Hoesch:腈类与氯化氢在Lewis酸催化剂ZnCl2的存在下与羟基或烷氧基取代的芳烃反应生成酮亚胺,再经水解得芳酮10.Michael:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合生成β-羰烷基类化合物11.Pinacol:连乙二醇类用酸处理时重排成醛或酮12.Pictet-Spenglerβ-芳乙胺与羟基化合物在酸性溶液中缩合生成1,2,3,4-四氢异喹啉13.Prins:烯烃与甲醛在酸催化下加成得1,3-二醇或其环状缩醛1,3-二氧六环及α-烯醇14.Reimer-Tiemann:苯酚和氯仿在强碱水溶液中加热,生成芳醛15.Schmidt:在酸催化下,叠氮酸与羧酸、酮或醛反应分别生成伯胺、酰胺或腈16.Ullmann:由于卤代芳烃活性较低,又有位阻,不易与芳香伯胺反应。
如加入酮或碘化酮以及碳酸钾并加热,可得二苯胺及其同系物。
17.Vilsmeier-Haack:以N-取代甲酰胺为甲酰化试剂在氧氯化磷的催化下在芳环上引入甲酰基18.Wagner-Meerwein:正溴丙烷与AlBr3反应,形成碳正离子,重排得2-溴丙烷19.Witting:醛或酮与磷叶立德反应合成烯烃20.安息香:芳醛在含水乙醇中,以氰化钠为催化剂,加热后发生双分子缩合生成α-羟基酮1.Aldol缩合:含α-活性氢的的醛或酮,在碱或酸的催化下发生自身缩合,或与另一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物的反应,称为α-羟烷基化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《药物合成反应》人名反应
授课教师:武汉大学药学院郭鹏教授2010,12,20 1.Aldol condensation
2.Arndt–Eistert homologation
3.Baeyer–Villiger oxidation
4.Beckmann rearrangement
5.Benzilic acid rearrangement
6.Benzoin condensation
7.Birch reduction
8.Buchwald–Hartwig amination
9.Cannizzaro reaction
10. Claisen condensation
11. Claisen rearrangement
12. para-Claisen rearrangement
13. Clemmensen reduction
14. Cope rearrangement
15. Criegee mechanism of ozonolysis
16. Curtius rearrangement
17. Darzens condensation
18. Del é pine amine synthesis
19. Demjanov rearrangement
20. Tiffeneau–Demjanov rearrangement
21. Dieckmann condensation
22. Favorskii rearrangement
23. Fries rearrangement
24. Gabriel synthesis
25. Gattermann–Koch reaction
26. Hofmann rearrangement
27. Houben-Hoesch reaction
28. Jones oxidation
29. Knoevenagel condensation
30. Leuckart–Wallach reaction
31. Mannich reaction
32. Meerwein –Ponndorf–Verley reduction
33. Michael addition
34. Moffatt oxidation
35. Nef reaction
36. Oppenauer oxidation
37. Paal–Knorr furan synthesis
38. Paal–Knorr pyrrole synthesis
39. Perkin reaction
40. Pinacol rearrangement
基团迁移顺序:富电子基团迁移最快
烷基: 3o> 环己基 > 2 o > 苄基> 苯基> 1 o>甲基 >H
取代芳基:给电子取代的迁移能力大于无取代的芳基,无取代大于吸电子基团取代的芳基41. Pr é vost trans-dihydroxylation
42. Prins reaction
43. Reformatsky reaction
44. Reimer–Tiemann reaction
45. Robinson annulations
46. Robinson-Sch?pf reaction
47. Rosenmund reduction
48. Sandmeyer reaction
49. Schmidt rearrangement
50. Sommelet reaction
51. Sommelet–Hauser rearrangement
52. Stobbe condensation
53. Strecker amino acid synthesis
54. Swern oxidation
55. Vilsmeier-Haack reaction
56. [1,2]-Wittig rearrangement
57. [2,3]-Wittig rearrangement
58. Wolff rearrangement
59. Wolff–Kishner reduction
60. Woodward cis-dihydroxylation 有关 Cr 的氧化剂
极性反转。
