大学高等教育配位平衡习题及答案
(完整版)配位平衡和配位滴定法

配位平衡和配位滴定法自测题一.填空题1. 钴离子Co3+和4个氨分子、2个氯离子生成配离子,它的氯化盐的分子式为_______________ ,叫做 ____________ 。
2. 溴化一氯三氨二水合钴(山)的内界为______________ ,外界为_____________ 。
3. 四氯合铂(II)酸四氨合铜(II)的化学式为______________ 。
4. 在[RhBr 2(NH3)2]+中,Rh的氧化态为______________ ,配位数为______________ 。
5. K[CrCI 4(NH3)2]的名称是__________ ,Cr的氧化数是 __________ ,配位数是 __________ <6. 配离子[PtCI(NO 2)(NH 3)4]2+中,中心离子的氧化数为_____________ ,配位数为 _________该化合物的名称为 _________________ 。
7. 螯合物是由 __________ 和__________ 配位而成的具有环状结构的化合物。
8. 在[Ag(NH 3)2]NO3溶液中,存在下列平衡:Ag+ + 2NH 3 = [Ag(NH 3)2]+。
(1)若向溶液中力口入HCI,则平衡向 _______ 移动;(2)若向溶液中加入氨水,则平衡向____________ 移动。
9. [PtCI(NO 2)(NH3)4]CO3名称为_________________ ,中心离子的氧化数为_______ ,配离子的电荷数为 ________ 。
10. KCN为剧毒,而K4[Fe(CN)6]无毒,这是因为__________________________ 。
11. 金属离子M溶液的pH值增大时,副反应系数Y(H) _________________ ,M(OH) ________________ ,条件稳定常数K MY,的变化趋势是 _________________ 。
配位化学答案

配位化学答案一、选择题(每题1分,共15分)1-5A,A,C,B,D6-10C,D,D,B,D11-15B,C,B,B,A二、填空题(1题,每空0.5分,共7分;其余每空1分,共6分)1、+2,平面正方形,N,C u2+,4;d s p2,顺,-3,八面体,C,F e3+,6,s p3d2,顺2、1)硫酸四氨合铜(Ⅱ)2)六氰合铁(Ⅲ)酸钾3)三氯化三乙胺合钴(Ⅱ)4)c i s-[P t(C2H4)C l3].H2O5)N i[(C O)4]6)K3[F e(C N)6]三、名词解释(每题3分,共24分)1、配合物:可以给出孤对电子的分子和具有孤对电子的分子按照一定组成和空间构型所形成的化合物。
2、内轨型配合物:在形成配合物中,配位体的孤对电子所占空轨轨道是有(n-1)d轨道参与的杂化轨道[(n-1)d+ns+np],所以叫轨型配合物3、螯合物:由双齿或者多齿配体与同一个中心原子作用形成的具有环状结构的配合物4、键合异构:当一个单齿配体有两个可能用于配位的不同原子时,分别用不同的原子配位,可能产生键合异构现象5、多核配合物:含有2个或者2个以上中心原子(或者离子)的配合物6、Jahn-Teller 效应:电子在简并轨道中的不对称占据会导致分子的几何构型发生畸变,从而降低分子的对称性和轨道的简并度,使体系的能量进一步下降的现象称为Jahn-Teller 效应。
四、问答题(每题6分,共36分)1 简要阐明配合物的价键理论?答:1)中心离子或原子通过提供与配位数相等数目的杂化了的空轨道接受来自配体的孤电子对(或π键电子对)形成配位共价键。
2)杂化轨道与空间构型的关系为了增强成键能力,中心原子能量相近的空的价轨道要通过适当的方式线性组合成具有更强方向性的、符合σ对称性要求的等价杂化轨道。
2、简述配体的光谱化学序列?答:将一些常见配体按光谱实验测得的分裂能从小到大次序排列称为光谱化学序。
F->H2O>CO(NH2)2>NH3>C2O42-≈en>NCS->Cl-≈CN->Br->(C2H5O)2PS2≈S2-≈I ->C2H5O)2PSe2-3、用晶体场理论解释[Fe(CN)6]4-与FeSO4.7H2O的磁性差异?答:在上述两个配合物中,CN-是强场配体,分裂能大于电子成对能,所以中心原子铁采取低自旋,6个单电子全部成对,所以[Fe(CN)6]4-属于抗磁性配合物;而H2O是弱场配体,分裂能小于电子成对能,所以中心原子铁采取高自旋,6个单电子中只有1对成对,还有4个单电子,所以FeSO4.7H2O属于顺磁性配合物。
第12章 配位平衡习题简解

第12章配位平衡12-1:在1L 6mol/L 的NH3水中加入0.01 mol固体CuSO4,溶解后加入0.01mol固体NaOH,铜氨络离子能否被破坏?(K稳SCN [Cu(NH3)42+]=2.09×1013,K SP[Cu(OH)2]=2.2×10-20)12-2当少量NH4SCN和少量Fe3+ 同存于溶液中达到平衡时,加入NH4F使[F- ]=[SCN-]=1mol/L-1,问此时溶液中[FeF63- ]和[Fe(SCN)3]浓度比为多少?(K稳Fe[SCN]3=2.0×103,K稳[FeF6]=1×1016)解:5×101212-3:在理论上,欲使1×10-5mol的AgI溶于1cm3氨水,氨水的最低浓度应达到多少?事[Ag(NH3)2+]=1.12×107;Ksp(AgI)=9.3×10-17)实上是否可能达到这种浓度?(K稳解:3×102mol/L,实际上不可能达到。
12-4:通过配离子稳定常数和Zn2+/ Zn 和Au+/Au 的电极电势计算出Zn(CN)42-/Zn和Au(CN)2- /Au,说明提炼金的反应:Zn + 2 Au(CN)2- = Zn(CN)42-+ 2Au在热力学上是自发的。
12-5:为什么在水溶液中Co3+(aq) 离子是不稳定的,会被水还原而放出氧气,而3+氧化态的钴配合物,例如Co(NH3)63+,却能在水中稳定存在,不发生与水的氧化还原反应?通过标准电极电势作出解释。
(稳定常数:Co(NH3)62+ 1.38×105 ; Co(NH3)63+1.58×1035.标准电极电势:Co3+/Co2+1.808V,O2/H2O1.229V,O2/OH-0.401V;K b(NH3)=1.8×10-5)12-6:欲在1L水中溶解0.10molZn(OH)2,需加入多少克固体NaOH ?(Ksp[Zn(OH)2]=1.2×10-17;[Zn(OH)42-]=4.6×1017)解:13g12-7:在PH=10的溶液中需加入多少NaF才能阻止0.10mol/L 的Al3+溶液不发生Al(OH)3沉淀?(Ksp Al(OH)3=1.3×20-20; K稳(AlF63-)=6.9×1019)解:1.62mol/L12-8:测得Cu|Cu(NH3)42+ 1.00mol/L,NH31.00mol/L||H+1.00mol/L-1|H21bar, Pt的电动势为0.03V,试计算Cu(NH3)42+ 的稳定常数。
第八章 配位平衡 习题

第八章配位平衡习题一.选择题1、配位数是()A.中心离子(或原子)接受配位体的数目B.中心离子(或原子)与配位离子所带电荷的代数和C.直接与中心离子(或原子)配位的配位原子的总数D.中心离子(或原子)与配位体所形成的配位键数目2、乙二胺四乙酸根(-OOCCH2)2NCH2CH2N(CH2COO-)2可提供的配位原子数为()A. 2B. 4C. 6D. 83、下列叙述正确的是()A.配合物由正负离子组成B.配合物由中心离子(或原子)与配位体以配位键结合而成C.配合物由内界与外界组成D.配合物中的配位体是含有未成键的离子4、关于配位体,下列说法中不正确的是()A.配位体中具有孤对电子,与中心离子(或原子)形成配位键的原子称为配位原子B.多齿配位体只有两个配位原子C.只含一个配位原子的配位体称为单齿配位体D.配体的特征是能提供孤对电子5、化合物[Co(NH3)4Cl2]Br的名称是()A.溴化二氯·四氨钴酸盐(Ⅱ)B.溴化二氯·四氨钴酸盐(III)C.溴化二氯·四氨合钴(Ⅱ)D.溴化二氯·四氨合钴(III)6、下列说法中正确的是()A.配位原子的孤电子对越多,其配位能力就越强B.电负性大的元素充当配位原子,其配位能力就强C.能够供两个或两个以上配位原子的多齿配体只能是有机物分子D.内界中有配位键,也可能存在共价键7、下列配合物中,属于螯合物的是()A.[Ni (en)2]Cl2B.K2[PtCl6]C.(NH4) [Cr (NH3)2 (SCN)4]D.Li[AlH4]8、下列关于螯合物的叙述中,不正确的是()A.有两个以上配位原子的配位体均生成螯合物B.螯合物通常比具有相同配位原子的非螯合配合物稳定得多C.形成螯环的数目越大,螯合物的稳定性一定越好D.起螯合作用的配位体一般为多齿配为体,称螯合剂二、填空题1、配位化合物[Cu(NH3)4]2+的名称是。
2、配位化合物二氨合银离子的化学式是。
第八章 配位平衡和配位滴定课后答案

第八章 配位平衡与配位滴定法(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式? 答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3] 4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳) Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小 ③Fe 与SCN -会生成血红色的配合物6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
答: Ag + + 2NH 3 [Ag(NH 3)2]+ 初始 0.051.0171824.030932.0⨯⨯⨯=3假设反应x x 2x x 平衡 0.05-x 3-2x x)(Ag )(NH )])[Ag(NH (3223++=c c c K θ稳=1.12⨯107 ]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=平衡时Ag +=5.04×10-10mol/L7.在第6题的混合液中加0.10mol ∙L -1的KBr 溶液10mL ,有没有AgBr 沉淀析出?如果欲阻止AgBr 沉淀析出,氨的最低浓度是多少?答:因为Ag +×Br ->Ksp 所以会生成沉淀若不能生成沉淀,则Ag+的浓度必须小于12100.5--+⨯=<BrKsp Ag 设氨的最低浓度为y Ag + + 2NH 3 [Ag(NH 3)2]+ 初始 0.05×100/110 =0.045 y 假设反应平衡 5.0× 10-12 y-(0.045-5.0× 10-12) 0.045-5.0× 10-12)(Ag )(NH )])[Ag(NH (3223++=c c c K θ稳=1.12⨯107代入得y=8.67mol/L 9、当溶液的pH=11.0时并含有0.001mol/L 游离的CN-时,计算'HgY lgK θ的值解:查表得5.21lgK HgY =θ当pH=11.0时,lg αY(H) =0.07当含有0.001mol/L 的CN-时:当pH=11.0时,αHg(OH)=1015.9 所以αM =αM(L) + αM(OH)-1=1026.4+1015.9-1≈1026.4说明此时HgY 已经被破坏10解:该缓冲溶液的76.4lg==-=θθb b pK cacb pK pOH 所以pH=14-4.76=9.24 当pH=9.24时,lg αY(H) ≈1.28 αNi (OH)=100.1αM =αM(L) + αM(OH)-1=2.1×104+100.1-1≈2.1×104 11.解: lg αY(H) = lg K (ZnY) – 8 =16.36-8 =8.36查表可知最高酸度为pH=4.013.解: 水的总硬=0.01050mol ⋅L -1⨯19.00⨯10-3L ⨯56.08⨯103mg·mol -1/100.0⨯10-3L= 111.9mg ⋅L -115.解: w (Mg) = (0.05000⨯4.10⨯100⨯24.31)/(25⨯0.5000⨯1000) = 0.0399w (Zn) = (0.05000⨯13.40⨯100⨯65.39)/(25⨯0.5000⨯1000) = 0.3504w (Cu) = [0.05000⨯(37.30-13.40)⨯100⨯63.55]/(25⨯0.5000⨯1000) = 0.607516.Solution: Cu 2+ + 4NH 3 = [Cu(NH 3)4]2+1134113334f 2432342243f Lmol 108.4)100.1(1009.2100.1 )(NH ])[Cu(NH )(Cu )(NH )(Cu ])[Cu(NH ----++++⋅⨯=⨯⨯⨯⨯=⋅=⋅=c K c c c c c K17. Solution: c (Cu 2+) = [0.05083⨯16.06 – (0.05083⨯25.00 –0.01883⨯19.77)/2] /25.00= 0.01468 mol·L -197.407.04.265.21lg lg lg lg )(M(L)MY 'MY -=--=--=H Y K K ααθθ4.264.415221M(L)1010001.01)L ()L ()(L 1=⨯+=+⋅⋅⋅+++=n nβc βc βc α9.1228.13.45.18lg lg lg lg )(M(L)MY 'MY =--=--=H Y K K ααθθ474.7671.8596.7477.6304.5280.2221Ni(NH3)101.2101.0101.0101.0101.0101.0101.01)L ()L ()(L 1⨯=⨯+⨯+⨯+⨯+⨯+⨯+=+⋅⋅⋅+++=nn βc βc βc α。
南昌大学大学化学第七章习题答案
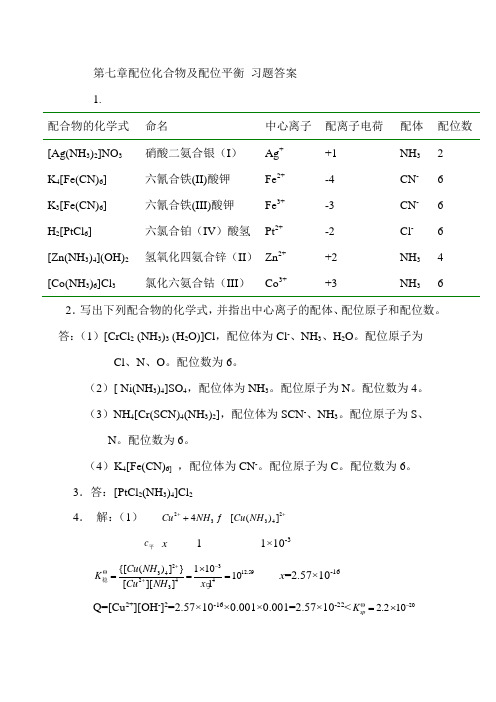
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
配位化学练习题

配位化学练习题配位化学是无机化学的重要分支,研究的对象是配位化合物和配位反应。
配位化学主要研究金属离子与配体之间的相互作用,以及在配位化合物中金属离子的周围有哪些配体。
以下是一些配位化学的练习题,用以帮助读者巩固相关知识。
题目一:给定以下化学方程式,请推导出反应类型,并写出反应物和生成物的化学式。
1. AgNO3 + NaCl →2. CuSO4 + NH3 →3. FeCl3 + KOH →题目二:根据以下配位化合物的谱系图,请回答以下问题。
1. 对于配位数为4的配合物,属于以下哪种晶体场理论?2. 高自旋和低自旋的配合物分别具有什么样的差异?3. 配体场强度增加,配体键长和配位键数会发生什么变化?4. 对于给定的配合物,如果配位键数为6,那么该配合物的中心离子是什么?题目三:结合以下反应机理,请写出反应的平衡常数表达式。
1. Co(H2O)6 2+ + 6NH3 ⇌ Co(NH3)6 2+ + 6H2O2. NH3 + H2O ⇌ NH4+ + OH-3. Cu(H2O)6 2+ + 4Cl- ⇌ [CuCl4]2- + 6H2O题目四:以下是一些配位化合物的常见名称,请根据化学式给出其对应的名称。
1. Fe2(SO4)32. K3[Fe(CN)6]3. [Co(NH3)4Cl2]Cl题目五:给定以下化学方程式,请写出反应的电子方程式和平衡常数表达式。
1. Co(H2O)6 2+ + [Cr(CN)6]4- → Co(CN)6 4- + [Cr(H2O)6]2+2. [Cu(NH3)4]2+ + 4Br- → [CuBr4]2- + 4NH3题目六:结合以下反应,回答以下问题。
1. 配位化合物的颜色与什么因素有关?2. 过渡金属配合物为什么可以具有催化性质?3. 配合物中的中心离子的电荷数会如何影响配合物的稳定性?4. 配体的选择如何影响配位化合物的形状?这些练习题覆盖了配位化学的不同方面,包括反应类型、配位反应机理、命名和电子结构等。
华东理工大学现代基础化学课后习题解答第11章

解:欲使 0.1mmolAgCl 全部溶解于 1.0 mL 氨水中,生成[Ag(NH3)2] + ,则:
[Ag(NH3)
+ 2
]
=
0.1
mol.L
−1
AgCl + 2NH3
[Ag(NH3)2] + +Cl −
x
0.1
0.1
K
Ο
=
K
Ο sp
(AgCl)·
K
Ο 稳
{[Ag(NH3)2]
+
}
=1.77×10 −10 ×1.12×10 7 =1.98×10 −3
设平衡时
Ag
+
为
x,则[Ag(NH3)
+ 2
]为
0.1-x,NH3
为
0.3+2x。
Ag + +2NH3 x 0.3+2x
[Ag(NH3)2] + 0.1-x
因
K
Ο 稳
较大,Ag
+
几乎全部配合,则
0.3+2x≈0.3,
0.1-x≈0.1
K
Ο 稳
=
[Ag(NH
3
)
+ 2
]
[Ag + ][NH 3 ]2
= 1.12×10 7
4
0.04 × 0.1 x2
= 1.98 × 10 −3
x = 1.42 mol.L −1
则原始 NH3 的浓度为 1.50 mol·L −1 ,需改用 12.5mL 浓氨水体积为:
(1.50 × 0.1÷12) × 1000 = 12.5 mL
5、10 mL0.10 mol⋅L −1 CuSO4 溶液与 10 mL 6.0 mol⋅L −1 氨水混合达平衡后,计算溶液中
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学高等教育配位平衡习题及答案一、判断题:1. Cu (Ⅱ) 、Zn (Ⅱ) 、Cd (Ⅱ) 的易溶盐较多。
()2. 金属锌可以与过量的氨水反应生成氢气。
()3. Zn 、Cd 、Hg 的金属活泼性分别比Cu 、Ag 、Au 强。
........ ()4. [ Cu (NH3 )4 ]2+ 的空间构型为正四面体,Cu2+ 以sp3 杂化轨道与NH3 形成配位键。
.........................................................................................................................()5. Zn2+ 、Cd2+ 、Hg2+ 与EDTA 形成配位数为 4 的螯合物。
()二、选择题:1.下列物质在酸性溶液中可以将Mn2+氧化为MnO4-的是.................()。
(A) PbO;(B) Bi3+;(C) NaClO;(D) (NH4 )2 S2O8。
2. 下列金属中,延展性最好的是..................................................... ()。
(A) 银;(B) 金;(C) 铜;(D) 锌。
3. 下列反应中,配离子作氧化剂的是....................................... ()。
(A) [Cu (OH)4]2- 与甲醛反应;(B)[ Fe (CN)6]4- 与FeCl3 反应;(C) [Co (NH3 )6]2+ 与O2 反应;(D)[ Ag (NH3 )2]+ 与KI 反应。
4. 下列化合物中易溶于水的是....................................................... ()。
(A) Cu2O ;(B) CuCl ;(C) CuCl2 ;(D) CuI 。
5. 下列离子分别与Hg2+ 反应不生成沉淀的是.................. ()。
(A) 少量I- ;(B) OH-;(C) Sn2+;(D) Cl-。
6. 在酸度较大的水溶液中也不溶解的盐是( )(A) Ag2SO4 (B) Ag3PO4 (C) Ag2CO3 (D) Ag2S7. 在CuSO4溶液中加入过量的碳酸钠溶液,常形成的产物是( )(A) Cu(HCO3)2 (B) CuCO3 (C) Cu2(OH)2CO3 (D) Cu(OH)28. 组成黄铜合金的两种金属是( )(A) 铜和锡(B) 铜和锌(C) 铅和锡(D) 铝和铜9. Cu+的磁矩是( )(A) (B) (C) (D) 010. 下述有关银的性质的正确论述是( )(A) 从稀盐酸中置换出氢(B) 从浓盐酸中置换出氢(C) 从氢碘酸中置换出氢(D) 从稀硫酸中置换出氢11. 要从含有少量Cu2+离子的ZnSO4溶液中除去Cu2+离子最好的试剂是( )(A) Na2CO3 (B) NaOH (C) HCl (D) Zn12. 能共存于溶液中的一对离子是( )(A) Fe3+和I-(B) Pb2+和Sn2+(C) Ag+和PO43-(D) Fe3+和SCN-13. 欲除去CuSO4酸性溶液中少量Fe3+,加入下列试剂效果最好的是( )(A) 氨水(B) NaOH (C) H2S水(D) Cu2(OH)2CO314. Cu2O 和稀H2SO4反应,最后能生成( )(A) Cu2SO4+ H2O (B) CuSO4+ H2O (C) CuSO4+ Cu + H2O (D) CuS15. 五水硫酸铜可溶于浓盐酸,关于所得溶液的下列说法中,正确的是( )(A) 所得溶液成蓝色;(B) 将溶液煮沸时释放出氯气,留下一种Cu(I) 的配合物溶液;(C) 这种溶液与过量的氢氧化钠溶液反应,不生成沉淀;(D) 此溶液与金属铜一起加热,可被还原为一种Cu(I)的氯配合物。
16. 下列描述银的性质中,正确的是( )(A) 能与浓HCl作用放出氢(B) 能与氢碘酸作用放出氢(C) 能与稀硫酸作用放出氢(D) 能与沸水作用放出氢17. 铜的氧化物和酸反应生成硫酸铜和铜,这氧化物和酸分别是( )(A) 铜的黑色氧化物和亚硫酸(B) 铜的红色氧化物和过二硫酸(C) 铜的红色氧化物和稀硫酸(D) 铜的黑色氧化物和稀硫酸18. 因Ag 中常含有少量的铜,在制备AgNO3时必须除去Cu ,可用的方法是( )(A) 控制温度热分解含Cu(NO3)2的AgNO3(B) 向AgNO3溶液中加新制备的Ag2O(C) 电解AgNO3溶液(D) (A) (B) (C)均可19. 精炼铜时,以粗铜作阳极,CuSO4作电解液,电解进行到一定程度时,电解质溶液的pH 值( )(A) 改变不大(B) 明显增大(C) 明显减小(D) 无法判断20. 加NH3·H2O水于Hg2Cl2上,容易生成的是( )(A) Hg(OH)2 (B) [Hg(NH3)4]2+(C) [Hg(NH3)2]+(D) HgNH2Cl+Hg21. 在工业上欲除去ZnSO4溶液中的Fe3+杂质,需加入最合适的试剂是( )(A) NaOH (B) Na2CO3 (C) ZnCO3 (D) Zn22. 下列的阳离子中,能与Cl-离子在溶液中生成白色沉淀,加氨水时又将转成黑色的是( )(A) 铅(II) (B) 银(I) (C) 汞(I) (D) 锡(II)23. 下列金属单质可以被HNO3氧化成最高价态的是( )(A) Hg (B) Ti (D) Pb (D) Bi24. 黄色HgO 低于573 K 加热时可以转化成红色HgO,这是因为( )(A)加热改变了结构类型(B)加热使晶体出现了缺陷(C)结构相同,仅仅由于晶粒大小不同(D)加热增强了Hg2+对O2-的极化作用25. 氧化锌长时间加热将由白色变成黄色,这是由于加热过程( )(A) 产生异构化(B) 晶粒变小(C) Zn2+对O2-的极化作用增强(D) 晶体出现了缺陷26. 下列各对离子用4 mol·dm-3 NaOH 溶液可分离的是( )(A) Cu2+,Ag+(B) Cr3+,Zn2+(C) Cr3+,Fe3+(D) Zn2+,Al3+27. 下列化合物中,既能溶于浓碱,又能溶于酸的是( )(A) Ag2O (B) Cu(OH)2 (C) HgO (D) Cd(OH)228. 能共存于酸性溶液中的一组离子是( )(A) K+,I-,SO42-,MnO4-(B) Na+,Zn2+,SO42-,NO3-(C) Ag+,AsO43-,S2-,SO32-(D) K+,S2-,SO42-,Cr2O72-29. 不能用H2S( 在mol·dm-3 HCl溶液中)分离的下述离子对是( )(A) Bi3+,Pb2+(B) Zn2+,Cu2+(C) Ni2+,Cd2+(D) Ni2+,Cu2+三、填空题:1. 在饱和的Hg2 (NO3 )2 溶液中,逐滴加入浓HCl ,开始有⎽⎽⎽⎽⎽⎽色的⎽⎽⎽⎽⎽⎽⎽生成,继续加浓HCl 有⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽和⎽⎽⎽⎽⎽⎽⎽⎽⎽生成。
2. 氢氧化铜是⎽⎽⎽⎽⎽色固体,⎽⎽⎽⎽⎽溶于水。
氢氧化铜⎽⎽⎽⎽⎽溶于浓的氢氧化钠溶液,⎽⎽⎽⎽溶于氨水.。
3 .铬绿的化学式是________,铬酐的化学式是________,铬铁矿的主要成分为________,红矾钠的化学式是_________。
4. Hg 的价层电子构型为⎽⎽⎽⎽⎽⎽⎽⎽⎽,能形成氧化值为⎽⎽⎽⎽⎽⎽⎽和⎽⎽⎽⎽⎽⎽的化合物。
较稳定的汞氧化物为⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
5. 向Al2(SO4)3和CuSO4混合溶液中放入一个铁钉,发生反应后可生成___________ 。
6. Al3PO4和AgCl都难溶于水,然而在HNO3溶液中,____________ 能溶解。
在NH3水中,_______________能溶解。
7. 在Ni(OH)2,Cu(OH)2,Ga(OH)3和Mn(OH)2中,______________________和________________________ 是两性氢氧化物。
8. 红色不溶于水的固体____________________与稀硫酸反应,微热,得到蓝色__________溶液和暗红色的沉淀物___________ 。
取上层蓝色溶液加入氨水生成深蓝色___________溶液。
加入适量的KCN 溶液生成无色的____________溶液。
9. Cu+在水溶液中_______________ ,容易发生歧化反应,其反应方程式是____________________________________________________________________ ,所以一价铜在水溶液中只能以____________物和____________物的形式存在。
10. 氯化亚铜溶于氨水之后的溶液,在空气中放置,其发生变化的化学方程式是:_________________________________________________________________。
11. 在氯化银溶于氨水的溶液中加入甲醛并加热,所发生反应的化学方程式是:____________________________________________________________________。
12. 在等浓度(mol·dm-3)等体积的Na3PO4,Na2HPO4,NaH2PO4溶液中,分别加入同浓度、等量(为适量)的AgNO3溶液均生成沉淀,沉淀依次分别是_______;________;__________。
13. 填写下列物质的颜色:Cu(CN)2-______________,VO2+____________________,Cu2O ___________________________,MnO42-_____________________________。
14. CuSO4是杀虫剂,和白灰混合使用的原因是_______________________________________________________________________________________________________。
15. 某含铜的配合物,测其磁矩为零,则铜的氧化态为_____________________;黄铜矿(CuFeS2)中铜的氧化态为________________________________________。
16. 金溶解于王水中的化学反应方程式是_____________________________________________________________________________________________________________17. Cu2+和有限量CN-的化学反应方程式是____________________________;Cu2+和过量CN-作用的化学方程式是__________________________________。
