环境化学第二章大气环境化学复习知识点
第2章 大气环境化学

=> ( R Cv ) T R p 根据迈耶定律:R’ +Cv=Cp(定压比热,压力不变情况下,体系
dT
dp
内能变化,Jmol-1K-1)
所以: C p
dT dp R T p
4、热(成)层
从80km到约800km的地方
(1)温度随高度增加迅速增高; (2)大气更为稀薄; (3)大部分空气分子被电离成为离子和自由电子,又称电 离层,可以反射无线电波
5、逸散层
( 1) 800km以上高空
( 2)
( 3)
空气稀薄,密度几乎与太空相同
空气分子受地球引力极小,所以
气体及其微粒可以不断从该层逃逸出去
上述两种分类方法具有很好的相关性,除了几种惰性气体以外,浓 度和寿命是密切相关的,一般说来浓度越大的成分寿命越长。分类仅限 于大约80公里以下的均质大气层
成分 氮(N2) 氧(O2) 氩(Ar) 二氧化碳(CO2) 氖(Ne) 氦(He) 氪(Kr) 氙(Xe) 氢(H2)
体积混合比 0.78083 0.20947 0.00934 0.00035 1.82×10-6 5.2×10-6 1.1×10-6 0.1×10-6 0.5×10-6
寿命 ~106年 ~5×103年 ~107年 ~ 5- 6年 ~107年 ~107年 ~107年 ~107年 6-8年
甲烷(CH4)
一氧化二氮(N2O) 一氧化碳(CO) 臭氧(O3)
1.7×10-6
0.3×10-6 0.1×10-6 10-50×10-9
~10年
~25年 ~0.2-0.5年 ~ 2年
dp g dz
dp g g
=
1
pg R T
=> p R T dz R T dz => => ln
环境化学 第二章 大气环境学

《京都议定书》
1997年12月,149个国家和地区的代表在日本召开 《联合国气候变化框架公约》缔约方第三次会议,会 议通过了旨在限制发达国家温室气体排放量以抑制全 球变暖的《京都议定书》。 《京都议定书》需要在占全球温室气体排放量55% 的至少55个国家批准之后才具有国际法效力。
2009年12月将在哥本哈根举行 《联合国气候变化框架公约》第15次 缔约方大会,就《京都议定书》201 2年到期后国际温室气体减排安排达成 一份新协议,协议内容需由各国通过谈 判达成一致。
光化学烟雾:汽车、工厂等污染源 排入大气的碳氢化合物 (HC) 和氮氧化 物 (NOx NOx)等一次污染物在阳光中紫 外线照射下发生光化学反应生成一些氧 化性很强的 O3、醛类、 PAN 、HNO3 等二次污染物。人们把参与光化学反应 过程的一次污染物和二次污染物的混合 物(其中有气体和颗粒物 )所形成的烟雾, 称为光化学烟雾。
3.腐蚀材料和古迹。 4.影响人体健康。 5.影响地球气候
7.5 酸雨的防治
减少硫氧化物和氮氧化物的排放量,是防止酸沉 降的主要途径。 1.制定严格标准,加强排放控制 2.调整能源结构,增加无污染或少污染的能源比 例。 3.积极开发利用煤炭的新技术,(1)使用低硫 燃料或改进燃烧装置;(2)烟气脱硫脱氮; 4.控制汽车尾气排放
7.3降水的化学性质 -- 降水的 化学组成及离子平衡
1.组成 ������ (1) 大气固定气体成分: ������ (2) 无机物: 土壤矿物离子 海洋盐类离子 大气转化产物 人为排放 (3) 有机物: ������ (4) 光化学反应产物: ������ (5) 不溶物
联合国气候变化峰会是由国家元首或政 府首脑参加的讨论气候变化问题规模最 大的峰会,目的就是要集中全球智慧, 推动实际行动”,为联合国今年12月 在丹麦首都哥本哈根举行的气候大会达 成协议铺平道路。
环境化学-第二章大气环境化学

19
三、大气中的主要污染物
2、含氮化合物
(2)燃料燃烧过程中NOx的形成机理 I.燃料中的含氮化合物在燃烧过程中氧化生成NOx,即含氮 化合物+O2→NOx。 II.燃烧过程中空气中的N2在高温(>2100℃)条件下氧化生 成NOx。其机理为链反应机制:
O2(高温)→O+O (非常快) O+N2→NO+N (非常快) N+O2→NO+O (非常快) N+OH→NO+H (非常快) 2NO+O2→2NO2 (慢)
D、热层(电离层) thermosphere E、逸散层exosphere
平流层 (臭氧 层) 对流层
240 T(K) 280
20
0 160
对流 层顶
200
图 大气温度的垂直分布
7
第一节 大气的组成及其主要污染物 二、大气层的结构
1、对流层: 平均厚度12km,赤道16~18km,两极
8~10km,云雨主要发生层,夏季厚,冬季薄。
第二章 大气环境化学
第二节 大气中污染物的迁移
20
第二节 大气中污染物的迁移 一、辐射逆温层(Radiation inversion)
1、对流层大气的重要热源是来自地面的长波辐射,故离地面 越近气温越高;离地面越远气温越低。
※随高度升高气温的降低率称为大气垂直递减率:
dT dz
T——绝对温度,K; z —— 高度,m。 此式可以表征大气的温度层结(气温随垂直高度增加的分布规律)
21℃
30
高温暖气团倾向于从地表移动到低压的高处,移动 过程中,气团绝热膨胀并降温。如果气团中没有水汽凝结, 冷却速率为10℃/1000m,称为温度的干绝热递减率(rd)。
环境化学第二章大气环境化学复习知识点

第二章大气环境化学1、大气成分:按浓度分成三大类:(1)主要成分,浓度在1%以上量级,包括氮(N2),氧(O2)和氩(Ar);(2)微量成分(也称次要成分),浓度在1ppmv到1%之间,包括二氧化碳(CO2),水汽(H2O),甲烷(CH4),氦(He), 氖(Ne),氪(Kr)等;(3)痕量成分,浓度在1ppmv以下,主要有氢(H2),臭氧(O3),氙(Xe),一氧化二氮(N2O),氧化氮(NO),二氧化氮(NO2),氨气(NH3),二氧化硫(SO2),一氧化碳(CO)以及气溶胶等等。
此外,还有一些大气中本来没有的,纯属人为产生的污染成分,它们目前在大气中的浓度多为pptv的量级,如氟氯烃类化合物(常记为CFCs)等。
2、大气层的结构:对流层、平流层、中间层、热层、逸散层对流层特性:由于对流层大气的重要热源来自于地面长波辐射,因此离地面越近气温越高;离地面越远气温则越低。
在对流层中,高度每增加100m,气温降低0.6℃。
云雨的主要发生层,赤道厚两极薄。
平流层特征:在平流层内,大气温度上热下冷,空气难以发生垂直对流运动,只能随地球自转产生平流运动,平流层气体状态非常稳定。
在平流层内,进入的污染物因平流运动形成一薄层而遍布全球。
中间层特征:在中间层中,由于层内热源仅来自下部的平流层,因而气温随高度增加而降低,温度垂直分布特征与对流层相似;由于下热上冷,空气垂直运动强烈。
热层特征:在热层中,温度随高度增加迅速上升。
热层空气极稀薄,在太阳紫外线和宇宙射线辐射下,空气处于高度电离状态,该层也可以称为电离层。
逸散层:800km以上高空;空气稀薄,密度几乎与太空相同;空气分子受地球引力极小,所以气体及其微粒可以不断从该层逃逸出去。
3、逆温由于过程的不同,可分为近地面的逆温、自由大气逆温。
近地面的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温自由大气逆温:乱流逆温、下沉逆温、锋面逆温逆温的危害:在对流层中,由于低层空气受热不均,能够使气体发生垂直对流运动,致使对流层上下空气发生交换。
环境化学复习

第二章大气环境化学1、大气层的结构 Layers of the Atmosphere(英文)A、对流层troposphere对流层是大气的最底层,其厚度在赤道附近为16—18km;在中纬度地区为10—12km,两极附近为8—9km。
最显著特点是气温随海拔高度的增加而降低,大约每上升100m,温度降低0.6度。
另一个特点是密度大,大气总质量的3/4以上集中在对流层。
B、平流层stratosphere从对流层顶到海拔高度约为50km的大气层。
特点:①空气没有对流运动,平流运动占显著优势。
②空气比对流层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象③在高15—60km内,有约20km的一层臭氧层The Ozone Layer。
O2→O•+O•、O•+O2→O3、O3→O•+O2、O3+O•→2O2是臭氧光解的过程。
平流层温度随海拔高度的增加而增加。
C、中间层mesosphere从平流层顶到80km高度的大气层。
空气较稀薄,由于臭氧层消失,温度随海拔高度的增加而迅速降低。
D、热层(电离层)thermosphere从80km到约500km的大气层。
大气温度随海拔高度的增加而迅速增加。
2.大气中的主要污染物含硫化合物;含氮化合物;含碳化合物;含卤素化合物2、辐射逆温层Radiation inversion对流层大气的重要热源是来自地面的长波辐射,故离地面越近气温越高;离地面越远气温越低。
随高度升高气温的降低率称为大气垂直递减率:Γ=-dT/dz T—热力学温度K, z—高度当Γ=0 时,称为等温气层;当Γ<0 时,称为逆温气层。
这时气层稳定性强,对大气的垂直运动的发展起着阻碍作用。
根据逆温形成的过程不同,可分为两种:近地面层的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温;自由大气的逆温:乱流逆温、下沉逆温、锋面逆温气块在大气中的稳定度与大气垂直递减率(Γ)和干绝热垂直递减率(Γd)两者有关。
若Γ<Γd,表明大气是稳定的;若Γ>Γd,大气是不稳定;若Γ=Γd,大气处于平衡状态。
环境化学 第二章 大气环境化学

大气中重要吸光物质的光离解
4 3
(1) O2和N2的光离解
2
1 O2键能493.8KJ/mol。相 应波长为243nm。在紫外区 lgε 0 120-240nm有吸收。
O2 + hν
λ < 240 nm
-1 -2
O· + O·
N2键能:939.4KJ/mol。 对应的波长为127nm。
-3
-4
HNO
3
h ν HO NO
2
2
HO CO CO
H
2
H O 2 M HO 2HO
2
M
(有CO存在时)
H 2O 2 O 2
产生过氧自由基和过氧化氢
(5) SO2对光的吸收
SO2的键能为545.1kJ/mol, 吸收光谱 中呈现三条吸收带,键能大,240 - 400 nm 的光不能使其离解,只能生成激发态:
思考题:
太阳的发射光谱 和地面测得的太阳光 谱是否相同?为什么?
3.3大气中重要自由基来源
自由基 由于在其电子壳层的外层有
一个不成对的电子,因而有很高的活 性,具有强氧化作用。如:
CH 3 C(O)H hv H 3 C HCO
由于高层大气十分稀薄,自由基的半 衰期可以是几分钟或更长时间。自由基参 加反应,每次反应的产物之一是自由基, 最后通过另一个自由基反应使链终止,如:
SO 2 h SO 2
*
240 400 nm
SO2*在污染大气中可参与许多光化学反应。
( P73,图2-32)
(6) 甲醛的光离解
HCHO中H-CHO的键能为 356.5 kJ/mol, 它对 240 – 360 nm 范围内的光有吸收, 吸光后的光解反应为:
环境化学期末复习资料
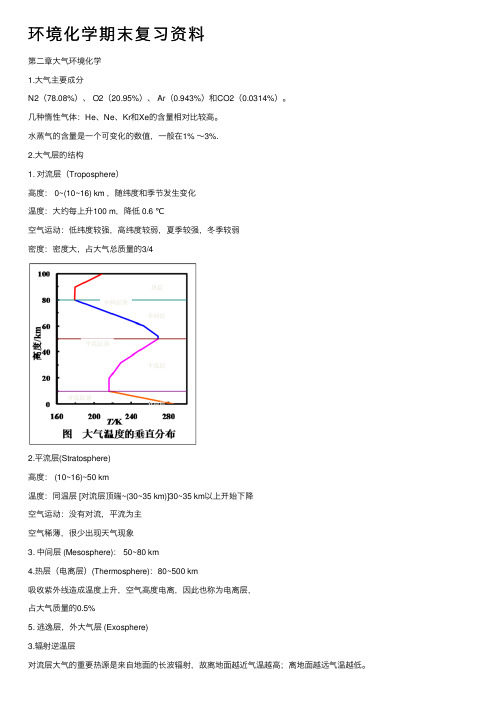
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
环境化学课件第二章 大气环境化学

O2
0.21
Ar
0.093
H2O
<0.0001-0.04
CO2
370 ppm
CH4
1.7 ppm
O3
10 ppb – 10 ppm
CO
50 ppb – 300 ppb
NOx
5 ppb – 1 ppt
OH
< 1 ppt
• Typical units Number concentration: molecules cm-3 Mixing ratio: ppm, ppb, ppt
➢ 固体悬浮粒子:来自工业烟尘、火山喷尘和海浪 飞逸的盐质等,包括降尘和飘尘。
0.035 0.93
0.01
20.94
氮
氮
氧
氧
氩
氩
78.09
二氧化碳
二氧化碳
稀有气体
稀有气体
99.9
空气的主要成分
TYPICAL ATMOSPHERIC COMPOSITION
(mole fraction)
N2
0.78
纬度地区为10~12km,两极附近为8~9km。
➢ 随季节变化夏季较厚,冬季较薄。
对流层(troposphere)
特点:
气温随高度升高而降低: 大气垂直递减率:随高度升高气温的降低率。表征 大气的温度层结。 dT dz
式中 T――绝对温度,K; z――高度。
在对流层中,dT/dz<0,且Γ=0.6K/100m,即每 升高100m,温度降低0.6℃。
输出速度
消耗
转化为 其它物质
循环
大气是一个流动体系和循环体系。 气体组分的寿命少则几小时, 多则达百万年以上。 这与组分的性质、储量及迁出或循环的途径等有密切关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章大气环境化学1、大气成分:按浓度分成三大类:(1)主要成分,浓度在1%以上量级,包括氮(N2),氧(O2)和氩(Ar);(2)微量成分(也称次要成分),浓度在1ppmv到1%之间,包括二氧化碳(CO2),水汽(H2O),甲烷(CH4),氦(He), 氖(Ne),氪(Kr)等;(3)痕量成分,浓度在1ppmv以下,主要有氢(H2),臭氧(O3),氙(Xe),一氧化二氮(N2O),氧化氮(NO),二氧化氮(NO2),氨气(NH3),二氧化硫(SO2),一氧化碳(CO)以及气溶胶等等。
此外,还有一些大气中本来没有的,纯属人为产生的污染成分,它们目前在大气中的浓度多为pptv的量级,如氟氯烃类化合物(常记为CFCs)等。
2、大气层的结构:对流层、平流层、中间层、热层、逸散层对流层特性:由于对流层大气的重要热源来自于地面长波辐射,因此离地面越近气温越高;离地面越远气温则越低。
在对流层中,高度每增加100m,气温降低0.6℃。
云雨的主要发生层,赤道厚两极薄。
平流层特征:在平流层内,大气温度上热下冷,空气难以发生垂直对流运动,只能随地球自转产生平流运动,平流层气体状态非常稳定。
在平流层内,进入的污染物因平流运动形成一薄层而遍布全球。
中间层特征:在中间层中,由于层内热源仅来自下部的平流层,因而气温随高度增加而降低,温度垂直分布特征与对流层相似;由于下热上冷,空气垂直运动强烈。
热层特征:在热层中,温度随高度增加迅速上升。
热层空气极稀薄,在太阳紫外线和宇宙射线辐射下,空气处于高度电离状态,该层也可以称为电离层。
逸散层:800km以上高空;空气稀薄,密度几乎与太空相同;空气分子受地球引力极小,所以气体及其微粒可以不断从该层逃逸出去。
3、逆温由于过程的不同,可分为近地面的逆温、自由大气逆温。
近地面的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温自由大气逆温:乱流逆温、下沉逆温、锋面逆温逆温的危害:在对流层中,由于低层空气受热不均,能够使气体发生垂直对流运动,致使对流层上下空气发生交换。
通过垂直对流运动,污染源排放的污染物能够被输送到远方,并由于分散作用而使污染物浓度降低。
逆温现象经常发生在较低气层中,这时气层稳定性特强,对于大气中垂直运动的发展起着阻碍作用,对大气垂直流动形成巨大障碍,地面气流不易上升,使地面污染源排放出来的污染物难以借气流上升而扩散。
4、气团的稳定性与密度层结和温度层结两个因素有关。
5、大气污染源:自然因素:火山喷发:排放出SO2、H2S、CO2、CO、HF及火山灰等颗粒物;森林火灾:排放出CO、CO2、SO2、NO2;自然尘(风砂、土壤尘);海浪飞沫:颗粒物主要为硫酸盐与亚硫酸盐。
人为因素:工厂企业废气排放;交通运输:飞机、机动车、轮船尾气;燃油燃煤(农村炉灶);农业活动(农药喷洒)。
6、大气中有哪些重要污染物及分类定义:大气污染物是指由于人类的活动或是自然过程所直接排入大气或在大气中新转化生成的对人或环境产生有害影响的物质。
城市中影响健康的主要大气污染物是二氧化硫(及进一步氧化产物三氧化硫、硫酸盐)、悬浮颗粒物(烟雾、灰尘、PM10、PM2.5、PM1.0)、氮氧化物、一氧化碳、挥发性有机化合物(碳氢化合物和氧化物)、臭氧、铅和其他有毒金属。
分类:大气污染物按存在形式分可分为气态污染物和颗粒态污染物;大气污染物按形成过程又可以分为一次污染物和二次污染物。
一次污染物:是指由污染源直接排入大气环境中且在大气中物理和化学性质均未发生变化的污染物,又称为原发性污染物:二次污染物:指由一次污染物与大气中已有成分或几种污染物之间经过一系列的化学或光化学反应而生成的与一次污染物性质不同的新污染物,又称为继发性污染物。
7、重要污染物来源及消除途径二氧化硫:燃烧。
降水清除:雨除、冲刷;气相或液相氧化成硫酸盐;土壤:微生物降解、物理和化学反应、吸收;植被:表面吸收、消化摄取;海洋、河流:吸收硫化氢:火山喷射、海水浪花、生物活动等。
氧化为二氧化硫(写去除反应)臭氧:在植被、土壤、雪和海洋表面上的化学反应氮氧化物:燃烧、尾气排放。
土壤:化学反应;植被:吸收、消化摄取;气相或液相化学反应一氧化碳:不完全燃烧。
平流层:与OH自由基反应;土壤:微生物活动;二氧化碳植被:光合作用,吸收;海洋:吸收甲烷:燃烧、泄露、发酵。
土壤:微生物活动;植被:化学反应、细菌活动;对流层及平流层:化学反应碳氢化合物:向颗粒物转化;土壤:微生物活动;植被:吸收、消化摄取8、影响大气污染物迁移的因素由染源排到大气中的污染物的迁移主要受到空气的机械运动、由天气形势和地理地势造成的逆温现象以及污染物本身的特性。
9、基本气象要素:气温、气压、湿度、风、云量10、燃烧过程中NO的生成量主要与燃烧温度和空燃比有关11、CFC-11和Halon1211d分子式分别为CFCl3 和CF2ClBr12、大气中的CH4主要来自煤、石油、天然气的排放。
13、大气中有哪些重要自由基?其来源如何?(产生:热裂解法、光解法、氧化还原法)大气中主要自由基有:HO、HO2、R、RO2HO的来源:①O3的光解:O3+hr O+O2O+H2O 2HO②HNO2的光解:HNO2 +hr HO +NO③H2O2的光解:H2O2+hr 2HO清洁大气中HO.来源是O3,污染大气来源是HNO3和H2O。
HO2的来源:①主要来自醛特别是甲醛的光解H2CO +hr H + HCOHO2 + MH + O2 + MHCO + O2 +M HO2 + CO + MCH3O + NO②亚硝酸酯的光解:CH3ONO +hrCH3O + O2HO2 + H2CO③H2O2的光解:H2O2+hr 2HOHO + H2O2HO2 + H2OR的来源:RH + O R + HORH + HO R + H2OCH3的来源:CH3CHO的光解 CH3CHO +hr C H3 + CHOCH3COCH3的光解 CH3COCH3 +hr CH3 + CH3COCH3O的来源:甲基亚硝酸酯的光解 CH3ONO +hr CH3O + NO甲基硝酸酯的光解 CH3ONO2 +hr CH3O + NO2 RO2的来源:R + O2 RO214、叙述大气中NO转化为NO2的各种途径。
①NO + O3NO2 + O2②HO + RH R + H2OR + O2 RO2NO + RO 2 NO 2 + ROR`CHO + HO 2 (R`比R 少一个C 原子)RO + O 2 NO + HO 2 NO 2 + HO15、氮循环主要通过 同化、 氨化、 硝化 和 反硝化等四个生物化学过程完成。
16、分子、原子、自由基或离子吸收光子而发生的化学反应称光化学反应,大气光化学反应分为初级过程和次级过程。
(光化学第一定律)当激发态分子的能量足够使分子内的化学键断裂,即光子的能量大于化学键时才能引起光离解反应。
其次,为使分子产生有效的光化学反应,光还必须被所作用的分子吸收,即分子对某特定波长的光要有特征吸收光谱,才能产生光化学反应。
(光化学第二定律)光被分子吸收的过程是单光子过程,由于电子激发态 分子的寿命<10-8s ,在如此短的时间内,辐射强度比较弱的情况下,只可能单光子过程,再吸收第二个光子的几率很小。
17、大气中重要吸光物质的光离解(1) O 2、N 2的光离解N 2的光离解限于臭氧层以上(2) O 3的光离解(3)NO 2的光离解据称是大气中唯一已知O3的人为来源(4) HNO 2、 HNO 3的光解初级过程次级过程HNO 2的光解是大气中HO 的重要来源之一。
(5) 甲醛的光离解初级过程对流层中由于有O 2的存在,可进一步反应醛类光解是氢过氧自由基(H02 · )的主要来源(6)卤代烃的光解如果有一种以上的卤素,则断裂的是最弱的键。
CH 3-F> CH 3-H> CH 3-Cl> CH 3-Br> CH 3-I18、含有NOx 和CH 化合物等一次污染物的大气,在阳光的照射下发生光化学反应而产生⋅+⋅→+O O h O ν2⋅+⋅→+N N h N ν223O O h O +⋅→+ν⋅+→+O NO h NO ν232O M O O →++⋅NO HO h HNO +⋅→+ν222NO H h HNO +⋅→+ν2HNO NO HO →+⋅32222HNO NO HO NO O H HNO HO →+⋅+→+⋅CO H h HCHO HCO H h HCHO +→+⋅+⋅→+2νν⋅→+⋅22HO O H CO HO O HCO +⋅→+⋅22二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾。
(控制:控制反应活性高的有机物的排放;控制臭氧的浓度)特征:蓝色烟雾,强氧化性,具有强刺激性,使大气能见度降低,在白天生成傍晚消失, 高峰在中午。
光化学烟雾形成的简单机制光化学烟雾形成反应是一个链反应,链的引发主要是NO 2的光解。
引发反应:自由基传递:碳氢化合物的存在是自由基转化和增殖的根本原因:过氧酰基 终止:19、说明烃类在光化学烟雾形成过程中的重要作用。
烷烃可与大气中的HO 和O 发生摘氢反应。
RH + HO R + H 2ORH + O R + HOR + O 2 RO 2RO 2 + NO RO + NO 2RO + O 2 R`CHO + HO 2RO + NO 2 RONO 2另外:RO 2 + HO 2 ROOH + O 2ROOH +hr RO + HO稀烃可与HO 发生加成反应,从而生成带有羟基的自由基。
它可与空气中的O 2结合成相应的过氧自由基,由于它有强氧化性,可将NO 氧化成NO 2,自身分解为一个醛和CH 2OH 。
如乙烯和丙稀。
CH = CH + HO CH 2CH 2OHCH 3CH = CH 2 CH 3CHCH 2OH + CH 3CH(OH)CH 2CH 2CH 2OH + O 2 CH 2(O 2)CH 2OHCH 2(O 2)CH 2OH + NO CH 2(O)CH 2OH + NO 2CH 2(O)CH 2OH CH 2O + CH 2OHCH 2(O)CH 2OH + O 2 HCOCH 2OH + HO 2223322O NO O NO M O M O O O NO h NO +→++→++⋅⋅+→+ν()()2222222222222222CO RO NO NO O O RC RO NO NO RO HO NO NO HO CO HO RO h RCHO OH O O RC HO RCHO O O O +⋅+→+⋅⋅+−→−+⋅⋅+→+⋅+⋅+⋅−−→−++⋅−→−⋅+νO H RO HO RH O 222+⋅−→−⋅+32HNO NO HO→+⋅()()()()22222222NO O O RC NO O O RC NO O O RC NO O O RC +⋅→→+⋅CH2OH + O2H2CO + HO2稀烃还可与O3发生反应,生成二元自由基,该自由基氧化性强,可氧化NO和SO2等生成相应的醛和酮。
