(修改)04.全程C反应蛋白(CRP)测定试剂盒(荧光免疫层析法)工艺规程
全程C-反应蛋白(CRP)测定试剂盒(量子点荧光免疫层析法)产品技术要求lanshizi

全程C-反应蛋白(CRP)测定试剂盒(量子点荧光免疫层析法)适用范围:用于体外定量测定人血清、血浆、全血中C-反应蛋白的含量。
1.1 包装规格10人份/盒,20人份/盒,25人份/盒,30人份/盒,40人份/盒,50人份/盒。
1.2 主要组成成分2.1 物理性状2.1.1外观试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
2.1.2 膜条宽度产品的膜条宽度应≥2.5 mm。
2.1.3 液体移行速度液体移行速度应不低于10 mm/min。
2.1.4 净含量试剂盒中稀释液净含量的相对偏差应不超过±15%。
2.2 检出限应不高于0.5 mg/L。
2.3 准确度用CRP有证参考物质ERM-DA474/IFCC作为样本进行测定,其测量结果的相对偏差应不超过±15%。
2.4 线性在线性区间 [0.5,200] mg/L内,线性相关系数r应不小于0.990。
2.5 重复性在线性范围内,选择(1±0.1)mg/L和(10±1)mg/L浓度水平的样本,浓度选择参考医学决定水平,代表正常值和异常值水平。
各重复检测10次,其变异系数(CV)应不大于15%。
2.6 批间差用三个批号的试剂盒分别选择(1±0.1)mg/L和(10±1)mg/L浓度水平的样本,则三个批号试剂盒之间的批间相对极差应不大于15%。
2.7 效期稳定性4℃~30℃保存,有效期为24个月。
取到期后2~3个月的试剂盒进行测定,测定结果应符合2.2、2.3、2.4、2.5项的要求。
超敏C反应蛋白(hs-CRP)测定试剂盒(荧光免疫层析法)产品技术要求puenguangde
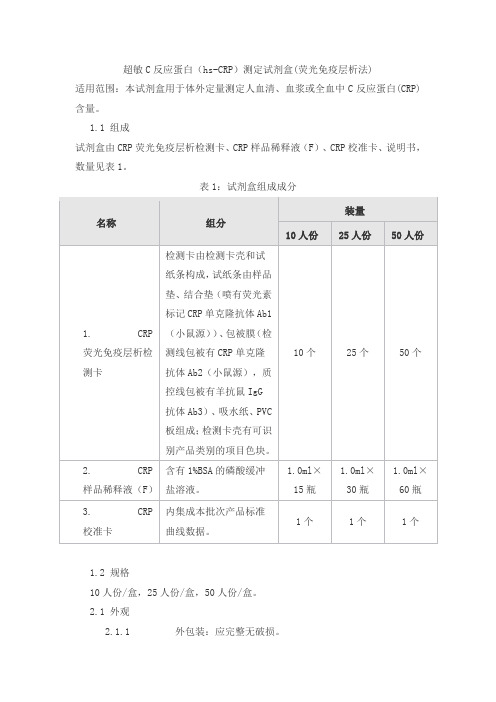
超敏C反应蛋白(hs-CRP)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中C反应蛋白(CRP)含量。
1.1 组成试剂盒由CRP荧光免疫层析检测卡、CRP样品稀释液(F)、CRP校准卡、说明书,数量见表1。
表1:试剂盒组成成分1.2 规格10人份/盒,25人份/盒,50人份/盒。
2.1 外观2.1.1 外包装:应完整无破损。
2.1.2 液体组份:应澄清透明,无沉淀、无渗漏。
2.1.3 检测卡:应整洁完整、无毛刺、无破损、无污染,保持密封真空包装。
2.2 物理性状2.2.1 试纸条宽度:应不小于2.5mm。
2.2.2 液体移行速度:应不低于10mm/min。
2.3 空白检出限空白检出限浓度应不高于2.5ng/ml。
2.4 线性范围在[0.5~64]mg/L范围内线性相关系数r≥0.990;线性区间[0.5-3.0]mg/L内,绝对偏差应不超过±0.45mg/L;线性区间(3.0-64]mg/L内,相对偏差应不超过±15%。
2.5 精密度2.5.1 重复性变异系数CV应不超于10%。
2.5.2 批间差相对极差R应不超于15%。
2.6 准确度将已知浓度的纯品加入到低浓度血清样品基质中,其回收率应在85%~115%之间。
2.7 分析特异性测定含有胆红素、血红蛋白、甘油三酯三个物质的血清样本,用CRP血清样本按表2所示规定浓度进行交叉反应物的稀释,相对偏差应在15%范围内。
表1:交叉反应物及浓度列表2.8 定量限试剂盒定量限为0.5mg/L,变异系数(CV)应不大于20%。
2.9 效期稳定性试验试剂盒2℃-30℃储存,有效期为3个月,效期后检定结果应符合2.2、2.3、2.4、2.5.1、2.6、2.8项要求。
全量程C反应蛋白测定试剂盒产品技术要求

全量程C反应蛋白测定试剂盒产品技术要求全量程C反应蛋白测定试剂盒是一种用于检测体内C反应蛋白水平的试剂盒。
C反应蛋白是一种非特异性炎症标志物,广泛应用于临床诊断、疾病监测和预后判断。
全量程C反应蛋白测定试剂盒采用荧光免疫层析法,具有高灵敏度、高特异性和广泛的线性测量范围等优点。
为了确保试剂盒的性能和质量稳定,以下是全量程C反应蛋白测定试剂盒的产品技术要求。
一、试剂盒的主要组成1.标本预处理试剂:用于处理样品,去除干扰物质,提取和纯化C反应蛋白。
2.检测试剂盒:包括检测试剂盒板、标准品、检测缓冲液、生物素抗体、HRP标记物、底物溶液、停止溶液等。
二、试剂盒的性能指标1. 灵敏度:试剂盒的灵敏度是指能够准确测量的最低C反应蛋白浓度。
灵敏度应达到或低于临床常见的C反应蛋白浓度范围,常用单位为mg/L。
2.线性范围:试剂盒应具有广泛的线性测量范围,能够准确测量体内不同浓度的C反应蛋白。
线性范围应能够涵盖正常范围内的浓度以及高浓度的样品。
3.特异性:试剂盒应具有高特异性,能够识别和测量C反应蛋白而不受其他蛋白质的干扰。
在存在其他蛋白质的情况下,试剂盒的测量结果应能够准确反映C反应蛋白的浓度。
4.重复性和精密度:试剂盒应具有较低的测量变异性和良好的重复性,重复测量同一样品应具有较小的测量偏差。
5.操作简便性:试剂盒应操作简便,无需复杂的样品处理步骤,并且能够在短时间内完成测量。
试剂盒的使用说明应详细清晰,操作过程易于理解。
6.稳定性:试剂盒在适当的储存条件下应具有较长的保存期限,并且测量结果不易受到存储时间和温度等因素的影响。
三、试剂盒的质量控制要求1.试剂盒应具有完善的质量控制系统,包括标准样品和质控样品的使用和管理。
试剂盒的标准品应具有稳定的浓度和良好的一致性。
2.试剂盒的生产过程应符合相关的质量管理标准和规定,包括原材料的选择和检验、生产工艺的控制、产品的包装和质检等环节。
3.试剂盒的销售商应提供售后服务和技术支持,对使用中出现的问题进行解答和处理,并及时提供相关的技术资料和指导。
c反应蛋白荧光免疫层析国标

c反应蛋白荧光免疫层析国标c反应蛋白(C-reactive protein,CRP)是一种由肝脏合成的血浆蛋白,是一种急性相应蛋白。
它最早是在1930年由美国科学家波尔尼斯基(Tillet and Francis)发现并命名。
CRP的合成与释放主要受到肝脏细胞的刺激,特别是在感染、炎症和组织损伤等病理状态下,其合成速度和含量都会显著增加。
CRP是一种典型的急性相应蛋白,其浓度可在感染、炎症和组织损伤等病理状态下迅速升高。
因此,CRP被广泛应用于临床诊断和疾病监测中。
特别是在感染性疾病的早期诊断、炎症反应的监测以及心血管疾病的风险评估等方面具有重要价值。
荧光免疫层析(Fluorescent Immunoassay)是一种常用的检测方法,可以用于检测CRP的浓度。
该方法利用荧光标记的抗体与待测样品中的CRP结合,并通过荧光信号的强弱来判断CRP的浓度。
荧光免疫层析具有灵敏度高、特异性强、操作简便等优点,因此在临床实验室中得到了广泛应用。
根据国际标准,正常人的CRP浓度通常很低,一般在0-10mg/L之间。
而在感染、炎症和组织损伤等病理状态下,CRP浓度会显著升高。
根据CRP的浓度水平,可以将其分为以下几个等级:1. 低风险:CRP浓度小于1 mg/L,表示患者处于低风险状态,一般不需要进一步检查和治疗。
2. 中风险:CRP浓度在1-3 mg/L之间,表示患者处于中等风险状态,可能存在轻微的感染或炎症反应,需要进一步观察和检查。
3. 高风险:CRP浓度大于3 mg/L,表示患者处于高风险状态,可能存在严重的感染、炎症或组织损伤等情况,需要进一步检查和治疗。
荧光免疫层析国标是针对CRP检测方法的标准化要求。
该标准主要包括以下几个方面:1. 样品处理:要求对待测样品进行适当的处理,以保证样品中CRP的稳定性和活性。
2. 试剂准备:要求对荧光标记抗体和其他试剂进行准确配制,并保证其质量稳定。
3. 检测方法:要求使用合适的荧光免疫层析方法进行CRP的检测,并保证其准确性和可靠性。
全量程C反应蛋白测定试剂盒(荧光免疫层析法)产品技术要求

全量程C反应蛋白测定试剂盒(荧光免疫层析法)结构组成:每盒含10/20/50人份的试纸条、样品缓冲液(主要成分:0.01mol/L 的PBS缓冲液,pH:7.4±0.2,装量:1mL×10支/1mL×20支/1mL×50支)和标曲信息卡。
每人份试纸条含1份检测卡、1套取样滴管(选配)和1包干燥剂。
检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗人C反应蛋白单克隆抗体,C线包被羊抗鼠多克隆抗体)、荧光垫(包被荧光标记的鼠抗人C反应蛋白单克隆抗体)、吸水纸、塑料载板组成。
预期用途:本产品用于体外定量测定全血、血清或血浆中C反应蛋白(CRP)含量。
1.1包装规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分每盒含10/20/50人份的试纸条、样品缓冲液(主要成分:0.01mol/L的PBS缓冲液,pH:7.4±0.2,装量:1mL×10支/1mL×20支/1mL×50支)和标曲信息卡。
每人份试纸条含1份检测卡、1套取样滴管(选配)和1包干燥剂。
检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗人C反应蛋白单克隆抗体,C线包被羊抗鼠多克隆抗体)、荧光垫(包被荧光标记的鼠抗人C反应蛋白单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1外观测定试剂应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2膜条宽度测定试剂的膜条宽度≥2.5 mm。
2.1.3液体移行速度液体移行速度应不低于10 mm/min。
2.2空白限空白限应不高于0.5mg/L。
2.3重复性分别检测低、中、高3个浓度的样本,变异系数(CV)应不高于15.0%。
2.4批间差用3个批号试剂分别检测低、中、高浓度的样本,相对极差(R)应不高于15.0%。
2.5线性在[0.5,150]mg/L的范围内,线性相关系数应不低于0.990。
全程C—反应蛋白(hsCRP+常规CRP)测定试剂(荧光免疫层析法)产品技术要求广州万孚生物技术

全程C-反应蛋白(hsCRP+常规CRP)测定试剂
(荧光免疫层析法)
1.性能指标
2.1 外观检查
外观应平整,材料附着应牢固,各组份应齐全,卡固定紧密。
2.2 物理检查
膜条应宽于4.0mm;液体移行速度应不低于10mm/min。
2.3 准确度
对C-反应蛋白浓度分别为0.5mg/L、5.0mg/L、10.0mg/L、20.0mg/L、50.0mg/L的参考品进行测定,检测浓度为0.5mg/L~5mg/L时,结果误差应在±20%内;检测浓度为5mg/L~200mg/L时,结果误差应在±15%内。
2.4 线性范围
对C-反应蛋白浓度分别为0.5mg/L、5.0mg/L、10.0mg/L、20.0mg/L、50.0mg/L、100.0mg/L的参考品进行测定,每份参考品重复检测三次,计算出直线方程y=a+bx,以及相关系数r,其中r值应≥0.9900。
2.5 灵敏度
对C-反应蛋白灵敏度参考品进行测定,最低检出限应不高于0.5mg/L。
2.6 精密度
2.6.1 批内精密度
随机抽取同一批号的C-反应蛋白检测试剂10份,分别对浓度为10.0mg/L的C-反应蛋白参考品进行测定,变异系数CV(%)值应≤15%。
2.6.2 批间精密度
随机抽取连续三个批号的试剂,每个批号取3份分别对浓度为10.0mg/L的C-反应蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
1。
一种全程定量检测C-反应蛋白的荧光免疫层析方法及其试剂盒[发明专利]
![一种全程定量检测C-反应蛋白的荧光免疫层析方法及其试剂盒[发明专利]](https://img.taocdn.com/s3/m/ddbbfb8464ce0508763231126edb6f1aff0071a4.png)
(10)申请公布号 CN 102539785 A(43)申请公布日 2012.07.04C N 102539785 A*CN102539785A*(21)申请号 201110451637.9(22)申请日 2011.12.29G01N 33/68(2006.01)G01N 21/64(2006.01)(71)申请人深圳康美生物科技股份有限公司地址518057 广东省深圳市南山区科丰路二号通讯工业大厦二楼东侧一号(72)发明人王秀利(74)专利代理机构深圳市深佳知识产权代理事务所(普通合伙) 44285代理人唐华明(54)发明名称一种全程定量检测C-反应蛋白的荧光免疫层析方法及其试剂盒(57)摘要本发明公开了一种全程定量检测C-反应蛋白(CRP)的荧光免疫层析方法及其试剂盒。
本发明的全程定量检测CRP 荧光免疫层析方法是利用量子点的优良荧光特性,结合双色标记技术及免疫层析技术,在优化试纸条各组成部件基础上,实现的荧光定量检测。
与常规胶体金免疫层析方法相比,本发明具有标记稳定性好、非特异性低、灵敏度高、线性范围宽以及定量准确的优势。
本发明试剂盒可对CRP 进行全程定量,即可同时对感染性疾病、抗生素疗效,及心脑血管疾病进行预测评估,适用于各级医院,特别有助于在基层医院及诊所的广泛推广。
(51)Int.Cl.权利要求书2页 说明书9页 附图2页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 2 页 说明书 9 页 附图 2 页1.一种全程定量检测C-反应蛋白的荧光免疫层析方法,其特征在于,包括以下步骤:步骤1)用化学交联或生物分子间特异性作用将C-反应蛋白的特异性抗体连接到量子点表面,得到抗体修饰的量子点,所述抗体修饰的量子点的发射波长范围为550~1300nm;步骤2)将步骤1)得到的抗体修饰的量子点固定在标记垫上,且标记垫上同时固定有质控分子修饰的量子点,所述质控分子修饰的量子点的发射波长与步骤1)得到的抗体修饰的量子点的发射波长不同,且波长范围为550~1300nm,在层析膜上分别设有定量带和质控带,其中质控带固定有能与所述质控分子特异性结合的生物分子,定量带固定有对应C-反应蛋白的与步骤1)所述特异性抗体不同抗原决定簇的特异性抗体;步骤3)以样品垫、标记垫、层析膜、吸水垫和底板构建成荧光免疫层析试纸条,其中所述层析膜为弱荧光层析膜,底板具低荧光特性;步骤4)试纸条免疫层析后,检测定量带和质控带的荧光信号强度,并以质控带荧光信号强度校正定量带的荧光信号强度,进而实现C-反应蛋白的定量检测。
全量程C反应蛋白测定试剂盒(免疫荧光层析法)产品技术要求注册版

医疗器械产品技术要求编号:全量程C反应蛋白测定试剂盒(免疫荧光层析法)1. 产品型号/规格及其划分说明1.1 型号规格25人份/盒1.2 组成试剂盒主要由测试卡、样本缓冲液、信息卡组成。
测试卡:由荧光垫(包被有荧光标记的CRP单克隆鼠源抗体)、硝酸纤维素膜(包被有CRP单克隆鼠源抗体)、吸水纸、PVC底板组成;样本缓冲液:磷酸盐缓冲液;信息卡:记载本批次试剂的标准曲线信息。
1.3 适用范围用于体外定量检测人血清、血浆、全血样本中C反应蛋白的含量,主要作为一种非特异性炎症指标和用于评价心血管疾病风险。
1.性能指标1.1外观试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
测试卡的外观应符合下列要求:a)测试卡应平整,边缘无毛刺;b)测试卡外观整齐、色泽均匀、不能有色斑或污渍。
1.2物理检测1.2.1试纸条宽度试纸条宽度应不小于 2.5mm。
1.2.2液体移行速度液体移行速度应不低于10mm/min。
1.3试剂装量全量程CRP 样本缓冲液装量为 1.00mL,相对偏差不超过±5.0%。
1.4准确度使用C 反应蛋白国家标准品(产品编号:360039)稀释为浓度(1.00±0.10)mg/L、(10.00±1.00)mg/L、(36.00±3.60)mg/L 的参考品进行测定,相对偏差应不超过±10.0%。
1.5线性在所规定的线性范围[0.50,200.00]mg/L 内:a)线性相关系数(r)应不小于0.9900;b)[0.50,5.00]mg/L 区间内,线性绝对偏差(D i)应不超过±0.50mg/L。
(5.00,200.00]mg/L 区间内,线性相对偏差(R i)应不超过±10.0%。
1.6重复性抽取同一批次试剂盒,分别对(1.00±0.10)mg/L、(10.00±1.00)mg/L、(36.00±3.60)mg/L 参考品进行测定,各重复测定10 次,变异系数(CV)应不大于10.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
文件名称: 全程C反应蛋白(CRP)测定试剂盒文件编号:(荧光免疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控编制人:日期:年月日审核人:日期:年月日批准人:日期:年月日生效日期:年月日颁发部门:质量部颁发份数: 2 份分发部门:生产部、质量部受控编号:全程C反应蛋白(CRP)测定试剂盒(荧光免疫层析法)1.产品名称、剂型、注册分类、规格、定义、组成及用途中文名称:全程C反应蛋白(CRP)测定试剂盒(荧光免疫层析法)规格:25人份/盒、40人份/盒剂型:诊断试剂注册分类:二类6840体外诊断试剂定义、组成及预期用途:本产品采用高度特异性的抗原抗体反应及免疫层析分析技术,通过夹心法检测原理来体外定量测定人血清、血浆样本中C反应蛋白(CRP)的含量。
依据:《全程C反应蛋白(CRP)测定试剂盒(荧光免疫层析法)产品技术要求》文件名称: 全程C反应蛋白(CRP)测定试剂盒文件编号:(荧光免疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控目录1.生产工艺流程图2.试剂卡制备生产工艺3.质量控制点4.主要原辅料、包装材料消耗定额、能源消耗定额、物料平衡的计算方法5.包装要求、标签、说明书(附样本)与产品贮存方法及有效期6.设备一览表7.技术安全及劳动保护文件名称: 全程C 反应蛋白(CRP )测定试剂盒(荧光免疫层析法)工艺规程 文件编号:版本/修改状态: V1.0/00受控状态: 受 控1. CRP 生产工艺流程图羊抗兔IgG 抗体鼠抗C 反应蛋白抗体包被液配制(C 线)包被液配制(T 线)划线(NC 膜)BSA 及其他化学试剂贴膜组装探针稀释液配制样品垫制作 # ★BSA 及其他化学试剂样本稀释液配制分装★切条样品垫处理NC 膜干燥 # ★压卡装袋贴签、组装成品检验烧数据卡化学试剂合格入库不合格品控制十万级洁净区十万级洁净区干燥 环境#★:关键工序◇:质量控制点#:湿度≤30%半成品检验合格十万级洁净区干燥环境 #标准曲线制作合格不合格兔IgG 抗体微球偶联物鼠抗人CRP 抗体微球偶联物BSA 及其他化学试剂样品垫处理液配制探针配制....半成品检验不合格品控制不合格不合格品控制不合格合格不合格品控制不合格半成品检验万级洁净区文件名称: 全程C 反应蛋白(CRP )测定试剂盒(荧光免疫层析法)工艺规程 文件编号:版本/修改状态: V1.0/00受控状态: 受 控2. 试剂卡制备生产工艺2.1工序一:样品垫制作 2.2工序二:NC膜制备 2.3工序三:样本稀释液制备 2.4工序四: 贴膜组装 2.5工序五: 切条 2.6工序六:压卡装袋 2.7工序七:烧数据卡2.8工序八:全程C 反应蛋白(CRP )测定试剂盒(荧光免疫层析法)试剂盒组装2.1 工序一:样品垫制作 2.1.1 探针稀释液 2.1.1.1 标准配方名称 物料名称 配制1000ml 使用量75人份使用量探针稀释液三羟甲基氨基甲烷2.4228g0.12ml调节PH=8.4±0.2 蔗糖 150g 牛血清白蛋白 5g proclin3000.3ml纯化水定容至1000ml2.1.1.2 配制方法按照标准配方准确称取三羟甲基氨基甲烷2.4228g ,放入洁净烧杯中,加纯化水800ml ,放入1个洁净的磁力搅拌子,置磁力搅拌器上搅拌至充分溶解后,使用多参数测试仪测量PH 值应在8.4±0.2范围内,再依次加入蔗糖150g 、牛血清白蛋白5g 、proclin300 0.3ml ,置磁力搅拌器上搅拌至充分溶解后,将溶液缓缓倒入容积为1000ml 的容量瓶中,用纯化水反复冲洗3次烧杯,所有溶液倒入上述容量瓶中,用纯化水定容至1000ml 。
混合均匀4~30℃保存备用,有效期7天。
2.1.2 样品垫处理液 2.1.2.1 标准配方文件名称: 全程C 反应蛋白(CRP )测定试剂盒(荧光免疫层析法)工艺规程 文件编号:版本/修改状态: V1.0/00受控状态: 受 控名称 物料名称 配制1000ml 使用量75人份使用量样品垫处理液十二水合磷酸氢二钠 5.73g 40ml 二水合磷酸二氢钠0.62g调节PH=7.4±0.2 纯化水定容至1000ml2.1.2.2 配制方法按照标准配方分别准确称取十二水合磷酸氢二钠5.73g 、二水合磷酸二氢钠0.62g ,放入洁净烧杯中,加纯化水800ml ,放入1个洁净的磁力搅拌子,置磁力搅拌器上搅拌至充分溶解后,使用多参数测试仪测量PH 值应在7.4±0.2范围内,将充分溶解并调好pH 的溶液缓缓倒入容积为1000ml 的容量瓶中,用纯化水反复冲洗3次烧杯,所有溶液倒入上述容量瓶中,用纯化水定容至1000ml ,混合均匀4~30℃保存备用,有效期7天。
2.1.3 样品垫制作 2.1.3.1样品垫处理(1) 将玻璃纤维平铺到水平槽内,倒入足量样品垫处理液,应让玻璃纤维完全浸泡入样品垫处理液中; (2)浸泡至少15分钟,保证玻璃纤维完全浸透,玻璃纤维表面无气泡; (3)玻璃纤维浸透后,将玻璃纤维取出,45度恒温干燥4-6小时; (4)干燥完成后4~30℃封存备用,有效期7天。
2.1.3.2样品垫制作(1)处理后的样品垫裁切成29mm 宽度;(2)按照兔IgG 抗体微球偶联物:鼠抗人CRP 抗体微球偶联物:探针稀释液=1:3:20的比例配制探针溶液; (3)按4ul/cm 喷量,将配制好的探针溶液均匀喷点到已裁切的样品垫上。
(4)在45度恒温干燥、湿度小于30%的环境下干燥4-6小时。
注:干燥湿度的控制是本岗位的工艺要点之一,湿度应控制在30%以下。
(5)干燥完成后4~30℃封存备用,有效期14个月。
注:干燥后应避免长时间放置于4~30℃环境。
2.2工序二:NC膜制备 2.2.1 包被液 2.2.1.1标准配方名称物料名称配制1000ml 使用量 75人份使用量文件名称: 全程C 反应蛋白(CRP )测定试剂盒(荧光免疫层析法)工艺规程 文件编号:版本/修改状态: V1.0/00受控状态: 受 控包被液磷酸氢二钾 1.82g 0.06ml二水合磷酸二氢钠0.22g氯化钠 8.76g调节PH=7.2±0.2 蔗糖30g纯化水定容至1000ml2.2.1.2配制方法按照标准配方分别准确称取磷酸氢二钾1.82g 、二水合磷酸二氢钠0.22g 、氯化钠8.76g ,放入洁净烧杯中,加纯化水800ml ,放入1个洁净的磁力搅拌子,置磁力搅拌器上搅拌至充分溶解后,使用多参数测试仪测量PH 值应在7.2±0.2范围内,再加入蔗糖30g ,置磁力搅拌器上搅拌至充分溶解后,将溶液缓缓倒入容积为1000ml 的容量瓶中,用纯化水反复冲洗3次烧杯,所有溶液倒入上述容量瓶中,用纯化水定容至1000ml ,混合均匀4~30℃保存备用,有效期7天。
2.2.2 C 线包被液使用包被液将羊抗兔IgG 抗体稀释成终浓度为1mg/ml 。
充分混合后保存备用。
注:现用现配 2.2.3 T 线包被液使用包被液将鼠抗人C 反应蛋白抗体稀释成终浓度为1mg/ml 。
充分混合后保存备用。
注:现用现配 2.2.4 NC 膜划线(1)按左图所示,将PVC 底板摆好;除去PVC 底板中间25mm 处的保护纸,沿上面保护纸的下边缘,将硝酸纤维素膜(NC 膜)贴在该区; 注:1.粘贴上下边缘与相邻区上下边缘齐平;2.粘贴时注意动作轻柔,避免用手直接按压硝酸纤维素膜(NC 膜)表面。
(2)贴吸水滤纸:按27mm 的宽度将吸水滤纸切割成条,除去PVC 底板上端25mm 处的保护纸,将切好的吸水滤纸贴在该区;注:吸水滤纸下边缘超出该区2mm 覆盖硝酸纤维素膜(NC 膜);上边缘与底板边缘齐平。
(3)使用划线包被机按照1μl/cm 包被量将C 线包被液及T 线包被液包被至NC 膜适当位置;文件名称: 全程C反应蛋白(CRP)测定试剂盒(荧光免疫层析法)工艺规程文件编号:版本/修改状态: V1.0/00 受控状态:受控(4)C、T线区域间距应调节足够宽度以保证检测仪可以显著区分,习惯上C线距NC膜上边缘距离为10mm,CT线之间间距为6mm,T线与NC膜下边缘间距为9mm。
注:1、贴膜和包被过程应注意避免膜的污染。
2、划线时的湿度条件是NC膜制备的要点之一,湿度应控制在45%~65%。
3、制备前需将C线包被液、T线包被液与硝酸纤维素膜(NC膜)平衡至相同温度。
2.2.5 NC膜干燥将包被的NC膜放置在相对湿度≤30%(环境温度18℃~26℃)条件下干燥。
NC膜干燥时间至少6小时。
干燥完成后封存备用,有效期14个月。
注:1、干燥时,湿度的控制是本岗位的工艺要点之一,湿度应控制在≤30%。
干燥后应避免长时间放置于4~30℃环境。
2.3工序三:样本稀释液制备2.3.1 标准配方名称物料名称配制1000ml使用量75人份使用量样本稀释液磷酸氢二钾 1.82g37.5ml二水合磷酸二氢钠0.22g氯化钠8.76g调PH至7.4±0.2S9 10g乙二胺四乙酸二钠0.2g聚乙烯吡咯烷酮(40K)3gProclin300 0.3ml牛血清白蛋白5g2.3.2配制方法按照标准配方分别准确称取磷酸氢二钾1.82g、二水合磷酸二氢钠0.22g、氯化钠8.76g,放入洁净烧杯中,加纯化水800ml,放入1个洁净的磁力搅拌子,置磁力搅拌器上搅拌至充分溶解后,使用多参数测试仪测量PH值应在7.4±0.2范围内,再依次加入S9 10g、乙二胺四乙酸二钠0.2g、聚乙烯吡咯烷酮(40K)3g、Proclin300 0.3ml、牛血清白蛋白5g,置磁力搅拌器上搅拌至充分溶解后,将溶液缓缓倒入容积为1000ml的容量瓶中,用纯化水反复冲洗3次烧杯,所有溶液倒入上述容量瓶中,用纯化水定容至1000ml,混合均匀后4-30℃保存备用,有效期7天。
文件名称: 全程C反应蛋白(CRP)测定试剂盒文件编号:(荧光免疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控2.3.3分装将上面配制好的样本稀释液按照500ul/支的装量进行分装,4-30℃条件下保存,有效期12个月。
2.3.4标签打印、贴签2.3.5质控项目和标准项目标准外观样本稀释液为无色透明液体,无悬浮物及沉淀物。
净含量样本稀释液净含量应在标示值的90%~110%之间。
pH 在7.4±0.2范围内。
2.4工序四:贴膜组装(湿度≤30%)(1)贴样品垫:将样品垫贴在已包被好的NC膜底板28mm处;注:样品垫上边缘1mm覆盖NC膜;下边缘与底板边缘齐平。
(2)贴好后,应如下图所示;注:1、避免混淆是本工序的要点,确保指令、样品垫标示和包被好的NC膜三者之间的完全一致。
