高中阶段常见元素的化合价
【全新版】常见元素的化合价记忆口诀4
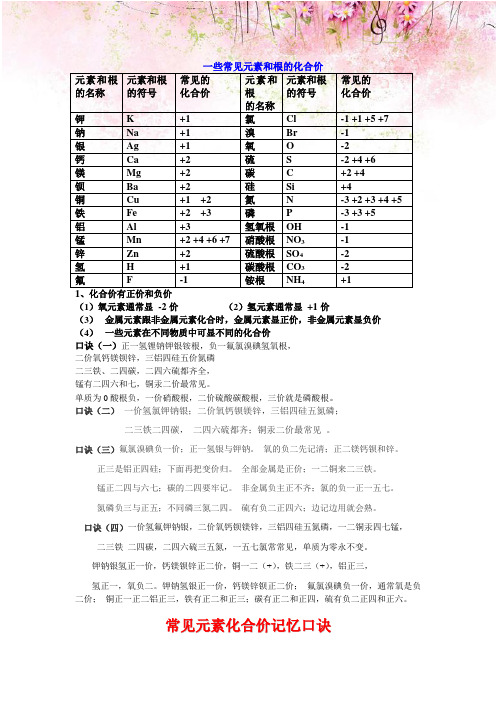
一些常见元素和根的化合价元素和根的名称元素和根的符号常见的化合价元素和根的名称元素和根的符号常见的化合价钾K +1 氯Cl -1 +1 +5 +7钠Na +1 溴Br -1银Ag +1 氧O -2钙Ca +2 硫S -2 +4 +6镁Mg +2 碳 C +2 +4钡Ba +2 硅Si +4铜Cu +1 +2 氮N -3 +2 +3 +4 +5铁Fe +2 +3 磷P -3 +3 +5铝Al +3 氢氧根OH -1锰Mn +2 +4 +6 +7 硝酸根NO3-1锌Zn +2 硫酸根SO4-2氢H +1 碳酸根CO3-2氟 F -1 铵根NH4+11、化合价有正价和负价(1)氧元素通常显-2价(2)氢元素通常显+1价(3)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价(4)一些元素在不同物质中可显不同的化合价口诀(一)正一氢锂钠钾银铵根,负一氟氯溴碘氢氧根,二价氧钙镁钡锌,三铝四硅五价氮磷二三铁、二四碳,二四六硫都齐全,锰有二四六和七,铜汞二价最常见。
单质为0酸根负,一价硝酸根,二价硫酸碳酸根,三价就是磷酸根。
口诀(二)一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;铜汞二价最常见。
口诀(三)氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
口诀(四)一价氢氟钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷,一二铜汞四七锰,二三铁二四碳,二四六硫三五氮,一五七氯常常见,单质为零永不变。
钾钠银氢正一价,钙镁钡锌正二价,铜一二(+),铁二三(+),铝正三,氢正一,氧负二。
钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧是负二价;铜正一正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正六。
化合价表格

在化学中,化合价是一个元素在化合物中的氧化态,通常用罗马数字表示。
化合价是原子之间互相连接的方式,决定了分子的形状和性质。
化合价的概念不仅在无机化学中有广泛应用,也在有机化学中有着重要的应用。
一价表示只有一个原子结合到其他原子或离子中,如氢(H)和氯(Cl)结合成氯化氢(HCl),其中氢原子呈一价。
二价表示有两个原子结合到其他原子或离子中,如氧(O)和两个氢(H)结合成水(H₂O),其中氧原子呈二价。
同样,三价表示有三个原子结合到其他原子或离子中,如铝(Al)和三个氯(Cl)结合成三氯化铝(AlCl₃)。
除了这些基本的化合价,还有更复杂的化合物,其中原子可以呈负价或正价。
负价表示原子获得电子,而正价表示原子失去电子。
例如,在硫酸(H₂SO₄)中,硫(S)呈正六价,因为它失去了六个电子;而在亚硫酸(H₂SO₃)中,硫(S)呈正四价,因为它失去了四个电子。
测它们在化学反应中的行为,以及它们如何与其他元素相互作用。
因此,化合价表格是化学教育中的重要工具,帮助我们理解和预测化合物和化学反应的性质。
高中阶段常见元素地化合价

中学阶段常见元素化合价表 注:本表不列出稀有气体、金属的 元素 常见化合价 【主要离子】0 价及非常见价态等。
例子 该 化 合价 的 性 元素及单质的其他性质质氢 H+1(主要) 【 H +】-1【 H -】在大多数化合物中,如 HCl 、H 2O 、NaHCO 3、NH3 等 在活泼金属氢化物中及 有强还原性,可其衍生物, 如 NaH 、KH 、 以 和 水反 应 放CaH2 、KBH 4 等 出 H 2 1 2 ●有三种同位素: H 、 H(或3 D)、H( 或 T) ●单质有还原性●可燃 ●密度最小的气体 ● 无色无味锂 Li +1 【 Li +】钠 Na +1【 Na +】锂化合物如 LiCl 、LiOH 、 焰色为深红色 Li 2O 等钠化合物如 NaCl 、Na 2O2等●银白色的活泼金属,可以和水反应 ●熔点比水高,密度很小 ●同位素 6Li 用在核反应堆内吸收中子 ●使用于电池内 ●在空气中燃烧生成 Li 2O ●强还原剂●银白色的活泼金属,可以 和水反应,保存在煤油中 ● 熔点比水低,密度、硬度小●和醇、酸反应放出氢气 ● 在空气中燃烧生成强还原剂 钾K +1 【 K +】铷 Rb +1铯 Cs 【 Rb +】【 Cs +】钾化合物如 KCl 、KNO 3 等铷、铯化合物如RbCl 、 CsCl 等●银白色活泼金属,可以和有 Na +时会为黄 水反应,比钠更剧烈,保存色,透过蓝色钴 在煤油中 ●熔点比水低、密玻 璃 才能 看 到 度、硬度小 ●强还原剂 ●在空 紫色) 气中燃烧生成 K 2O2 和 KO 2●钾钠合金用作核反应 堆的冷却剂 铷的焰色为浅 ●铷是银白色金属,铯是略紫色,铯的焰色 带金黄色光泽的金属, 熔点为天蓝色 低,和水极其猛烈地反应 ●铯可以在空气中自燃●强还 原剂 镁 Mg+2镁 化 合 物 如 MgCl 2 、【 Mg 2+】MgSO4 等●银白色活泼金属,和沸水略有反应 ●在空气中燃烧生成 MgO ,也有 Mg 3N 2 生成 ● 能在 CO 2 等大多数气体中燃烧 ●和酸剧Na2O 2● 焰色为紫色(混 焰色为黄色烈反应●强还原剂●军事上用作照明弹1钙 Ca+2【 Ca2+】锶 Sr+2钡 Ba 【 Sr2+】【 Ba2+】钙化合物如CaCl2、焰色为砖红色●银白色活泼金属,和水反CaSO4、CaO等应●密度比水大●在空气中缓慢氧化或燃烧生成CaO●强还原剂锶、钡化合物如SrCl 2、锶的焰色为深●银白色活泼金属,可以和BaSO4 等红色,钡的焰色水反应●密度比水大●强还为黄绿色;Ba2+原剂●可以在空气中燃烧有毒硼 B+3 大多数硼化合物如【 BO33-】H3BO3、B2O3 等铝 Al+3 大多数铝化合物如●银白色活泼金属,在空气【 Al 3+】Al2O3、NaAlO 2等中生成致密的氧化膜阻止【 AlO 2-】( 偏铝酸进一步氧化●两性金属,可根 )以和强酸、强碱反应●在浓硫酸、浓硝酸中钝化●高温下有强还原性,铝热反应的原料铊 Tl+1 【 Tl +】亚铊化合物如 TlCl等剧毒●较软的银白色金属,和酸+3 【 Tl 3+】三价铊化合物如 Tl2O3等剧毒;强氧化性反应生成亚铊化合物●剧毒镓 Ga+3 大多数镓、铟化合物中●镓的熔点低于体温铟 In【 Ga3+、In 3+】碳 C+2 CO 等有还原性+4 CO2、CS2 等【 CO32-】【 HCO3-】等其他金属碳化物中碳显负价负价的碳化合(如 CaC2等);有机物一物有还原性般不讨论碳的化合价●有多种同素异形体,如金刚石、石墨、 C60等●高温下有还原性,可以还原金属氧化物、CO2等●可以在纯氧中燃烧发出耀眼白光●同位素14C用于考古硅 Si+4 硅酸盐如 Na2SiO3、硅酸、●半导体材料●用作电脑芯【 SiO 2- 】、氟硅酸盐等片●可以和碱反应放出氢气3 SiF4+3 SiHCl3-4 某些硅化物如Mg 2Si 、和水反应放出【 Si4-】Ca2Si 等自燃性的硅烷锗 Ge+4 GeO2等●半导体材料锡 Sn+4 四价锡化合物如SnO2、可溶于过量强●熔点较低,常用来制备合【 Sn4+】SnCl4 等碱金,如青铜(传统的青铜是+2 亚锡化合物如 SnCl2、有还原性;溶于铜锡合金)、焊锡等2【 Sn2+】铅 Pb+4【 Pb4+】+2(主要)【 Pb2+】SnSO4等过量强碱四价铅化合物如有强氧化性●铅和酸反应生成二价铅化Pb(CH3 COO)4、PbO2 等;合物,四价铅则难达到●质Pb3O4含有 +2 和 +4 价的软的金属●有毒●熔点较低,铅。
常见元素的化合价口诀表

常见元素的化合价口诀表
一、引言
化学学习中,化合价是至关重要的概念。
为了帮助大家更好地掌握常见元素的化合价,本文将介绍一份常见的化合价口诀表。
这份口诀表包括了金属元素、非金属元素以及常见酸碱盐的化合价,希望能够为广大化学爱好者提供便利。
二、常见元素的化合价口诀表介绍
1.金属元素化合价口诀
金属元素化合价口诀主要包括了一至三价的金属元素。
例如:
钾钙镁铝锌,一价氯氢氧;
二价铁钙铜,三价铝硅磷。
2.非金属元素化合价口诀
非金属元素化合价口诀涵盖了一至五价的非金属元素。
例如:
一价氢氟氯,二价氧硫氮;
三价氯磷硫,四价硅氧氮;
五价磷氯硫,硼钠镁钙钾。
3.常见酸碱盐化合价口诀
常见酸碱盐化合价口诀包括了酸、碱、盐类化合物的化合价。
例如:
酸有一价氢,二价硫酸根;
碱有氢氧根,一价碳酸根;
盐类化合价,根据酸碱定。
三、化合价口诀表的应用
1.快速查询元素化合价
掌握了化合价口诀表,同学们可以迅速查询到元素的化合价,方便进行化学计算。
2.辅助计算化学方程式
化合价口诀表还可以帮助同学们在书写化学方程式时,准确地判断反应物和生成物的化学式,提高方程式的正确性。
3.提高化学学习效率
通过熟悉化合价口诀表,同学们可以更好地理解化学原理,提高学习效率。
四、总结
本文介绍了常见元素的化合价口诀表,包括金属元素、非金属元素以及常见酸碱盐的化合价。
掌握这份口诀表,对于化学学习具有重要的指导意义。
化合价

2+
HgS
HgCl2。
需要十分熟悉。较不常见的有 Al4C3,C 爲-4 价,水解生成 Al(OH)3 和 CH4。 镓分族不必了解。
ⅣA C Si Ge Sn Pb
C:[-4 ,+4] ,常见的 CO 碳爲+2 价, CO2
+1 −1+ 3 −3
2− − H2CO3 碳爲+4 价,氰根 CN-碳 CO3 HCO3
+1 −1−1 +1+ 3 −3
Cu3P。
CrCl 3,+6 价如 CrO 4 Cr2O 7 。
2−
2−
Mn: +2 价+4 价+6 价+7 价, +2 价如 MnSO4, +4 价如 MnO2, +6 价如 K2MnO4, +7 价如 KMnO4。 其他的 Hg:+1 价+2 价,+1 价如 Hg 2 (双聚) ,+2 价如 HgO Au:+3 价,+3 价如 Au2Cl6(双聚) AuCl 4 。
ⅤA N P As Sb Bi
N:[-3,+5]所有整数化合价均有且均较常见,
NH 3 + N 2H 4 NH 4 , -2 价 ,-1 价 NH2OH,+1 价 N2O, 如-3 价 + − N H ( 肼合氫離子 ) NH ( 氨基離子 ) 2 5 2 氮化物(如Mg N ) 3 2
硒分族不必了解。
ⅦA F Cl Br I At
F:化合态只有-1 价,无正价。 卤素互化物通式 XX n ,n∈{1,3,5,7} ,其中 X 显正价,爲+n 价,X’显负价,爲-1 价。
高中阶段常见元素的化合价(word版)

高中阶段常见元素的化合价(word 版)中学阶段常见元素化合价表注:本表不列出稀有气体、金属的 0 价及非常见价态等。
元素常见化合价 【主要离子】例子 该化合价的性质 元素及单质的其他性质氢 H+1(主要) 【H +】 在大多数化合物中,如 HCl 、 H 2 O 、NaHCO 3 、NH 3 等●有三种同位素:1H 、2H(或 D)、3H(或 T)●单质有 还原性●可燃●密度最小的气体●无色无味-1 【H -】在活泼金属氢化物中及其衍生 物,如 NaH 、KH 、CaH 2 、KBH 4 等有强还原性,可以 和水反应放出 H 2锂 Li +1 【Li +】锂化合物如 LiCl 、LiOH 、Li 2 O 等焰色为深红色 ●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素 6Li 用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成 Li 2 O●强还 原剂钠 Na +1 【Na +】钠化合物如 NaCl 、Na 2 O 2 等焰色为黄色●银白色的活泼金属,可以和水反应,保存在煤 油中●熔点比水低,密度、硬度小●和醇、酸反应 放出氢气●在空气中燃烧生成 Na 2 O 2 ●强还原剂钾 K+1 【K +】钾化合物如 KCl 、KNO 3 等 焰色为紫色(混有 Na +时会为黄色,透 过蓝色钴玻璃才能 看到紫色)●银白色活泼金属,可以和水反应,比钠更剧烈, 保存在煤油中●熔点比水低、密度、硬度小●强还 原剂●在空气中燃烧生成 K 2O 2 和 KO 2●钾钠合金 用作核反应堆的冷却剂镁 Mg +2 【Mg 2+】镁化合物如 MgCl 2 、MgSO 4 等 ●银白色活泼金属,和沸水略有反应●在空气中燃 烧生成 MgO ,也有 Mg 3 N 2 生成●能在 CO 2 等大多 数气体中燃烧●和酸剧烈反应●强还原剂●军事上 用作照明弹钙 Ca+2 【Ca 2+】钙化合物如 CaCl 2 、CaSO 4 、 CaO 等焰色为砖红色 ●银白色活泼金属,和水反应●密度比水大●在空 气中缓慢氧化或燃烧生成 CaO●强还原剂硼 B+3 【BO 33-】大多数硼化合物如 H 3 BO 3 、 B 2 O 3 等铝 Al +3 【Al 3+】 【AlO 2 -】(偏铝 酸根)大多数铝化合物如 Al 2 O 3 、 NaAlO 2 等●银白色活泼金属,在空气中生成致密的氧化膜 阻止进一步氧化●两性金属,可以和强酸、强碱 反应●在浓硫酸、浓硝酸中钝化●高温下有强还原 性,铝热反应的原料碳 C +2 CO 等 有还原性 ●有多种同素异形体,如金刚石、石墨、C 60 等● 高温下有还原性,可以还原金属氧化物、CO 2 等● +4 【CO 32-】 【HCO 3 -】等CO 2 、CS 2 等可以在纯氧中燃烧发出耀眼白光●同位素 14C 用 于考古其他 金属碳化物中碳显负价(如 CaC 2 等);有机物一般不讨论 碳的化合价负价的碳化合物有 还原性硅 Si +4【SiO 3 2-】硅酸盐如 Na 2 SiO 3 、硅酸、SiF 4 、 氟硅酸盐等高中阶段常见元素的化合价(word版)●半导体材料●用作电脑芯片●可以和碱反应放出氢气+3 SiHCl3-4【Si4-】某些硅化物如Mg2 Si、Ca2 Si等和水反应放出自燃性的硅烷氮N +5【NO3 -】硝酸及硝酸盐( 如KNO3 ) 、N2 O5 等硝酸根离子酸化后具有强氧化性●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时和O2 反应产生NO●和H2 高温高压在有催化剂的条件下化合成NH3 ●游离态氮转化+4 NO2 、N2 O4 等易歧化为化合态氮的过程叫做固氮●用作冷却、防腐、+3【NO2 -】亚硝酸及亚硝酸盐( 如NaNO2 )、N2 O3 等亚硝酸跟离子有致癌性保护气体+2 NO 等+1 N2 O 等-3【NH4 +】【N3-】氨气、铵盐(如NH4 C l)、氮化物(如Na3 N、Mg3 N2 等)NH3 溶于酸;铵盐和碱反应生成NH3 ;活泼金属氮化物和水反应放出NH3 ,生成碱其他【N3 -】叠氮化物(如NaN3 等)磷P +5(主要)磷酸及其盐(如H3 P O4 、HPO3 、无显著氧化性●有红磷、白磷(P4 )、黑磷等多种同素异形体●易【PO4 3-】【HPO4 2-】【H2 PO4 -】等K3 P O4 、NaH2 P O4 等)、P4 O10 、PCl5 、POCl3 等燃,在空气中燃烧生成P4 O10 ●白磷易自燃,剧毒,可溶于CS2 ●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●和氧化剂混合易爆+3 【PO3 3-】等H3 P O3 、PCl3 等+1 次磷酸(H3 P O2 )及其盐有强还原性氧O -2氧化物如SO2 、CuO、I2 O5 等;最常见的价态●无色无味的气体,供给呼吸,助燃●最常见的同【O2-】【OH-】【……】-1【O22-】氢氧化物如KOH 等;大多数含氧酸及其盐如HClO4 、BaSO4等;……过氧化物如H2 O2 、Na2 O2 等和水反应放出氧气素异形体是臭氧(O3 ),有鱼腥臭味和很强的氧化性(常温下能将银、硫化铅等物质氧化),易被催化分解,受热易分解●在氧气中高压放电能产生臭氧●液氧为淡蓝色液体,固态为淡蓝色雪花状固体●绝大多数元素都存在氧的化合物●接近100%的纯氧能使人的呼吸停止其他【O2 -】【O3 -】等硫S +6 【SO4 2-】【S2 O82-】【S2 O72-】等超氧化物(如KO2 )、臭氧化物(如CsO3 )、HOF(此处0 价)等SO3 、H2 SO4 、硫酸盐、过硫酸盐、焦硫酸盐、SF6 等强氧化性;超氧化物、臭氧化物和水反应放出氧气●黄色固体,可燃,在空气中燃烧产生淡蓝色火焰,在纯氧中则为蓝紫色火焰●熔点低●和碱金属反应爆炸,研磨即可反应●能和一些不活泼金属如Cu、Hg 反应●溶于二硫化碳或碱金属硫化物溶+4 【SO3 2-】等SO2 、亚硫酸盐等+2 SCl2 等液中●硫的分子式为S8 ●硫有多种同分异构体●硫、碳、硝酸钾用一定的工艺混合可以制成黑火-2【S2-】硫化物(如K2S、H2S、Cu2 S、HgS 等)、硫取代氧的化合物等活泼金属硫化物和药酸反应产生H2 S;某些金属的硫化物则很稳定;还原性氟 F -1 氟化物(如CaF2 、HF、NH4 F、可溶性氟化物有●极毒的淡黄绿色气体,有芥末气味,化学性质【F-】【HF2-】【SiF6 2-】等NH4 HF2 、KHF2 、UF6 、XeF6等)、氟代含氧酸盐、含氟有机物等毒,直接接触可引起严重灼伤极其活泼●无正价●只有少数元素不能和氟直接化合●用于制造含氟高分子材料、制造农药、制造人造血液、分离铀的同位素氯Cl +7 【ClO4 -】高氯酸、高氯酸盐、Cl2 O7 等强氧化剂●剧毒的黄绿色气体,有刺激性气味,化学性质十分活泼●化合价多、氧化物不稳定●有漂白性●+5 【ClO3 -】氯酸、氯酸盐等强氧化剂+4 ClO2 等+3 【ClO2 -】亚氯酸、亚氯酸盐等易液化●可溶于水●用于有机合成,是重要的化工原料+2 ClO·+1 【ClO-】次氯酸、次氯酸盐、Cl2 O等强氧化剂-1 【Cl-】等氯化物等溴Br +7、+5、+4、+3、见“氯Cl”(溴、碘+1 价有BrX、溴酸盐有强氧化性●有毒的深红棕色重质液体,易挥发,有刺激性+1、-1 IX 等) 气味,化学性质活泼●溶于水、乙醇、四氯化碳、苯等●用于消毒碘I +7、+5、+3、+1、见“氯Cl”(次碘酸及其盐常温碘化物有较强的还●深紫色固体,有毒,易升华,有刺激性气味●受-1其他【I3 -】等不存在)碘溶于碘化物溶液中产生:I2 +I-=I3 -原性使淀粉变蓝;有较强的还原性热升华●用于消毒●溶于水、碘化物溶液、乙醇、四氯化碳、苯等铬Cr +6【CrO42-】CrO3 、CrO5 、铬酸盐(BaCrO4 、铬酸跟在酸性条件●银白色金属,十分坚硬●有丰富的价态,化合物【Cr2 O72-】(此价态常见)K2 C rO4 、Na2 C rO4 等)、重(chóng)铬酸盐(K2 C r2 O7 、(NH4 )2 C r2 O7 等)下转化为重铬酸根,碱性条件下逆转换。
物质的化合价

物质的化合价
化合价是用来表示原子之间互相化合的数目。
常见的化合价有:
1. 氢元素的化合价:在化合物中,氢通常显正一价,但在一些特殊化合物中可能显正二价。
2. 钠元素的化合价:钠在化合物中通常显+1价。
3. 氧元素的化合价:在化合物中,氧元素通常显-2价。
4. 金属元素和非金属元素的化合价:金属元素通常显正价,而非金属元素通常显负价。
5. 非金属元素的常见化合价:氟、氯、溴、碘常显负价,氧显-2价,硫和氮等常显负二到正五价。
需要注意的是,在特定的化合物中,化合价可能会有所不同。
同时,同一元素在不同的化合物中的化合价也可能不同。
在化学学习中,我们需要根据具体的化学式和元素来了解物质的化合价。
高中化学化合价变价

高中化学化合价变价篇一:高中化学常考变价元素及其变价高中必考化合价1.分析下列常见物质的化合价非金属H NaH CaH2Li2NH 其他+1CH4N2H4O Na2O2H2O2KO2 其他-2As2O3 CH3CH2OH CrO42- S2O42-N NH3NH4+N2H4 N2N2ONONaNO2NO2HNO3 NH4NO3S H2S FeS Cu2S FeS2 S H2S NaS2O3 SO2 H2SO4P Cu3PPH3 P2O3PCl3 PCl5 P2O5 H3PO4Cl HClO4 HClOClO2 Cl-Br HBrO3Br2 Br-I H I O3 I 2I -金属Fe FeS FeOFeS2Fe2O3 Fe3O4Li FePO4FeO42-Cu CuI Cu2SCu3PMn KMnO4K2MnO4 MnO2 Mn2+Cr Cr3+ Cr2O72-CrO42-2.氧化还原反应原则1 总升高= 总降低2 一般向临近价态转化(就近原则)3 低价阳离子,高价酸根4 酸根形式不变价态不变5前后价态一致肯定不变N2O5篇二:化合价与化学式化合价及其变化化合价与化学式一、知识梳理1、化合价的定义知识衔接点拨:这部分内容在初中教材中介绍的不够深入,虽然也可能进行过大量训练,但是由于初中知识的局限性,大多数同学对化合价的概念没有掌握,以至于在进入高中后的学习过程中感到与化合价的变化密切相关的氧化还原理论非常艰涩难懂,甚至在整个高中化学的学习过程中都分不清关于氧化还原反应的相关概念,更不用说弄清它们之间的关系了。
因此,要想从根本上解决这个问题,首先应把常见元素的符号及常见化合价记准背熟,再次应下大力气弄清1-18号元素的核外电子排布和原子结构示意图,按照结构决定性质、性质反映结构的观点,用元素周期律揭示常见元素的主要化合价的递变规律,最后用元素周期表中元素所处的位臵印证元素的性质与原子结构之间的关系,就能真正的领会掌握元素的“位(位臵)、构(原子结构)、性(元素性质)”三者之间的关系,从而更深刻地理解并掌握元素化合价的定义,最终为氧化还原理论的深入学习打下坚实的基础,做好知识的充分准备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+1
【Na+】
钠化合物如NaCl、Na2O2等
焰色为黄色
●银白色的活泼金属,可以与水反应,保存在煤油中●熔点比水低,密度、硬度小●与醇、酸反应放出氢气●在空气中燃烧生成Na2O2●强还原剂
钾K
+1
【K+】
钾化合物如KCl、KNO3等
焰色为紫色(混有Na+时会为黄色,透过蓝色钴玻璃才能瞧到紫色)
-3
砷化物(如AsH3、K3As等)
活泼金属砷化物与水反应产生H3As
其她
As4S4等
锑Sb
+5【SbO3-】
【SbF6-】等
SbF5、HSbF6、SbCl5、锑酸盐等
SbF5或锑与氟构成的阴离子有极强的酸性
●熔点低,有多种同素异形体,但只有灰锑最稳定●用作合金、半导体●有毒
锗Ge
+4
GeO2等
●半导体材料
锡Sn
+4
【Sn4+】
四价锡化合物如SnO2、SnCl4等
可溶于过量强碱
●熔点较低,常用来制备合金,如青铜(传统的青铜就是铜锡合金)、焊锡等
+2
【Sn2+】
亚锡化合物如SnCl2、SnSO4等
有还原性;溶于过量强碱
铅Pb
+4
【Pb4+】
四价铅化合物如Pb(CH3COO)4、PbO2等;Pb3O4含有+2与+4价的铅。
大多数铝化合物如Al2O3、NaAlO2等
●银白色活泼金属,在空气中生成致密的氧化膜阻止进一步氧化●两性金属,可以与强酸、强碱反应●在浓硫酸、浓硝酸中钝化●高温下有强还原性,铝热反应的原料
铊Tl
+1【Tl+】
亚铊化合物如TlCl等
剧毒
●较软的银白色金属,与酸反应生成亚铊化合物●剧毒
+3【Tl3+】
三价铊化合物如Tl2O3等
+3【PO33-】等
H3PO3、PCl3等
+1
次磷酸(H3PO2)及其盐
有强还原性
-3
【P3-】
磷化物(如K3P等)
砷As
+5【AsO43-】等
砷酸及其盐、As2O5
●有灰色类金属砷(灰砷)、黄砷、黑砷等多种同素异形体●可燃●大多数含砷化合物有剧毒●用作半导体
+3【AsO33-】等
亚砷酸及其盐、As2O3
锶Sr
钡Ba
+2
【Sr2+】
【Ba2+】
锶、钡化合物如SrCl2、BaSO4等
锶的焰色为深红色,钡的焰色为黄绿色;Ba2+有毒
●银白色活泼金属,可以与水反应●密度比水大●强还原剂●可以在空气中燃烧
硼B
+3
【BO33-】
大多数硼化合物如H3BO3、B2O3等
铝Al
+3
【Al3+】
【AlO2-】(偏铝酸根)
中学阶段常见元素化合价表
注:本表不列出稀有气体、金属的0价及非常见价态等。
元素
常见化合价
【主要离子】
例子
该化合价的性质
元素及单质的其她性质
氢H
+1(主要)
【H+】
在大多数化合物中,如HCl、H2O、NaHCO3、NH3等
●有三种同位素:1H、2H(或D)、3H(或T)●单质有还原性●可燃●密度最小的气体●无色无味
有强氧化性
●铅与酸反应生成二价铅化合物,四价铅则难达到●质软的金属●有毒●熔点较低,常用来制合金●可以防护放射线●在空气中生成致密的碱式碳酸铅氧化膜
+2(主要)
【Pb2+】
二价铅化合物如PbO、PbCl2等
氮N
+5
【NO3-】
硝酸及硝酸盐(如KNO3)、N2O5等
硝酸根离子酸化后具有强氧化性
●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时与O2反应产生NO●与H2高温高压在有催化剂的条件下化合成NH3●游离态氮转化为化合态氮的过程叫做固氮●用作冷却、防腐、保护气体
剧毒;强氧化性
镓Ga
铟In
+3
【Ga3+、In3+】
大多数镓、铟化合物中
●镓的熔点低于体温
碳C
+2
CO等
有还原性
●有多种同素异形体,如金刚石、石墨、C60等●高温下有还原性,可以还原金属氧化物、CO2等●可以在纯氧中燃烧发出耀眼白光●同位素14C用于考古
+4
【CO32-】
【HCO3-】等
CO2、CS2等
+4
NO2、N2O4等
易歧化
+3
【NO2-】
亚硝酸及亚硝酸盐(如NaNO2)、N2O3等
亚硝酸跟离子有致癌性
+2
NO等
+1
N2O等
-3
【NH4+】
【N3-】
氨气、铵盐(如NH4Cl)、氮化物(如Na3N、Mg3N2等)
NH3溶于酸;铵盐与碱反应生成NH3;活泼金属氮化物与水反应放出NH3,生成碱
其她【N3-】
-1
【H-】
在活泼金属氢化物中及其衍生物,如NaH、KH、CaH2、KBH4等
有强还原性,可以与水反应放出H2
锂Li
+1
【Li+】
锂化合物如LiCl、LiOH、Li2O等
焰色为深红色
●银白色的活泼金属,可以与水反应●熔点比水高,密度很小●同位素6Li用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成Li2O●强还原剂
●银白色活泼金属,可以与水反应,比钠更剧烈,保存在煤油中●熔点比水低、密度、硬度小●强还原剂●在空气中燃烧生成K2O2与KO2●钾钠合金用作核反应堆的冷却剂
铷Rb
铯Cs
+1
【Rb+】
【Cs+】
铷、铯化合物如RbCl、CsCl等
铷的焰色为浅紫色,铯的焰色为天蓝色
●铷就是银白色金属,铯就是略带金黄色光泽的金属,熔点低,与水极其猛烈地反应●铯源自以在空气中自燃●强还原剂镁Mg
+2
【Mg2+】
镁化合物如MgCl2、MgSO4等
●银白色活泼金属,与沸水略有反应●在空气中燃烧生成MgO,也有Mg3N2生成●能在CO2等大多数气体中燃烧●与酸剧烈反应●强还原剂●军事上用作照明弹
钙Ca
+2
【Ca2+】
钙化合物如CaCl2、CaSO4、CaO等
焰色为砖红色
●银白色活泼金属,与水反应●密度比水大●在空气中缓慢氧化或燃烧生成CaO●强还原剂
其她
金属碳化物中碳显负价(如CaC2等);有机物一般不讨论碳的化合价
负价的碳化合物有还原性
硅Si
+4
【SiO32-】
硅酸盐如Na2SiO3、硅酸、SiF4、氟硅酸盐等
●半导体材料●用作电脑芯片●可以与碱反应放出氢气
+3
SiHCl3
-4
【Si4-】
某些硅化物如Mg2Si、Ca2Si等
与水反应放出自燃性的硅烷
叠氮化物(如NaN3等)
磷P
+5(主要)
【PO43-】
【HPO42-】
【H2PO4-】等
磷酸及其盐(如H3PO4、HPO3、K3PO4、NaH2PO4等)、P4O10、PCl5、POCl3等
无显著氧化性
●有红磷、白磷(P4)、黑磷等多种同素异形体●易燃,在空气中燃烧生成P4O10●白磷易自燃,剧毒,可溶于CS2●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●与氧化剂混合易爆
