金属晶体堆积模型及计算公式
金属晶体四类晶胞空间利用率的计算

金属晶体四类晶胞空间利用率的计算高二化学·唐金圣在新课标人教版化学选修3《金属晶体》一节中,给出了金属晶体四种堆积方式的晶胞空间利用率。
空间利用率就是晶胞上占有的金属原子的体积与晶胞体积之比。
下面就金属晶体的四种堆积方式计算晶胞的空间利用率。
一、简单立方堆积:在简单立方堆积的晶胞中,晶胞边长a等于金属原子半径r的2倍,晶胞的体积V晶胞=(2r)3。
晶胞上占有1个金属原子,金属原子的体积V原子=4πr3/3 ,所以空间利用率V原3/ (3×(2r)3)=52.33﹪。
子/V晶胞 = 4πr二、体心立方堆积:在体心立方堆积的晶胞中,体对角线上的三个原子相切,体对角线长度等于原子半径的4倍。
假定晶胞边长为a ,则a2 + 2a2 = (4r)2, a=4 r/√3 ,晶胞体积V晶胞 =64r3/ 3√3 。
体心堆积的晶胞上占有的原子个数为2,原子占有的体积为V原子=2×(4πr3/3)。
晶胞的空间利用率等于V原子/V晶胞 =(2×4πr3×3√3)/(3×64r3)= 67.98﹪。
三、面心立方最密堆积在面心立方最密堆积的晶胞中,面对角线长度是原子半径的4倍。
假定晶胞边长为a,则a2 + a2 = (4r)2 ,a = 2√2r ,晶胞体积V晶胞=16√2r3。
面心立方堆积的晶胞上占有的原子数为4,原子占有的体积为V原子 = 4×(4πr3/3)。
晶胞的空间利用率等于V原子/V晶胞 =(4×4πr3)/(3×16√2r3)= 74.02﹪.四、六方最密堆积六方最密堆积的晶胞不再是立方结构。
晶胞上、下两个底面为紧密堆积的四个原子中心连成的菱形,边长a = 2r ,夹角分别为60°、120°,底面积s = 2r×2r×sin(60°) 。
晶胞的高h的计算是关键,也是晶胞结构中最难理解的。
晶体的堆积模型及其计算1课时

2 4 r3 2 4 ( 3 a)3
=
3 a3
34 a3
100% 68%
c 金属的最密堆积
金属晶体的两种最密堆积方式──镁型和铜型
镁型
铜型
第二层对第一层来讲最紧密的堆积方式是将球对 准 1,3,5 位 ( 或对准 2,4,6 位,其情形是一 样的 )
,
12
6
3
54
12
6
3
54
AB
思考:第三层如何才能作到密置层的堆积呢?
这种堆积晶胞是一个体心立方,
每个晶胞含 2个原子,空间
利用率也不高(68%),属于非
密置层堆积,配位数为 8,
如碱金属、Fe等采取这种堆积方 式。
空间利用率计算
设原子半径为r 、晶胞边长为a , 根据勾股定理, 得:2a 2 + a 2 = (4r) 2
3a 2 16r 2
r 3a
空间利用率
4
= 晶胞含有原模型
1.理论基础:
由于金属键没有方向性,每个金属原 子中的电子分布基本是球对称的,所以 可以把金属晶体看成是由直径相等的刚 性圆球的三维空间堆积而成的。
堆积原理:
组成晶体的金属原子在没有其他因 素影响时,在空间的排列大都遵循紧 密堆积原理。这是因为金属键没有方 向性,因此都趋向于使金属原子吸引 更多的其他原子分布于周围,并以紧 密堆积方式降低体系的能量,使晶体 变得比较稳定。
镁型----六方最密堆积
下图是此种六方 紧密堆积的前视图
A
12
6
3
B
54
A
B 第一种是将球对准第一层的球。
A 是每两层形成一个周期,即 AB
AB 堆积方式,形成六方紧密堆积。
金属晶体金属键堆积方式
修高
3
) 第 三 章
二 化 学 ( 选
第三节
金属晶体
Ti
金属样品 Ti
1、金属共同的物理性质
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢? 2、金属的结构
㈠、金属键
(1)定义: 金属离子和自由电子之间的相互作用。 (2)成键微粒: 金属阳离子和自由电子 (3)键的存在: 金属单质和合金中 (4)方向性: 无方向性 (5)键的本质: 电子气理论
【总结】非金属单质是原子晶体还是分子晶体的 判断方法
(1)依据组成晶体的粒子和粒子间的作用判断: 原子晶体的粒子是原子,质点间的作用是共价键; 分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。 (3)依据晶体的熔点判断:原子晶体熔、沸点高, 常在1000℃以上;分子晶体熔、沸点低,常在数百 度以下至很低的温度。 (4)依据导电性判断:分子晶体为非导体,但部 分分子晶体溶于水后能导电;原子晶体多数为非导 体,但晶体硅、晶体锗是半导体。 (5)依据硬度和机械性能判断:原子晶体硬度大, 分子晶体硬度小且较脆。
③ 六方堆积 ——六方晶胞
④面心立方堆积 ——面心立方晶胞
配位数 = 12 空间利用率 = 74.05% 配位数 = 12 空间利用率 = 74.05%
知识拓展-石墨
一种结晶形碳,有天然出产的矿物。铁 黑色至深钢灰色。质软具滑腻感,可沾污手 指成灰黑色。有金属光泽。六方晶系,成叶 片状、鳞片状和致密块状。密度2.25g/cm3, 化学性质不活泼。具有耐腐蚀性,在空气或 氧气中强热可以燃烧生成二氧化碳。石墨可 用作润滑剂,并用于制造坩锅、电极、铅笔 芯等。
4.金属晶体熔点变化规律
晶胞结构
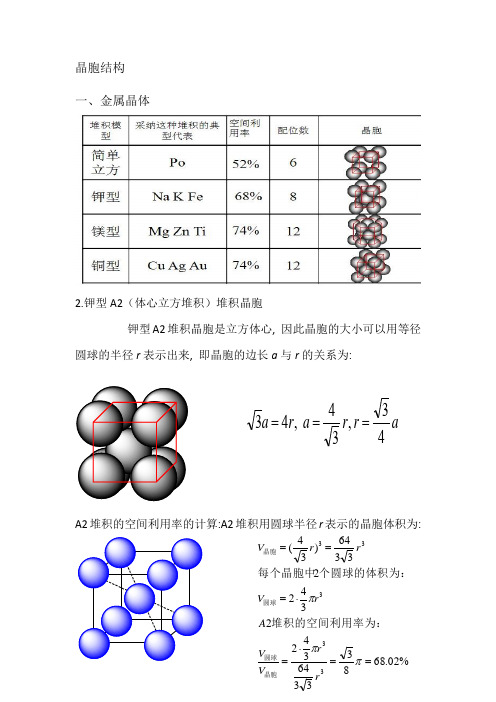
晶胞结构一、金属晶体2.钾型A2(体心立方堆积)堆积晶胞钾型A2堆积晶胞是立方体心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A2堆积的空间利用率的计算:A2堆积用圆球半径r 表示的晶胞体积为:ar r a r a 43,34 ,43===%02.68833364342234223364)34(33333==⋅=⋅===πππr r V V A rV rr V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中3.六方最密堆积(4)A1(面心立方最密堆积)A1是ABCABCABC······型式的堆积,从这种堆积中可以抽出一个立方面心点阵,因此这种堆积型式的最小单位是一个立方面心晶胞。
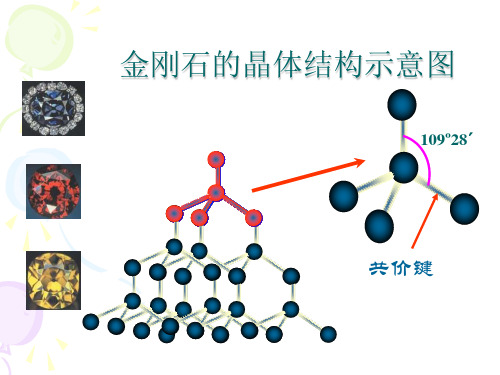
A1堆积晶胞是立方面心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A1堆积空间利用率的计算:A1堆积用圆球半径r 表示的晶胞体积为:(5)A4堆积形成晶胞A4堆积晶胞是立方面心点阵结构, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A4堆积的空间利用率的计算:A4堆积用圆球半径r 表示的晶胞体积为: ra r a 22 ,42==%05.742312163441344 4216)22(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中ar r a r r a 83,38 ,8243===⨯=%01.34163335123484348 833512)38(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中二、原子晶体1.金刚石立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
金属晶体的三种密堆积方式

金属晶体的三种密堆积方式金属晶体的三种密堆积方式中,原子排列的密堆积方式是指原子在三维空间中紧密排列,以使得晶体的空间利用率达到最大。
密堆积方式可以有效影响金属的密度、强度、硬度等物理性质,因此在材料科学和固体物理中具有重要意义。
通常,金属晶体的密堆积方式主要分为以下三种:面心立方堆积(FCC)、六方最密堆积(HCP)和体心立方堆积(BCC)。
一、面心立方堆积(FCC)面心立方堆积(Face-Centered Cubic, FCC)是一种常见的密堆积方式,其中每个立方体的面上都有一个原子,且每个顶点上也有一个原子。
FCC结构可以看作是由许多面心立方单元重复堆积而成,其代表性金属包括铜(Cu)、铝(Al)、银(Ag)和金(Au)等。
1. 结构特点:在FCC结构中,每个原子都有12个最近邻原子,即配位数为12。
该结构单胞中包含4个原子(8个顶点上的原子分别与相邻单元共享,6个面的原子与邻近单元共享),堆积因子达到0.74,即约74%的空间被原子占据,属于最密堆积结构。
2. 性质:FCC结构由于其紧密的堆积方式,具有较高的塑性和延展性。
因此,FCC金属在室温下一般较易发生滑移,从而产生延展变形。
例如,铜和铝具有良好的延展性,易于加工成型。
3. 堆积方式:在面心立方堆积中,原子在平面上形成紧密的六边形排列,层间顺序为ABCABC 的排列模式。
这意味着每三层后结构重复,形成周期性排列。
4. 应用:FCC结构的金属由于其良好的延展性和抗冲击性,常用于制造电线、金属薄膜和结构材料等。
二、六方最密堆积(HCP)六方最密堆积(Hexagonal Close-Packed, HCP)是一种与面心立方相似的密堆积方式,但其晶体结构为六方柱体,且具有不同的堆积顺序。
HCP结构的代表性金属包括镁(Mg)、钛(Ti)、锌(Zn)和钴(Co)等。
1. 结构特点:在HCP结构中,原子的配位数同样为12,说明其紧密度与FCC相似。
【强烈推荐】晶体原子堆积模型模型与计算(绝对精品)汇总

7 6 5
1
8 9 4
2 3
10
11
12
属于最密置层堆集,配位数为 12 ,这种堆积 晶胞空间利用率高,许多金属(如Cu Ag Au 等)采取这种堆积方式。
找铜型的晶胞
C B
A
面心立方(铜型)空间利用率计算:
在立方体顶点的微粒为8个晶胞共有,在面 心的为2个晶胞共有。
属于1个晶胞微粒数为: 8×1/8 + 6×1/2 = 4
请计算:空间利用率?
面心立方堆积方式的空间利用率计算
a
a
面心
面心立方堆积方式的空间利用率计算
a
a
面心
面心立方空间利用率:
属于1个晶胞微粒数为: 8×1/8 + 6×1/2 = 4 空间利用率: 4×4πr3/3 (2×1.414r)3 = 74.05%
堆积方式及性质小结
堆积方式 晶胞类型 空间利 配位数 用率 简单立 方堆积 简单立方 52% 68% 74% 74% 6 8 12 实例
2
配位数: 12 空间占有率:
六方密堆积(镁型)的空间利用率计算:
四点间的夹角均为60°
先求S
在镁型堆积中取出六方晶胞,平行六面体的底是 平行四边形,各边长 a=2r,则平行四边形的面积:
3 2 S a a sin 60 a 2
平行六面体的高: 再求h
h 2 边长为a的四面体高 6 2 6 2 a a 3 3
空间利用率的计算
1、空间利用率:指构成晶体的原子、离子或 分子在整个晶体空间中所占有的体积百分比。 球体积 晶胞体积
空间利用率 =
100%
2、空间利用率的计算步骤: (1)计算晶胞中的微粒数
金属晶体的四种堆积模型总结

金属晶体的四种堆积模型总结Metal crystals can be classified into four main stacking models: Close-packed cubic (FCC), Close-packed hexagonal (HCP), Body-centered cubic (BCC), and Simple cubic (SC). These models represent different ways in which metal atoms arrange themselves in a crystal lattice. Close-packed cubic structures have atoms arranged in layers of repeating ABCABC... pattern, giving them high packing efficiency.金属晶体可以分为四种主要的堆积模型:密堆立方(FCC)、密堆六方(HCP)、体心立方(BCC)和简单立方(SC)。
这些模型代表了金属原子在晶格中排列的不同方式。
密堆立方结构中,原子按照重复ABCABC...模式排列在不同层中,使得具有较高的填充效率。
Close-packed hexagonal structures, on the other hand, consist of layers with an ABAB... stacking sequence. This type of arrangement gives rise to a compact structure with a hexagonal unit cell. Body-centered cubic structures have atoms arranged in a simple cubic lattice with an additional atom at the center of the cube. This arrangement provides good mechanical properties due to thepresence of the central atom, which enhances the strength of the crystal lattice.另一方面,密堆六方结构由具有ABAB...堆叠序列的层组成。
金属晶体堆积模型复习及计算

请计算:空间利用率?
以体心立方晶胞为例,计算晶胞中原子的 空间占有率。
小结:(2)钾型 (体心立方堆积)
配位数:8
(3)面心立方:在立方体顶点的微粒为8 个晶胞共有,在面心的为2个晶胞共有。
微粒数为: 8×1/8 + 6×1/2 = 4
请计算:空间利用率?
B
此种立方紧密堆积的前视图A
7 1 9
6
5
8 2
3 4
10
11
12
这种堆积晶胞空间利用率高(74%),属于 最密置层堆集,配位数为 ,许多金属(如 Mg、Zn、Ti等)采取这种堆积方式。
回顾镁型的晶胞
1200
平行六面体
找铜型的晶胞
C B A
回顾:配位数 每个小球周围距离最近的小球数
=19.36g/cm3 1nm=10-9m=10-7cm
复习1pm=10-12m
练2:
现有甲、乙、丙、丁四种晶胞,可推知甲
晶晶体体体的中化的与学化的式学粒 为式子—为E—个F——D或—数—C——F比2——E—为;或——丁—C—1—晶—2:D1——体——;的—;丙化乙晶学 式为—X—Y——2Z——。
BA
甲
DC
乙
F
E
丙
Z X
Y
丁
练3: 甲
乙
丙
上图甲、乙、丙分别为体心堆积、面心立方堆积、 六方堆积的结构单元,则甲、乙、丙三种结构单
元中,金属原子个数比为——1—:—2:—3————。
乙晶胞中所含金属原子数为8×1/8+6×1/2=4 晶胞中所含金属原子数为12×1/6+2×1/2+3=6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
= 52.36%
(2)钾型
----体心立方堆积:
5 8 1
6 7 2
4
3
这种堆积晶胞是一个体心立方,每个晶胞含 2 个原子,属于非密置层堆积,配位数 为 8 ,许多金属(如Na、K、Fe等)采取这种 堆积方式。
空间利用率的计算
(2)体心立方:在立方体顶 点的微粒为8个晶胞共享,处 于体心的金属原子全部属于 该晶胞。 微粒数为:8晶胞含 2 个原子
六方最密堆积的空间利用率计算
• 解:
在六方堆积中取出六方晶胞,平行六面体的底是 平行四边形,各边长 a=2r ,则平行四边形的面积:
3 2 a S= a sin 60 = 2
2
平行六面体的高:
h= 2 边长为a的四面体高 6 2 6 =2 a= a 3 3
第二课时
Ti
回顾练习
下列物质中含有金属键的是 A、金属铝 C、NaOH B、合金 D、NH4Cl ( AB )
一、金属晶体的原子堆积模型
1、理论基础
由于金属键没有方向性,每个金属 原子中的电子分布基本是球对称的,所 以可以把金属晶体看成是由直径相等的 圆球的三维空间堆积而成的。
2、二维堆积
I 型 II 型
Po Na、K、Fe
体心立方 体心立方 堆积 六方最 密堆积 六方
Mg、Zn、Ti
Cu、Ag、Au
面心立方 面心立方 最密堆积
12
巩固练习
已知金属铜为面心立方晶体,如图所示,铜的 相对原子质量为63.54,密度为8.936g/cm3,试 求 (1)图中正方形边长 a, r (2)铜的金属半径 r
提示: 数出面心立方中的铜的个数: 晶胞的密度等于晶体的密度
非密置层 行列对齐四球一 空 非最紧密排列
密置层 行列相错三球一 空最紧密排列
3、三维堆积
非密置层 密置层
4、金属晶体基本构型
(1).简单立方堆积:
非最紧密堆积,每个晶胞含 1 个原子, 配位数是 6 个. 只有金属(Po)采取这种堆积方式
空间利用率的计算
(1)简单立方:在立方体顶点的微 粒为8个晶胞共享, 微粒数为:8×1/8 = 1 空间利用率: 4лr3/3 (2r)3
r
o
r r a
a
铜型
1 6 5
2 3 4
C B A B C A
A
(3)面心立方:在立方体顶点的微粒为8 个晶胞共有,在面心的为2个晶胞共有。 微粒数为: 8×1/8 + 6×1/2 = 4 空间利用率: 4×4лr3/3 (2×1.414r)3
= 74.05%
堆积方式及性质小结
堆积方式 晶胞类型 空间利 配位数 用率 简单立 方堆积 简单立方 52% 68% 74% 74% 6 8 12 实例
(3)镁型和铜型
金属晶体的两种最密堆积方式──镁型和铜型
镁型
铜型
镁型
1 6 5 4 2 3 6 5 4
1
2
3
1 6 5
2 3 4
铜型
1 6 5 4 2 3 6 1 2 3 6 1 2 3
5
4
5
4
下图是镁型紧密堆积的前视图
A
1 6 5 4 2 3
B
A B A
第四层再排 A,于是形 成 ABC ABC 三层一个周
下图是铜型型紧密堆积的前视图
A
期。 得到面心立方堆积。
AC CB BA
1 6
5
2
3
4
AC
CB
A
配位数 12 。 ( 同层 6, 上下层各 3 )
B
A 此种立方紧密堆积的前视图
镁型(六方紧密堆积)
7 6 5 10 1 8 9 4 11 2 3
12
这种堆积晶胞属于最密置层堆集,配位数 为 12 ,许多金属(如Mg、Zn、Ti等)采取这 种堆积方式。
3 2 2 6 V晶胞= a a 2 3 3 3 = 2a =8 2r
4 π 3 V球=2 r (晶胞中有2个球) 3
V球
100 % = 74 . 05 % V晶胞
铜型(面心立方紧密堆积)
7 6 5 1 8 9 4 2 3
12
10 11
这种堆积晶胞属于最密置层堆集,配位数 为 12 ,许多金属(如Cu、Ag、Au等)采取这 种堆积方式。
