化学反应中溶质质量分数的计算 PPT课件
合集下载
《溶质的质量分数》(化学精品课件)
投入49克稀硫酸中,恰好完全反应,生成0.2克氢 气,试求: (1)黄铜中锌的质量分数是多少? (2)反应后所得溶液的溶质的质量分数是多少?
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
9.3溶质的质量分数第1课时溶质的质量分数课件-+2024-2025学年九年级化学人教版下册

×100%(S为溶解度)。
S+100 g
D )
【例】已知KNO3的溶解度如表。下列说法不正确的是(
. . .
A.20 ℃时,向100 g水中加入35 g KNO3,充分搅拌,所得溶液质
量为135 g
温度/℃
10
20
30
40
50
60
70
溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
B.KNO3的溶解度随温度的升高而增大
A.每100 g水中含食盐16 g
B.每100 g溶液中含食盐16 g
C.溶液质量为100 g
D.溶液中含食盐16 g
知识点2
有关溶质的质量分数的计算
3.(教材变式)把15 g固体硝酸钾放入85 g水中,完全溶解后,
溶液中硝酸钾的质量分数为( A )
A.15%
B.17.6%
C.21.4%
D.85%
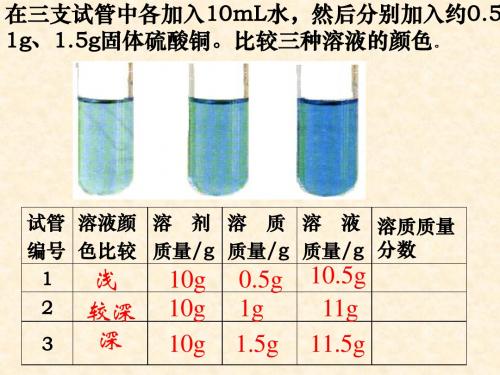
稀?你的判断根据是什么?
烧杯Ⅲ中的最浓,烧杯Ⅰ中的最稀。判断的根据是溶液颜色
的深浅
【小结】一般情况下,对于有色溶液来说,根据 颜色
的深
浅可以判断溶液的浓稀程度。这种方法比较粗略,不能准确地
表明一定量的溶液里究竟含有多少溶质。在实际应用中,常常
浓度
要准确知道一定量的溶液里所含溶质的量,即
。
1.溶质的质量分数的概念: 溶质质量
溶质质量+溶剂质量
知识点1
溶质的质量分数
1.(核心素养)从100 g 15%的NaOH溶液中取出20 g,将剩余
D )
溶液与原溶液进行比较,没有发生改变的是(
. .
S+100 g
D )
【例】已知KNO3的溶解度如表。下列说法不正确的是(
. . .
A.20 ℃时,向100 g水中加入35 g KNO3,充分搅拌,所得溶液质
量为135 g
温度/℃
10
20
30
40
50
60
70
溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
B.KNO3的溶解度随温度的升高而增大
A.每100 g水中含食盐16 g
B.每100 g溶液中含食盐16 g
C.溶液质量为100 g
D.溶液中含食盐16 g
知识点2
有关溶质的质量分数的计算
3.(教材变式)把15 g固体硝酸钾放入85 g水中,完全溶解后,
溶液中硝酸钾的质量分数为( A )
A.15%
B.17.6%
C.21.4%
D.85%
稀?你的判断根据是什么?
烧杯Ⅲ中的最浓,烧杯Ⅰ中的最稀。判断的根据是溶液颜色
的深浅
【小结】一般情况下,对于有色溶液来说,根据 颜色
的深
浅可以判断溶液的浓稀程度。这种方法比较粗略,不能准确地
表明一定量的溶液里究竟含有多少溶质。在实际应用中,常常
浓度
要准确知道一定量的溶液里所含溶质的量,即
。
1.溶质的质量分数的概念: 溶质质量
溶质质量+溶剂质量
知识点1
溶质的质量分数
1.(核心素养)从100 g 15%的NaOH溶液中取出20 g,将剩余
D )
溶液与原溶液进行比较,没有发生改变的是(
. .
9.3.1+溶质的质量分数课件-2024~2025学年九年级化学人教版(2024)下册

新知讲授
02
溶质质量分数的含义
氯化钠的质量占整个 溶液质量的5% 溶质质量
100g氯化钠溶液 中含有氯化钠5g 溶液质量
“5%的NaCl溶液”
每5g氯化钠溶于95g 水形成的溶液
m氯化钠:m水:m氯化钠溶液 =5:95:100
练一练
03
1.对“溶质质量分数为20%的NaCl溶液”的认识正确的是(C ) A.100 g水中溶解了20 g NaCl B.该溶液中溶质与溶剂的质量比为1∶5 C.50 g该溶液中含有10 g NaCl D.该溶液中溶质与溶液的质量比为1∶6
人教版九年级下册
课时1 溶质的质量分数
9.3 溶质的质量分数
学习目标
01
1.认识溶质的质量分数。 2.学会溶质的质量分数的简单计算。 3.掌握溶质的质量分数与溶解度的关系。
新知讲授
02
生活中我们可以用品尝的方法区分两杯糖水的浓稀, 那么化学式我们如何定量表示溶液的浓稀呢? 如果把一个鸡蛋放入半杯水中,不断加食盐搅拌,你会 看到什么现象?为什么会出现这样的现象呢?
b
②t2时,a、b、c三种物质的饱和溶液,
c
溶质的质量分数由大到小为:a>b>c
t1
t2 温度/℃
溶解度曲线上溶液状态对应点的位置越高,溶质的质量分数越大。
新知讲授
02
溶解度/g
t1
a
③a、b、c的饱和溶液从t1升温至t2,溶质
的质量分数由大到小为: b>a>c
④a、b、c的饱和溶液从t2降温至t1,溶质 的质量分数由大到小为: b>a>c
新知讲授
02 【实验9-7】
烧杯 溶液颜色 溶剂质 溶质质 溶液质
溶质的质量分数PPT授课课件

第九单元 溶液
课题3 溶液的浓度 第1课时 溶质的质量分数
一、溶质质量分数 1.概念:溶质质量与溶液质量之比 ( 溶质质量 ) 2.计算公式:溶质质量分数=( 溶液质量 )×100%
3.相关计算:(1)溶液质量=溶质质量+溶剂质量 (2)溶液质量=溶液体积×溶液密度 (3)溶质质量=溶液质量×溶质质量分数
溶质质量 (4)溶液质量=溶质质量分数×100%
二、饱和溶液溶质质量分数计算 ( 溶解度 )
溶质质量分数=( 溶解度+100 g )×100%
三、溶液的稀释:稀释前后,溶质质量不变。
浓溶液质量×浓溶液溶质质量分数= 稀溶液质量×稀溶液溶质质量分数 浓溶液质量×浓溶液溶质质量分数= ( 浓溶液质量+水的质量 )×稀溶液溶质质量分数
四、溶液的浓缩
原溶质质量+新加溶质质量 1.加入溶质:溶质质量分数=原溶液质量+新加溶质质量×100%
2.蒸发溶剂:溶质质量不变 稀溶液质量×稀溶液溶质质量分数= ( 稀溶液质量-水的质量 )×浓溶液溶质质量分数
观察 血液的分层现象
抽取鸡或猪等动物的新 鲜血液10毫升,放入盛有 少量抗凝剂(如柠檬酸钠) 的试管里,静置一段时间。
在危急情况下可 以异血型输血,此时 要考虑供血者的红细 胞中凝集原是否会与 受血者血清中凝集素 发生反应,造成红细
O
O
BB
AA
AB AB
ABO血型之间的输血关系
3( )若出B球为肾小小动球脉),C,则为A(为动入脉球小动)脉,流
4()若B为血肾)小管外的毛细血管,则A为
((5(多 6出))静若若的动球脉BB(脉静为为小血小肺脉动)),肠泡C脉血为绒周))(毛 围,C静内 毛为脉毛 细(肾细 血静)管血,C脉管,内则),,流则 AC为内含A为流(养料) (肺静动脉脉 ),C为( 肺动静脉脉 ),A内流
课题3 溶液的浓度 第1课时 溶质的质量分数
一、溶质质量分数 1.概念:溶质质量与溶液质量之比 ( 溶质质量 ) 2.计算公式:溶质质量分数=( 溶液质量 )×100%
3.相关计算:(1)溶液质量=溶质质量+溶剂质量 (2)溶液质量=溶液体积×溶液密度 (3)溶质质量=溶液质量×溶质质量分数
溶质质量 (4)溶液质量=溶质质量分数×100%
二、饱和溶液溶质质量分数计算 ( 溶解度 )
溶质质量分数=( 溶解度+100 g )×100%
三、溶液的稀释:稀释前后,溶质质量不变。
浓溶液质量×浓溶液溶质质量分数= 稀溶液质量×稀溶液溶质质量分数 浓溶液质量×浓溶液溶质质量分数= ( 浓溶液质量+水的质量 )×稀溶液溶质质量分数
四、溶液的浓缩
原溶质质量+新加溶质质量 1.加入溶质:溶质质量分数=原溶液质量+新加溶质质量×100%
2.蒸发溶剂:溶质质量不变 稀溶液质量×稀溶液溶质质量分数= ( 稀溶液质量-水的质量 )×浓溶液溶质质量分数
观察 血液的分层现象
抽取鸡或猪等动物的新 鲜血液10毫升,放入盛有 少量抗凝剂(如柠檬酸钠) 的试管里,静置一段时间。
在危急情况下可 以异血型输血,此时 要考虑供血者的红细 胞中凝集原是否会与 受血者血清中凝集素 发生反应,造成红细
O
O
BB
AA
AB AB
ABO血型之间的输血关系
3( )若出B球为肾小小动球脉),C,则为A(为动入脉球小动)脉,流
4()若B为血肾)小管外的毛细血管,则A为
((5(多 6出))静若若的动球脉BB(脉静为为小血小肺脉动)),肠泡C脉血为绒周))(毛 围,C静内 毛为脉毛 细(肾细 血静)管血,C脉管,内则),,流则 AC为内含A为流(养料) (肺静动脉脉 ),C为( 肺动静脉脉 ),A内流
高中化学-溶质的质量分数课件

【视频播放】不同 组成的硫酸铜溶液
知1-导
问题
有颜色的溶液它们的浓度 怎么判断呢?可不可以用 颜色的深浅来判断溶液浓 稀的程度(浓度)呢?
知1-导
归纳
知1-导
溶质的质量分数 ➢ 概念:溶质质量和溶液质量的比值叫做溶质的质
量分数。
归纳
知1-导
➢ 公式:溶质的质量分数
溶质的质量
= 溶液的质量 100%
A.20 ℃时,甲、乙饱和溶液中溶质质量分数相等
B.40 ℃时,甲的溶解度大于乙的溶解度
C.40 ℃时,乙的饱和溶液中溶质的质量分数为40%
D.将40 ℃甲的饱和溶液降温到20 ℃,会有晶体析出
知4-导
知识点 4 有关溶液的稀释、浓缩和混合问题的计算
问 题(一)
有关溶液的稀释、浓缩的计算依据是什么?
1 知识小结
第1课时 溶质质量分数 ➢ 溶质的质量分数 1.定义:溶质的质量与溶液的质量之比。 2.公式:溶质的质量分数=溶质的质量/溶液的质
量×100%
➢ 溶质质量分数的计算
1. 有关溶质的质量分数的简单计算
2. 溶质的质量分数与溶解度的关系一定温度下的
饱和溶液中:
溶质的质量分数
溶解度 100g 溶解度
配制500 mL质量分数为20%的稀硫酸(密度为1.14
g/cm3),稀释时需用的水的体积约为( B )
A.436.8 mL
B.453.7 mL
C.456.0 mL
D.458.3 mL
易错点:根据稀释前后溶质的质量不变这一等量关系,
设稀释时需用浓硫酸的质量为x,则x×98%= 500 mL×1.14 g/cm3×1 cm3/mL×20%,解得x≈116.3 g, 稀释时需加水的体积:
知1-导
问题
有颜色的溶液它们的浓度 怎么判断呢?可不可以用 颜色的深浅来判断溶液浓 稀的程度(浓度)呢?
知1-导
归纳
知1-导
溶质的质量分数 ➢ 概念:溶质质量和溶液质量的比值叫做溶质的质
量分数。
归纳
知1-导
➢ 公式:溶质的质量分数
溶质的质量
= 溶液的质量 100%
A.20 ℃时,甲、乙饱和溶液中溶质质量分数相等
B.40 ℃时,甲的溶解度大于乙的溶解度
C.40 ℃时,乙的饱和溶液中溶质的质量分数为40%
D.将40 ℃甲的饱和溶液降温到20 ℃,会有晶体析出
知4-导
知识点 4 有关溶液的稀释、浓缩和混合问题的计算
问 题(一)
有关溶液的稀释、浓缩的计算依据是什么?
1 知识小结
第1课时 溶质质量分数 ➢ 溶质的质量分数 1.定义:溶质的质量与溶液的质量之比。 2.公式:溶质的质量分数=溶质的质量/溶液的质
量×100%
➢ 溶质质量分数的计算
1. 有关溶质的质量分数的简单计算
2. 溶质的质量分数与溶解度的关系一定温度下的
饱和溶液中:
溶质的质量分数
溶解度 100g 溶解度
配制500 mL质量分数为20%的稀硫酸(密度为1.14
g/cm3),稀释时需用的水的体积约为( B )
A.436.8 mL
B.453.7 mL
C.456.0 mL
D.458.3 mL
易错点:根据稀释前后溶质的质量不变这一等量关系,
设稀释时需用浓硫酸的质量为x,则x×98%= 500 mL×1.14 g/cm3×1 cm3/mL×20%,解得x≈116.3 g, 稀释时需加水的体积:
质量分数的计算PPT课件

A.70% B.75% C.80% D.85%
2021/3/9
授课:XXX
6
3.溶液中溶质的质量分数的计算
2021/3/9
授课:XXX
7
类型
一.最简型 二.过量型
三.结晶水合物型
四.同溶质相混合型
五.稀释,浓缩型 六.化学反应型
1.最简型 2.气体型
3.沉淀型
2021/3/9
授课:XXX
8
一.最简型 例.医院里配制1500克生理盐水,需要 食盐13.5克,试确定此生理盐水的质量 分数;并计算需水多少克?
2021/3/9
授课:XXX
3
2.混合物中某物质的质量分数 的计算
2021/3/9
授课:XXX
4
例.铜和铁混合物共12克,加入足量的稀
盐酸中充分的反应后,有0.2克的气体放 岀。试计算混合物中金属铜的质量分数。
2021/3/9
授课:XXX
5
练习: 经测定,某赤铁矿(主要成分是 Fe2O3,
杂质中不含铁)含铁为56%,则该赤铁矿中 含氧化铁的质量分数为( )
15
2021/3/9
授课:XXX
16
2.气体型
例. 将6.5克锌投入到93.7克稀盐酸
中,恰好完全反应,试计算生成 氢气的质量和反应所得溶液的溶 质质量分数?
2021/3/9
授课:XXX
17
3.沉淀型
例. 100克BaCl2溶液和100克稀H2SO4 溶液恰好完全反应生23.3克白色沉 淀, (1).试计算原BaCl2溶液和稀H2SO4 溶液各自溶质质量分数。 (2).试计算生成的盐酸的质量分数?
(1) 固体混合物中的碳酸钠的质量分数 (2) 生成CO2的质量 (3) 该盐酸中溶质的质量分数
2021/3/9
授课:XXX
6
3.溶液中溶质的质量分数的计算
2021/3/9
授课:XXX
7
类型
一.最简型 二.过量型
三.结晶水合物型
四.同溶质相混合型
五.稀释,浓缩型 六.化学反应型
1.最简型 2.气体型
3.沉淀型
2021/3/9
授课:XXX
8
一.最简型 例.医院里配制1500克生理盐水,需要 食盐13.5克,试确定此生理盐水的质量 分数;并计算需水多少克?
2021/3/9
授课:XXX
3
2.混合物中某物质的质量分数 的计算
2021/3/9
授课:XXX
4
例.铜和铁混合物共12克,加入足量的稀
盐酸中充分的反应后,有0.2克的气体放 岀。试计算混合物中金属铜的质量分数。
2021/3/9
授课:XXX
5
练习: 经测定,某赤铁矿(主要成分是 Fe2O3,
杂质中不含铁)含铁为56%,则该赤铁矿中 含氧化铁的质量分数为( )
15
2021/3/9
授课:XXX
16
2.气体型
例. 将6.5克锌投入到93.7克稀盐酸
中,恰好完全反应,试计算生成 氢气的质量和反应所得溶液的溶 质质量分数?
2021/3/9
授课:XXX
17
3.沉淀型
例. 100克BaCl2溶液和100克稀H2SO4 溶液恰好完全反应生23.3克白色沉 淀, (1).试计算原BaCl2溶液和稀H2SO4 溶液各自溶质质量分数。 (2).试计算生成的盐酸的质量分数?
(1) 固体混合物中的碳酸钠的质量分数 (2) 生成CO2的质量 (3) 该盐酸中溶质的质量分数
初中化学《溶质的质量分数》专项PPT课件

3、配制20mL10%的NaOH溶液 (密度为1.1g/cm3 ) 需要NaOH 和水各多少克?
复习提问:
1、对于70g10%的硝酸钾溶液 ①若蒸发30g水且无晶体析出,此时溶 液的质量分数为多少? ②若加入15g硝酸钾晶体并完全溶解, 此时溶质的质量分数又为多少?
2、从200g质量分数为20%的硝酸钾溶 液中取出50g,则这50g硝酸钾溶液的 质量分数是多少?
九年级化学第一单元《溶液》
溶质的质量分数
一、溶质的质量分数(P%)
1.定义:溶质质量与溶液质量之比
2.数学表达式:
溶质的质量质质量 溶质质量 溶剂质量 100%
(1)、溶质的质量分数
溶质质量 溶液质量
100%
溶质质量 溶质质量 溶剂质量 100%
(2)溶质质量 = 溶液质量× 溶质质量分数
(M质) (M液)
(P%)
例1、从一瓶氯化钾的溶液中取 出20g溶液蒸干后得到2.8g氯化 钾固体,求这瓶溶液溶质的质量
分数。
解:溶质的质量分数
溶质的质量 溶液的质量100%
2.8g 100% 14% 20g
答:这瓶溶液中氯化钾的质量 分数为14%
例2、在农业上,常需要用质量分数 为16%的氯化钠溶液来选种。配制 150kg这种溶液,需要氯化钠和水 的质量各是多少?
解: 氯化钠: 150kg× 16%=24kg
水: 150kg - 24kg=126kg
答:需NaCl24kg,水126kg
1、食盐在20℃时100克水中溶解36g, 计算食盐溶液中氯化钠的质量分数。
解: 36 g 100 % 26.5% 36 g 100 g
2、若配制20%的KNO3溶液1000g, 需要KNO3和水各多少克?
复习提问:
1、对于70g10%的硝酸钾溶液 ①若蒸发30g水且无晶体析出,此时溶 液的质量分数为多少? ②若加入15g硝酸钾晶体并完全溶解, 此时溶质的质量分数又为多少?
2、从200g质量分数为20%的硝酸钾溶 液中取出50g,则这50g硝酸钾溶液的 质量分数是多少?
九年级化学第一单元《溶液》
溶质的质量分数
一、溶质的质量分数(P%)
1.定义:溶质质量与溶液质量之比
2.数学表达式:
溶质的质量质质量 溶质质量 溶剂质量 100%
(1)、溶质的质量分数
溶质质量 溶液质量
100%
溶质质量 溶质质量 溶剂质量 100%
(2)溶质质量 = 溶液质量× 溶质质量分数
(M质) (M液)
(P%)
例1、从一瓶氯化钾的溶液中取 出20g溶液蒸干后得到2.8g氯化 钾固体,求这瓶溶液溶质的质量
分数。
解:溶质的质量分数
溶质的质量 溶液的质量100%
2.8g 100% 14% 20g
答:这瓶溶液中氯化钾的质量 分数为14%
例2、在农业上,常需要用质量分数 为16%的氯化钠溶液来选种。配制 150kg这种溶液,需要氯化钠和水 的质量各是多少?
解: 氯化钠: 150kg× 16%=24kg
水: 150kg - 24kg=126kg
答:需NaCl24kg,水126kg
1、食盐在20℃时100克水中溶解36g, 计算食盐溶液中氯化钠的质量分数。
解: 36 g 100 % 26.5% 36 g 100 g
2、若配制20%的KNO3溶液1000g, 需要KNO3和水各多少克?
九年级化学下册 9.3.1 溶质的质量分数的基本计算课件

确的是( )
A.甲物质的溶解度大于乙物质的溶解度 B.t1℃时,甲、乙两种物质各50 g分别(fēnbié)加入到100 g水中,充分溶解, 得到的溶液质量都是140 g C.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D.t2℃时,甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
(2)向1第2.一5%份溶液中加入15 g水后,溶液中KNO3的质量分数为________; (3)向第二份溶液中加15 g KNO3并全部溶解,所得溶液中KNO3的质量分数为 _______5_0;%
(4)若将第三份溶液变为10%的溶液,可采取的措施是_______________;
(5加)若入将(jiā第rù)四25份g溶的液水变为40%的溶液,可加热蒸发___________水。(无KNO3晶
______。
25
烧杯(shāobēi)
第五页,共二十一页。
(溶质质量)
(溶质(róngzhì)质量)
(1)溶质(róngzhì)的质量分(溶数=液(róngyè)质量)×100%= (溶质质量+溶剂质量)
×100%
2. 溶质质量=( 溶液质量)×( 溶质的质量分数)。
第六页,共二十一页。
1.(5分)对“10%的食盐溶液”含义的解释(jiěshì)错误的是( D )
溶液___kg。100
第三页,共二十一页。
【思路点拨】(1)溶质质量(zhìliàng)=溶液质量(zhìliàng)×溶质的
质量分数,配制120 kg溶质质量分数为20%的食盐溶液,需
要取用固体食盐的质量为120 kg×20%=24 kg。(2)设稀释成 12%的食盐溶液的质量为x,根据溶液稀释前后,溶质的质量 不变,则60 kg×20%=x×12%,x=100 kg。
A.甲物质的溶解度大于乙物质的溶解度 B.t1℃时,甲、乙两种物质各50 g分别(fēnbié)加入到100 g水中,充分溶解, 得到的溶液质量都是140 g C.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D.t2℃时,甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
(2)向1第2.一5%份溶液中加入15 g水后,溶液中KNO3的质量分数为________; (3)向第二份溶液中加15 g KNO3并全部溶解,所得溶液中KNO3的质量分数为 _______5_0;%
(4)若将第三份溶液变为10%的溶液,可采取的措施是_______________;
(5加)若入将(jiā第rù)四25份g溶的液水变为40%的溶液,可加热蒸发___________水。(无KNO3晶
______。
25
烧杯(shāobēi)
第五页,共二十一页。
(溶质质量)
(溶质(róngzhì)质量)
(1)溶质(róngzhì)的质量分(溶数=液(róngyè)质量)×100%= (溶质质量+溶剂质量)
×100%
2. 溶质质量=( 溶液质量)×( 溶质的质量分数)。
第六页,共二十一页。
1.(5分)对“10%的食盐溶液”含义的解释(jiěshì)错误的是( D )
溶液___kg。100
第三页,共二十一页。
【思路点拨】(1)溶质质量(zhìliàng)=溶液质量(zhìliàng)×溶质的
质量分数,配制120 kg溶质质量分数为20%的食盐溶液,需
要取用固体食盐的质量为120 kg×20%=24 kg。(2)设稀释成 12%的食盐溶液的质量为x,根据溶液稀释前后,溶质的质量 不变,则60 kg×20%=x×12%,x=100 kg。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.稀盐酸 B.硫酸亚铁溶液 C.硫酸镁溶液 D.硝酸银溶液
3.将7.3 g已部分氧化的锌粉,加入到98 g 10%的稀硫酸中,恰好完全
反应。则所得溶液中溶质的质量为( C) A.14.5 g B.15.5 g C.16.1 g D.18.1 g
4.硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取溶质质量分数 为8.5%的过氧化氢溶液40 g倒入小烧杯中,向其中加入溶质质量分数为
所得溶液中溶质质量分数=88234.2.8gg×100%≈10.1% 答:所得NaHSO3溶液的质量为824.8 g,质量分数为10.1%。
20%的硫酸铜溶液6.6 g,使过氧化氢完全分解。请按下列步骤计算反应后
所得溶液中溶质的质量分数:
(1)40 g溶质质量分数为8.5%的过氧化氢溶液中过氧化氢的质量为 3.4 g ,根据化学方程式可计算出过氧化氢完全分解后放出氧气的质量为 1.6 g;
(2)6.6 g溶质质量分数为20%的硫酸铜溶液中硫酸铜的质量为 1.32 g, 由于硫酸铜是 催化 剂,故反应后其质量不改变;
(2)用15%的氯化钠溶液浸泡瓜果片刻可以起到消毒作用。要使(1)中氯 化钠溶液的溶质质量分数变为15%,可向其中加入一定量的 氯化钠 (填 “氯化钠”或“水”)。
10.(2014·北京)某厂烟气中SO2的平均含量为0.032 g/L,用780 g硫化钠 (Na2S)溶液恰好能吸收2000L该厂烟所中的SO2,反应的化学方程式为:2Na2S +5SO2+2H2O===4NaHSO3+3S↓
6.将含有杂质的 22.2 g 石灰石样品,放入盛有 146 g 稀盐酸的烧杯中, 石灰石中的碳酸钙与盐酸均恰好完全反应(杂质不参加反应),放出气体后, 烧杯中物质的质量变为 159.4 g。求盐酸中 HCl 的质量分数。
解:放出气体的质量为 22.2 g+146 g-159.4 g=8.8 g 设参加反应的 HCl 的质量为 x。 CaCO3+2HCl===CaCl2+H2O+CO2↑
(3)由于过氧化氢已完全分解,故反应后溶液中的溶质为 CuSO4 (填化
学式);
(4)反应后溶液的质量应等于反应前两种溶液质量之和减去放出的氧气质
量,可列算式为:反应后溶液质量= 40 g+6.6 g-1.6 g=45 g
;
(5)反应后所得溶液中硫酸铜的质量分数= 1.32 g÷45 g×100%=2.93%
(2)计算该过氧化氢溶液中溶质的质量分数。
大家学习辛苦了,还是要坚持
继续保持安静
解:生成O2的质量是20 g+0.5 g-19.7 g=0.8 g 设该过氧化氢溶液中溶质的质量为x。 2H2O2=M=n=O==22H2O+O2↑ 68 32 x 0.8 g 6382=0.x8 g,x=1.7 g
求:(1)m= 2.0 。 (2)样品中碳酸钙的质量分数为 80% 。 (3)所用盐酸的溶质质量分数。
解:设 15.0 g 盐酸中氯化氢的质量为 x。 CaCO3+ 2HCl===CaCl2+H2O+CO2↑ 100 73 10.0 g-7.0 g x 10 1g0-0 7g=7x3 x=2.19 g
73 44 x 8.8 g 7x3=84.84g x=14.6 g
盐酸中 HCl 的质量分数=1144.66 gg×100%=10% 答:盐酸中 HCl 的质量分数是 10%。
7.某同学外出游玩,带回了几小块石灰石样品。为了检测样品中碳酸钙 的含量,他称取10.0 g样品,将60.0 g稀盐酸分四次加入,测量的有关数据 见下表(已知样品中的杂质不溶于水,且不与稀盐酸反应)。
盐酸的溶质质量分数=21.51.90 gg×100%=14.6%。 答:所用盐酸的溶质质量分数为 14.6%。
8.某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20 g,加入二氧化锰0.5 g,完全反应后,称得烧杯内剩余物质的总质量为19.7 g。请回答下列问题:
(1)二氧化锰在反应中的作用是 催化作用 。
(1)计算该氯化钠溶液的溶质质量分数(根据化学方程式列式计算)。 解:设NaCl的质量为x NaCl+AgNO3===AgCl↓+NaNO3 58.5 143.5 x 1.435 g
58x.5=11.44335.5g x=0.585 g
NaCl的质量分数=0.15085g g×100%=5.85%。
该溶液中溶质的质量分数为12.07 gg×100%=8.5% 答:该过氧化氢溶液中溶质的质量分数是8.5%。
(3)利用上述溶液配制100 g溶质质量分数为3%的过氧化氢消毒液, 需该溶液的质量为 35.3 g。(结果保留一位小数)
9.取10 g某氯化钠溶液,滴入足量硝酸银溶液,得到1.435 g白色沉 淀。(提示:NaCl+AgNO3===AgCl↓+NaNO3)
。
5.实验室用 6.5 g 锌与 100 g 稀硫酸反应,两者恰好完全反应,该硫酸 溶液的溶质质量分数是多少?
解:设与锌反应的硫酸的质量为 x。 Zn+H2SO4===ZnSO4+H2↑ 65 98 6.5 g x 66.55=9x8 x=9.8 g
稀硫酸中溶质的质量分数=190.80 gg×100%=9.8% 答:该硫酸溶液的溶质质量分数是 9.8%。
第九单元 溶 液
溶质的质量分数
专题三 化学反应中溶质质量分数的计算
1.电解水时,常在水中加入少量硫酸以增强水的导电性,若用25 g 8% 的硫酸通入直流电进行电解水实验,过一段时间后5 g B.5 g C.8 g D.10 g
2.把锌片放入下列溶液中充分反应,反应后溶液的质量比反应前减少的 是( D )
求理论上得到NaHSO3溶液的质量及其溶质的质量分数。(假设烟气中其 他成分不能被吸收)
解:设生成NaHSO3的质量为x,生成S的质量为y,则SO2的质量=2000 L×0.032 g/L=64 g
2Na2S+5SO2+2H2O===4NaHSO3+3S↓ 320 416 96 64 g x y
63420g=4x16=9y6 x=83.2 g y=19.2 g 所得溶液质量=780 g+64 g-19.2 g=824.8 g
3.将7.3 g已部分氧化的锌粉,加入到98 g 10%的稀硫酸中,恰好完全
反应。则所得溶液中溶质的质量为( C) A.14.5 g B.15.5 g C.16.1 g D.18.1 g
4.硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取溶质质量分数 为8.5%的过氧化氢溶液40 g倒入小烧杯中,向其中加入溶质质量分数为
所得溶液中溶质质量分数=88234.2.8gg×100%≈10.1% 答:所得NaHSO3溶液的质量为824.8 g,质量分数为10.1%。
20%的硫酸铜溶液6.6 g,使过氧化氢完全分解。请按下列步骤计算反应后
所得溶液中溶质的质量分数:
(1)40 g溶质质量分数为8.5%的过氧化氢溶液中过氧化氢的质量为 3.4 g ,根据化学方程式可计算出过氧化氢完全分解后放出氧气的质量为 1.6 g;
(2)6.6 g溶质质量分数为20%的硫酸铜溶液中硫酸铜的质量为 1.32 g, 由于硫酸铜是 催化 剂,故反应后其质量不改变;
(2)用15%的氯化钠溶液浸泡瓜果片刻可以起到消毒作用。要使(1)中氯 化钠溶液的溶质质量分数变为15%,可向其中加入一定量的 氯化钠 (填 “氯化钠”或“水”)。
10.(2014·北京)某厂烟气中SO2的平均含量为0.032 g/L,用780 g硫化钠 (Na2S)溶液恰好能吸收2000L该厂烟所中的SO2,反应的化学方程式为:2Na2S +5SO2+2H2O===4NaHSO3+3S↓
6.将含有杂质的 22.2 g 石灰石样品,放入盛有 146 g 稀盐酸的烧杯中, 石灰石中的碳酸钙与盐酸均恰好完全反应(杂质不参加反应),放出气体后, 烧杯中物质的质量变为 159.4 g。求盐酸中 HCl 的质量分数。
解:放出气体的质量为 22.2 g+146 g-159.4 g=8.8 g 设参加反应的 HCl 的质量为 x。 CaCO3+2HCl===CaCl2+H2O+CO2↑
(3)由于过氧化氢已完全分解,故反应后溶液中的溶质为 CuSO4 (填化
学式);
(4)反应后溶液的质量应等于反应前两种溶液质量之和减去放出的氧气质
量,可列算式为:反应后溶液质量= 40 g+6.6 g-1.6 g=45 g
;
(5)反应后所得溶液中硫酸铜的质量分数= 1.32 g÷45 g×100%=2.93%
(2)计算该过氧化氢溶液中溶质的质量分数。
大家学习辛苦了,还是要坚持
继续保持安静
解:生成O2的质量是20 g+0.5 g-19.7 g=0.8 g 设该过氧化氢溶液中溶质的质量为x。 2H2O2=M=n=O==22H2O+O2↑ 68 32 x 0.8 g 6382=0.x8 g,x=1.7 g
求:(1)m= 2.0 。 (2)样品中碳酸钙的质量分数为 80% 。 (3)所用盐酸的溶质质量分数。
解:设 15.0 g 盐酸中氯化氢的质量为 x。 CaCO3+ 2HCl===CaCl2+H2O+CO2↑ 100 73 10.0 g-7.0 g x 10 1g0-0 7g=7x3 x=2.19 g
73 44 x 8.8 g 7x3=84.84g x=14.6 g
盐酸中 HCl 的质量分数=1144.66 gg×100%=10% 答:盐酸中 HCl 的质量分数是 10%。
7.某同学外出游玩,带回了几小块石灰石样品。为了检测样品中碳酸钙 的含量,他称取10.0 g样品,将60.0 g稀盐酸分四次加入,测量的有关数据 见下表(已知样品中的杂质不溶于水,且不与稀盐酸反应)。
盐酸的溶质质量分数=21.51.90 gg×100%=14.6%。 答:所用盐酸的溶质质量分数为 14.6%。
8.某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20 g,加入二氧化锰0.5 g,完全反应后,称得烧杯内剩余物质的总质量为19.7 g。请回答下列问题:
(1)二氧化锰在反应中的作用是 催化作用 。
(1)计算该氯化钠溶液的溶质质量分数(根据化学方程式列式计算)。 解:设NaCl的质量为x NaCl+AgNO3===AgCl↓+NaNO3 58.5 143.5 x 1.435 g
58x.5=11.44335.5g x=0.585 g
NaCl的质量分数=0.15085g g×100%=5.85%。
该溶液中溶质的质量分数为12.07 gg×100%=8.5% 答:该过氧化氢溶液中溶质的质量分数是8.5%。
(3)利用上述溶液配制100 g溶质质量分数为3%的过氧化氢消毒液, 需该溶液的质量为 35.3 g。(结果保留一位小数)
9.取10 g某氯化钠溶液,滴入足量硝酸银溶液,得到1.435 g白色沉 淀。(提示:NaCl+AgNO3===AgCl↓+NaNO3)
。
5.实验室用 6.5 g 锌与 100 g 稀硫酸反应,两者恰好完全反应,该硫酸 溶液的溶质质量分数是多少?
解:设与锌反应的硫酸的质量为 x。 Zn+H2SO4===ZnSO4+H2↑ 65 98 6.5 g x 66.55=9x8 x=9.8 g
稀硫酸中溶质的质量分数=190.80 gg×100%=9.8% 答:该硫酸溶液的溶质质量分数是 9.8%。
第九单元 溶 液
溶质的质量分数
专题三 化学反应中溶质质量分数的计算
1.电解水时,常在水中加入少量硫酸以增强水的导电性,若用25 g 8% 的硫酸通入直流电进行电解水实验,过一段时间后5 g B.5 g C.8 g D.10 g
2.把锌片放入下列溶液中充分反应,反应后溶液的质量比反应前减少的 是( D )
求理论上得到NaHSO3溶液的质量及其溶质的质量分数。(假设烟气中其 他成分不能被吸收)
解:设生成NaHSO3的质量为x,生成S的质量为y,则SO2的质量=2000 L×0.032 g/L=64 g
2Na2S+5SO2+2H2O===4NaHSO3+3S↓ 320 416 96 64 g x y
63420g=4x16=9y6 x=83.2 g y=19.2 g 所得溶液质量=780 g+64 g-19.2 g=824.8 g
