物理化学期中测试答案
川大物理化学期中答案

Tb KbbB
Tf Kf bB
Kf 1.86 Tf Tb 0.0073 0.026 K Kb 0.52
8.在298K,101.325kPa下,将0.5mol苯和0.5mol甲苯混合形成理想液体混 合物,该过程的ΔH = 0 ,ΔU = 0 ,ΔS = 5.76 J· K- 1 。
mix S nR xB ln xB
B
9.2mol A和1mol B形成的理想液体混合物,已知pA*=90kPa,pB*=30kPa。若 气相的量相对液相而言很小,则气相中两物质摩尔分数之比yA : yB = 6:1
O B T xO T RT ln a ,B x,B x,B T RT ln x,B RT ln xB O B T bO T RT ln a ,B b,B b,B T RT ln b,B RT ln bB O B T cO T RT ln a ,B c,B c,B T RT ln c,B RT ln cB
g B T xO T RT ln a ,B x,B B T
a x ,B
B T
O b,B
T RT ln ab,B T
g B
xB
x ,B b ,B
ac ,B
B T
O c,B
T RT ln ac,B T
G nRT ln xA
1 8.314 298.15ln 0.4 2271 J
H G 0 2271 S 7.62 J K 1 T 298.15
12.在一定的温度下,对于组成一定的某溶液,若组分B选择不同 的标准态,则, μBo, μB, aB, γB, xB五个量中μBo, aB, γB 会改变, μB, xB 不会改变。
物理化学期中试卷答案

ΔrHm=179.5 kJ·mol-1
反应 (2) C2H2(g) + H2O (l) → CH3CHO (g);
ΔrHm=-107.2 kJ·mol-1
反应 (3) C2H4(g) + H2O (l) → C2H5OH (l);
ΔrHm=-44.08 kJ·mol-1
反应 (4) CS2(l) + 3O2(g) → CO2(g) + 2SO2(g);
(D) 不定
19.理想气体由同一始态出发,分别经 (1) 绝热可逆膨胀, (2) 多方过程膨胀,达到同一体积
V2,则熵变ΔS1 和ΔS2 之间的关系为:
(C)
(A) ΔS1>ΔS2 (B) ΔS1<ΔS2 (C) ΔS1=ΔS2 (D) 两者无确定关系 20. 某气体的状态方程为 p[(V/n)-b]=RT,式中 b 为常数, n 为物质的量。若该气体经一等温过
程,压力自 p1 变至 p2,则下列状态函数的变化,何者为零?
(A)
(A) ΔU (B) ΔH (C) ΔS (D) ΔG
二、填空题 ( 共 5 题 10 分 ) 21.某气体服从状态方程 pVm= RT + αp (α> 0 的常数),若该气体经恒温可逆膨胀,其内 能变化ΔUm= _________ J。 [答] 零
物理化学期中试卷答案
班级
姓名
分数
一、选择题 ( 共 20 题 40 分 )
1.某理想气体可逆压缩至同一压力 p2,
若环境所做功的绝对值分别为 WT 和 WA,问 WT 和 WA 的关系如何?
(A)
(A) WT>WA
(B) WT <WA
(C) WT =WA
内江六中2021届九年级上期期中半期物理化学试题及答案

内江六中2020-2021年度九年级上学期物理化学期中测试题考生注意:1.本试卷物理满分100分,化学满分100分,120分钟完卷。
2.答题时,务必按答题要求在答题纸规定的位置上作答,在草稿纸、本试卷上答题一律无效。
3.可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Cl-35.5 Ca-40一、单选题(每小题只有一个正确答案,每题3分,共72分。
将答案用2B铅笔填涂在答题卡上。
)1.关于图中的四个实验现象,分析正确的是()A B C DA.用力压下活塞棉花燃烧,说明气体对外做功,内能增加B.抽去玻璃板,瓶中的两种气体逐渐混合,说明气体分子在做无规则运动C.拉起接触水面的玻璃,弹簧测力计的示数增大是因为大气压的存在D.表面磨平的铅棒压紧后能够吊住大钩码,说明固体分子之间只存在引力2.下列说法正确的是()A.冬天搓手取暖是通过热传递增大内能的B.温度高的物体内能一定比温度低的物体内能大C.用冰冷却饮料是利用冰熔化吸热,饮料的内能减小D.用力挤压空矿泉水瓶,瓶盖猛烈冲出后,瓶内气体内能增大3.甲、乙两金属块,c甲:c乙=1:3,m甲:m乙=3:1,若两金属块放出相同热量后立即接触,则下列情况中正确的是()A.甲将热量传给乙B.乙将热量传给甲C.甲、乙之间没有热传递发生D.无法确定4.如图所示,取两个相同的验电器A和B,使A带负电,B不带电,用带有绝缘手柄的金属棒把A和B连接起来,下列说法正确的是()A.B中正电荷通过金属棒流向A,A金属箔的张角减小B.A中的自由电子通过金属棒流向B,B金属箔的张角增大C.A中负电荷通过金属棒流向B,B中正电荷通过金属棒流向AD.若把金属棒的绝缘手柄拆除,再进行实验,实验现象跟原来一样5.如图甲是无风条件下铝箔气球的静止状态,图乙是用带正电的a棒靠近气球时的情景,图丙是用b棒靠近气球时的情景,则()A.气球可能不带电B.气球带负电C.b棒可能不带电D.b棒带正电6.取一个橙子,把铜片、铁片插入其中,就制成了一个水果电池。
物理化学期中考试

化学平衡练习题一、是非题 1.等温等压条件下,r m B B G νμ∆=>∑ 的化学反应一定不能进行。
2.对于反应过程中温度、压力有变化的化学反应,就不能使用吉布斯自由能判据,()0r m T p G ∆≤ 。
3.所有标准平衡常数都是无量纲的。
4.化学反应亲和势越大,自发反应趋势愈强,反应进行的愈快。
5.平衡常数因条件变化而改变,则化学平衡一定发生移动;但平衡移动则不一定是由于平衡常数的改变。
6.在确定的反应条件下,一个化学反应只有一个平衡态,标准态却可任意选定。
7.气相反应的平衡常数pK 只与温度有关。
8.0K 时完整晶体的熵值为零,以此为基准,可以计算熵的绝对值。
9.温度T 时,1a K θ= ,说明这个反应在温度T 、压力 101.325kPa 的条件下已达到平衡。
10.用化学方法测平衡常数,因为是测定已达平衡的物质浓度,所以不必像测定反应速率那样——采取措施使反应“冻结”。
二、选择题11.化学反应若严格遵循体系的“摩尔吉布斯自由能-反应进度”曲线进行,则该反应在A.曲线的最低点B.最低点与起点或终点之间的某一侧C.曲线上的每一点D.曲线以外某点进行着热力学可逆过程。
12.有一理想气体反应A+B=2C ,在某一温度下进行,按下列条件之一可以用r mG直接判断反应方向和限度: A.任意压力和组成B.总压101.325kPa,物质的量分数A x =B x =C x =1/3C.总压303.975kPa, A x =B x =C x =1/3D.总压405.300kPa, A x =B x =1/4,C x =1/2 13.气相反应2NO+2O =22NO 在27℃时的p K 与c K 之比值约为:A.4410-⨯B.3410-⨯C.32.510⨯D.22.510⨯14.实际气体反应的平衡常数f K 的数值与下列因素中的哪一个无关?A.标准态B.温度C.压力D.体系的平衡组成15.化学反应的平衡状态随下列因素当中的哪一个而改变? A .体系组成 B.标准态C .浓度标度 D.化学反应式中的计量系数B v16.在相同条件下有反应式(1)A+2B (1)r mGC ,(2)(2)1122r m G A B C + ,则对应于(1)(2)两式的标准摩尔吉布斯自由能变化以及平衡常数之间的关系为:A.(1)r m G =2(2)r m G,1K =2K B.(1)r m G =2(2)r m G ,1K =()22K C.(1)r m G =(2)r m G ,1K =()22K D.(1)r m G =(2)r m G ,1K =2K 17.反应222()()()()CO g H O g CO g H g +=+,在600℃、100kPa 下达到平衡后,将压力增大到5000kPa ,这时各气体的逸度系数为2CO γ=1.09,2H γ=1.10,CO γ=1.23,2H O γ=0.77。
物化期中试卷样题及答案

物化期中试卷样题及答案华南农业⼤学期中考试试卷学年第学期考试科⽬:物理化学考试类型:(闭卷)考试时间:120 分钟学号姓名年级专业⼀.选择题:(10×2分)( )1. ⼆氧化碳的临界温度是304.16K,在装有⾜够数量的⼆氧化碳的钢瓶中,25℃时⼆氧化碳是什么状态?(A) 液态及⽓态(B) 超临界状态(C) 临界状态(D) 都可能( )2. 实际⽓体经节流膨胀, 状态函数的变化何者为零?(A) ΔU = 0 (B) ΔH = 0(C) ΔS = 0 (D) ΔG = 0( )3. 在下列哪种情况下, 实际⽓体的性质与理想⽓体相近?(A) 低温和⾼压(B) 低温和低压(C) ⾼温和⾼压(D) ⾼温和低压( )4. 理想⽓体从状态(P1 V1 T)恒温膨胀到(P2 V2 T).此过程的ΔG 与ΔA有什么关系?(A) ΔG = ΔA (B) ΔG > ΔA(C) ΔG < ΔA (D) ⽆确定关系( )5. ΔU = Q + W 适⽤于什么系统?(A) 敞开系统(B) 封闭系统(C) 隔离系统(D) 三种系统都适⽤( )6. 在⼀定T , P下, 某实际⽓体的V m⼤于理想⽓体的V m , 则该⽓体的压缩因⼦Z(A) ⼤于1 (B) ⼩于1(C) 等于1 (D) ⼩于零( )7. 氢⽓在298.15K的标准摩尔燃烧焓为-285.8 kJ·mol-1, 则氢⽓在298.15K燃烧时的标准摩尔反应焓为:(A) 142.9 kJ·mol-1(B) -142.9 kJ·mol-1(C) 285.8 kJ·mol-1(D) -285.8 kJ·mol-1( )8.在⼀简单的(单组分,单相,各向同性)封闭体系中,恒外压只做膨胀功的条件下,吉布斯⾃由能值随温度升⾼如何变化?(A) (?G/?T )p> 0(B) (?G/?T )p< 0(C) (?G/?T )p= 0(D)视具体体系⽽定( )9.在系统温度恒定的变化中,体系与环境之间:(A)⼀定有热交换(B)⼀定没有热交换(C)不⼀定有热交换(D)温度恒定与热交换⽆关( )10.关于热机的效率, 以下结论正确的是:(A) 可逆热机的效率可以等于1, 但不能⼤于1(B) 可逆热机的效率与⼯作物质的种类有关(C) 可逆热机的效率与⼯作物质的种类⽆关(D)任意热机的效率均可表⽰为η=1-T2/T1⼆.填空题:(20×1分)1.从微观⾓度⽽⾔,熵具有统计意义,它是系统的度量。
华东师范大学2021-2022学年物理化学期中考试试题(含答案)

华东师范大学期中/期末试卷(A )2021 —2022学年第二学期课程名称: 物理化学II (A )学生姓名:___________________ 学 号:___________________专 业:___________________ 年级/班级:__________________课程性质:公共必修、公共选修、专业必修或专业选修考试时间:4月21日9:50——11:50请于12:00前提交试卷!一、 选择题。
(每题2分,共20分)1、某反应,其半衰期与起始浓度成反比,则反应完成87.5%所用的时间t 1 与反应完成50%所用的时间t 2之间的关系是( D )A. t 1= 2t 2B. t 1= 4t 2C. t 1= 5t 2D. t 1= 7t 22、1-1级对峙反应12k k A B ,由纯A 开始反应,当进行到A 和B 浓度相等的时间为:(A )A. 1121221ln ()k t k k k k ⎛⎫= ⎪+-⎝⎭ B. 1212ln /()t k k k k =- C. 12ln(/)t k k = D. 112121ln ()k t k k k k ⎛⎫= ⎪+-⎝⎭ 3、对于定域子体系,N 个粒子分布方式D 所拥有的微观状态数t D 为:( B )A. !!i g i D i i n t N n =∏B. !!in i D i ig t N n =∏C. !i g i D i i g t N n =∏D. !in i D i i g t n =∏4、碳的放射性同位素14C 在自然界中正常含量约为总碳量的1.10×10-15,某考古学家测定一古墓中发现的木炭中的14C 含量为9.86×10-16,已知14C 的半衰期为5700年,则这古墓的大约年代为:( B )A. 约500年B. 约900年C. 约1100年D. 约1500年5、对于反应A 2+B 2 →2AB ,测得速率方程式22A B r kc c =⋅,下列判断可能错误的是 (D )A. 对反应物A 2来说是一级反应B. 反应级数是2C. 无法肯定是否为基元反应D. 反应一定是基元反应。
苏州大学物理化学下(一)课程期中试卷及答案

苏州大学物理化学下(一)课程期中试卷共7页考试形式闭卷 2010 年4月(2008级应化、化教、化学专业)院系:材料与化学化工学部年级:专业:姓名:学号:成绩:一、选择题 ( 共10题 20分 )1. 2 分 (4016)AgCl 在以下溶液中溶解度递增次序为:( )(a) 0.1mol·dm-3 NaNO3 (b) 0.1mol·dm-3 NaCl (c) H2O(d) 0.1mol·dm-3Ca(NO3)2 (e) 0.1mol·dm-3 NaBr(A) (a) < (b) < (c) < (d) < (e)(B) (b) < (c) < (a) < (d) < (e)(C) (c) < (a) < (b) < (e) < (d)(D) (c) < (b) < (a) < (e) < (d)2. 2 分 (5256)二级反应的速率常数的单位是:( )(A) s-1(B) dm6·mol-2·s-1(C) s-1·mol-1(D) dm3·s-1·mol-13. 2 分 (4940)25℃时, H2在锌上的超电势为 0.7 V,φ (Zn2+/Zn) = -0.763 V,电解一含有Zn2+(a=0.01) 的溶液,为了不使H2析出,溶液的 pH值至少应控制在( )(A) pH > 2.06(B) pH > 2.72(C) pH > 7.10(D) pH > 8.024. 2 分 (4082)在25℃时,若要使电池 Pb(Hg)(a1) | Pb(NO3)2(aq) | Pb(Hg)(a2) 的电池电动势E为正值,则Pb在汞齐中的活度:()(A) 一定是a1>a2(B) 一定是a1=a2(C) 一定是a1<a2(D) a1和a2都可以任意取值5. 2 分 (5288)某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该反应的级数是: ( ) (A) 零级 (B) 一级反应 (C) 二级反应 (D) 三级反应6. 2 分 (4932)用铜电极电解 0.1mol ·kg -1的 CuCl 2水溶液,阳极上的反应为 ( ) (A) 2Cl- ─→ Cl 2+ 2e - (B) Cu ─→ Cu 2++ 2e - (C) Cu ─→ Cu ++ e - (D) 2OH - ─→ H 2O +12O 2+ 2e -7. 2 分 (4008)质量摩尔浓度为 m 的 Na 3PO 4溶液, 平均活度系数为 γ ±,则电解质的活度为:( ) (A) a B = 4(m /m )(γ 4 ±)4 (B) a B = 4(m /m ) (γ ±)4 (C) a B = 27(m /m )(γ 4 ±)4 (D) a B = 27(m /m ) (γ ±)48. 2 分 (5102)一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁 箱的寿命,选用哪种金属片为好? ( ) (A) 铜片 (B) 铁片 (C) 镀锡铁片 (D) 锌片9. 2 分 (4236)若算得电池反应的电池电动势为负值时,表示此电池反应是: ( ) (A) 正向进行 (B) 逆向进行 (C) 不可能进行 (D) 反应方向不确定10. 2 分 (5253)反应 2A → P 为二级反应,其半衰期: ( )(A) 与 [A]0无关 (B) 与 [A]0成正比 (C) 与 [A]0成反比 (D) 与 [A] 成反比 [A]0为反应物 A 的起始浓度。
湖北省咸宁市赤壁市2022-2023学九年级上学期期中物理化学模拟试题(含答案)
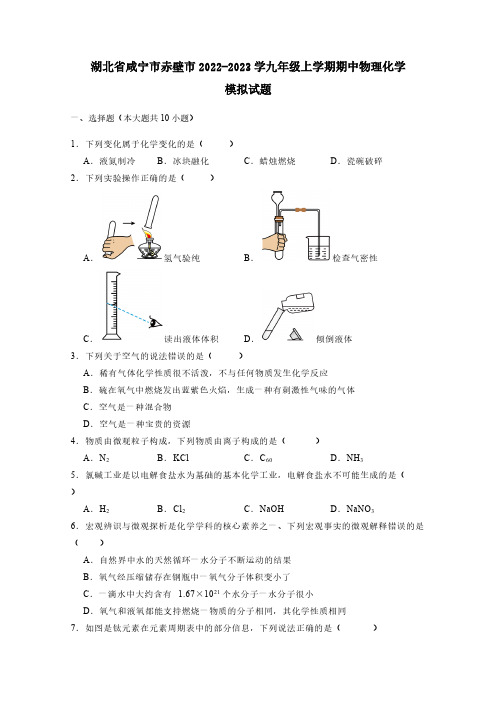
湖北省咸宁市赤壁市2022-2023学九年级上学期期中物理化学模拟试题一、选择题(本大题共10小题)1.下列变化属于化学变化的是( )A.液氮制冷B.冰块融化C.蜡烛燃烧D.瓷碗破碎2.下列实验操作正确的是( )A.氢气验纯B.检查气密性C.读出液体体积D.倾倒液体3.下列关于空气的说法错误的是( )A.稀有气体化学性质很不活泼,不与任何物质发生化学反应B.硫在氧气中燃烧发出蓝紫色火焰,生成一种有刺激性气味的气体C.空气是一种混合物D.空气是一种宝贵的资源4.物质由微观粒子构成,下列物质由离子构成的是( )A.N2B.KCl C.C60D.NH35.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成的是( )A.H2B.Cl2C.NaOH D.NaNO36.宏观辨识与微观探析是化学学科的核心素养之一、下列宏观事实的微观解释错误的是( )A.自然界中水的天然循环一水分子不断运动的结果B.氧气经压缩储存在钢瓶中一氧气分子体积变小了C.一滴水中大约含有 1.67×1021个水分子一水分子很小D.氧气和液氧都能支持燃烧一物质的分子相同,其化学性质相同7.如图是钛元素在元素周期表中的部分信息,下列说法正确的是( )A .钛原子的中子数为22B .钛为固态非金属元素C .钛原子的电子数为22D .钛元素的相对原子质量为47.87g8.中国科学家成功以二氧化碳和水为原料合成了葡萄糖(C 6H 12O 6),下列说法正确的是( )A .每个葡萄糖分子中含有6个水分子B .葡萄糖由碳、氢、氧3种元素组成C .葡萄糖属于氧化物D .葡萄糖由6个C 原子、12 个H 原子和6个O 原子构成9.拉瓦锡在研究空气成分时,将氧化汞(HgO)收集后加强热,反应的微观示意图如下,下列说法错误的是( )A .该反应的基本反应类型为分解反应B .原子是化学变化中的最小粒子C .该反应中,分子的种类发生了变化D .该反应的化学方程式为2HgO Hg+O 2↑Δ−−→10.一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )A .乙是反应物B .反应前后四种物质总质量不变C .丁可能是此化学反应的催化剂D .生成30g 丙,需消耗12g 甲二、填空与简答(本大题共4小题)A.氢气在氧气中燃烧13.学习化学要建立元素观、粒子观和分类观。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学期中测试(2011秋)
一、选择题
1.关于反应级数,说法正确的是: ( D )
(A) 只有基元反应的级数是正整数; (B) 反应级数不会小于零 ;
(C) 催化剂不会改变反应级数; (D) 反应级数都可以通过实验确定 。
2.关于反应速率r ,表达不正确的是( D )
(A) 与体系的大小无关而与浓度大小有关; (B) 与各物质浓度标度选择有关;
(C) 可为正值也可为负值; (D) 与反应方程式写法无关。
3.进行反应A + 2D→3G 在298K 及2dm 3容器中进行,若某时刻反应进度随时间变化率为0.3 mol·s -1,则此时G 的生成速率为(单位:mol·dm -3·s -1
) : ( C )
(A) 0.15 ; (B) 0.9 ; (C) 0.45 ; (D) 0.2 。
4.基元反应体系aA + dD→ gG 的速率表达式中,不正确的是: ( C )
(A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ;
(C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。
6.反应3O 2 →2O 3,其速率方程 -d[O 2]/dt = k[O 3]2[O 2] 或 d[O 3]/dt = k'[O 3]2[O 2],那么k 与k'的关系是: ( C )
(A) 2k = 3k' ; (B) k = k' ; (C) 3k = 2k' ; (D) k =2k' 。
7.某反应,其半衰期与起始浓度成反比,则反应完成87.5%的时间t 1与反应完成50% 的时间t 2之间的关系是: ( C )
(A) t 1 = 2t 2 ; (B) t 1 = 4t 2 ; (C) t 1 = 7t 2 ; (D) t 1 = 5t 2 。
8.某反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间的两倍,反应转化率达到64%的时间是转化率达到x %的时间的两倍,则x 为: ( C )
(A) 32 ; (B) 36 ; (C) 40 ; (D) 60 。
9.某一气相反应在500℃下进行,起始压强为p 时,半衰期为2秒;起始压强为0.1p 时半衰期为20秒,其速率常数为: ( C )
(A) 0.5 s -1 ; (B) 0.5 dm 3·mol -1·s -1 ;
(C) 31.69 dm 3·mol -1·s -1 ; (D) 31.69 s -1 。
10.某化合物与水相作用时,其起始浓度为1 mol·dm-3,1小时后为0.5 mol·dm-3,2小时后为0.25 mol·dm-3。
则此反应级数为:(B )
(A) 0 ;(B) 1 ;(C) 2 ;(D) 3 。
11.某反应进行时,反应物浓度与时间成线性关系,则此反应之半衰期与反应物最初浓度有何关系? (B )
(A) 无关;(B) 成正比;(C) 成反比;(D) 平方成反比。
12.对自由基反应A + B-C→A-B + C,已知摩尔等压反应热为-90kJ·mol-1,B -C的键能是210 kJ·mol-1,那么逆向反应的活化能为:()
(A) 10.5 kJ·mol-1 ;(B) 100.5 kJ·mol-1 ;
(C) 153kJ·mol-1 ;(D) 300 kJ·mol-1 。
13.一个基元反应,正反应的活化能是逆反应活化能的2倍,反应时吸热120 kJ·mol-1,则正反应的活化能是(kJ·mol-1):( B )
(A) 120 ;(B) 240 ;(C) 360 ;(D) 60 。
14. 若某电池反应的热效应是负值,那么此电池进行可逆工作时,与环境交换的热:( D )
(A) 放热;(B) 吸热;(C) 无热;(D) 无法确定。
15. 在温度为T时,有下列两反应
½Cu+½Cl2=½Cu2++Cl-E1
Cu+Cl2=Cu2++2Cl-E2
两反应对应的电池E1和E2的关系为( A )
(A) E1=E2;(B) 2E1=E2;(C) 4E1=E2;(D) E1=2E2
16. 下列电池中,电动势与Cl-离子的活度无关的是:( C )
A. Zn|ZnCl2(a)|Cl2(p)(Pt);
B. Zn|ZnCl2(a1)||KCl(a2)|AgCl(s),Ag;
C. Ag,AgCl|KCl(a)|Cl2(p)(Pt);
D. (Pt)H2(p)|HCl(a)|Cl2(p)(Pt)
17. 在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:( B )
(A) κ增大,Λm增大;(B) κ增大,Λm减少;
(C) κ减少,Λm增大;(D) κ减少,Λm减少。
18. 丹聂尔电池(铜- 锌电池)在放电和充电时锌电极分别称为:( C )
(A) 负极和阴极;(B) 正极和阳极;
(C) 阳极和负极;(D) 阴极和正极。
二、计算题
1.1033 K时N2O5的热分解获得如下数据:
p
0
/Pa 38663 47996
t1/2/s265 216
求:(1) 反应级数;
(2) 起始压强p0=101325 Pa时的半衰期。
解:(1) 因t1/2与P0有关,故不可能是一级反应。
用零级试尝:k= P0/2 t1/2,得:k=72.95及k=111.10
用二级试尝:k= 1/ (P0 t1/2),得:k=9.76×10-8及k=9.65×10-8显然应为二级反应,平均:k=9.71×10-8
对于二级反应k=1/(t1/2×P o)
k=1/(265×38663)=9.76×10-8
k=1/(216×47996)=9.65×10-8
(2) 当P0=101325 Pa时,t1/2=1/ (P0 t1/2)= 101.6 s
2. 双光气分解反应:ClCOOCCl
3(g) → 2COCl
2
(g)为一级反应,将一定量的双光
气引入到一个预先抽空的280℃的刚性容器中,751秒后测得系统的压力为2.710 kPa,反应完了之后测得系统的压力为4.008 kPa。
305℃时重复实验,320秒时测得系统的压力为2.838 kPa,反应完了之后系统的压力为3.554 kPa。
(1)求出两温度下的速率常数k
1和k
2
;
(2)求上述分解反应的表观活化能。
解:由ClCOOCCl3----------- 2COCl2
在280℃下,t=0时,P A,00 P=P A,0
t=751s时,P A P B=2P A,0-P A,)P=P A+2(P A,0-P A,)P A=2P A,0-P=P∞-P
t ∞ 时,0 P B=P∞=2P A,0 P A,0=1/2P∞此关系在305℃时也成立。
由一级反应的关系式,lnP A,0/P A=kt
k=ln(P A,0/P A)/t (2’)
∴在280℃时,
k1=ln[(4.008/2)/(4.008-2.710)]/751=0.0005783s-1
在305℃
k2=ln[(3.554/2)/(3.554-2.838)]/320=0.00284s-1
由lnk2/k1=E a(T2-T1)/RT2T1
E a=RT2T1ln(k2/k1)/(T2-T1)
=8.314(578.15×553.15)ln(0.00284/0.0005783)/(305-280)
=169.3kJ·mol-1
3. 五氧化二氮的分解为典型的一级反应,分解产物为NO2和O2,下面的复杂反应历程推断较之单分子反应历程推断来得正确。
试按复杂反应历程推导分解速率方程式。
k1 k2
N2O5——→NO2+ NO3 , NO2+ NO3——→N2O5 ,
k3 k4
NO2+ NO3——→NO2 + O2 + NO (慢), NO + NO3 ——→2NO2
解:总反应为:2N2O5======4NO2+O2
-dC N2O5/dt=2×dC O2/dt
∵dC O2/dt=k3C NO2·C NO3
而:dC NO/dt= k3C NO2·C NO3-k4C NO·C NO3=0
dC NO3/dt=k1C N2O5-k2·C NO2·C NO3-k3·C NO2·C NO3-k4·C NO·C NO3=0 解得:C NO2·C NO3= k1C N2O5/( k2+2 k3)
∴dC N2O5/dt=2k1·k3C N2O5/(k2+2 k3)
4. 电池在25℃时测得电池电动势,试计算待测溶液的pH。
查表知,在所给条件下甘汞电极的电极电势为。
